ANTECEDENTES
La leucemia mieloide crónica es una enfermedad mieloproliferativa clonal, con origen en células hematopoyéticas troncales, debido a la existencia del cromosoma Filadelfia, la marca característica de esta enfermedad es la traslocación recíproca entre el cromosoma 9 y el cromosoma 22.1 El gen de fusión en esta enfermedad es el BCR/ABL1, esta oncoproteína favorece el crecimiento y replicación a través de las vías RAS, RAF, JUN y STAT.2 La incidencia es de 0.5 a 2 casos por cada 100,000 habitantes, pero puede variar en cada región geográfica,3 tiene predominio por hombres y prevalencia estimada de 10 a 12 casos por 100,000 habitantes.4 Representa aproximadamente 15% de todas las leucemias y es rara en menores de 40 años; la mediana de edad es de alrededor de 60 años.5 En México no existe información epidemiológica nacional sólida.
El tratamiento ha cambiado a través de los años desde su primera descripción, comienza con el uso de soluciones con arsénico en el siglo XIX, la radioterapia, seguido de la incorporación de agentes de quimioterapia, como busulfán e hidroxicarbamida, y la llegada de inmunomoduladores, como el interferón alfa en el siglo XX.6 El trasplante de médula ósea representaba la mejor opción de tratamiento en el decenio de 1980, con tasa alta de mortalidad.7 Pero con el conocimiento de la biología de la enfermedad asociada con el cromosoma Filadelfia con gen de fusión BCR/ABL1 aparecieron los nuevos agentes, los inhibidores de tirosin cinasa (ITKs), desplazando a cada uno de los tratamientos a condiciones específicas en los distintos espectros de la enfermedad.8 La enfermedad suele tener una fase crónica con curso entre tres y cinco años, seguida de una fase acelerada y una fase blástica que generalmente son fatales o difíciles de tratar.9
Los inhibidores de tirosin cinasa aparecieron en el decenio de 1990, el imatinib fue el primero de esta familia, se une al bolsillo de unión del ATP de la conformación inactiva de ABL evitando de esta forma su conversión a la forma activa en la oncoproteína p210 de BCR/ABL1, bloqueando señalizaciones por c-kit, PDGFR y EGFR.10 En el primer ensayo clínico con imatinib, realizado por Druker y colaboradores, se obtuvo respuesta en 53 de 54 pacientes en las primeras cuatro semanas, lo que generó grandes expectativas en esta enfermedad;11 sin embargo, el estudio IRIS demostró la utilidad clínica más importante para el imatinib.12 En 2007 fue aprobada la administración de nilotinib para el tratamiento de la leucemia mieloide crónica, porque incluso 20% de los pacientes no alcanzaban respuesta citogenética debido a resistencia. El nitolotinib en un inhibidor de tirosin cinasa de segunda generación que se une selectivamente al bolsillo ABL y es incluso 20 veces más potente que la inhibición de imatinib.13 El estudio ENESTnd demostró a 12 meses mayor tasa de respuesta citogenética completa y molecular mayor en los brazos de nilotinib, 43 y 80% respectivamente en comparación con 22 y 65% para el brazo de imatinib.14 Dasatinib es otro inhibidor de segunda línea con potencia incluso 325 veces mayor que imatinib, el estudio DASISION demostró a 12 meses una respuesta citogenética mayor confirmada de 77% y molecular mayor de 46% a favor de dasatinib versus imatinib de 66 y 28%, respectivamente.15
En nuestro país existe disponibilidad de imatinib, nilotinib y dasatinib. El ISSSTE cuenta con la aprobación de los tres fármacos para su prescripción en el tratamiento de la leucemia mieloide crónica, por lo que decidimos comunicar los resultados de la administración de inhibidores de tirosin cinasa para el tratamiento de pacientes con leucemia mieloide crónica en el Hospital Regional General Ignacio Zaragoza del ISSSTE.
MATERIAL Y MÉTODO
Estudio retrospectivo, transversal, observacional y explicativo, basado en los registros de pacientes atendidos en el Hospital Regional General Ignacio Zaragoza del ISSSTE de enero de 2005 a enero de 2016 con diagnóstico de leucemia mieloide crónica. Se realizó registro en el comité local de investigación, tras su aprobación y previo consentimiento informado, se incluyeron pacientes mayores de 18 años de edad, con diagnóstico de leucemia mieloide crónica confirmada por la existencia de al menos una prueba confirmatoria: cariotipo con cromosoma Filadelfia, FISH para traslocación 9:22 y BCR/ ABL1 cuantitativo para p190, p210(b2a2 y b3a2) y p230, p210 con reporte de escala internacional estandarizado; con cualquiera de las tres fases de la enfermedad: crónica, acelerada y blástica y que hubiesen recibido tratamiento con cualquiera de los inhibidores de tirosin cinasa: imatinib, nilotinib y dasatinib. Se excluyeron los pacientes con datos incompletos o sin carta de consentimiento informado. La fuente primaria de información fue el expediente clínico.
Se construyó una hoja de recolección de datos para tal propósito y se analizó la información con el programa estadístico SPSS de IBM versión 23 (IBM Corp., Armonk, Nueva York, Estados Unidos). El análisis estadístico se realizó con estadística descriptiva para las variables cualitativas, la diferencia entre grupos para variables cualitativas se estimó por prueba χ2 de Pearson. La diferencia entre medias se realizó con ANO- VA para valores paramétricos y Kruskall-Wallis para datos no paramétricos. Las diferencias se consideraron significativas si éstas eran menores de 0.05. La supervivencia se analizó con método de Kaplan-Meier.
RESULTADOS
Se incluyeron 31 casos de leucemia mieloide crónica; se eliminaron dos casos por no contarcon información completa para los propósitos de este estudio. De los 29 casos analizados, 16 fueron mujeres y 13 hombres. La mediana de edad fue de 62 años. Aproximadamente 50% de los pacientes estaban asintomáticos al momento del diagnóstico de la enfermedad. La esplenomegalia se documentó en 55.2% de los pacientes. En la biometría hemática se encontró que 93% de los pacientes tenían leucocitosis, anemia en 69%, poliglobulia en 7% y trombocitosis en 51.7% de los casos. Se encontró deshidrogenasa láctica mayor del valor normal en 55.2% de los casos (Figura 1). El 72.4% se diagnosticó en fase crónica, 27.6% en fase acelerada y ninguno en fase blástica.
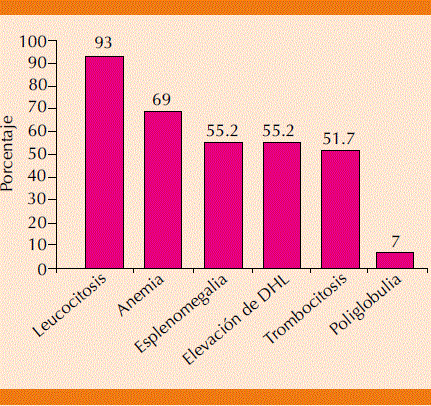
DHL:deshidrogenasa láctica
Figura 1 Porcentaje de síntomas y signos mas frecuentes en los pacientes diagnosticadas con leucemia mieloide crónica
El riesgo por la escala SOKAL se distribuyó como sigue: 79.3% en riesgo bajo, 17.2% en riesgo intermedio y 3.4% en riesgo alto. Por escala de Hasford encontramos 93.2% en riesgo bajo, 3.4% en riesgo intermedio y 3.4% en riesgo alto. En los pacientes que recibieron tratamiento con imatinib el riesgo por EUTOS fue bajo en 93.1% y alto en 6.9%.
En cuanto al cromosoma Filadelfia identificado en el cariotipo convencional, se documentó en 58.6% de los pacientes, PCR positivo a BCR/ABL se identificó en 79.3%, la detección del cromosoma Filadelfia por método de FISH se contó en 10.3%. Ningún paciente se diagnosticó con las tres técnicas, en tanto que solo 6.8 % de los pacientes contaron con dos métodos. Las alteraciones citogenéticas asociadas se encontraron en 13.8% de los pacientes, las documentadas fueron 45-X, 47XY +19, 45 X-Y y 47XY +8. En cuanto al punto de ruptura del transcrito en pacientes con BCR/ABL positivo, P210 se encontró en 87.7%, P190 en 8.7%, doble positivo a P190 y P210 en 3.6% y ninguno positivo para P230. Los logaritmos en escala internacional se determinaron con media de 26.1% (IC95%, 6.9-45.4) al diagnóstico en los pacientes con positividad al BCR/ABL.
Tras el diagnóstico de leucemia mieloide crónica todos los pacientes recibieron citorreducción con hidroxiurea. El imatinib en primera línea lo recibieron 58.7% de los pacientes, inhibidores de segunda generación recibieron nilotinib 17.2% de los pacientes y 24.1% dasatinib.
De los pacientes tratados con imatinib en primera línea, la dosis fue de 400 mg cada 24 horas con máximo de 600 mg cada 24 horas. Asimismo, el nilotinib se prescribió a dosis de 600 mg cada 24 horas. Por último, la dosis de dasatinib prescrita fue de 100 mg con intervalo de 70 a 150 mg.
La respuesta hematológica se logró en 94.1% de los pacientes tratados con imatinib, 90% de los tratados con nilotinib y 96% de los pacientes tratados con dasatinib; no se encontró diferencia estadística entre la respuesta hematológica y los inhibidores prescritos. La respuesta se logró en el 100% de los pacientes a las 4 semanas de iniciado el imatinib, a la semana 2 en los pacientes con nilotinib y dasatinib (Cuadros 1 y 2).
Cuadro 1 Hallazgos en la biometría hemática y BCR/ABL al diagnóstico de leucemia mieloide crónica y cifras actuales tras la administración de inhibidores de tirosin cinasa, que muestran la normalización de los mismos , excepto en eosinófilos
Cuadro 2 Grados de respuesta alcanzados por tipo de inhibidor de tirosin cinasa
| Respuesta | Imatinib (%) | Nilotinib (%) | Dasatinib (%) | p |
|---|---|---|---|---|
| Hematológica | 94.1 | 90 | 96 | 0.10 |
| Citogenética | 69.2 | 60 | 57 | 0.17 |
| Molecular mayor | 62.9 | 68.6 | 69.1 | 0.90 |
| Molecular de 4.5 o más profunda | 13.3 | 26 | 28 | 0.06 |
La respuesta citogenética completa a 12 meses se alcanzó en 69.2% de los pacientes tratados con imatinib, 60% en el caso de los tratados con nilotinib y 57% en los pacientes tratados con dasatinib. No se encontró diferencia significativa entre la administración de inhibidores de tirosin cinasa y la respuesta citogenética. De los pacientes que lograron respuesta citogenética completa el tiempo para alcanzarla fue: con imatinib 18 meses, nilotinib 10 meses y dasatinib 8 meses. No se identificaron diferencias entre los inhibidores de tirosin cinasa de segunda generación (nilotinib vs dasatinib), pero sí en los de primera y segunda generación (p < 0.05).
La respuesta molecular nula se documentó en 13.6% de los casos, la respuesta molecular menor en 18.2% de los casos, en tanto que se obtuvo respuesta molecular mayor o más profunda en 68.2% de los casos. La respuesta molecular mayor se documentó en 62.9% de los pacientes tratados con imatinib, en 68.6% de los tratados con nilotinib y en 69.1% de los pacientes tratados con dasatinib. No se encontró diferencia entre los inhibidores de tirosin cinasa y la respuesta molecular mayor. El tiempo para lograr la respuesta molecular mayor fue de 12 meses con imatinib, 9 meses con nilotinib y dasatinib. No hubo diferencia estadística entre los grupos. La respuesta molecular temprana no se determinó en ningún caso porque el primer estudio molecular se realizó en todos los casos después de tres meses de iniciado el inhibidor de tirosin cinasa.
El cambio de inhibidor de tirosin cinasa se realizó en 37.9% de los pacientes, las razones fueron: falla en 31% e intolerancia en 6.9% de los casos. No hubo pacientes que experimentaran cambios por resistencia. El 31.8% de los casos sin respuesta molecular no tenían mutaciones identificadas en el ABL. El tiempo de cambio de inhibidor de tirosin cinasa fue de 33 meses como mediana con percentil 25 de 24 meses y percentil 75 de 38 meses.
El 17.2% de los pacientes cambiaron de imatinib a nilotinib, 17.2% de imatinib a dasatinib, 3.4% de nilotinib a dasatinib y 3.4% de dasatinib a nilotinib. En la actualidad se encuentra 31% con imatinib, 34.5% con nilotinib y 34.5% con dasatinib.
La supervivencia libre de enfermedad en este grupo a cinco años fue de 83%. La supervivencia global a cinco años fue de 94% (Figura 2).
DISCUSIÓN
La administración de inhibidores de tirosin cinasa se ha convertido en el tratamiento están-dar para los pacientes con leucemia mieloide crónica en todo el mundo.16 La supervivencia en la era imatinib se ha incrementado de forma importante, lo que ha transformado la historia natural de la enfermedad. 17 La normalización de la biometría hemática con remisión de la esplenomegalia es el primer escalón de las respuestas, en nuestro caso fue superior a 90% de los pacientes independientemente del inhibidor administrado, Von Bubnoff reportó que de no lograrlo repercute de forma adversa en las otras respuestas y en la supervivencia.18,19
Las respuestas citogenéticas se encontraron en alrededor de 60% a los 12 meses con los tres inhibidores, lo que es inferior a lo reportado en diversos estudios prospectivos fase III, como el de Cross y su grupo, en el que se alcanzó incluso 80% en los primeros 12 meses en estudio.20
La respuesta molecular mayor o más profunda se logró en 68%, similar a los resultados reportados por Ayala y colaboradores en México, asimismo, Mahon21 destaca la importancia de lograr respuesta de al menos tres logaritmos para la supervivencia libre de eventos y supervivencia global.
El número de pacientes en nuestro estudio es limitado, es solo una descripción y análisis que permite explicar algunas características. No medimos la respuesta molecular temprana. Se realizó análisis de supervivencia pero fue limitado en nuestra muestra. Es, sin duda, una necesidad en nuestro país realizar estudios colaborativos para tener mejores perspectivas epidemiológicas en México.











 nueva página del texto (beta)
nueva página del texto (beta)




