ANTECEDENTES
La endocarditis de Libman-Sacks, también llamada endocarditis verrucosa atípica, es una endocarditis no infecciosa caracterizada por vegetaciones estériles. Se encuentran lesiones anatómicas entre 15 y 75% de los estudios de necropsia, en 40 a 50% se detectan por otros motivos al realizar ecocardiografía transtorácica y en 50 a 60% por abordaje transesofágico dirigido. Las alteraciones anatómicas se localizan habitualmente en las válvulas mitral y aórtica. Los estudios anatomopatológicos pueden mostrar dos tipos diferentes de verrucosidades: lesiones activas con necrosis focal e infiltración de células mononucleares, más frecuentemente observadas en pacientes jóvenes con inicio reciente de la enfermedad, y lesiones antiguas cicatriciales caracterizadas por tejido fibroso vascularizado, asociado con calcificaciones, encontradas en pa cientes con enfermedad de larga evolución y que frecuentemente se relacionan con insuficiencia valvular.1,2 También se ha informado la asociación entre anormalidades valvulares y la existencia de anticuerpos antifosfolipídicos;3 su evolución no parece modificarse por la administración de anticoagulantes orales. Asimismo, se ha encontrado mayor frecuencia de anticuerpos anti-Ro/SSA y anti-La/SSB en pacientes con afección valvular, aunque su papel patogénico no está dilucidado.4
Se han postulado dos diferentes hipótesis de la patogénesis de las alteraciones valvulares en lupus eritematoso sistémico: los anticuerpos antifosfolipídicos y antiendotelio se unen y activan a las células endoteliales, llevando a agregación plaquetaria con formación de trombos, o el depósito de los inmunocomplejos entre el endotelio y la membrana basal lleva a infiltración por células inflamatorias. Es posible que ambos mecanismos actúen de manera sinérgica.3
La endocarditis habitualmente es asintomática y rara vez lleva a la aparición de soplos audibles. Las vegetaciones crecen cerca de los bordes libres de las valvas, por lo que no alteran el sistema de cierre valvular, aun cuando sean grandes y protruyan dentro de las cámaras cardiacas. Las complicaciones de la endocarditis de Libman-Sacks son raras, aunque pueden ocurrir eventos embólicos. Las lesiones hemodinámicamente significativas se manifiestan en sólo 3 a 4% de los pacientes. La endocarditis infecciosa sobreagregada se observa en 7% de los pacientes con enfermedad valvular, mientras que el embolismo central o periférico ocurre, incluso, en 13%.5,6 La incidencia de este hallazgo en los estudios postmortem ha mostrado tendencia hacia su disminución en los últimos 40 años, lo que puede ser resultado de la administración generalizada de glucocorticoides.7
Debido a que la endocarditis de Libman-Sacks habitualmente es silente, por lo general, no es tratada. Cuando se logra detectar en estadios tempranos y activos, se recomienda la administración de los glucocorticoides (PDN 1 mg/ kg/día), especialmente en los pacientes con anticuerpos antifosfolipídicos y anticoagulante lúpico negativos. El daño valvular puede ser tan grave que frecuentemente se requiere reemplazo por medios quirúrgicos incluso en 20% de los pacientes. El cuadro clínico más grave lo representa la insuficiencia aórtica y los factores clínicos relacionados más comúnmente con su existencia son la hipertensión arterial sistémica y la válvula aórtica bicúspide.8
CASO CLÍNICO
Paciente femenina de 62 años de edad, con antecedente de cáncer cervicouterino in situ con histerectomía, quien ingresó por disnea de grandes esfuerzos, fatiga, astenia y adinamia. Analítica al ingreso: hemoglobina en 5.9 g/ dL, hematócrito 17.7%, deshidrogenasa láctica 2030 UI/L, bilirrubina total 6.3 mg/dL, bilirrubina indirecta 5.8 mg/dL. El Coombs reportó positivo a IgG y C3D, lo que confirmó el diagnóstico de anemia hemolítica.
Ante la sospecha de enfermedad autoinmunitaria se solicitaron los siguientes anticuerpos: anti-ADN doble cadena 110 unidades (control < 9.6 unidades). Anti-beta 2 glucoproteína negativos, anti-Smith negativos, anti-ribonucleoproteína (RNP) negativos, anti-cardiolipinas IgG > 40 unidades. Se estableció diagnóstico de lupus eritematoso sistémico y síndrome antifosfo-lipídico; se inició tratamiento con prednisona a 1.5 mg/kg, durante su hospitalización la paciente tuvo fiebre y desorientación sin otro hallazgo a la exploración física, por lo que se solicitó punción lumbar que evidenció hiperproteinorraquia, sin otra alteración. La paciente mostró mejoría clínica, por lo que se inició danazol, cuenta con cultivo de líquido cefalorraquídeo, urocultivo y dos hemocultivos sin desarrollo bacteriano.
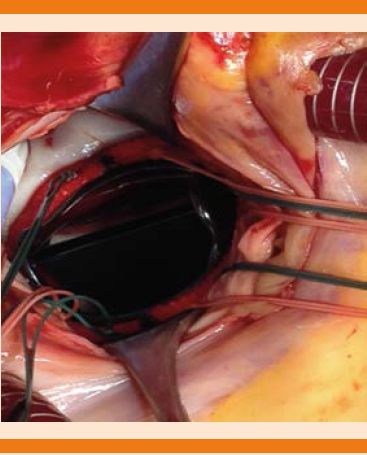
Durante su evolución se encontró soplo regurgitante en foco mitral grado 3 de la escala de Levine-Harvey, irradiado a la región axilar, sin s3 ni s4. Tórax posterior con adecuada entrada y salida de aire, estertores subcrepitantes espiratorios en bases de forma bilateral, no se integró síndrome pleuropulmonar. Extremidades íntegras, pulsos distales presentes, llenado capilar integro, sin dermatosis, sin fenómenos vasculares a nivel distal. El estudio ecocardiográfico transtorácico (Figura 1) mostró ligera dilatación del ventrículo izquierdo, diastólico de 53 mm y sistólico de 35 mm, distancia de 9 mm, sistólico de la aurícula izquierda paraesternal de 42 mm, apical 53 x 43 mm, área de 18 cm2, diastólico del ventrículo derecho de 29 mm, área de la aurícula derecha de 16 cm2, anillo pulmonar de 24 mm, tronco pulmonar de 24 mm, anillo aórtico de 20 mm y la unión sinutubular de 28 mm; grosor parietal normal, septum diástole de 7 mm y sístole de 12 mm, pared posterior diástole de 7 mm y sístole de 12 mm; movilidad global y segmentaria normal, con fracción de eyección de 60% y de acortamiento de 32%, volumen diastólico final de 133 mL y sistólico final de 53 mL; válvula mitral con imagen en los bordes libres de ambas valvas que prolapsaban hacia la aurícula izquierda, de 11 mm por 6 la de la valva anterior y 8 mm la valva posterior, lo que condicionaba insuficiencia mitral severa, ancho de vena contracta de 9 mm, rebasaba la mitad de la aurícula el chorro, intensidad de la señal acústica 4+, orificio efectivo regurgitante de 0.4 cm2, volumen regurgitante de 71 mL, porcentaje de área regurgitante de 38%, disfunción diastólica tipo II, patrón pseudonormalizado, onda E: 1.27, relación E/A de 1.17, tiempo de desaceleración 200 mseg y de relajación isovo lumétrica de 55 mseg, onda E+ : medial 0.05 m/ seg y lateral 0.06 m/seg, relación E/E: 22.51, s/d 0.74; válvula aórtica trivalva, sin alteraciones; con presión diastólica pulmonar de 15 mmHg; tricúspide normal, con velocidad máxima de regurgitación de 2.66 m/seg y presión sistólica del ventrículo derecho de 38 mmHg, TAPSE de 24 mm; vena cava inferior de 13 mm, con colapso de 70%. El caso se presentó en sesión médico-quirúrgica y se decidió realizar cambio valvular mitral con prótesis mecánica y resección de las vegetaciones (Figura 2). En la inspección quirúrgica las vegetaciones se redujeron a engrosamiento del borde libre de ambas valvas, con cierta calcificación, deformación de los bordes y al extraerlas en más de la mitad de su extensión se observó infiltración hemorrágica (Figuras 3 y 4). El anillo en ambas valvas se observó de características normales, e incluso dos cuerdas tendinosas estaban con el mismo aspecto irregular a calcificado de la superficie sin observar propiamente aspecto de vegetación y dos de estas cuerdas estaban rotas del lado ventricular (por ruptura espontánea). El estudio anatomopatológico confirmó endocarditis aguda moderada.

Figura 1 Ecocardiograma transtorácico que muestra engrosamiento valvular mitral por la vegetación en la cara ventricular.

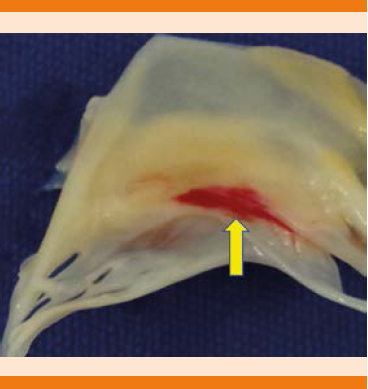
Figura 3 Vegetación localizada en la cara ventricular de la válvula que afecta las cuerdas tendinosas con ruptura de dos de ellas.
DISCUSIÓN
El caso que exponemos es relevante por diversas razones, la primera es un caso cuyos síntomas de manifestación fueron de insuficiencia cardiaca de 62 años se encuentra fuera de la media de edad en que ocurren los casos de lupus eritema toso sistémico-Libman-Sacks (27 ± 3 años). En tercer lugar, es inusual el daño valvular grave en los casos de lupus eritematoso sistémico-Libman-Sacks, especialmente con daño subvalvular que genere insuficiencia valvular grave que requiera cambio de la válvula, identificándose, en este caso, ruptura de las cuerdas tendinosas e infiltrado hemorrágico como causa del daño valvular que la llevó a la cirugía.
La mayoría de los casos de lupus eritematoso sistémico-Libman-Sacks responden a tratamiento con esteroides sistémicos, por lo que es importante su identificación, abordaje y diagnóstico; el caso comunicado tuvo adecuada evolución con reemplazo mitral porque la paciente se encuentra en clase funcional I.
La endocarditis de Libman-Sacks se observa como complicación cardiaca de lupus eritematoso sistémico y de síndrome antifos-folipídico, esta endocarditis se caracteriza por vegetaciones fibrinosas estériles que afectan principalmente la válvula mitral y aórtica y pueden observarse hasta en 30% de los pacientes; su curso es asintomático en la mayoría de los casos y como complicaciones se han reportado endocarditis bacteriana sobreagregada, eventos tromboembólicos, disfunción valvular severa que requiere manejo quirúrgico y alta mortalidad.5 Se ha reportado que hasta en 63% de estos pacientes la válvula mitral es la más afectada.6
La paciente tuvo síntomas de insuficiencia cardiaca y hepática, se detectó soplo regurgitante mitral, por ecocardiograma transtorácico se identificó vegetación en la válvula mitral con insuficiencia severa en la válvula mitral, lo que también es una forma de manifestación poco frecuente, descartándose otras causas frecuentes que afectan la válvula mitral, como la isquémica; en el control con coronariografía invasiva no se advirtieron lesiones coronarias.
El ecocardiograma transesofágico detecta vegetaciones valvulares con más frecuencia que el ecocardiograma transtorácico por lo que se prefiere para su diagnóstico.9 En la mayoría de los casos está indicado el tratamiento conservador con inmunosupresores, anticoagulación, profilaxis para endocarditis y tratamiento de la insuficiencia cardiaca. En casos con disfunción valvular severa debe valorarse el tratamiento quirúrgico de manera temprana. Las complicaciones tromboembólicas son comunes después de la cirugía valvular, sobre todo en presencia de anticuerpos antifosfolipídicos.5-21
La patogénesis de la endocarditis por Libman-Sacks se ha relacionado con la formación y depósitos de trombos de fibrina en una valva deteriorada. La formación causa fibrosis de la valva, distorsión y disfunción subsecuente.8
CONCLUSIÓN
La endocarditis de Libman-Sacks afecta a pacientes con lupus eritematoso sistémico y síndrome antifosfolipídico, en la mayoría de los casos es asintomática, su incidencia disminuye con la administración de esteroides. Debe realizarse ecocardiograma transesofágico para su diagnóstico debido a que tiene mayor sensibilidad y especificidad para la detección de vegetaciones valvulares con predominio de afección mitral y aórtica, e iniciar tratamiento conservador y, en caso de disfunción valvular severa, valorar el beneficio del reemplazo valvular mitral, como lo ilustra el caso que comunicamos.22-25











 text new page (beta)
text new page (beta)