ANTECEDENTES
La obesidad, definida por la Organización Mundial de la Salud como exceso de tejido adiposo -en particular el tejido adiposo visceral- que se acumula en una cantidad tal que la salud puede verse afectada de manera adversa,1 se ha convertido en un importante problema de salud mundial porque se asocia con varias enfermedades, entre las que se incluyen: resistencia a la insulina, diabetes tipo 2, aterosclerosis y cardiopatía isquémica; que reducen la esperanza de vida y, en conjunto, tienen enormes consecuencias económicas y sociales.2 La evidencia indica que la obesidad está causalmente vinculada con un estado inflamatorio crónico de bajo grado, que contribuye a la aparición de trastornos relacionados con la obesidad, en particular con la disfunción metabólica.3
Está bien establecido que el tejido adiposo no sólo está implicado en el almacenamiento de energía, sino que también funciona como órgano endocrino que secreta diversas sustancias bioactivas denominadas en conjunto adipocinas. La expresión desregulada de estos factores, causada por el exceso de adiposidad y la disfunción de los adipocitos, se ha relacionado con la patogénesis de diversas enfermedades.4
Adipocinas
El tejido adiposo se ha considerado tradicionalmente un órgano de almacenamiento de energía a largo plazo, pero ahora se sabe que tiene un papel clave en la integración del metabolismo sistémico. Esta función metabólica está mediada, en parte, por su capacidad de secretar numerosas proteínas. Los factores que son secretados por el tejido adiposo se denominan colectivamente adipocinas. La expresión de las adipocinas también puede variar según el sitio de depósito de tejido adiposo. Los dos depósitos más abundantes son el tejido adiposo visceral y subcutáneo que producen perfiles únicos de adipocinas (Figura 1).
La producción de la mayor parte de las adipocinas está regulada positivamente en los sujetos obesos, donde estas proteínas proinflamatorias funcionan para promover enfermedades metabólicas relacionadas con la obesidad.
El exceso de adiposidad visceral se relaciona con aumento de las concentraciones de la proteína C reactiva (PCR), que se asocia con la resistencia a la insulina, la hipertensión y la dislipidemia. De hecho, el aumento de las concentraciones de PCR y de su inductor interleucina 6 (IL-6) son predictivos de diabetes tipo 2 en diversas poblaciones. Además, las intervenciones destinadas a causar la pérdida de peso conducen a reducciones en las concentraciones de proteínas proinflamatorias, incluidas la PCR y la IL-6.5
Sin embargo, el tejido adiposo también secreta en menor cantidad adipocinas antiinflamatorias, como la adiponectina, que ha sido objeto de intensa investigación.
Adiponectina
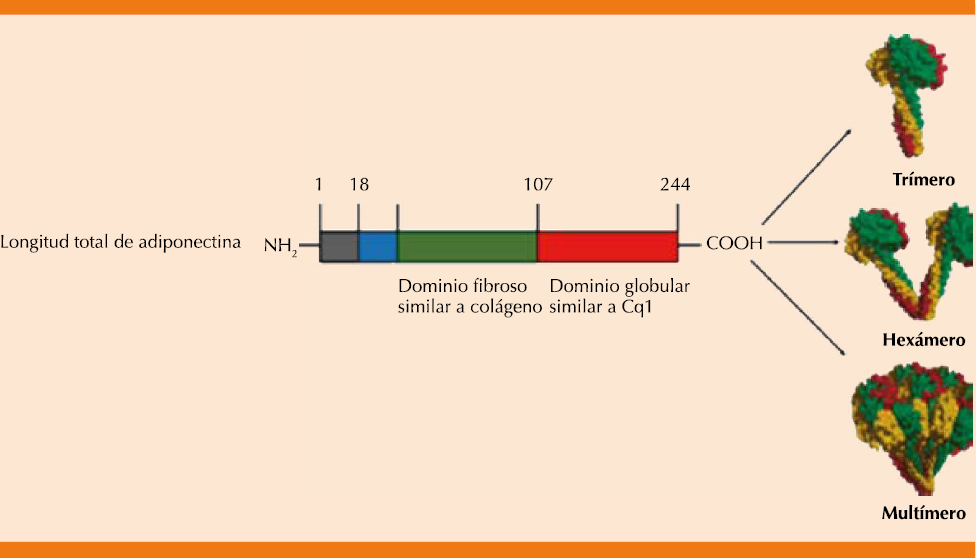
La adiponectina (también conocida como Acrp30, AdipoQ, apM1 o GBP-28)6-9es una proteína de 244 aminoácidos y 30 kDa, secretada principalmente por el tejido adiposo. Fue identificada casi simultáneamente por cuatro grupos diferentes usando diversos enfoques. La adiponectina humana está codificada por el gen Adipo Q, que abarca 17 kb en el locus cromosómico 3q27. El gen para la adiponectina humana contiene tres exones, con el codón de inicio en el exón 2 y el codón de parada en el exón 3.10,11 El locus cromosómico 3q27 se ha identificado como una región que porta un gen de susceptibilidad para la diabetes tipo 2 y el síndrome metabólico.12,13
La adiponectina tiene un dominio similar al colágeno seguido por un dominio globular que es semejante al factor del complemento C1q. De manera similar a C1q, la adiponectina forma trímeros, a través de interacciones de los dominios de tipo colágeno, que pueden asociarse adicionalmente para formar oligómeros multiméricos estables. La adiponectina se secreta desde los adipocitos al torrente sanguíneo como tres complejos oligoméricos, que incluyen un trímero (67 kDa), un hexámero (140 kDa) y un multímero de alto peso molecular (300 kDa) que comprende al menos 18 monómeros, es posible detectar las tres formas en la sangre (Figura 2).14,15
AdipoR1 y AdipoR2, dos receptores transmembrana estructuralmente relacionados, se han identificado como receptores de adiponectina funcionales. Son estructural y funcionalmente distintos de los receptores clásicos acoplados a proteína G (GPCR). A diferencia de otros GPCR reportados, AdipoR1 y AdipoR2 tienen una topología de membrana invertida con un extremo NH2 citoplasmático y un dominio terminal COOH extracelular corto de aproximadamente 25 aminoácidos. AdipoR1 y AdipoR2 son codificados por genes situados en las regiones cromosómicas 1p36.13-q41 y 12p13.31, respectivamente. AdipoR1 es un receptor de alta afinidad para la adiponectina globular y de baja afinidad para adiponectina de longitud completa. Se expresa de forma ubicua, pero principalmente y en abundancia en el músculo esquelético. Asimismo, AdipoR2 reconoce principalmente adiponectina de longitud completa y se expresa predominantemente en el hígado.16
La concentración plasmática de adiponectina es alta (3 a 30 μg/mL) y depende de distintos factores. Se ha observado menor concentración de adiponectina en individuos obesos en comparación con individuos delgados. Estudios in vitro en adipocitos 3T3-L1 han mostrado que la producción de adiponectina se ve inhibida por factores proinflamatorios, como TNF e IL-6, así como por hipoxia y estrés oxidativo. Los agonistas del PPARγ promueven la diferenciación de los adipocitos y la secreción de adiponectina se estimula en los adipocitos mediante la activación del PPARγ.17
El incremento en el volumen del tejido adiposo observado en la obesidad se acompaña de otros cambios en las características biológicas habituales de éste, que se vuelve disfuncional. El depósito visceral de la grasa, la hipertrofia y cambio del perfil secretor de los adipocitos, junto con la infiltración del tejido adiposo por células inflamatorias son algunas de las características que determinan la comunicación alterada del tejido adiposo con otros órganos. Varias observaciones clínicas apoyan una asociación entre las concentraciones de adiponectina y la disfunción metabólica ligada a la obesidad: primero, las concentraciones plasmáticas de adiponectina se correlacionan negativamente con la acumulación de grasa visceral; segundo, las concentraciones plasmáticas de adiponectina disminuyen en pacientes con diabetes tipo 2, y tercero, los concentraciones altas de adiponectina se asocian con menor riesgo de diabetes tipo 2. Estas características hacen a la adiponectina ÚNICA porque es expresada en concentraciones más altas por adipocitos funcionales, pero su expresión está regulada negativamente en los adipocitos disfuncionales, que se vinculan con la obesidad.18,19
Adiponectina y metabolismo intermediario
La evidencia de modelos experimentales indica que la adiponectina protege contra la disfunción metabólica ligada a la obesidad. Se ha demostrado que la administración de adiponectina a ratones diabéticos reduce la hiperglucemia potenciando la actividad de la insulina; asimismo, cuando se administra a ratones obesos, aumenta la oxidación de ácidos grasos en el tejido muscular y reduce las concentraciones plasmáticas de glucosa, ácidos grasos libres y triglicéridos. En concordancia con estas observaciones, los ratones con deficiencia de adiponectina desarrollan resistencia a la insulina exacerbada por la dieta, mientras que la sobreexpresión en ratones ob/ob transgénicos en el gen de adiponectina, mejora el metabolismo de la glucosa independientemente de la pérdida de peso.20
Los efectos de la adiponectina en la sensibilidad a la insulina parecen estar mediados, en parte, por su capacidad de activar la proteína cinasa activada por AmP (AmPK) en el músculo esquelético y el hígado, porque la activación de AmPK conduce al aumento en la oxidación de ácidos grasos y la absorción de glucosa en el tejido muscular y la inhibición de la gluconeogénesis en el hígado. Se piensa que la adiponectina media la activación de AmPK a través de interacciones con sus receptores de superficie celular: receptor de adiponectina 1 y receptor de adiponectina 2. En las células del músculo esquelético, se ha descubierto que la adiponectina aumenta la concentración de Ca2+ intracelular y la actividad de la proteína cinasa dependiente de calcio/calmodulina (CamKK), AmPK y sirtuina 1(sIRT1), lo que eleva la expresión y actividad del coactivador 1α de PPARγ (PPARγC1α).21 Figura 3

Basada en: Ruan H, et al. Adiponectin signaling and function in insulin target tissues . J Mol Cell Biol 2016,8:101-109.
Figura 3 Vías de señalización de la adiponectina a través de AdipoR1 y AdipoR2.
Múltiples estudios en animales y humanos han demostrado correlación entre las concentraciones plasmáticas de adiponectina y la sensibilidad a la insulina.22-25 Esta correlación permanece incluso después del ajuste por la distribución del tejido adiposo.
De hecho, la disminución en las concentraciones de adiponectina parece identificar la resistencia a la insulina antes de la aparición de una diabetes manifiesta. Se observó en un estudio reciente que las concentraciones circulantes de adiponectina disminuyeron con la progresión de la resistencia a la insulina en monos rhesus genéticamente predispuestos a padecer resistencia a la insulina. Esta disminución en la adiponectina precedió a la aparición de hiperglucemia manifiesta.23 Asimismo, la administración de adiponectina a ratones ha demostrado inducir la pérdida de peso, revertir la hiperlipidemia y la hiperglucemia y disminuir los marcadores de inflamación vascular.26-28
Un estudio en adultos jóvenes no diabéticos mostró disminución en las concentraciones de adiponectina asociadas con aumento de las concentraciones de glucosa en ayunas y los índices de HOMA.29,30 Otros estudios han demostrado que las concentraciones más altas de adiponectina se relacionan con riesgo reducido de diabetes tipo 2 en múltiples grupos étnicos.31-33
Tratamientos experimentales
Debido al amplio potencial benéfico y terapéutico en humanos, la adiponectina se ha convertido en el tema de intensa investigación preclínica en los últimos años. La manipulación preclínica de la adiponectina plasmática circulante se ha planteado en dos enfoques: la administración de adiponectina recombinante o el aumento farmacológico de la producción endógena de adiponectina. Sin embargo, ha habido una serie de dificultades en la producción de adiponectina recombinante porque la adiponectina de longitud completa producida a través de ingeniería genética en bacterias carece de modificaciones postraduccionales críticas, por lo que es virtualmente inactiva y requiere que se produzca adiponectina de longitud completa en cultivo de células de mamífero, un proceso que generalmente no es factible para la producción farmacéutica a gran escala. Debido a las dificultades inherentes en la producción de adiponectina recombinante, combinadas con su semivida circulante breve prevista una vez administrada, el desarrollo de una estrategia exitosa para su administración terapéutica se ha vuelto bastante desafiante.34 En consecuencia, los esfuerzos para aumentar las concentraciones de adiponectina se han centrado en aumentar la producción de adiponectina endógena por el tejido adiposo. El éxito de esta táctica, sin embargo, es críticamente dependiente de nuestra comprensión de los mecanismos celulares subyacentes a la biosíntesis y la secreción de adiponectina.
Se ha observado que muchos medicamentos existentes aumentan las concentraciones de adiponectina, incluyendo las estatinas, los inhibidores de la enzima convertidora de angiotensina y las tiazolidinedionas. Gran parte del mecanismo por el que estos medicamentos aumentan la adiponectina no está claro, pero la comprensión de estos mecanismos puede indicar el camino a futuras terapias dirigidas para aumentar la adiponectina.
Perspectivas
Varios estudios in vitro e in vivo han marcado un progreso en la exploración del mecanismo fisiológico a través del cual la adiponectina ejerce su acción. En particular, el conocimiento de las funciones pleiotrópicas de la adiponectina se ha ido acumulando rápidamente. Sin embargo, muchas preguntas deben abordarse antes de que la adiponectina pueda usarse como un objetivo terapéutico potente. Por ejemplo, la existencia de diferentes isoformas oligoméricas de adiponectina y sitios de producción, el dimorfismo sexual en la concentración de adiponectina, la distribución de isoformas oligoméricas y la identificación de múltiples receptores con afinidad diferente por oligómeros de adiponectina se suman a la complejidad de las acciones de adiponectina en una serie de procesos y enfermedades. Sin embargo, los estudios en modelos animales de diabetes, obesidad y aterosclerosis demostraron claramente que la adiponectina puede tener efectos benéficos en esos estados de enfermedad.
CONCLUSIONES
La adiponectina es una hormona derivada del tejido adiposo que parece desempeñar un papel decisivo en la protección contra la resistencia a la insulina y la diabetes tipo 2. Se cree que la disminución de las concentraciones de adiponectina juega un papel central en el desarrollo de la diabetes tipo 2, la obesidad y las enfermedades cardiovasculares en humanos. La investigación en humanos y modelos animales ha demostrado consistentemente el papel de la adiponectina como un importante regulador fisiológico de la sensibilidad a la insulina, la glucosa y el metabolismo de los lípidos, así como la homeostasia cardiovascular. Estudios recientes realizados en modelos humanos y animales de obesidad, diabetes y aterosclerosis han reportado el posible papel de la adiponectina y los receptores de adiponectina en el tratamiento de estas enfermedades metabólicas. Como la producción de adiponectina endógena se ve afectada como efecto de la obesidad y las enfermedades relacionadas, un enfoque terapéutico práctico es recurrir a intervenciones farmacológicas o dietéticas para restablecer la capacidad del tejido adiposo en la secreción de adiponectina. Aunque la administración directa de adiponectina ha demostrado mejorar la resistencia a la insulina y la aterosclerosis en modelos animales, no se han realizado ensayos en humanos, se necesitan ensayos clínicos para mostrar los beneficios causados por la elevación en las concentraciones de adiponectina per se. En el futuro, esta estrategia probablemente pueda servir como enfoque terapéutico potencial, novedoso e innovador para el tratamiento de las enfermedades metabólicas.











 nueva página del texto (beta)
nueva página del texto (beta)