ANTECEDENTES
Las micobacterias atípicas o no tuberculosas son patógenos importantes que afectan a los humanos, que pueden ser causa de enfermedades sistémicas y la manifestación clínica más frecuente es la cutánea.1 Otras manifestaciones pueden afectar los pulmones, los ganglios linfáticos y los aparatos gastrointestinal y genitourinario. El diagnóstico de este tipo de infecciones suele ser tardío debido a la baja sospecha clínica y a la dificultad para el cultivo e identificación de los patógenos.2
Este grupo bacteriano fue clasificado en 1950 por Runyon, según su patrón de pigmentación, en cuatro grupos (Cuadro 1).3,4
Las bacterias del género Mycobacterium son aerobias, bacilos inmóviles, no encapsulados, no esporulados, que contienen alto contenido de lípidos, principalmente en la pared celular, lo que hace difícil la permeabilidad de soluciones colorantes, agua y microbicidas.5 Representan 10% de todas las micobacterias;6 sin embargo, el conocimiento de sus mecanismos inmunológicos y patogénicos es aún limitado, lo que contribuye a su diagnóstico tardío.
Estas micobacterias se encuentran en el medio ambiente, biopelículas o ecosistemas bien organizados adheridos a una membrana celular o en un tejido, incluyendo agua, tierra y polvo. Mycobacterium chelonae puede crecer en sistemas de agua destilada y se ha encontrado en albercas, suelo, plantas, heces de animales sanos y en tinas para hidroterapia, además de ser resistente a esterilizadores y antisépticos; también se han detectado bacilos en eventos quirúrgicos de rutina.7M. chelonae suele colonizar soluciones inyectables, por lo que se ha asociado con infecciones posteriores a procedimientos cosméticos.
De acuerdo con el sistema de clasificación de Runyon, M. chelonae pertenece al grupo de micobacterias de rápido crecimiento, específicamente al grupo Mycobacterium chelonae-Mycobacterium abcessus (MC-MAG), que, junto con el complejo Mycobacterium fortuitum, es responsable de la mayor parte de las infecciones causadas por micobacterias de rápido crecimiento.8 Mientras que M. fortuitum se considera productor de infecciones en pacientes inmunocompetentes hasta en 90%,9 M. chelonae afecta con mayor frecuencia a personas inmunodeprimidas.10
En términos clínicos, las lesiones en la piel pueden manifestarse como celulitis, furunculosis, úlceras, nódulos dolorosos, gomas y abscesos que drenan contenido purulento o serosanguíneo. Las especies más comúnmente relacionadas con enfermedades en la piel son Mycobacterium marinum, ulcerans, fortuitum, chelonae y abscesus.11
Se comunican dos casos clínicos por M. chelonae, uno adquirido en medio hospitalario y otro en la comunidad. Las características clínicas similares fueron la aparición de orificios fistulosos y úlceras, la evolución crónica, así como respuesta similar al tratamiento convencional.
CASOS CLÍNICOS
Caso 1
Paciente masculino de 68 años de edad, quien cursó con hernia inguinal bilateral que requirió hernioplastia con colocación de malla hacía 20 años; tuvo una segunda hernioplastia y recolocación de malla en 2015, en cuyo posoperatorio tardío tuvo una fístula y úlcera en abdomen, que secretaba material seropurulento.
A la exploración física se encontró una dermatosis localizada al tronco del que afectaba el abdomen en el hipogastrio y el flanco izquierdo, constituida por una placa vegetante de bordes irregulares eritematosa con tres pequeñas úlceras u orificios fistulosos por donde drenaba secreción seropurulenta. No había fiebre ni dolor (Figuras 1 y 2).
En el flanco derecho se palpó una masa blanda renitente de 8 cm de diámetro, no fija a planos profundos y no dolorosa (que correspondía a la hernia inguinal). Con diagnóstico clínico de micobacteriosis atípica vs tuberculosis cutánea se inició protocolo de estudio con biometría hemática, química sanguínea y pruebas de función hepática, que se encontraron en límites normales. Se obtuvo telerradiografía de tórax sin anormalidades. El derivado proteico purificado (PPD) fue negativo. La biopsia de piel demostró infiltrado granulomatoso, no tuberculoso crónico (Figura 3).
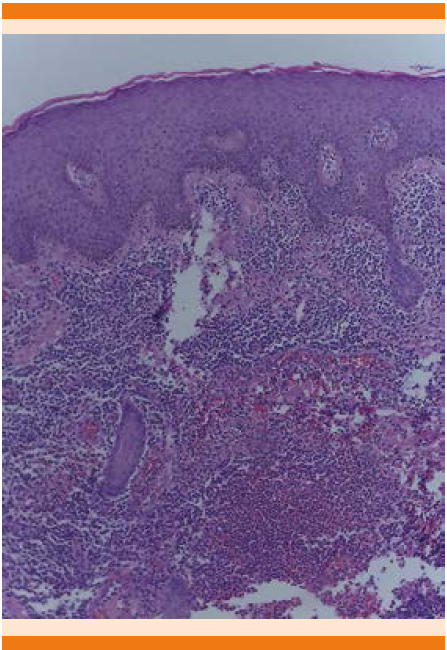
Figura 3 Microfotografía 4X H/E con atrofia epidérmica y papilomatosis e infiltrado inflamatorio granulomatoso crónico (caso 1).
Se envió muestra de piel al Laboratorio Estatal de Salud Pública del Estado de México y el departamento de micobacteriosis envió el resultado de cultivo negativo para bacilo tuberculoso y positivo para M. chelonae. La reacción en cadena de la polimerasa (PCR) Genexpert Mtb/Rif en tiempo real resultó positiva para M. chelonae.
Se inició tratamiento con claritromicina a dosis de 500 mg/12 h durante 6 meses, con mejoría relativa, se inició doxiciclina 100 mg cada 24 h durante tres meses, con lo que hubo disminución del tamaño de la lesión, los orificios fistulosos dejaron de drenar material seropurulento y se envió a cirugía general para una tercera reintervención y corrección de hernia inguinal.
Caso 2
Paciente masculino de 32 años de edad originario y residente de Texcaltitlán, Estado de México, dedicado a la agricultura, alcoholismo ocasional a base de fermentados, casa-habitación tipo rural sin servicios básicos. En 1994 vivió en Fresno, California, Estados Unidos, donde también se dedicó a la agricultura hasta 1997.
Inició a los 12 años de edad con una dermatosis de 20 años de evolución, constituida por una herida en la pierna derecha, que fue creciendo en longitud y aumentando de volumen, cambiando de color piel a marrón claro, fue tratado por médicos generales, sin observar cambios en la dermatosis. El paciente refirió que en Fresno, California, Estados Unidos, le iniciaron tratamiento con diagnóstico de tuberculosis cutánea con antifímicos; no obstante, desconocía con certeza qué tipo y a qué dosis. Refirió que durante seis meses tuvo alivio transitorio de la lesión; sin embargo, al año inició nuevamente con recaída.
Acudió a consulta privada de dermatología donde se encontró una dermatosis localizada a la pierna derecha, constituida por una placa eritematosa en la periferia y en el centro se observaba color marrón; se palpaba piel atrófica en algunas zonas que alternaba con micronódulos y gomas de 0.8-1.0 cm de diámetro con costras hemáticas, escama furfurácea periférica. Negó síntomas concomitantes (Figura 4).
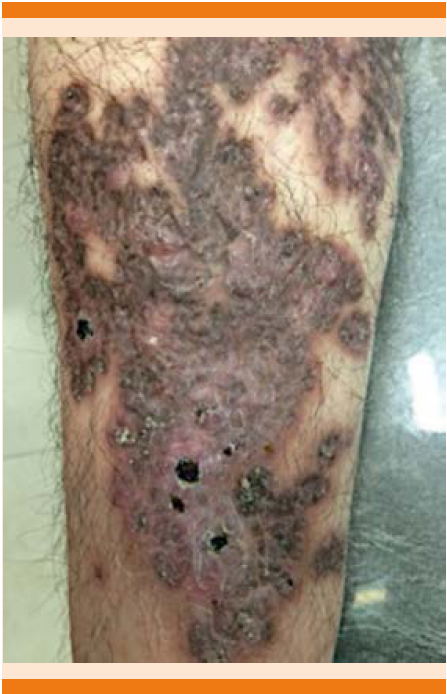
Figura 4 Caso clínico 2: aspecto clínico en la extremidad inferior derecha con una placa constituida por mancha color ocre, micronódulos, gomas, costras hemáticas y cicatrices.
Con diagnóstico presuntivo de tuberculosis cutánea variedad pápulo-necrótica, se realizó biometría hemática, química sanguínea, pruebas de función hepática, reactantes de fase aguda y radiografías de la extremidad afectada, que se encontraron en límites normales. El PPD fue positivo y midió 15 mm de diámetro, la biopsia de piel se envió al departamento de patología de la Facultad de Medicina de la Universidad Autónoma del Estado de México (UAEMex) con diagnóstico patológico de inflamación crónica granulomatosa de causa fímica.
Se envió muestra de piel al Laboratorio Estatal de Salud Pública del Estado de México, el resultado fue de cultivo negativo para bacilo tuberculoso y positivo para M. chelonae. La PCR Genexpert Mtb/Rif en tiempo real resultó positiva para M. chelonae.
Se inició tratamiento en forma conjunta con la Jurisdicción Tenancingo del Instituto de Salud del Estado de México (ISEM) con claritromicina a dosis de 500 mg/12 h durante ocho meses, fomentaciones con sulfato de cobre y la evolución ha sido tórpida, no ha habido secreción seropurulenta, pero la dermatosis ha sufrido mínimos cambios cicatriciales.
DISCUSIÓN
Se comunican dos casos clínicos, uno en el contexto comunitario y otro intrahospitalario con lesiones crónicas secundarias a M. chelonae.
Aunque todas las micobacterias tienen la capacidad de infectar la piel, Mycobacterium chelonae se ha descrito en algunos casos en pacientes a quienes se les efectuó liposucción y algunos otros pacientes posoperados. Igualmente se ha descrito la erosión de bandas gástricas por parte del patógeno, así como la infección ocular en pacientes postrasplantados de córnea.12,13 La mayor parte de la evidencia de infecciones de este tipo proviene de pacientes inmunodeprimidos, en quienes se han descrito varios factores de riesgo, como infecciones crónicas, cáncer o terapia inmunosupresora; inadecuada esterilización de instrumentos médicos y contacto traumático en heridas quirúrgicas con agujas o con otro material contaminado.11 El incremento en las lesiones por infección de micobacterias atípicas se ha relacionado con la terapia antirretroviral en pacientes con virus de la inmunodeficiencia humana (VIH). Asimismo, se han notificado casos de infecciones cutáneas diseminadas en pacientes con diagnóstico de artritis reumatoide y postrasplantados renales.2 No obstante, la relevancia de estos factores de riesgo se desconoce en pacientes inmunocompetentes debido a que existen pocos casos reportados, como el de nuestros pacientes.
La fisiopatología de la infección por Mycobacterium chelonae es poco conocida; sin embargo, se sabe que los gérmenes entran por inhalación en los pulmones o penetran a través de lesiones en la piel o secundario a procedimientos quirúrgicos y cosméticos.14,15
En Brasil se notificaron infecciones por micobacterias de rápido crecimiento de 1998 a 2009, los años con más prevalencia fueron entre 2006 y 2008 y durante este último periodo, 13 casos correspondieron a infección por Mycobacterium chelonae, la edad media de los pacientes fue de 51 años y todos eran mujeres; el procedimiento asociado fue la inyección de diversas sustancias modelantes en la cara para efectos cosméticos.16
Se estudiaron 49 pacientes con infección por micobacterias que habían recibido biológicos inhibidores del factor de necrosis tumoral (anti-TNF) y M. chelonae se identificó en cinco de esos pacientes.17
En 2003 se reportaron tres casos de M. chelonae y M. fortuitum, infecciones causadas por procedimientos podológicos en el sur de California.7
Como parte del tratamiento de úlceras cutáneas crónicas, lo primero que debe hacerse es historia clínica y exploración física detalladas, en las que debemos obtener datos como la causa, cronicidad de la lesión, la lesión primaria, progresión o evolución de la lesión, si duele o es sintomática, tratamientos previos y si ha habido alivio con éstos, preguntar respecto a otras enfermedades y en el caso de estas lesiones es muy importante conocer si se asocia con un procedimiento quirúrgico previo (Figura 5).
En estos casos en particular, los pacientes tenían más de cuatro semanas de evolución con la lesión, por lo que se trataba de una úlcera crónica. Las lesiones cutáneas pueden aparecer uno o dos meses después de la inoculación, pero se han reportado periodos de latencia mayores a 15 años.18
En relación con las lesiones, no se conoce la primaria; sin embargo, ambos casos evolucionaron hacia la úlcera y en uno de ellos hacia la fistulización.
La evaluación de los pacientes con úlceras cutáneas debe incluir estudios de laboratorio generales, como biometría hemática, marcadores de inflamación, hemoglobina glucosilada y, en algunos casos, abordaje específico de causas reumatológicas, vasculares o de alteraciones en la coagulación, además de cultivos para evitar un resultado falso positivo secundario a colonización o biota habitual de la piel, por lo que se sugiere que el tejido analizado sea de tejidos más profundos, con especial insistencia en la cantidad de colonias por gramo de tejido y tinciones especiales para micobacterias, hongos y otros patógenos que se sospechen.
En relación con nuestros pacientes, la clínica y los estudios de laboratorio no sugerían inflamación sistémica o algún otro dato compatible con las enfermedades descritas.
Una vez concluido el abordaje de causas frecuentes de úlceras crónicas, la sospecha diagnóstica se limitó a un número menor de posibilidades, entre las que se incluía Mycobacterium tuberculosis y micobacterias atípicas; el cultivo y las pruebas de biología molecular confirmaron el diagnóstico.
Las manifestaciones se caracterizan por la cronicidad y escasa respuesta sin el tratamiento adecuado; sin embargo, el cuadro suele ser inespecífico y su diagnóstico requiere un alto nivel de sospecha clínica.
El diagnóstico clínico es difícil porque se trata de una dermatosis polimorfa y la sospecha clínica suele ser baja; clínicamente predominan los nódulos, gomas, fistulas y cicatrices producto de las mismas lesiones, por lo que nos ayudamos de otros métodos diagnósticos como son:
1. La histología con tinción de hematoxilina y eosina que se caracteriza por un infiltrado granulomatoso con inflamación crónica, inespecífica y supurativa, donde difícilmente se observan granulomas de tipo tuberculoide, la histología de las lesiones puede ayudar, pero no es específica durante los tres primeros meses.14
2. Los métodos tradicionales usados para la identificación de micobacterias, como la tinción de Ziehl-Neelsen o cultivo de Lowenstein-Jensen, no son suficientemente sensibles, son positivos en menos de 15% de los casos. El cultivo del tejido es el patrón de referencia para la detección de micobacterias atípicas, pero deben tener una temperatura específica para el desarrollo de las mismas. Para el crecimiento óptimo de micobacterias atípicas la temperatura adecuada es de 37°C y específicamente para Mycobacterium chelonae de 28°C,20 otros cultivos que pueden utilizarse son caldo de tioglicolato, agar sangre, agar chocolate y agar MacConkey.
3. Métodos moleculares novedosos, como la secuenciación de ácidos nucleicos y los genes blanco más recurridos son hsp65, gyrB, recA, rpoB y el gen 16S de ARNR, lo que ha significado la rápida identificación en comparación con los cultivos. En Holanda se estudió la utilidad de ADN 16S ribosomal para el diagnóstico de infección por micobacterias atípicas cutáneas, se encontró hibridización positiva con Mycobacterium fortuitum, pero no indicaba infección con el organismo, por lo que fue necesario repetir varias veces la prueba y el diagnóstico se corroboró con el cultivo.21
4. El diagnóstico hasta el momento se establece mediante reacción en cadena de la polimerasa y esta técnica se introdujo recientemente para detectar estas micobacterias en lesiones de la piel.
El diagnóstico tardío de infecciones por micobacterias en las extremidades, seguido de tratamiento inadecuado y progresión a estructuras más profundas, resulta en destrucción articular, osteomielitis y amputación de la extremidad afectada.
El tratamiento de elección es la claritromicina a dosis de 500 mg/12 h. Es el fármaco agonista altamente específico contra infecciones por Mycobacterium chelonae y su administración es el único tratamiento validado por un ensayo clínico y publicado en las guías de la Sociedad Americana de Enfermedades Infecciosas/Sociedad Americana del Tórax, publicadas en 2007.22 Los aislamientos de Mycobacterium fortuitum son habitualmente susceptibles a amikacina, imipenem-cilastatina, quinolonas y sulfamidas con susceptibilidad variable a doxiciclina y cefotaxima.23,24 También se ha demostrado que la tobramicina es más activa que la amikacina, pero solamente en estudios in vitro.22
La duración y combinación de los antibióticos prescritos como tratamiento todavía no están bien definidas. El desbridamiento quirúrgico antes del tratamiento con antibióticos se recomienda contra M. fortuitum y M. chelonae, lo que ha mostrado resultados favorables.25
CONCLUSIÓN
Se comunican dos casos clínicos de infección por Mycobacterium chelonae. Uno adquirido en medio hospitalario y otro en la comunidad, cuyas características clínicas variaron por el medio donde se adquirió la enfermedad, la dificultad en el diagnóstico clínico, la topografía, la evolución crónica y la falta de síntomas sistémicos, así como la mala respuesta a los antibióticos, sobre todo del caso adquirido en la comunidad. Consideramos que es importante la comunicación de estos casos clínicos para el diagnóstico e intervención oportunos de los diferentes especialistas que atendemos este tipo de infecciones.
Las infecciones cutáneas por M. chelonae suelen tener un desenlace favorable tras iniciar el tratamiento antimicrobiano específico y en algunos casos requieren desbridamiento quirúrgico.
En nuestros pacientes, a pesar de la realización de estudios de laboratorio y un extenso abordaje clínico en el que se descartaron otras causas, como úlceras vasculares, algunas causas reumatológicas, tumorales o secundarias a medicamentos, se requirieron pruebas sumamente complejas, como la PCR, para confirmar el diagnóstico, situación que dificulta el manejo considerando que las infecciones por este patógeno son comunes en Estados Unidos y Australia, pero también en países con menos recursos e infraestructura en salud como la India, China, Brasil y Arabia Saudita.











 nueva página del texto (beta)
nueva página del texto (beta)





