La diabetes es una enfermedad fría y húmeda en la que la carne
y los músculos se funden para convertirse en orina
Areteo De Capadocia
ANTECEDENTES
Definición
La definición precisa de hipoglucemia continúa en debate actualmente; sin embargo, la Asociación Americana de Diabetes (ADA) describe la hipoglucemia como la condición clínica que se caracteriza por concentraciones bajas de glucosa en sangre usualmente menores a 70 mg/dL. Debido a la tolerancia fisiológica a concentraciones bajas de glucosa en sangre de cada persona, resulta difícil abarcar una sola definición, además, debe tenerse en cuenta que la definición anterior no es válida en niños, estado comatoso y pacientes con nutrición parenteral. Asimismo, en estudios clínicos, organizaciones, artículos comerciales y académicos, frecuentemente se utilizan definiciones diferentes, debido a la heterogeneidad de la hipoglucemia.1
La hipoglucemia constituye la urgencia endocrinológica más común, sobre todo en pacientes diabéticos que reciben insulinoterapia, este antecedente es de vital importancia durante la evaluación inicial debido a que en personas sin diabetes mellitus, los mecanismos fisiológicos compensatorios se disparan con concentraciones plasmáticas menores de 80 mg/dL, al contrario de lo que ocurre en pacientes diabéticos en los que las consecuencias biológicas de la hipoglucemia están alteradas, por lo que las manifestaciones clínicas y por consiguiente el diagnóstico con frecuencia son inadvertidos.
Epidemiología
Las enfermedades cardiovasculares y la diabetes mellitus son las principales causas de muerte en América.
En México la diabetes mellitus ocupa el primer lugar entre las principales causas de mortalidad y tiene incremento ascendente de aproximadamente 400,000 casos al año y 60,000 muertes por año.
Las complicaciones agudas de la diabetes representan aproximadamente 20 a 30% de los pacientes adultos hospitalizados en los servicios de urgencias.
En México las estadísticas indican que la mortalidad por cada 100,000 habitantes representa más del doble que en Brasil, más del triple que en Chile y 14 veces más que en el Reino Unido.
En México, la mortalidad por diabetes mellitus se ha incrementado constantemente desde 1998 hasta 2014, llegando hasta 94,029 defunciones y se posicionó como la primera causa de mortalidad en todo el país según el INEGI.
La OMS calcula que existen en el mundo más de 180 millones de personas con diabetes y es probable que esta cifra aumente a más del doble para 2030.
Alrededor de 90% de todos los pacientes que reciben insulina experimentan al menos un episodio de hipoglucemia.
Los pacientes con diabetes mellitus tipo 1 tienen en promedio dos episodios de hipoglucemia sintomática por semana y un episodio de hipoglucemia grave una vez al año. Se calcula que entre 2 y 4% de las muertes de esta población se atribuyen a la hipoglucemia.
La incidencia de la hipoglucemia suele subestimarse debido a la dificultad para determinarla.
El riesgo de sufrir hipoglucemia es más alto en pacientes con diabetes mellitus 2 que han recibido insulina por más de 10 años.
En mujeres embarazadas con diabetes mellitus los episodios de hipoglucemia severa son 3 a 5 veces más frecuentes en el primer trimestre que en el tercer trimestre, porque el embarazo en sí mismo se asocia con la supresión de las respuestas contrarreguladoras de la glucosa, aunque el mecanismo exacto de esta supresión aún no está claro.
En los ancianos la hipoglucemia es un problema muy común porque el envejecimiento modifica las respuestas hormonales contrarreguladoras a la hipoglucemia, además, las múltiples comorbilidades, como la enfermedad renal crónica, la insuficiencia cardiaca crónica, la desnutrición y la polifarmacia, aumentan el riesgo de esta complicación.
Debido a la alta prevalencia de la diabetes en la población, la hipoglucemia es la emergencia ambulatoria endocrinológica encontrada con más frecuencia en la atención hospitalaria.
Se estima que entre 10 y 30% de los pacientes diabéticos tipo 1 han experimentado alguna vez episodios de hipoglucemia que han requerido asistencia para el tratamiento. Los antecedentes de episodios anteriores de hipoglucemia, las concentraciones bajas de hemoglobina glucosilada y una terapia preventiva enérgica con reconocimiento de los signos y síntomas por parte de los pacientes fueron predictores de acontecimientos de hipoglucemia en esta población. En los primeros 10 años de un amplio estudio prospectivo realizado en el Reino Unido (el estudio UKPDS), los episodios de hipoglucemia que requirieron intervención tuvieron incidencia de 1.2% en pacientes con diabetes tipo 2 tratados con insulina. Estudios más recientes sugieren incidencia mayor de hipoglucemia severa en la diabetes tipo 2 que en la tipo 1. La población con riesgo de padecer episodios de hipoglucemia son los pacientes de edad avanzada, los que padecen una enfermedad crítica, las personas con ascendencia afro-americana y la administración de cinco o más medicamentos, todos ellos indicadores independientes de hipoglucemia.
Clasificación
La Asociación Americana de Diabetes (ADA) propone la siguiente clasificación: 1) hipoglucemia severa: evento que requiere la asistencia de otra persona. 2)Hipoglucemia sintomática documentada: síntomas con glucosa menor de 70 mg/dL. 3)Hipoglucemia asintomática: cifras de glucosa menores de 70 mg/dL sin síntomas asociados. 4)Probable hipoglucemia sintomática: síntomas no acompañados de determinación de glucosa. 5)Hipoglucemia relativa: síntomas típicos con glucosa sérica mayor de 70 mg/dL.
Clasificación de la hipoglucemia en la diabetes:
Valor de alarma para la hipoglucemia: menor o igual a 70 mg/dL (3.9 mmol/L) en plasma.
Hipoglucemia severa: requiere la ayuda de otra persona para administrar activamente carbohidratos, glucagón o tomar otras medidas correctivas. Las concentraciones de glucosa plasmáticas pueden no estar disponibles durante un evento. La recuperación neurológica después de las concentraciones de glucosa en plasma al volver a la normalidad se considera suficiente evidencia de que el evento fue inducido por una concentración baja de glucosa en plasma.
Hipoglucemia sintomática documentada: síntomas típicos de hipoglucemia acompañados de glucosa plasmática con valores ≤ 70 mg/dL (3.9 mmol/L).
Hipoglucemia asintomática: sin síntomas típicos de hipoglucemia pero con glucosa plasmática medida ≤ 70 mg/dL (3.9 mmol/L).
Probable hipoglucemia sintomática: síntomas típicos de hipoglucemia sin acompañarse de determinación de glucosa plasmática pero probablemente causados por glucosa plasmática ≤ 70 mg/dL (3.9 mmol/L).
Pseudohipoglucemia: reporte de síntomas típicos de hipoglucemia con glucosa plasmática mayor de 70 mg/dL.
Causas
En general, la hipoglucemia en pacientes diabéticos ocurre cuando existe desequilibrio entre la ingesta de insulina o algún agente hipoglucemiante y las necesidades fisiológicas existentes del cuerpo (Cuadro 1).
Cuadro 1 Principales causas de la hipoglucemia
| Fármacos | Insulina Sulfonilureas Etanol Pentamidina Quinina Salicilatos Sulfonamidas Otros |
| Hepatopatía |
Insuficiencia hepática, cardiaca o renal Sepsis Inanición y desnutrición |
| Insuficiencia endocrina |
Cortisol Hormona de crecimiento Glucagón Adrenalina (diabetes tipo 1) |
| Tumores de no células beta |
Fibrosarcona, mesotelioma Rabdomiosarcoma, liposarcoma Hepatoma, tumores adrenocorticales Carcinoides Leucemia, linfoma, melanoma, teratoma |
| Hiperinsulinismo endógeno |
Insulinoma Otras alteraciones de las células beta Secretagogos (sulfonilureas) Autoinmunitaria Secreción de insulina ectópica |
| Alteraciones de la infancia y adolescencia |
Intolerancia transitoria al ayuno Hijos de madres diabéticas (hiperinsulinismo) Hiperinsulinismo congénito Defectos enzimáticos congénitos |
| Posprandial |
Reactivo (tras cirugía bariátrica) Inducido por etanol Síntomas autonómicos sin hipoglucemia verdadera |
La hipoglucemia también puede ser el resultado de la escasa ingesta de alimentos o del aumento de la actividad en relación con la medicación y la ingesta de alimentos.
Otras causas pueden ser el consumo de alcohol, algunas drogas, el estrés y las infecciones. El alcohol puede contribuir a la severidad de la hipoglucemia mediante la inhibición de la gluconeogénesis.
La hipoglucemia también podría ser un síntoma de un órgano gravemente enfermo, como en el caso de las enfermedades hepáticas (cirrosis). Las enfermedades renales a menudo causan hipoglucemia, sobre todo por el papel importante que tienen estos órganos en la producción y mantenimiento de las concentraciones de glucosa en sangre. El antecedente de episodios severos es factor de riesgo de hipoglucemia.
Fisiopatología
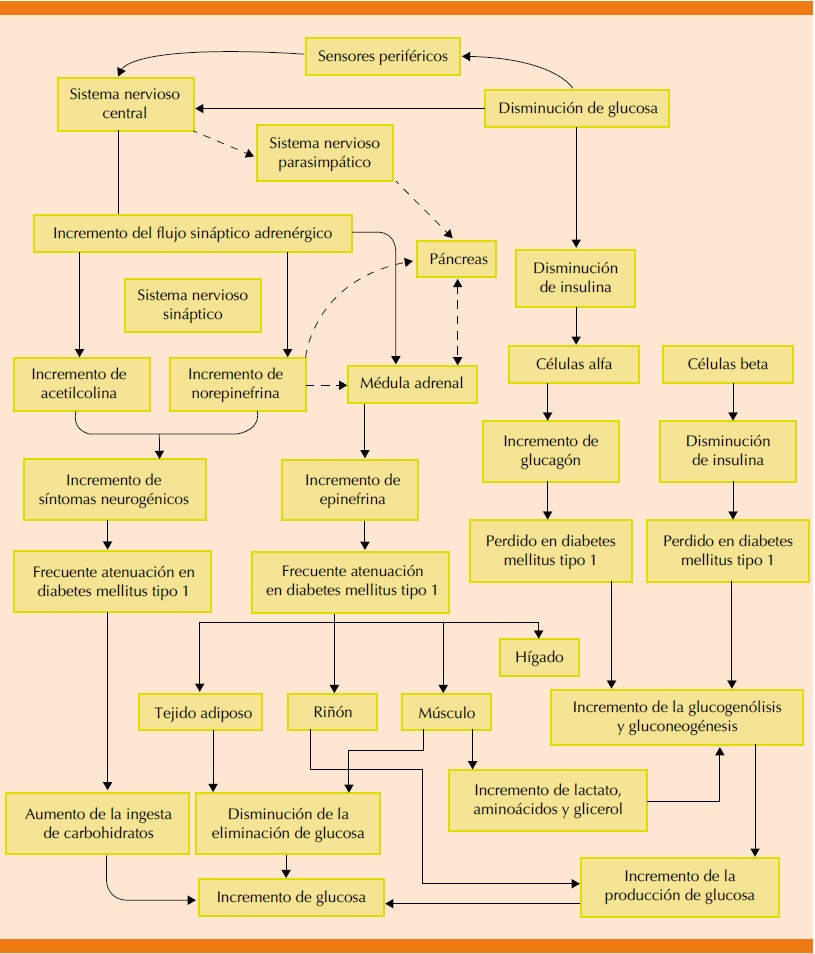
Ante la disminución de las concentraciones séricas de glucosa, tiene lugar una serie de respuestas en el organismo de manera escalonada. El primer mecanismo de defensa desencadenado es el cese de producción de insulina en las células B pancreáticas, que aparece aproximadamente a 80 mg/dL. En segundo lugar, el aumento de la secreción de glucagón aparece alrededor de 68 mg/dL. De manera paralela, aumenta la producción de epinefrina; sin embargo, esta última parece no tener papel fundamental en la respuesta fisiológica inicial. Estas hormonas aumentan el valor de la glucemia mediante distintos mecanismos: 1)aumentan la producción hepática de glucosa mediante gluconeogénesis y glucogenólisis. 2)Disminuyen la captación periférica de glucosa. 3)Inhiben la secreción de insulina (Cuadro 2).2
Cuadro 2 Respuesta fisiológica al descenso de las concentraciones de glucosa sérica
| Respuesta | Concentración sérica de glucosa (mg/dL) | Efectos fisiopatológicos | Papel en la prevención o corrección de la hipoglucemia (respuesta contrarreguladora) |
|---|---|---|---|
| Insulina | 80-85 | Aumento de la producción de glucosa por el hígado y el riñón. Disminución de utilización de glucosa por tejidos sensibles a insulina (excepto el cerebro) | Primera defensa contra la hipoglucemia |
| Glucagón | 65-70 | Aumento de la producción de glucosa por el hígado y el riñón | Segunda defensa contra la hipoglucemia |
| Epinefrina | 65-70 | Aumento de la producción de glucosa por el hígado y el riñón. Disminución de la utilización de glucosa por tejidos sensibles a insulina (excepto cerebro) | Tercera defensa contra la hipoglucemia. Crítico (cuando el glucagón es deficiente) |
| Cortisol y GH | 65-70 | Aumento de la producción de glucosa por el hígado y el riñón. Disminución de la utilización de glucosa por tejidos sensibles a insulina (excepto el cerebro) | No crítico |
| Síntomas | 50-55 | Aporte de glucosa exógena | Comportamiento de defensa: ingesta de alimentos |
| Cognición | < 50 | - | Compromiso de comportamientos de defensa |
Durante la gluconeogénesis se sintetiza glucosa a partir de compuestos no glucídicos, sus precursores son el ácido láctico, glicerol y aminoácidos glucogenéticos. Este proceso se lleva a cabo principalmente en el hígado a nivel mitocondrial (piruvato a malato) y en menor medida en el citosol (reacción de Peck), consumiendo seis moléculas de ATP y produciendo únicamente dos moléculas de ATP, lo que hace a este proceso energéticamente muy costoso.
Asimismo, la glucogenólisis es el proceso mediante el que se degrada glucógeno. Mediante la glucógeno fosforilasa incide en los enlaces glucosídicos utilizando un grupo fosfato, formando glucosa-1-fosfato como producto.
La glucosa es un combustible oxidativo obligado para el cerebro en condiciones fisiológicas. El cerebro representa 50% de la utilización de glucosa en todo el cuerpo. El cerebro puede oxidar los combustibles alternativos, como las cetonas, si sus concentraciones circulantes se elevan lo suficiente como para entrar en el cerebro en cantidad, pero rara vez es así.
La primera defensa fisiológica contra la hipoglucemia es la disminución de la secreción de insulina de las células β de los islotes pancreáticos. Esto ocurre cuando las concentraciones plasmáticas de glucosa disminuyen dentro de las concentraciones fisiológicas y aumenta la producción de glucosa hepática (y renal) con preservación virtual de la utilización de glucosa por tejidos no neuronales sensibles a la insulina. La segunda defensa fisiológica es el aumento en la secreción de glucagón de células α de los islotes pancreáticos. Esto ocurre cuando las concentraciones de glucosa plasmática caen justo por debajo del rango fisiológico y aumenta la producción de glucosa hepática (en gran medida estimulando la glucogenólisis). El aumento de la secreción de glucagón se señala por la disminución en la insulina intraislote, tal vez entre otros productos de secreción de células β, en el establecimiento de concentraciones bajas de glucosa en plasma. La tercera defensa fisiológica, que se hace crítica cuando la secreción de glucagón es deficiente, es el aumento de la secreción adreno-medular de epinefrina. Esto también ocurre cuando las concentraciones de glucosa en plasma caen justo por debajo del rango fisiológico y aumentan las concentraciones plasmáticas de glucosa a través de una serie de mecanismos que incluyen la estimulación directa de la producción de glucosa hepática (y renal), la limitación del aclaramiento de la glucosa por tejidos sensibles a la insulina, la movilización de sustratos gluconeogénicos como el lactato y los aminoácidos del músculo y el glicerol de la grasa y la limitación de la secreción de insulina. A diferencia de la secreción de insulina y glucagón, que se regulan principalmente por los cambios en las concentraciones de glucosa dentro de los islotes pancreáticos y sólo secundariamente por los aportes autonómicos mediados por el sistema nervioso central, la actividad simpato-renal, incluida la secreción de epinefrina, está regulada en el sistema nervioso central.
Si estas defensas fisiológicas no abortan la hipoglucemia en desarrollo, las concentraciones plasmáticas más bajas de glucosa causan una respuesta simpato-adrenal más intensa que induce síntomas neurogénicos. Éstos, a su vez, conducen a la conciencia de la hipoglucemia que impulsa la defensa conductual: la ingestión de carbohidratos. Todas estas defensas contra la hipoglucemia en desarrollo, y no sólo la secreción de insulina, están típicamente afectadas en personas con diabetes tipo 1 y diabetes tipo 2 avanzada (es decir, absolutamente endógena con deficiencia de insulina).
Mecanismos cerebrales en la hipoglucemia
El tejido cerebral consume aproximadamente 25% del consumo corporal total en su estado posabsortivo (Cuadro 3). La glucosa sérica atraviesa la barrera hematoencefálica a través de los capilares por difusión facilitada mediante el transportador GLUT-1. Las neuronas, a su vez, disponen de un transportador específico, el GLUT-3. Modelos experimentales apoyan el modelo que en sujetos sometidos de manera recurrente a hipoglucemia desarrollan sobreexpresión de GLUT-1 y GLUT-3 a nivel endotelial cerebral y neuronal, respectivamente. Este mecanismo resulta contrastante, porque, por un lado, preserva las funciones cognitivas, pero resulta perjudicial porque la manifestación clínica puede pasar inadvertida. Las zonas más sensibles a la disminución de aporte glucémico son la corteza, el hipocampo y el cuerpo estriado.3
Cuadro 3 Consumo energético fisiológico del cerebro
| Requerimientos fisiológicos cerebrales | Valores normales |
|---|---|
| Consumo cerebral de oxígeno | 3.5 mL/100 g/min |
| Flujo sanguíneo cerebral | 50 mL/100 g/min |
| Flujo sanguíneo cerebral en la sustancia gris | 75-80 mL/100 g/min |
| Presión de perfusión cerebral (PPC) = PAM - PIC | 50 a 150 mmHg |
| Presión intracraneal | 5 a 13 mmHg |
| Reactividad al CO2 | 3 a 4% por cada mmHg |
| Aporte de oxígeno | 16 y 20 mL de O2/100 mL de sangre |
| Tasa metabólica cerebral de glucosa | 5 mg/100 g de tejido cerebral/minuto |
PAM: presión arterial media; PIC: presión intracraneal.
Se han desarrollado diversos modelos animales para estudiar el daño neuronal relacionado con hipoglucemia. Las observaciones más concluyentes en este campo describen al glutamato con propiedades tóxicas a nivel neuronal que causan neurodegeneración, por la estimulación prolongada de sus receptores posinápticos. La captura de glutamato es dependiente de Na+ para el transporte de este aminoácido al interior de la célula. Esto, a su vez, conlleva al colapso del gradiente electroquímico, despolarización de la membrana presináptica y activación de los canales de Ca+ dependientes de voltaje, aumentando la concentración intracelular de este ion. Por último, este proceso se traduce en falla de los sistemas sinápticos por deficiencia energética.4
El tejido cerebral tiene la capacidad de adaptarse a la disminución del suministro de glucosa; sin embargo, ésta es limitada. Esta adaptación ocurre básicamente por dos mecanismos: 1)aumento en el flujo sanguíneo cerebral y 2)el uso de reservorios de sustratos alternativos a la glucosa. El aumento del flujo cerebral lo han propuesto varios autores apoyando la participación del óxido nítrico como factor relajante de las células endoteliales; sin embargo, no se ha demostrado en modelos in vivo.
El principal sustrato metabólico alterno a nivel cerebral es el glucógeno con el inconveniente de su rápida depleción descrita en los primeros cinco minutos de la privación de glucosa. Los aminoácidos constituyen sustrato endógeno porque pueden incorporarse al ciclo de Krebs. Otros sustratos que pueden utilizarse son los fosfolípidos, lo que conduce al aumento de la concentración de ácidos grasos libres, entre ellos el ácido araquidónico cuyo metabolismo genera especies reactivas de oxígeno, que resultan tóxicas para la célula. La disminución de los niveles energéticos afecta el funcionamiento de la bomba Na+/K+ impidiendo que la célula se despolarice y que los mecanismos de amortiguamiento de Ca+ funcionen adecuadamente. Así, se genera una sobrecarga de Ca+ en la mitocondria, perdiendo su polaridad y capacidad de producción de ATP. Las concentraciones de este nucleótido se mantienen disminuidas en el cerebro incluso tres horas posteriores al restablecimiento de las concentraciones de glucemia.5
Otra de las teorías propuestas del daño neuronal inducido por hipoglucemia es la activación de caspasas. Las caspasas son una familia de proteasas implicadas principalmente en la apoptosis y en la activación de citocinas proinflamatorias. Se dividen en iniciadoras y ejecutadoras, las más estudiadas son la caspasa 9 (iniciadora) y la caspasa 3 (ejecutadora).
Mientras que el exceso de insulina de magnitud suficiente puede causar hipoglucemia, la hipoglucemia iatrogénica en los pacientes con diabetes es típicamente el resultado de la interacción de la hiperinsulinemia terapéutica relativa o absoluta y las defensas fisiológicas y de comportamiento comprometidas contra la caída de las concentraciones plasmáticas de glucosa. Debido a sus imperfecciones farmacocinéticas, los secretagogos de insulina o la insulina producen episodios de hiperinsulinemia y disminución de las concentraciones plasmáticas de glucosa. La integridad de las defensas contra la caída de las concentraciones de glucosa en plasma determina si estos episodios resultan en hipoglucemia clínica.
Contrarregulación defectuosa de la glucosa e hipoglucemia desconocida
En la diabetes tipo 1 completamente desarrollada (es decir, C-peptídica negativa), las concentraciones circulantes de insulina no disminuyen a medida que las concentraciones plasmáticas de glucosa disminuyen en respuesta a la hiperinsulinemia terapéutica (exógena). Ése es el resultado del fallo de las células β, que también causa la pérdida de la respuesta secretiva del glucagón por las células α. Así, la primera y la segunda defensas fisiológicas contra la hipoglucemia se pierden. En este contexto, el aumento atenuado de la secreción adrenomedular de adrenalina, la tercera defensa fisiológica, causa el síndrome clínico de la contrarregulación defectuosa de la glucosa, que se asocia con aumento de 25 veces el riesgo de hipoglucemia iatrogénica severa. Además, la respuesta atenuada a la epinefrina es un marcador de respuesta atenuada simpato-adrenal, incluida la respuesta simpática neural, que es en gran medida responsable del desarrollo del síndrome clínico de hipoglucemia. La falta de conocimiento de la hipoglucemia se vincula con un riesgo seis veces mayor de hipoglucemia iatrogénica severa. Aunque con diferentes cursos de tiempo, la fisiopatología de la contrarregulación de la glucosa es la misma en la diabetes tipo 1 y en la tipo 2 avanzada (es decir, absolutamente endógena). Cuadro 4
Cuadro 4 Funciones de la insulina y las hormonas contrarreguladoras
| Insulina | Glucagón | Adrenalina | Cortisol | GH | |
|---|---|---|---|---|---|
| Glucogenólisis | Inhibe | Estimula | Estimula | ||
| Glucogenogénesis | Estimula | Inhibe | |||
| Neoglucogénesis | Inhibe | Estimula | Estimula | Estimula | Estimula |
| Lipólisis | Inhibe | Estimula | Estimula | Estimula | Estimula |
| Lipogénesis | Estimula | Inhibe | |||
| Proteólisis | Inhibe | Estimula | Estimula | ||
| Síntesis proteica | Estimula | Estimula |
Debido a que el fallo absoluto de las células β (que causa la pérdida de la insulina y de las respuestas al glucagón) ocurre rápidamente en la diabetes tipo 1, pero lentamente en la diabetes tipo 2, los síndromes de contrarregulación defectuosa de la glucosa y la hipoglucemia se desarrollan tempranamente en la diabetes tipo 1 y tipo 2. Esto explica por qué la hipoglucemia iatrogénica se vuelve progresivamente más frecuente y limita el control glucémico cuando los pacientes se acercan al final de insulina deficiente del espectro de la diabetes tipo 2.
Fases neurológicas de la hipoglucemia
Las manifestaciones clínicas de la hipoglucemia son muy variadas e inespecíficas. A grandes rasgos pueden dividirse en dos categorías: las autonómicas causadas por la actividad aumentada del sistema nervioso autónomo y las causadas por la actividad reducida del sistema nervioso central. Por lo general, se acepta que los síntomas a nivel nervioso central aparecen alrededor de 55 mg/dL. Los síntomas neuroglucopénicos dependen del área cerebral afectada, la corteza es el área más sensible al déficit de glucosa (Cuadro 5).6
Cuadro 5 Síntomas y signos en las distintas fases neurológicas de la hipoglucemia
| Cortical | Somnolencia, sudoración, hipotonía, temblor |
| Diencefálica (subcortical) | Lipotimia, movimientos primitivos (succión, muecas), espasmos clónicos, inquietud |
| Mesencefálica | Espasmos tónicos, desviación ocular, Babinski positivo |
| Premiencefálica | Espasmo de músculos extensores |
| Miencefálica | Coma profundo, respiración superficial, ausencia de reflejo fotomotor y corneal, hipotermia, atonía e hiporreflexia |
Diagnóstico
Cuadro clínico
En 1938, Allen Whipple, cirujano precursor de la cirugía pancreática, reportó una tríada patognomónica de hipoglucemia: síntomas compatibles con hipoglucemia, concentraciones de glucosa menores a 50 mg/dL y alivio inmediato de los síntomas después de la ingestión de glucosa.7
El valor de glucemia específico para definir hipoglucemia es difícil de establecer, debido a la idiosincrasia de algunos sujetos (mujeres, jóvenes, ancianos, diabéticos tipo 1). Sin embargo, es bien aceptada la cifra de 55 mg/L como punto de corte de hipoglucemia en pacientes no diabéticos. Asimismo, las glucemias mayores de 70 mg/dL con o sin síntomas asociados, descartan hipoglucemia. Sin embargo, en pacientes con diabetes tipo 1 o 2 se establece como punto de corte 70 mg/dL.
Para el diagnóstico de hipoglucemia se requiere una glucosa capilar o sérica de 70 mg/dL o menor o independiente de la existencia o no de síntomas concomitantes. Los síntomas de hipoglucemia se dividen en dos categorías:8
Síntomas neurogénicos (autonómicos): se generan al disminuir las concentraciones de glucosa (< 55 mg/dL/3.7 mmol/L) y permiten a los pacientes identificar que están sufriendo un episodio de hipoglucemia; estos síntomas son mediados por la liberación simpaticoadrenal de catecolaminas y de acetilcolina por las terminaciones simpáticas nerviosas, los síntomas típicos son: temblor, agitación, ansiedad, nerviosismo, palpitaciones, diaforesis, sequedad de boca, hambre, palidez y dilatación pupilar.
Síntomas neuroglucopénicos: éstos se producen al consumirse las reservas de glucosa de las neuronas (< 45 mg/dL, 2.5 mmol/dL); estos síntomas suelen manifestarse en los episodios severos y suelen ser identificados por terceras personas. Los síntomas típicos son: confusión, inatención, irritabilidad, alteraciones en el lenguaje, ataxia, parestesias, cefalea, estupor, convulsiones, déficit neurológico focal transitorio, coma y muerte (si no es tratada).
Las Guías de Práctica Clínica de la Sociedad Americana de Endocrinología indican que se realice la evaluación y manejo de la hipoglucemia sólo en pacientes con la tríada descrita desde 1938 por Whipple: síntomas, signos o ambos sugerentes de hipoglucemia, la concentración de glucosa plasmática baja y alivio de los síntomas o signos después de que la concentración de glucosa plasmática aumenta.
El punto de corte para definir hipoglucemia ha sido definido de forma arbitraria por algunos autores en 50 mg/dL con síntomas y 40 mg/dL en ausencia de síntomas. En las guías de la Sociedad Americana de Endocrinología el punto de corte de hipoglucemia se ha establecido considerando que los síntomas aparecen en personas sanas cuando la concentración de glucosa plasmática está alrededor de 55 mg/dL. Sin embargo, el umbral de la glucosa para la aparición de síntomas varía en pacientes con hipoglucemia recurrente, además, existen diferencias en la concentración arteriovenosa de glucosa, la concentración de glucosa en plasma a nivel de sangre venosa antecubital es incluso un tercio más baja que la concentración de glucosa arterial.
Hipoglucemia en pacientes sin diabetes: punto de corte: 55 mg/dL (3.0 mmol/dL).
Hipoglucemia en pacientes con diabetes: punto de corte: 70 mg/dL (3.9 mmol/dL).
Diferencia según concentración venosa de glucosa.
Glucemias inferiores a 100 mg/dL, diferencia media: 8.88 mg/dL.
Glucemias en intervalo de 100-150 mg/dL, diferencia: media 13 mg/dL.
Glucemias mayores de 150 mg/dL, diferencia media: 29 mg/dL.
Esto puede ser una limitante para la administración de glucosa por vía intravenosa en pacientes que son en realidad hipoglucémicos.
Alteraciones electrocardiográficas asociadas con la hipoglucemia
La glucosa es vital para el metabolismo de las fibras miocárdicas y la hipoglucemia puede suponer, por una parte, un déficit de aporte energético a la célula y, por otra, la descarga simpaticoadrenal secundaria aumenta el consumo de oxígeno y, además, puede disminuir el aporte por vasoconstricción. Todo ello puede originar importante deterioro del metabolismo Este amplio espectro de alteraciones parece indicar que la hipoglucemia es capaz de producir depresión a distintos niveles del sistema de conducción, desde el nodo sinusal hasta el sistema His-Purkinje, afectando de forma importante la activación cardiaca, además del proceso de recuperación celular.
Las alteraciones electrocardiográficas vinculadas con la hipoglucemia son: depresión del segmento ST, aplanamiento e inversión de la onda T y prolongación del intervalo QT, trastornos del ritmo, como taquicardia y bradicardia sinusal, bloqueo auriculoventricular de diverso grado, fibrilación auricular paroxística, extrasistolia ventricular y supraventricular o cambios en la variabilidad de la frecuencia cardiaca.
En la actualidad se dispone de medidores de autoanálisis y monitores continuos de glucosa. Para garantizar la calidad de los primeros, los estándares que requieren la Dirección de Alimentos y Fármacos (FDA) y la Organización Internacional de Normalización (ISO) exigen 20% de desviación en valores > 75 mg/dL y +15 mg/dL en valores < 75 mg/dL.
Insulinas
La concentración de glucosa tiene un papel principal en la regulación de la liberación de insulina. La insulina se une a un receptor específico tipo protein-cinasa en la superficie celular, particularmente en el hígado, el músculo y el tejido adiposo. La insulina se sintetiza in vivo en las células beta del páncreas como una prohormona que al ser fragmentada resulta en el péptido C y la insulina misma. Los sitios principales de degradación de la insulina son el hígado (70%) y los riñones (10-40%). Después de la administración intravenosa o subcutánea de insulina, la vida media será dependiente de la dosis y del tipo de insulina. Las concentraciones suprafisiológicas condicionan mayor duración del efecto hipoglucemiante, probablemente por saturación de los sistemas hepáticos de depuración. Por un tiempo, la insulina exógena se obtuvo del páncreas de res o de cerdo. En el decenio de 1980 se inició la comercialización de insulinas semisintéticas, disminuyendo las complicaciones alérgicas, la distrofia adiposa subdérmica y la variabilidad en la absorción. Existen variaciones individuales en el pico de acción y la duración de los diferentes tipos de insulinas (Cuadro 6).
Tratamiento
El tratamiento inicial de la hipoglucemia debe estar dirigido a restablecer la euglucemia, prevenir recurrencias y en la medida de lo posible, dilucidar la causa.
Los pacientes con hipoglucemia secundaria a hipoglucemiantes orales deben permanecer en observación durante un tiempo no inferior a dos veces la vida media del hipoglucemiante administrado, porque es frecuente la recurrencia de hipoglucemia; en cambio, cuando es desencadenada por insulina, es infrecuente que repita una vez resuelto el cuadro.
Tratamiento oral
Para la administración de carbohidratos en el paciente con síntomas leves, que aún no tienen deterioro de las funciones cognitivas, puede utilizarse la vía oral en forma de leche, jugo, galletas o una colación, con un aporte aproximado de 15 gramos de glucosa en cada uno de éstos, que deben repetirse cada 20 minutos si las cifras de glucosa no mejoran o los síntomas persisten. Sin embargo, durante la evaluación del paciente en el servicio de urgencias difícilmente se elegirá la vía oral como vía primaria de administración de tratamiento, por el contexto de atención del paciente en este servicio, por lo que suele recurrirse a la vía parenteral con soluciones glucosadas, previamente evaluado el ABC de rutina en el paciente tratado en el servicio de urgencias.
El tratamiento de la hipoglucemia debe ir dirigido a la severidad de la misma, la vía oral es la recomendada en episodios leves a moderados, con consumo de hidratados de carbono simple de absorción rápida a dosis de 10 a 20 gramos (100 mL de refresco de cola, dos cucharadas de azúcar, una cucharada de miel, 230 mL de leche), con especial atención en el tiempo de absorción de los mismos que puede no ser inmediato, perpetuando los efectos nocivos de la hipoglucemia en las neuronas.9
Glucagón
Polipéptido de 29 aminoácidos secretado por las células del islote pancreático, La unión del glucagón a su receptor activa la adenilciclasa provocando el aumento del adenosín monofosfato cíclico (AMPc) intracelular que determina la activación de la proteincinasa A (PKA), que fosforila enzimas claves que ponen en marcha todas las acciones biológicas del glucagón en el hígado, el glucagón aumenta la liberación de glucosa mediante la inhibición de la síntesis de glucógeno y la estimulación de la glucogenólisis y de la gluconeogénesis. Además, el glucagón favorece la captación de aminoácidos, como alanina, glicina y prolina, que sirven de sustrato para la gluconeogénesis. En el adipocito, la lipasa sensible a hormona media la degradación de triglicéridos a ácidos grasos no esterificados y glicerol.
Dosis: 1 mg IM o SC, administrar durante un minuto. Puede repetirse en 15 minutos según sea necesario. El tiempo de acción promedio en revertir al estado de alerta es de 15 minutos.
La inyección rápida puede provocar aumento de náuseas y vómitos. Coloque al paciente en posición recostada lateral para proteger las vías respiratorias y para evitar asfixia cuando vuelva la conciencia. Este fármaco debe evitarse en pacientes con enfermedad hepática o con ingesta etílica, por la posible depleción de glucógeno.
En caso de no responder a la reposición de glucosa por vía oral, puede administrarse 1 mg de glucagón intramuscular (hormona que causa la liberación de glucosa almacenada en el hígado) con tiempo de acción de 8-18 minutos en revertir el estado de alerta y una vez que el paciente recupere la conciencia y pueda deglutir deben administrarse 20 g de glucosa y posteriormente 40 g de carbohidrato complejo. El glucagón puede ser la elección en pacientes agitados o que no colaboren.
Tratamiento parenteral
En pacientes con deterioro neurológico en los que no esté indicada la vía oral como vía de reposición de glucosa, y en los pacientes que no respondan a la administración de glucagón, se procede a la administración intravenosa de 25 a 50 g en solución a 50% hasta la remisión de los síntomas, seguido de infusión de solución a 10%.
La solución glucosada a 50% contiene 25 g de glucosa por cada 50 mL, con osmolaridad de 2775 mOsm/L y aporta 2000 kcal/L. Desde 1999 la solución glucosada a 50% ha sido el tratamiento patrón de referencia en los pacientes con hipoglucemia con síntomas neuroglucopénicos (Joint Royal Colleges Ambulance Liaison Committee).10 Sin embargo, esta solución es más polar, hidrófoba, menos lipófila, por lo que resulta más difícil su difusión a través de las membranas celulares y su biodisponibilidad es menor que soluciones glucosadas a menor concentración. Después de la administración de glucosa a 50% existe una excesiva cantidad de glucosa disponible, lo que lleva al consumo aumentado en los tejidos, por lo que se suprime la gluconeogénesis y la glucogenólisis, pudiendo provocar un rebote de hipoglucemia. Se han citado altas tasas de extravasación, incluso 10-30%, efecto que puede ser mitigado en cierto modo con la administración lenta de este líquido durante dos a cinco minutos.
Cuando se administra solución glucosada se metaboliza vía ácido láctico o pirúvico a dióxido de carbono y agua, liberando energía. Todas las células del cuerpo son capaces de oxidar glucosa. Administrar una dosis suficiente de glucosa puede disminuir la pérdida de proteínas corporales y de nitrógeno, promover el depósito de glucógeno y disminuir o prevenir la cetosis.
Las nuevas tendencias refieren que la solución glucosada a 10% es igual de efectiva que la solución glucosada a 50%. La dosis de solución glucosada a 10% es de 0.2 g/kg o 2 mL/kg continuando con una infusión de la misma solución a 5 mL/kg/h con monitoreo de glucosa cada 30 a 60 minutos hasta la estabilización de las concentraciones; en caso de persistir con concentraciones bajas de glucosa, la infusión puede aumentarse a 10 mL/kg/h. En caso de existir reserva para la administración de soluciones de manera deliberada, como el caso de pacientes con insuficiencia renal o cardiaca, puede indicarse solución glucosada a 20%. El modo de preparación es el siguiente: por cada 100 mL de solución glucosada a 5% (5 g) se agregan 50 mL de solución glucosada a 50% (25 g). La solución final contendrá 30 g de glucosa en 150 mL, que resulta en una solución a 20%.
Una vez resuelto el episodio agudo, debe vigilarse el ritmo de perfusión de solución glucosada, mediante la determinación frecuente de glucemia capilar, para evitar la reaparición de hipoglucemia por una perfusión demasiado lenta y la hiperglucemia por una perfusión demasiado rápida.
Se recomienda hospitalizar al paciente en una unidad de urgencias para la observación de la glucemia cada 1-4 horas. En la hipoglucemia producida por hipoglucemiantes orales es frecuente cometer el error de dar de alta al paciente después del bolo de dextrosa intravenosa, con el riesgo de que ocurra recurrencia fuera del hospital, pues la glucosa infundida estimula aún más la secreción de insulina y la vida media de los hipoglucemiantes orales varía de 24 a 72 horas. En estos casos se recomienda la administración de 300 g de glucosa en las primeras 24 horas siguientes a la hipoglucemia y se continúa en las siguientes 24 a 48 horas con reducción lenta del aporte de glucosa. En los pacientes que continúan con alteración en el estado de conciencia a pesar de haber normalizado las concentraciones de glucosa debe sospecharse edema cerebral, por lo que el tratamiento deberá ser en una unidad de terapia intensiva con la administración de 40 g de manitol en 20 minutos en una solución a 20%.
La sobrecarga de volumen, la hipocalemia y la hiponatremia dilucional son las potenciales complicaciones de los volúmenes de soluciones de las infusiones con dextrosa.











 text new page (beta)
text new page (beta)