ANTECEDENTES
La neurocisticercosis es la infección parasitaria más común del sistema nervioso central y es causada por el estadio de larva de Taenia solium. Aunque su prevalencia exacta no se conoce, se estima que son millones de personas infectadas en países en desarrollo; la mayor parte de los países de América Latina, África subsahariana y Asia son áreas endémicas.1-8 La forma más común de transmisión es fecal-oral y se favorece por el clima cálido de las zonas endémicas, el bajo nivel socioeconómico, analfabetismo, la crianza de animales, como cerdos, en campos abiertos y la inmigración. Afecta a adultos (20 a 50 años) y a niños, sin predominio de género, aunque las mujeres suelen padecer cuadros más severos.1,2,4,5,7,9
Es causa importante de convulsiones o de epilepsia adquirida en países en desarrollo y se le atribuyen alrededor de 50,000 muertes al año; sin embargo, en las últimas décadas, con el desarrollo de mejores tratamientos médicos y de neurocirugía, el pronóstico ha mejorado.1,6,7,9
CASO CLÍNICO
Paciente femenina de 40 años de edad, originaria y residente de la Ciudad de México, soltera, con escolaridad de licenciatura, sin antecedentes familiares, patológicos y no patológicos relevantes.
Ingresó al servicio de urgencias de nuestro hospital por ser encontrada por un familiar con pérdida del estado de alerta, emitiendo sonidos incomprensibles, con restos alimentarios y vómito en la boca, así como pérdida de control del esfínter vesical. Se recibió con frecuencia cardiaca de 90 lpm, frecuencia respiratoria de 18 rpm, temperatura de 36ºC, presión arterial 120/80 mmHg y saturación de oxígeno 95% (FiO221%). A la exploración física se encontró en estupor, las funciones cognitivas, como atención, memoria, lenguaje, juicio, abstracción, praxias, gnosias, no fueron valorables. Fondo de ojo con borramiento de bordes de la papila, pupilas de 3 mm y normorreactivas, movimientos oculocefálicos horizontales y verticales presentes, gesticulación simétrica a la maniobra de Foix (valoración del VII par craneal), úvula central, simétrica, elevación normal del paladar, reflejo nauseoso presente. Motor: tono, trofismo y fuerza muscular normal sin datos de focalización. Reflejos de estiramiento muscular +++ en forma generalizada. Sensibilidad: al estímulo nociceptivo localizaba y retiraba. Marcha y cerebelo no valorables. Signos meníngeos: sin rigidez de nuca. Respuesta plantar extensora bilateral. Campos pulmonares con adecuados movimientos de amplexión y amplexación, murmullo vesicular presente, sin ruidos agregados. Ruidos cardiacos rítmicos, de adecuada intensidad y frecuencia. Abdomen globoso, peristalsis presente, depresible, no doloroso a la palpación, sin datos de irritación peritoneal. Extremidades eutróficas, sin edema, llenado capilar menor a dos segundos.
Los exámenes de laboratorio reportaron leucocitosis con neutrofilia (leucocitos 11,000/mm3 y neutrófilos de 90%), el resto estaba dentro de parámetros normales. Se realizó punción lumbar y el líquido cefalorraquídeo se envió a estudio citoquímico que reportó aspecto de agua de roca, ligeramente turbio, coagulación negativa, leucocitos 0, eritrocitos 470, proteínas totales 18.62, glucosa 88.68, cloruros 127. Tinta china, tinción de Gram, PCR para micobacterias, desaminasa de adenosina (ADA), coaglutinación y tinción BAAR negativa.
La tomografía de cráneo simple y con contraste evidenció hidrocefalia aguda no comunicante y edema cerebral. Se procedió a colocación de válvula de derivación ventrículo-peritoneal, sin complicaciones con control tomográfico posterior donde se observó válvula de derivación ventrículo-peritoneal en el asta anterior del ventrículo derecho. Los estudios de imagen se complementaron con una resonancia magnética de cráneo en secuencia FIESTA (Figura 1) donde ese observó un quiste intraventricular anterior a la masa intertalámica con nódulo en su interior (escólex) y pared delgada bien definida, con lo que se estableció el diagnóstico de neurocisticercosis intraventricular. La paciente se sometió a una neuroendoscopia para extracción del quiste (Figuras 2 y 3). El procedimiento se realizó sin complicaciones y durante el quinto día de hospitalización se inició tratamiento con albendazol a dosis de 15 mg/kg/día y esteroides. La paciente tuvo buena evolución clínica, con mejoría del estado de alerta, persistencia de inatención y con alteración de la memoria de trabajo; el resto de la exploración neurológica fue normal.

Figura 1 Resonancia magnética secuencia FIESTA que muestra un quiste intraventricular anterior a la masa intertalámica con escólex en su interior y una pared delgada bien definida.
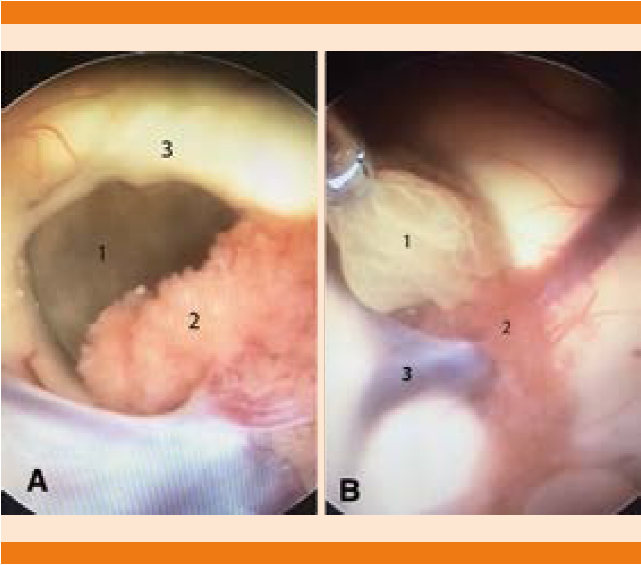
Figura 2 Imágenes de la neuroendoscopia: A. Se observa el foramen de Monro y en el interior se observa el cisticerco (1). Los puntos anatómicos de referencia son el plexo coroides (2) y el pilar anterior del fórnix (3) para delimitar el foramen. B. Imagen de la extracción del quiste: (1) cisticerco extraído cuidadosamente con una pinza de biopsia para conservar la integridad de la cápsula y evitar una reacción inflamatoria. (2) Plexo coroides. (3) Vena tálamo estriada.
DISCUSIÓN
Comunicamos el caso de una paciente con neurocisticercosis intraventricular en quien la manifestación principal fue la pérdida súbita del estado de alerta secundario a la hidrocefalia causada por la obstrucción del flujo de líquido cefalorraquídeo en el tercer ventrículo, lo que es una manifestación inicial poco común, porque las crisis convulsivas son la manifestación reportada en la bibliografía con más frecuencia. El patógeno causal de esta infección es la larva de Taenia solium, que es el helminto que más comúnmente causa infecciones del sistema nervioso central en humanos.1,5
El ciclo de vida de T. solium implica dos huéspedes: el humano y el cerdo, el humano es el huésped definitivo del céstodo adulto y actúa como huésped intermediario al igual que el cerdo para la forma de larva. El parásito adulto tiene una cabeza (escólex) con cuatro ventosas que se adhieren a la pared intestinal y desprende proglótidos, liberando huevos resistentes al ambiente. En lugares con higiene deficiente y mal manejo de desechos humanos, los cerdos tienen contacto e ingestión accidental de los huevos de T. solium, una vez en el intestino del cerdo los huevos liberan oncoesferas, que cruzan la pared intestinal y entran al torrente sanguíneo para ser llevados a diferentes tejidos donde evolucionan a cisticercos, lo que vuelve al cerdo huésped intermediario. El ciclo se completa cuando el humano consume carne de cerdo contaminada y en el intestino delgado el cisticerco se libera por la acción de enzimas digestivas, se evagina y se adhiere a la pared intestinal, donde los proglótidos comienzan a multiplicarse alcanzando una forma madura cuatro meses después de la infección.1-7
El cisticerco entra al sistema nervioso central en estadio de vesícula (metacéstodo), con una membrana transparente, líquido vesicular claro y escólex de 4-5 mm, manteniéndose así vivo por años, evadiendo la respuesta inmunitaria o puede sufrir un proceso de degeneración como consecuencia de la reacción inmunológica del huésped, que es compleja e impredecible.1,3,6,7
Después del ataque del sistema inmunológico, el cisticerco pasa a un estadio coloidal, donde el escólex sufre degeneración hialina. Posteriormente pasa a estadio granular (o nodular) en donde la pared del cisticerco se vuelve delgada y el escólex se transforma en gránulos mineralizados, en este momento el cisticerco ya no es viable y finalmente puede permanecer como nódulo calcificado. El parénquima cerebral alrededor del cisticerco en estadio vesicular muestra una reacción inflamatoria compuesta de células plasmáticas, linfocitos y eosinófilos, mientras que en el estadio coloidal la reacción inflamatoria es de predominio mononuclear y el parénquima cerebral que lo rodea muestra gliosis astrocítica asociada con proliferación de la microglía, edema y cambios neuronales degenerativos. En la fase granular y de calcificación, el edema subsiste y los cambios astrocíticos alrededor de las lesiones se vuelven más intensos. Es común encontrar cisticercos en diferentes estadios en el mismo paciente.1,3,5,6
La neurocisticercosis intraventricular, como el caso de la paciente del caso comunicado, causa una reacción inflamatoria si se encuentra adherida a los plexos coroideos o a la pared ventricular, las células gliales subependimales bloquean el flujo de líquido cefalorraquídeo cerca del orificio de Monro o el acueducto cerebral. Algunos antígenos del cisticerco participan en la evasión de la respuesta inmunológica, por ejemplo, se cree que el antígeno B se une al C1q, inhibiendo la activación de la vía clásica del complemento. Se ha reportado en pacientes con neurocisticercosis disfunción del sistema inmunitario celular, así como concentraciones anormales de citocinas, incremento de la subpoblación de linfocitos T CD8 y alteración en la proliferación de linfocitos totales, estas alteraciones de la inmunidad celular pueden vincular a la neurocisticercosis con tumores de la glía.1
La neurocisticercosis puede ser asintomática en 50% o tener manifestaciones severas según la localización, número de las lesiones y grado de severidad de la respuesta inmunológica del huésped. El 80% de los cuadros sintomáticos se manifiestan con crisis convulsivas de repetición que suelen ser generalizadas o parciales secundariamente generalizadas y se asocian con la degeneración del parásito. La fase de calcificación es el mayor factor de riesgo de crisis convulsivas recurrentes.1,3,7
Otras manifestaciones son cefalea en 27.7%, déficit neurológico focal (motor, sensitivo, alteraciones del lenguaje, movimientos involuntarios, rigidez tipo Parkinson, alteraciones de la marcha e incoordinación) en 16%, hipertensión intracraneal en 12% y deterioro cognitivo en 5%. Estas manifestaciones pueden estar vinculadas con cisticercosis parenquimatosa o con eventos vasculares (infartos lacunares).1,3
El cuarto ventrículo es el sitio más común de neurocisticercosis intraventricular y se ha relacionado con mortalidad alta y riesgo de muerte súbita. En la hidrocefalia por oclusión de los orificios de Luschka y Magendie, los pacientes tienen pérdidas del estado de alerta súbitas asociadas con movimientos de la cabeza (síndrome de Bruns). Si existe oclusión del acueducto cerebral, se puede manifestar por cefalea intensa y síndrome de Parinaud.1,2,7,10,11
En el abordaje y estudio de la neurocisticercosis, los estudios generales contienen datos poco específicos, como eosinofilia periférica y en el examen coproparasitoscópico pueden encontrarse huevos de T. solium.1,7
En el líquido cefalorraquídeo se observan anormalidades no específicas correlacionadas con la actividad de la infección y la localización del parásito, como incremento leve de proteínas (50 a 300 mg/dL) y concentraciones de glucosa por lo general normales, pero la hipoglucorraquia se ha asociado con mal pronóstico. Las pruebas inmunológicas se han usado para evaluar la prevalencia y confirmación del diagnóstico de neurocisticercosis; sin embargo, las pruebas de fijación del complemento y de ELISA tienen sensibilidad y especificidad bajas, con falsos negativos o positivos.1,7,8
El ensayo de inmuno-electrotransferencia ligado a enzimas (EITB) es la única prueba serológica para la detección de anticuerpos específicos de T. solium, con sensibilidad de 98% y especificidad del 100% para dos o más parásitos vivos en el sistema nervioso central, por lo que es el patrón de referencia para el serodiagnóstico. La prueba de ELISA para la detección de antígenos o anticuerpos en líquido cefalorraquídeo tiene sensibilidad de 87% y especificidad de 95% y es útil para la vigilancia de la respuesta al tratamiento antiparasitario.1,3,6-8,12
Los estudios de neuroimagen son el método de elección para el diagnóstico de neurocisticercosis y para determinar el tipo de intervención terapéutica. La tomografía axial computada (TAC) y la resonancia magnética, al combinarse con estudios serológicos, dan evidencia objetiva de la topografía de las lesiones, el estadio de evolución del cisticerco y la severidad de la reacción inflamatoria del huésped.1,3,5,13
La TAC es el estudio de elección para el tamizaje en casos con sospecha de neurocisticercosis porque detecta calcificaciones que no pueden observarse en la resonancia magnética; sin embargo, éste es el método de elección para evaluar las lesiones en el sistema ventricular, en el tronco cerebral y el espacio subaracnoideo.1-3,10
Según el estadio se observan diferentes lesiones en el parénquima cerebral. En el estadio vesicular se puede observar el signo de hole-with-sole, y cuando se trata de una infección masiva se encuentra la imagen de “queso suizo”. En la fase coloidal se observan lesiones indefinidas rodeadas de edema y algunos muestran realce en anillo con el medio de contraste, también se puede encontrar una imagen hiperintensa en secuencias T1, T2 y Flair. El estadio granular tiene un patrón con lesiones nodulares que realzan con el medio de contraste y pueden estar rodeadas o no de edema, en la resonancia magnética pueden observarse bien en la secuencia T1 y T2. Por último, la fase de calcificación se aprecia como un nódulo hipertenso sin edema perilesional.1,5,14
En la neurocisticercosis ventricular, la TAC muestra lesiones hipodensas que causan hidrocefalia obstructiva asimétrica y los quistes dentro del ventrículo se observan isodensos con el líquido cefalorraquídeo y no pueden visualizarse directamente. El diagnóstico por imagen puede ser difícil, por lo que se utilizan secuencias especiales como FIESTA (fast-imaging employing steady-state adquisition), que tiene mayor resolución y cortes más delgados para ver las paredes de los quistes que pueden pasar inadvertidos en secuencias normales.1,3
Los criterios diagnósticos de neurocisticercosis mejoran la detección de casos si sólo se cuenta con datos clínicos y estudios serológicos de baja sensibilidad. Su interpretación nos da dos grados de certeza diagnóstica; el diagnóstico definitivo (un criterio absoluto o dos criterios mayores más un criterio menor y un criterio epidemiológico) y diagnóstico probable (un criterio mayor más dos criterios menores o un criterio mayor más uno menor y uno epidemiológico o tres criterios menores y uno epidemiológico).1,4,5
El tratamiento se decide una vez que se establece el tipo de lesión cerebral del paciente. El tratamiento antiparasitario puede ser con albendazol o praziquantel, no es una intervención de urgencia y debe iniciarse en pacientes estables y asintomáticos. Este tratamiento alivia 60 a 70% de los casos (sin tratamiento el alivio ocurre en 40%) y su administración también se ha relacionado con disminución de las crisis convulsivas. La meta se define por la destrucción de los cisticercos y control de la reacción inmunológica.1,3,15
Durante la administración de cisticidas, puede haber cefalea, vómito o convulsiones vinculados con la reacción inflamatoria del huésped en respuesta a la destrucción del parásito, sobre todo si hay más de un cisticerco; las manifestaciones más importantes son entre el segundo y quinto días del tratamiento, por lo que la administración simultánea de esteroides y anticomiciales ayuda a controlar estos efectos, la extensión de su administración depende de la desaparición de las lesiones o de que éstas se transformen en calcificaciones.1-3
El albendazol se prefiere cuando el parásito está en estadio vesicular en el parénquima cerebral, la dosis indicada en caso de quistes únicos es de 15 mg/kg/día durante tres días o praziquantel 30 mg/kg en tres dosis cada dos horas. En caso de infecciones leves a moderadas se administra albendazol a dosis de 15 mg/kg/día por una semana o praziquantel 50 mg/kg/día durante 15 días y en las infecciones severas se mantiene la dosis de albendazol por una semana con esteroides y anticomiciales.1,7
La administración de albendazol en la fase coloidal ha demostrado reducción del riesgo de convulsiones y en casos severos de encefalitis por neurocisticercosis. Se recomienda la administración de cisticidas acompañados de esteroides y diuréticos osmóticos para reducir la severidad del edema cerebral. Este tratamiento debe extenderse dos a tres semanas hasta que el edema se alivie o se realice una craneotomía descompresiva. En los casos de hipertensión intracraneal, neurocisticercosis subaracnoidea y encefalitis se recomienda la administración primero de esteroides (prednisona a 1-2 mg/kg/día o dexametasona 0.1 mg/kg/día).1,3,6,7
El estadio de calcificación no debe tratarse con fármacos cisticidas y aún no se ha establecido si el tratamiento anticonvulsivo profiláctico se justifica, por lo que se indica únicamente en casos de convulsiones recurrentes. En el caso de hidrocefalia concomitante con aracnoiditis, puede indicarse la colocación de una derivación ventricular antes de otra intervención terapéutica, asimismo, la administración continua de prednisona (a dosis de 50 mg tres veces a la semana durante dos años) puede disminuir el riesgo de disfunción de la derivación.1,7
Los quistes ventriculares pueden tratarse quirúrgicamente o con tratamiento cisticida, según su tamaño y localización; sin embargo, las guías se inclinan al tratamiento quirúrgico con escisión directa o aspiración por neuroendoscopia con fenestración del tercer ventrículo. La neuroendoscopia es un procedimiento que en los últimos años ha experimentado avances en equipo y en habilidades; aunque la bibliografía aún es escasa, la resección neuroendoscópica con ventriculostomía del quiste es el tratamiento de elección, porque se trata de una intervención de mínima invasión, tiene pocas complicaciones, implica menor hospitalización y menores costos.1,7,10,16-18
CONCLUSIÓN
El caso comunicado representa una localización poco común de la neurocisticercosis y una manifestación clínica poco frecuente. El abordaje diagnóstico requirió una serie de estudios de imagen para poder establecer la causa. La secuencia FIESTA fue esencial para el diagnóstico y el tratamiento definitivo fue mediante neuroendoscopia para la extracción del quiste intraventricular. La neurocisticercosis continúa siendo un problema de salud pública en las zonas endémicas como nuestro país; sin embargo, el acceso al tratamiento cisticida y el desarrollo de técnicas quirúrgicas mínimamente invasivas han mejorado el pronóstico de los pacientes.











 text new page (beta)
text new page (beta)



