ANTECEDENTES
La coagulación es un proceso fisiológico en el que participan las plaquetas, los leucocitos, el endotelio vascular, el sistema de coagulación, el sistema de anticoagulación y el sistema fibrinolítico, cuyo objetivo es evitar la pérdida de sangre ante la lesión del endotelio vascular.1 La coagulación puede ser activada durante los estadios inflamatorios, las enfermedades malignas o las infecciones; esa activación está mediada por diversas moléculas, como el factor de necrosis tumoral (TNF), la interleucina 1 (IL-1), la IL-6, la IL-8, entre otros.2,3 En la mayoría de los casos no hay complicaciones, debido a que es un proceso fisiológico y ocurre cotidianamente.2
En ocasiones, esta activación puede llegar a ser patológica con características sistémicas y se denomina coagulación intravascular diseminada, que es un síndrome caracterizado por la activación de la cascada de coagulación y la fibrinólisis, que ocasiona la formación de trombos y la embolización de los mismos en el lecho microvascular, este proceso puede originar amputaciones, gangrena e incluso la muerte por el daño de la perfusión de tejidos y órganos vitales, de ahí la importancia de un diagnóstico y tratamiento oportunos.4-8 Para llegar al diagnóstico de la coagulación intravascular diseminada se requiere la asociación del cuadro clínico del paciente, pruebas de coagulación y hemograma.9 Esta tarea no ha sido fácil, por esto el Ministerio de Salud y Bienestar de Japón (JMHW), la Sociedad Internacional de Trombosis y Hemostasia (ISTH) y la Asociación Japonesa de Medicina Aguda (JAAM) establecieron criterios para su diagnóstico (Cuadro 1).10
Cuadro 1 Criterios para el diagnóstico de coagulación intravascular diseminada establecidos por la Sociedad Internacional de Trombosis y Hemostasia (ISTH), la Asociación Japonesa de Medicina Aguda (JAAM) y el Ministerio de Salud y Bienestar de Japón (JMHW)10,47-55
| Criterio | JAAM | ISTH** | JMHW |
|---|---|---|---|
| Criterios de síndrome de respuesta inflamatoria sistémica | ≥ 3 (1 punto) 0-2 (0 puntos) | - | - |
| Recuento plaquetario (x 103cél/µL) | < 80 o > 50% disminuido en 24 horas (3 puntos) 81 a 120 o 30 a 50% disminuido en 24 horas (1 punto) ≥ 120 (0 puntos) | < 50 (2 puntos) 50 a 100 (1 punto) > 100 (0 puntos) | < 50 (3 puntos) 50 a 80 (2 puntos) 80 a 120 (1 punto) |
| TP (INR) | ≥ 1.2 (1 punto) < 1.2 (0 puntos) | Prolongación > 6 s (2 puntos) Prolongación de 3 a 6 s (1 punto) Prolongación < 3 s (0 puntos) | > 1.67 (2 puntos) 1.25 a 1.67 (1 punto) |
| Productos de degradación de fibrina | ≥ 25 µg/mL (3 puntos) 10 a 24 µg/mL (1 punto) < 10 µg/mL (0 puntos) | Aumento alto (3 puntos) Aumento moderado (2 puntos) Normal (0 puntos) | > 40 µg/mL (3 puntos) 20 a 40 µg/mL (2 puntos) 10 a 20 µg/mL (1 punto) |
| Concentración de fibrinógeno | < 35 mg/dL (1 punto) ≥ 35 mg/dL (0 puntos) | < 100 mg/dL (1 punto) > 100 mg/dL (0 puntos) | < 1 g/L (2 puntos) 1 a 1.5 g/L (1 punto) |
| Existencia de sangrado o insuficiencia orgánica | - | - | 1 punto |
| Enfermedad subyacente | - | - | 1 punto |
| Diagnóstico de coagulación intravascular diseminada | ≥ 4 puntos | ≥ 5 puntos | ≥ 7 puntos |
La coagulación intravascular diseminada es desencadenada por complicaciones, como sepsis, quemaduras, traumatismos graves, cáncer, malignidades hematológicas, medicamentos como rifampicina, rituximab y oxalapatin, quimioterapia, entre otras, por tanto, el tratamiento oportuno de esas enfermedades o la suspensión de los fármacos implicados son la piedra angular del tratamiento de la coagulación intravascular diseminada.11-16
Además de las manifestaciones trombóticas, debido a la fuerte estimulación de la actividad fibrinolítica, pueden aparecer eventos clínicos hemorrágicos, que clínicamente se distinguen por sangrado que puede llevar a la pérdida de pequeños a grandes volúmenes de sangre, esta última situación puede generar un importante daño hemodinámico en los pacientes.17,18
Por lo general, las complicaciones obstétricas y la destrucción tisular masiva cursan con hemorragia, mientras que, con frecuencia, las complicaciones trombóticas afectan a pacientes con cáncer.19,20
Al considerar sus manifestaciones la coagulación intravascular diseminada puede clasificarse en tres tipos:21
Asintomática: caracterizada por la ausencia de signos y síntomas vinculados con alteraciones de la hemostasia.
Hemorrágica: caracterizada por hemorragias, que según su grado causan mayor o menor afectación del estado hemodinámico del paciente, lo que es generado por el consumo de las plaquetas y los factores de coagulación.
Insuficiencia orgánica: caracterizada por el daño generado por la isquemia en los tejidos secundario a la existencia de depósitos de fibrina en la microcirculación que conlleva a la disminución del flujo sanguíneo, la isquemia puede causar insuficiencia de múltiples órganos y, en consecuencia, la muerte.
Esta clasificación es de gran importancia al momento de definir el tratamiento de cada paciente, aunque siempre debe tratarse o eliminarse el trastorno desencadenante.21
Causa y fisiopatología
La sepsis es la enfermedad más comúnmente vinculada con la coagulación intravascular diseminada porque existe gran relación entre la coagulación y la actividad inflamatoria. Cerca de 20 a 40% de los pacientes con sepsis padecen coagulación intravascular diseminada, generando altas tasas de mortalidad, que varía según el grado de la severidad de la sepsis; sin embargo, puede alcanzar cifras, incluso, de 28.6%.22
El síndrome de respuesta inflamatoria sistémica es una de las principales causas de la activación sistémica de la coagulación, donde 50 a 75% de los pacientes politraumatizados con síndrome de respuesta inflamatoria sistémica pueden padecer coagulación intravascular diseminada.4 El síndrome de respuesta inflamatoria sistémica puede ser causado por episodios traumáticos en los que existe destrucción tisular masiva, que genera la liberación del factor tisular, también puede ser causado por las infecciones, como ocurre en la sepsis bacteriana responsable de 7% de muertes en la infancia y cerca de 45% de muertes en unidades de cuidados intensivos neonatales de países en vía de desarrollo, mientras que en los neonatos con sepsis cerca de 33% padece coagulación intravascular diseminada y muere.23-25
Otras de las causas de coagulación intravascular diseminada, específicamente en niños, pueden ser procesos malignos, como la leucemia y los linfomas; en neonatos la hipoxia puede sobrevenir durante la vida fetal o perinatal, como en el síndrome de dificultad respiratoria (SDR), caracterizado por inmadurez pulmonar estructural y funcional que impide el intercambio gaseoso y puede afectar a recién nacidos con 37 a 42 semanas de gestación. La hipoxia conlleva a lesión endotelial y liberación de la tromboplastina, lo que se traduce en la alteración de la hemostasia.3,26 La hipoxia es de gran importancia debido a que afecta a 3-5% de los recién nacidos, de los que 50% puede padecer coagulación intravascular diseminada y morir.25
Además, los neonatos, en especial los pretérmino, son más vulnerables a padecer coagulación intravascular diseminada debido a que tienen bajas concentraciones de antitrombina y proteína C que juegan un papel importante en evitar eventos embólicos gracias a su importante papel como inhibidores de la coagulación por mecanismos diferentes al evitar el paso de fibrinógeno a fibrina y al inactivar al factor V y VIII de la coagulación, respectivamente (Figura 1 ).21
El daño endotelial ocasiona la liberación de fibras de colágeno, lo que lleva a un estado protrombótico que activa la cascada de coagulación, altera la reactividad de las plaquetas y genera vasoconstricción. Asimismo, ocurre activación del endotelio, es decir, aumenta su permeabilidad y la interacción con leucocitos dando lugar a la diapédesis, quimiotaxis y producción de citocinas.3
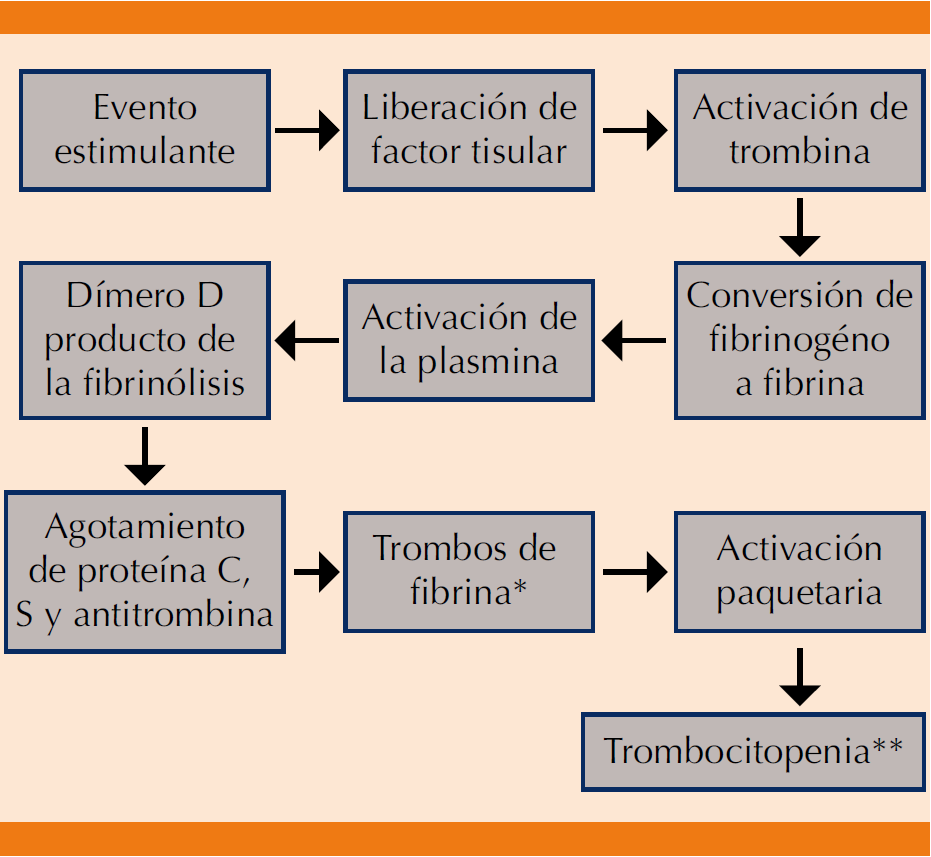
Las citocinas liberadas, principalmente la IL-6 y la IL8, son las responsables de modular el inicio de la coagulación, debido a que incrementan la expresión de moléculas de adhesión plaquetaria, leucocitos y células endoteliales. Sin embargo, la IL-1 y el factor de necrosis tumoral α (TNF-α) cumplen un papel muy importante, debido a que inducen la atracción de los leucocitos al factor tisular, que da inicio a la cascada de coagulación.3,27,28 Posteriormente, la trombina escinde el fibrinógeno en fibrinopéptidos A, B y monómero de fibrina, éste puede cubrir plaquetas y proteínas de coagulación, otorgándole capacidad anticoagulante; luego, el plasminógeno, que forma parte del sistema fibrinolítico, se activa transformándose en plasmina por la existencia de los monómeros de fibrina, cuya función es destruir los coágulos de fibrina generando productos de degradación de la fibrina X, Y, D, E y el dímero D, este último es el principal responsable de generar la respuesta inflamatoria.28,29
Más tarde se genera trombocitopenia debido a la interacción de las plaquetas con la fibrina y la trombina.29-31Éstas también pueden ser activadas por el factor plaquetario 4, B-trombomodulina, de manera que se forme un complejo plaqueta-neutrófilo, o bien porque las bacterias grampositivas se unan al receptor del factor activador de plaquetas.3 Las proteínas que controlan la cascada de coagulación, como la proteína C, proteína S y la antitrombina se agotan, todos estos fenómenos sumados dan lugar a la formación de microtrombos capaces de obstruir los vasos sanguíneos de pequeño calibre, además, puede haber hemorragia secundaria a la trombocitopenia, por ello, la coagulación intravascular diseminada se considera una enfermedad trombohemorrágica (Figura 2 ).29,32
Cuadro clínico
Al tener en cuenta que la coagulación intravascular diseminada es un síndrome secundario a una enfermedad sistémica, la mayor parte de sus hallazgos clínicos suelen estar ocultos en las manifestaciones clínicas de la enfermedad causal.33 A pesar de que los signos y síntomas pueden ser variables en niños y según el grado de severidad de la coagulación intravascular diseminada, con frecuencia se observa que la hemorragia es el signo más común y puede ser en forma de petequias o púrpura cutánea o severa.34,35
Asimismo, los eventos tromboembólicos generan insuficiencia orgánica debido a la disminución del flujo sanguíneo a diversos tejidos, esto puede generar consecuencias, como insuficiencia renal prerrenal, síndrome de dificultad respiratoria del adulto, disfunción hepática, alteraciones neurológicas y necrosis de piel, médula ósea y huesos.29,36
Se denomina cuadros clínicos mixtos a la existencia de eventos hemorrágicos y trombóticos simultáneamente en el paciente que, como en los cuadros hemorrágicos y trombóticos puros, se acompañan de la alteración de las pruebas de coagulación.17,37
Diagnóstico
El aumento en la producción de fibrina, la activación del sistema fibrinolítico y la conversión del fibrinógeno a fibrina son procesos implicados en la fisiopatología de la coagulación intravascular diseminada y pueden ser detectados mediante pruebas de laboratorio, incluso para establecer el diagnóstico. Desafortunadamente, existen diversas limitaciones debido a que no es costo-efectivo, no genera un beneficio tangible y no existen pruebas específicas de laboratorio con esa finalidad.24,36
Los criterios para el diagnóstico de la coagulación intravascular diseminada se basan en pruebas de coagulación, tiempo de trombina, cuantificación de productos de degradación de la fibrina y recuento plaquetario (Cuadro 1).10 En estas pruebas de laboratorio se puede obtener disminución de los factores de la coagulación y las plaquetas, como en la coagulación intravascular diseminada aguda o, por el contrario, elevados o normales, como es el caso de la coagulación intravascular diseminada crónica donde el hígado y la médula ósea compensan su consumo.11,38 Por lo general, los hallazgos obtenidos en estas pruebas son trombocitopenia progresiva que no siempre corresponde a coagulación intravascular diseminada u otras anomalías en la hemostasia; en el tiempo de protrombina (TP), encargado de evaluar la vía extrínseca de la coagulación, pueden observarse alteraciones por deficiencia de la vitamina K, especialmente en neonatos. El tiempo parcial de tromboplastina (TPT), que evalúa la vía intrínseca, puede alterarse por el deterioro en la coagulación o en la coagulación intravascular diseminada; sin embargo, pueden obtenerse valores elevados en otras enfermedades, como el lupus.39-41 El fibrinógeno, al ser un reactante de fase aguda, se eleva durante los periodos de infección, por ello, debe compararse el valor de otros reactantes de fase aguda, como la proteína C reactiva (PCR), si esta última tiene un valor normal y el fibrinógeno un valor elevado debe sospecharse coagulación intravascular diseminada, al igual que en casos donde exista trombocitopenia y bajas concentraciones de fibrinógeno. El dímero D también se cuantifica debido a que indica la activación de la coagulación y la fibrinólisis, éste puede elevarse ante la existencia de trombosis, embolia, daño tisular, infecciones, malignidad e hipoxia, si su resultado es negativo puede descartarse con certeza la coagulación intravascular diseminada.25
Otra prueba que puede realizarse es la tromboelastografía, un método in vitro que permite medir la formación, elasticidad de los trombos y las propiedades viscoelásticas de la sangre. Ésta ha mostrado mayor especificidad que las pruebas de coagulación para el diagnóstico de coagulación intravascular diseminada en niños, esto se debe a que es capaz de medir las variaciones durante las etapas de la coagulación, lo que permite analizar la relación entre plaquetas, fibrinógeno y proteínas de la coagulación mediante un pin que se encuentra suspendido dentro de la muestra de 0.36 mL de sangre, ese pin permite medir la variación de la resistencia presente en la muestra a medida que ocurre la coagulación.42-44
Los criterios del Ministerio de Salud y Bienestar de Japón parecen ser más útiles en el diagnóstico de coagulación intravascular diseminada bajo el contexto de una leucemia aguda, mientras que los criterios de la Sociedad Internacional de Trombosis y Hemostasia y la Asociación Japonesa de Medicina Aguda son más específicos y sensibles, respectivamente, en caso de sepsis.21,45
La escala de valoración desarrollada por la Sociedad Internacional de Trombosis y Hemostasia es una de las más utilizadas en cuidados intensivos; sin embargo, en niños y neonatos aún no se ha validado, al igual que la valoración creada en 1998 con el fin de diagnosticar coagulación intravascular diseminada en el recién nacido con bajo peso;25 esta valoración surgió al notar la necesidad de desarrollar un criterio más preciso, porque los neonatos son quienes tienen mayor probabilidad de padecer coagulación intravascular diseminada por su alta susceptibilidad.46 Esta valoración incluye cuantificación de trombina, recuento de plaquetas y productos de degradación de la fibrina. Lamentablemente, en ocasiones, la relación entre resultados anormales en las pruebas de laboratorio y las manifestaciones clínicas no permiten establecer el diagnóstico certero de coagulación intravascular diseminada.46
En los pacientes pediátricos se encuentran varias limitaciones al momento de interpretar diversas pruebas de laboratorio debido a que pueden tener alteraciones fisiológicas en el sistema de coagulación y, como consecuencia, se llega al diagnóstico de coagulación intravascular diseminada a través de las manifestaciones clínicas que padecen. Las pruebas para detectar productos de degradación de fibrina son relevantes para determinar si un paciente tiene coagulación intravascular diseminada; sin embargo, no existe una prueba específica de laboratorio con ese fin.45 A su vez, los criterios establecidos por la Sociedad Internacional de Trombosis y Hemostasia (ISTH), la Asociación Japonesa de Medicina Aguda y el Ministerio de Salud y Bienestar de Japón fueron creados para el diagnóstico de la coagulación intravascular diseminada en adultos, en el estudio realizado por Soundar y su grupo47 describieron que el sistema de puntuación del ISTH tiene menor sensibilidad que el basado en recomendaciones de expertos del Hospital infantil de Texas (Cuadro 2).
Cuadro 2 Sistema de puntuación del Hospital Infantil de Texas47
| Criterios | Puntos |
|---|---|
| Recuento plaquetario | Debe hacerse seguimiento |
| Prolongación del TP (s) | |
| < 2.6 | 0 |
| 2.6-5.6 | 1 |
| > 5.6 | 2 |
| Fibrinógeno | Debe hacerse seguimiento |
| Dímero D | |
| < 1.5 | 0 |
| 1.5-3.9 | 2 |
| ≥ 4 | 3 |
| Diagnóstico de coagulación intravascular diseminada | ≥ 5 |
Los criterios para el diagnóstico de coagulación intravascular diseminada expuestos anteriormente incluyen pruebas de coagulación globales, por ello su capacidad diagnóstica puede ser similar.56
Se reportado sensibilidad y especificidad altas de la evaluación de la coagulación intravascular diseminada a través de los criterios de la Sociedad Internacional de Trombosis y Hemostasia (ISTH) con 93 y 97%, respectivamente.57 En la actualidad, numerosos biomarcadores desarrollados se han basado específicamente en esta escala, pese a que no se han incorporado o no se han estandarizado los valores de referencia (como el dímero D), la ISTH sigue siendo referente.58
A pesar de que la ISTH es una gran guía al momento del diagnóstico, tiene algunas carencias, entre ellas resalta la inefectividad para valorar mujeres embarazadas; según Jonard y su grupo,59 deberían usarse otros criterios que tengan en cuenta los cambios fisiológicos que muestran esas pacientes, por ejemplo, el embarazo conlleva a un estado de hipercoagulabilidad, que busca evitar la pérdida de grandes volúmenes sanguíneos durante y después del parto. Además, la concentración de dímero D se incrementa fisiológicamente durante esta etapa, por ello, los criterios disponibles hasta el momento no son totalmente adecuados.
Wan y su grupo60 describieron la superioridad de los parámetros Sonoclot sobre ISTH y Acute Physiology and Chronic Health Evaluation (APACHE por sus siglas en inglés) como predictor de supervivencia a 30 días, incluso con la capacidad de identificar las insuficiencias de las dos últimas escalas. A pesar de esto, la ISTH sigue siendo muy importante y cobra más relevancia al momento de identificar a los pacientes con alto riesgo de morir o con riesgo de padecer enfermedad de manera aguda.61
Respecto de otras condiciones patológicas como el traumatismo, Koami y su grupo62 determinaron que entre los criterios de la Asociación Japonesa de Medicina Aguda, el aumento del INR ≥ 1.2 es fiable como predictor e indicador de gravedad en coagulación intravascular diseminada asociada con traumatismo, de ahí su importancia porque se trata de una medida asequible para la mayoría de médicos en el mundo.
Hace poco la Sociedad Japonesa de Trombosis y Hemostasia propuso un nuevo criterio diagnóstico porque es conocedora de que los marcadores, aunque no son específicos de coagulación intravascular diseminada y difieren según la enfermedad base, deben incluirse en los criterios diagnósticos.63,64 Clasificó a la coagulación intravascular diseminada en tipo fibrinolítico suprimido (observado en la coagulación intravascular diseminada secundaria a sepsis donde se encuentran elevados los marcadores de la coagulación), coagulación intravascular diseminada de tipo fibrinolítico mejorado (observado en pacientes con leucemia promielocítica aguda, aneurisma aórtico y cáncer prostático donde hay marcada activación del sistema fibrinolítico con aumento de los marcadores de la coagulación y la fibrinólisis, especialmente de productos de degradación de la fibrina) y de tipo fibrinolítico balanceado. Por lo anterior, deben proponerse criterios basados en la enfermedad desencadenante de la coagulación intravascular diseminada.63
Biomarcadores
Existen más de 150 biomarcadores a los que se le ha atribuido utilidad sólo para el diagnóstico de coagulación intravascular diseminada o sepsis, mismos que se implican en procesos relacionados con coagulación, fibrinólisis, plaquetas y anormalidades endoteliales. Sin embargo, deben tenerse en cuenta numerosos factores al momento de elegir un biomarcador fiable. Por esto, algunas técnicas de laboratorio, como los biochips, han participado en la identificación de numerosas proteínas, como interleucina (IL) 2, IL-4, IL-6, IL-8, IL-10, factor de crecimiento endotelial vascular (VEGF), interferón (IFN) g, factor de necrosis tumoral (TNF), IL-1a, IL-1b y factor de crecimiento epidérmico (EGF), de manera que puedan analizarse simultáneamente.65
Algunas investigaciones han demostrado que las células cancerosas y los blastos en la leucemia están implicados en la liberación de vesículas extracelulares que contienen en su interior factor tisular. El factor tisular es la molécula desencadenante más potente de la coagulación y, por ende, juega un papel importante en la homeostasia vascular. A través de técnicas moleculares se ha logrado estimar la concentración y los antígenos de superficie de las vesículas extracelulares, entre ellas se encuentran: citometría de flujo, microscopia de fuerza atómica, microscopia electrónica de transmisión y dispersión dinámica de luz; pese a que es posible hacerlos con dichas técnicas, existen limitaciones que impiden el uso rutinario.19
En la actualidad también se han propuesto dos nuevos predictores de gravedad en estados agudos en donde se manifiesta la coagulación intravascular diseminada, ellos son la angiopoyetina 2 y la tirosina cinasa 1 similar al tipo fms (SFlt-1); la primera es un factor de la angiogénesis, que participa en la unión e inhibición del receptor Tie-2 en las células endoteliales, que se han relacionado con la alteración del endotelio y la hemorragia, mientras que el SFlt-1 es un receptor en función del factor de crecimiento placentario y VEGF, en otras palabras, son marcadores de disfunción endotelial y se han relacionado con enfermedades como pancreatitis aguda e insuficiencia y lesión renal aguda.66
Delabranche y su grupo67 determinaron que las micropatrículas procoagulantes (CD105+-MPs, CD11a+-MPs/leucocitos) podrían ser marcadores de la coagulación intravascular diseminada en pacientes con choque séptico, además, determinaron la participación de los leucocitos por interacción CD11a+- MPs en la coagulación intravascular diseminada y pudieron descartarla en los pacientes con puntaje de la Asociación Japonesa de Medicina Aguda menor a 4 con el recuento plaquetario, TP y CD105+-MPs.
Takahashi y colaboradores68 afirman que la presepsina y la proteína C (PC) son marcadores muy importantes para el diagnóstico de coagulación intravascular diseminada inducida por sepsis y la clasifican en tres grupos: severa (presepsina > 900 pg/mL y proteína C < 45%); leve (presepsina < 650 pg/mL y proteína C > 45%, o presepsina < 900 pg/mL y proteína C > 55%) y moderada (entre los valores de los grupos anteriores).22,72 De igual manera, Ishikura y su grupo22 realizaron un estudio aplicando 11 biomarcadores diferentes a 82 pacientes, de los que los más acertados para determinar gravedad en cuanto a la morbilidad fueron la presepsina y la proteína C.
También se han evaluado otros biomarcadores que en el caso de la antitrombina su análisis es inversamente proporcional a la severidad de la enfermedad, de manera que en la sepsis sin disfunción orgánica, sepsis grave y coagulación intravascular diseminada, la actividad de la antitrombina es de 80, 60 y 40%, respectivamente.69
CONCLUSIONES
La coagulación intravascular diseminada es una complicación clínica muy importante que debe tratarse adecuadamente como urgencia médica, especialmente en los pacientes con alto riesgo de padecerlo, por esto debe hacerse el análisis detallado de las diferentes consideraciones diagnósticas que incluyan todos los criterios que mencionan las diferentes asociaciones internacionales médicas.











 text new page (beta)
text new page (beta)