ANTECEDENTES
El tromboembolismo venoso, que incluye trombosis venosa profunda y embolia pulmonar, es responsable de la hospitalización de más de 250,000 personas cada año en Estados Unidos y representa alto riesgo de morbilidad y mortalidad.1 En Europa, es la tercera causa de enfermedad cardiovascular más frecuente con incidencia anual de 100-200 casos por 100,000 habitantes.2,3 La incidencia puede estar subestimada teniendo en cuenta que hasta una tercera parte de los casos se detectan en autopsias.4 En Colombia, dos estudios de Dennis y su grupo reportaron incidencia de tromboembolismo venoso en pacientes hospitalizados de 7%5 y mortalidad hospitalaria por embolia pulmonar de 14.8%.6
La poca especificidad de la manifestación clínica de la embolia pulmonar y la probabilidad de pasar por alto el diagnóstico de una enfermedad potencialmente fatal ha llevado a que ésta sea sospechada en pacientes con una amplia variedad de síntomas, como disnea, dolor torácico tipo pleurítico, síncope, hemoptisis o hipotensión arterial. Estos pacientes representan más de 10 millones de visitas a urgencias al año en Estados Unidos.7
Así, durante la última década, la estrategia para el diagnóstico de embolia pulmonar ha sido bien definida con el fin de excluir de forma segura el padecimiento; en primer lugar, incluye la evaluación de la probabilidad clínica de embolia pulmonar, usando una regla de predicción estructurada (Wells o Ginebra) o una estimación no estructurada (Gestalt);8 en pacientes con probabilidad clínica baja-intermedia de embolia pulmonar, el dímero D (DD) positivo debe ser seguido por una imagen, por lo general una angiotomografía computada pulmonar (angio-TC) en ausencia de contraindicación. En los pacientes con probabilidad clínica alta debe efectuarse la angio-TC sin necesidad de pruebas diagnósticas previas.9,10
De acuerdo con esta estrategia se dispone del dímero D, un producto de degradación de la fibrina reflejo de la respuesta de fase aguda a la lesión tisular secundaria a los fenómenos trombóticos y embólicos.7 El dímero D puede medirse por ensayos de inmunoabsorción ligado a enzimas (ELISA) o por pruebas de aglutinación en látex, actualmente las de elección son las primeras con técnicas cuantitativas,10 con sensibilidad de 95% (IC95% 85-100%) y razón de verosimilitud (LR, del inglés likelihood ratio) negativa de 0.13 (0.03-0.58), pudiendo así excluir la embolia pulmonar con un resultado negativo en pacientes con probabilidad baja-intermedia.11-14
No obstante, el dímero D puede encontrarse elevado en múltiples situaciones fisiológicas, como embarazo, puerperio y en sujetos de raza negra; y patológicas, como en tabaquismo activo, traumatismos recientes, periodo posquirúrgico, trombosis arteriales (síndrome coronario agudo, accidentes cerebrovasculares, enfermedad arterial periférica, isquemia intestinal), trombosis microvasculares (coagulación intravascular diseminada), fibrilación auricular, insuficiencia cardiaca, disección aórtica, sepsis, neumonía adquirida en la comunidad, insuficiencia renal y neoplasias activas.7 De tal forma que el dímero D no se relaciona exclusivamente con la existencia de coágulos, por lo que no es un marcador específico de embolia venosa.9
Debido a su baja especificidad (40-60%), el dímero D puede llevar a frecuentes falsos positivos y realización de angiotomografías innecesarias. La amplia disponibilidad de las pruebas de dímero D, combinada con el temor de no diagnosticar un caso de embolia pulmonar, han llevado a reducir el umbral para la sospecha de la enfermedad; de ahí la disminución de la prevalencia de embolia pulmonar confirmada de 30% a menos de 10% en Estados Unidos.15 Del mismo modo, en la última década se ha reportado incremento de incluso 10-15 veces en la utilización de la angio-TC para el diagnóstico de embolia pulmonar,16 así como en la incidencia de embolia pulmonar diagnosticada;17 sin embargo, esta mayor incidencia de embolia pulmonar no se ha acompañado de disminución en la tasa de fatalidad por embolia pulmonar,17,18 es decir, el pronóstico de un paciente con embolia pulmonar ha mejorado, pero el número total de muertes por embolia pulmonar no ha cambiado. Es así que la embolia pulmonar tiende a ser “sobrediagnosticada” porque las embolias pulmonares pequeñas se diagnostican con mayor frecuencia, sin ningún beneficio claro en términos de desenlaces clínicos.17,19,20
Asimismo, el aumento en el número de angioTCs podría incrementar riesgos innecesarios, como la nefropatía y las reacciones alérgicas inducidas por el medio de contraste, los eventos adversos tras la administración de tratamiento anticoagulante o la aparición tardía de cáncer inducido por radiación.21-23
Es así que recientemente se han propuesto dos estrategias que podrían cambiar la práctica clínica usual al refinar el algoritmo diagnóstico de la embolia pulmonar. La primera de ellas, la regla de predicción clínica PERC (del inglés Pulmonary Embolism Rule-out Criteria), que permitiría descartar la enfermedad en pacientes con baja probabilidad de embolia pulmonar sin necesidad de solicitar el dímero D,24 pudiendo así disminuir la estancia en urgencias y la realización de estudios radiográficos adicionales.
La otra, el ajuste del dímero D por edad,25 teniendo en cuenta que varios reportes han señalado que la especificidad de la prueba disminuye cerca de 10% en los pacientes mayores de 80 años y que tan sólo en 10 a 15% de ellos se confirma la embolia pulmonar; de esta forma, en pacientes mayores de 50 años con probabilidad baja-intermedia de embolia pulmonar, se incrementaría la especificidad de la prueba sin modificar la sensibilidad, aumentado el número de pacientes en quienes podría descartarse la embolia pulmonar sin necesidad de pruebas radiográficas adicionales.26-30
Esta revisión tiene como objetivo describir de forma crítica la evidencia acerca del uso de la regla PERC y el dímero D ajustado por edad en el algoritmo diagnóstico de la embolia pulmonar y las posibles áreas de investigación en nuestro medio.
Obtención de datos
Se hizo una revisión sistemática de la bibliografía en las bases de datos PubMed (http://www.ncbi.nlm.nih.gov/pubmed/clinical), TripDatabase (https://www.tripdatabase.com/) y Epistemonikos (http://www.epistemonikos.org/es/), hasta enero 23 de 2017. Se limitó la búsqueda a metanálisis y estudios de cohorte prospectivos o retrospectivos y guías de práctica clínica. No se consideró límite de idioma y se utilizaron los términos MESH fibrin fragment D, pulmonary embolism y diagnosis, así como el término pulmonary embolism rule-out criteria y el acrónimo PERC.
Se hizo la lectura inicial del título y resumen de 38 referencias de la escala PERC y 1474 acerca del dímero D ajustado por edad, de las que se seleccionaron 24 y 26, respectivamente, que fueron representativas para el tema.
RESULTADOS
Regla de predicción clínica PERC
Estudio de validación
En 2004, Kline y su grupo llevaron a cabo un estudio de cohorte en 3148 pacientes con sospecha de embolia pulmonar que consultaron a los servicios de urgencias de 10 hospitales en Estados Unidos, con el fin de derivar y validar una regla de predicción clínica que permitiera descartar la enfermedad en sujetos con baja probabilidad clínica del diagnóstico, según las recomendaciones metodológicas vigentes.31
En el estudio de derivación se extrajeron de forma prospectiva 21 variables independientes previamente definidas y tomadas a la cabecera del paciente, con adecuada variabilidad interobservador; la prevalencia global de embolia pulmonar fue de 11% (IC95% 11-12%). Mediante el uso de técnicas de regresión logística con eliminación paso a paso hacia atrás, esas variables se redujeron finalmente a ocho (Cuadro 1), mismas que se incluyeron en una regla de predicción clínica negativa en bloque, es decir, la existencia de alguna de ellas.31
Cuadro 1 Componentes de la escala PERC
| Edad > 50 años |
| Frecuencia cardiaca > 100 lpm |
| SaO2 < 95% |
| Hemoptisis |
| Inflamación unilateral de pierna |
| Antecedente de trombosis venosa profunda o de embolia pulmonar |
| Traumatismo o cirugía reciente |
| Administración de estrógenos exógenos |
La fase de validación se llevó a cabo en dos grupos independientes de sujetos que consultaron a urgencias. Uno de bajo riesgo (1427 pacientes con sospecha de embolia pulmonar a quienes se les realizó dímero D), con el fin de evaluar la sensibilidad de la regla PERC y que mostró prevalencia de embolia pulmonar a 90 días de 8% (IC95% 8-9%); y otro de muy bajo riesgo (382 pacientes con disnea y en quienes no se sospechó embolia pulmonar), con el fin de evaluar la viabilidad de la regla, es decir, si era negativa en un porcentaje suficiente de pacientes para que fuera útil, con prevalencia de embolia pulmonar de 2% (IC95% 1-4%).31
La regla PERC fue negativa en 25% de los sujetos de baja probabilidad y mostró sensibilidad de 96% (IC95% 90-99%), especificidad de 27% (IC95% 25-30%) y tasa de falsos negativos de 1.4% (IC95% 0.4-3.2%) en el grupo de bajo riesgo; esta última por debajo de 1.8%, umbral de la prueba por debajo del que no sería necesario solicitar dímero D, según se estableció para el estudio. En el grupo de muy bajo riesgo, la regla PERC fue negativa en 15% de los sujetos y las cifras fueron de 100% (IC95% 59-100%), 15% (IC95% 11-18%) y 0% (IC95% 0-6%), respectivamente.31
Desde el punto de vista metodológico, el estudio fue bien realizado y la tasa de eventos a tres meses en el grupo de bajo riesgo estuvo por debajo de 1.7% (IC95% 1-2.7%), la observada después de una angiograma pulmonar negativo, el patrón de referencia aceptado en el momento.
Metanálisis
Posterior al estudio original, la regla PERC se evaluó en varios estudios,32-38 cuyos hallazgos se resumieron en dos metanálisis, publicados por Singh y colaboradores, en 201239 y 2013.40 La segunda publicación incluyó los datos de 14,844 pacientes (edad promedio 56 años y 63% mujeres) provenientes de 13 cohortes (3 retrospectivas, 10 prospectivas), con sensibilidad de 97% (IC95% 96-98%) y especificidad de 22% (IC95% 22-23%), con razón de probabilidad positiva de 1.22 (IC95% 1.16-1.29) y negativa de 0.17 (IC95% 0.13-0.23).2 El porcentaje total de embolia pulmonar no identificada con la escala de PERC fue de 0.3% (48 pacientes de 14,844) cuando la escala se usó sola o junto con la escala de Ginebra y disminuyó a 0.2% (44 de 14844) cuando se usó en combinación con la Gestalt. Los resultados no mostraron variación de acuerdo con la prevalencia de la embolia pulmonar (mayor o menor a 10%).8
Estudios adicionales
Posterior al metanálisis, ocho estudios evaluaron el uso de la escala PERC en pacientes con embolia pulmonar de baja probabilidad (Cuadro 2) y mostraron su utilidad para desacartar embolia pulmonar sin necesidad del uso de dímero D, evitando así la realización de estudios radiográficos innecesarios.41-48
Cuadro 2 Características y resultados de los estudios que evaluaron la escala PERC
| Autor/año | Tipo de estudio | Núm. de pacientes | Edad promedio (años) | Prevalencia de embolia pulmonar con PERC negativo (%) | Resultados |
|---|---|---|---|---|---|
| Huckins y col.41 2012 | Retrospectivo | 1136 | 51.3 | 0 | VPN negativo de PERC 100%. Reducción de 9.9% de angio-TC innecesarias |
| Crichlow y col.42 2012 | Prospectivo | 152 | 46.3 | 0 | Sensibilidad 100%, especificidad 10%, VPN 100%. Reducción de 9% de angio-TC innecesarias |
| Aydoğdu y col.43 2014 | Retrospectivo | 108 | 64 | 1.8 | Sensibilidad 98%, especificidad 7%, VPP 50%, VPN 80% |
| Bokobza y col.44 2014 | Retrospectivo | 1070 | 35 | 0. | 15% de estudios innecesarios en pacientes con PERC negativo |
| Bozarth y col.45 2015 | Retrospectivo | 719 | 47 | 1.2 | Sensibilidad 96.9%, especificidad 11.9%, VPN 98.8%. Reducción de 11.5% de angio-TC innecesarias |
| Stojanovska y col.46 2015 | Prospectivo | 602 | 53 | 1.9 | Reducción de 17.6% de angio-TC innecesarias |
| Theunissen y col.47 2016 | Retrospectivo | 377 | 58 | 0.5 | Sensibilidad 89%, especificidad 21%, LR 0.52, VPN 97% |
| Crane y col.48 2016 | Retrospectivo | 940 | 51.4 | 8 | Sensibilidad 91.4%, VPN 99.1% |
Angio-TC: angiotomografía computada pulmonar; VPN: valor predictivo negativo; VPP: valor predictivo positivo; LR: razón de verosimilitud.
Asimismo, Mongan y colaboradores reportaron el uso de la escala PERC en pacientes jóvenes (18-35 años) con embolia pulmonar, modificando el criterio de edad a mayor de 35 años, con resultados similares a los observados con la escala original 49 y Richardson y su grupo señalan que la escala PERC se identificó como la más útil de otras 14 escalas en una encuesta realizada en urgenciólogos de Estados Unidos.50
Asimismo, Hugli y colaboradores señalaron que la escala PERC podría no excluir de forma segura la embolia pulmonar, al menos en una población con relativamente alta probabilidad (22%), tras analizar de forma retrospectiva los datos de 1675 pacientes y encontrar frecuencia de 6% en sujetos con PERC negativa.51 De tal forma que se ha recalcado la necesidad de su uso sólo tras la aplicación de la escala Wells o la de Ginebra para clasificar la probabilidad previa.52,53 En la actualidad, y al tener en cuenta que ningún estudio de asignación aleatoria ha evaluado la escala PERC, se está llevando a cabo el estudio PROPER, un trabajo prospectivo realizado en 15 centros en Francia, que usa la escala en pacientes con probabilidad baja de embolia pulmonar determinada por Gestalt; el desenlace primario es el porcentaje de falla terapéutica, definido como la existencia de embolia pulmonar a los tres meses de seguimiento.54
Dímero D ajustado por edad
Estudios de validación
En 2010, Douma y su grupo reportaron un nuevo punto de corte del dímero D, ajustándolo según la edad del paciente con la fórmula [edad (años) x 10 μg/L], para uso en pacientes mayores de 50 años con sospecha de embolia pulmonar.55
Para la derivación, utilizaron una cohorte retrospectiva multicéntrica de 1721 pacientes con sospecha de embolia pulmonar y para la validación, dos cohortes (de 3306 y 1812 pacientes). Para descartar o comprobar embolia pulmonar usaron: reglas de predicción clínica (Wells y Ginebra), medición de las concentraciones de dímero D e imágenes (angio-TC, doppler venoso de miembros inferiores, gammagrafía de ventilación-perfusión o los tres) y todos los pacientes se siguieron a tres meses.55
En los casos de probabilidad baja de embolia pulmonar según la regla de predicción clínica aplicada, se cuantificó el dímero D; este grupo de pacientes se dividió en subgrupos según sus décadas de vida; se construyeron curvas ROC para las concentraciones de dímero D de cada subgrupo, se hizo análisis de regresión lineal para obtener el factor de multiplicación y establecer el nuevo punto de corte según la edad. Se encontró que las concentraciones de dímero D se incrementaban en 11.2 mg/L por cada año y que el ajuste del punto de corte debía hacerse en los mayores de 50 años.55
La utilidad clínica del nuevo punto de corte aumentó significativamente con la edad: la proporción de pacientes en que se descartó embolia pulmonar con el nuevo punto de corte ajustado por edad fue un tercio mayor en los pacientes con edad > 50 años y casi dos veces mayor en los sujetos con edad > 70 años.55 La mejoría en la utilidad clínica del punto de corte ajustado por edad no se observó a expensas de la seguridad, sin haber diferencias en las tasas de falsos negativos (Cuadro 3).55
Cuadro 3 Resultados de los estudios de validación del dímero D ajustado por edad
| Derivación | Validación 1 | Validación 2 | |
|---|---|---|---|
| Número de pacientes | 1331 | 2158 | 1643 |
| Punto de corte tradicional | |||
| Pacientes por debajo | 36 (33-39) | 46 (44-48) | 34 (32-37) |
| Falsos negativos | 0 (0-0.8) | 0.2 (0.1-0.7) | 0 (0-0.7) |
| Punto de corte ajustado por edad | |||
| Pacientes por debajo | 42 (39-45) | 51 (49-53) | 40 (38-43) |
| Falsos negativos | 0.2 (0-1) | 0.6 (0.3-1.3) | 0.3 (0.1-1.1) |
| Incremento de pacientes (%) | |||
| Absoluto | 6.3 | 5.1 | 620 |
| Relativo | 17 | 11 | 1100 |
Las limitaciones del estudio fueron el análisis retrospectivo de los datos y su falta de poder para precisar diferencias entre las dos técnicas utilizadas para la cuantificación del dímero D.
Metanálisis
Tras el reporte de Douma y colaboradores, cinco publicaciones reportaron la utilidad del dímero D ajustado por edad en el diagnóstico de tromboembolismo venoso.55-59 En 2013, Schouten y su grupo incluyeron estos datos en una revisión sistemática con metaanálisis que incluyó 22,608 pacientes.60
Se seleccionaron estudios que incluyeron pacientes con sospecha diagnóstica de tromboembolismo venoso, con probabilidad baja o media (usando los puntajes de Ginebra o Wells) en quienes se midió el dímero D y se hicieron pruebas de referencia para descartar el diagnóstico de tromboembolismo venoso y en el que los pacientes se hubieran seguido por al menos tres meses.60
Los datos mostraron disminución de la especificidad del punto de corte convencional del dímero D a medida que aumentaba la edad (15% en > 80 años), mientras que el punto de corte ajustado por edad mostró mayor especificidad en todas las categorías de edad, duplicándose en mayores de 80 años (alcanzó especificidad de 35%). La sensibilidad del punto de corte ajustado por edad fue menor que el punto de corte tradicional, sin ser estadísticamente significativa, y manteniéndose por encima de 97% en todas las edades.60
No se observó efecto en los resultados al ajustar por covariables como edad, prevalencia de o si los pacientes tenían sospecha inicial de trombosis venosa profunda o embolia pulmonar; sin embargo, sí hubo diferencia entre las distintas técnicas de medición del dímero D, la técnica de ELISA fue favorecida sobre la prueba cuantitativa de látex.60
Al realizar un análisis basado en cohortes hipotéticas de 1000 pacientes para cada grupo etario, se concluyó que con el punto de corte tradicional se descartarían correctamente 124 casos por cada 1000 pacientes que no tuvieran alto riesgo en los mayores de 80 años, mientras que con el nuevo punto de corte se descartarían 303 por cada 1000.60
La ventaja de utilizar un punto de corte ajustado por edad sería la capacidad de excluir embolia pulmonar en mayor número de pacientes (1 de cada 3 en los mayores de 80 años), sin aumento de los casos de embolia pulmonar pasados por alto. De hecho, el número de estos casos en la población de mayor edad utilizando el punto de corte ajustado por edad (aproximadamente de 1-4 por cada 1000 pacientes) fue comparable a la tasa de falsos negativos en las personas menores de 50 años (3 por 1000).60
Las limitaciones del estudio fueron: la selección de reportes de sólo tres grupos de investigación, la imposibilidad de analizar otros puntos de corte del dímero D ajustado por edad propuestos y que el seguimiento a tres meses fue sólo clínico en 12 cohortes, sin practicar ningún estudio de imagen para confirmar la ausencia de embolia pulmonar. Como resultado, la exactitud diagnóstica del uso del punto de corte ajustado por edad podría haberse sobreestimado de forma no significativa.
Estudio ADJUST-PE
En 2014, Righini y su grupo publicaron el estudio ADJUST-PE (del inglés Age-Adjusted D-Dimer Cutoff Levels to Rule Out Pulmonary Embolism Study), que determinó la tasa de fallas del dímero D ajustado por edad (falla definida como evento embólico o muerte en los siguientes tres meses), éste fue el primer estudio prospectivo en el que los pacientes con sospecha de embolia pulmonar eran tratados sin anticoagulantes basándose en el dímero D ajustado por edad.61
El estudio incluyó 3324 pacientes que acudieron al servicio de urgencias con sospecha de embolia pulmonar. Si tenían propabilidad de embolia pulmonar baja-intermedia (según la escala de Ginebra simplificada) o no probable (según escala de Wells), se medían las concentraciones de dímero D usando el punto de corte ajustado por edad en mayores de 50 años. A los pacientes con dímero D mayor al punto de corte ajustado se les realizó angio-TC, mientras que los pacientes con dímero D < 500 mg/L o en zona gris (dímero D entre 500 mg/L y el punto de corte ajustado por edad) no se trataron y se observaron.61
La tasa de falla fue de 1 por cada 810 pacientes (0.1%; IC95% 0%-0.7%) para concentraciones de dímero D < 500 mg/L y de 1 por cada 331 pacientes (0.3%; IC95% 0.1-1.7%) para concentraciones de dímero D en zona gris, comparadas con una tasa de falla de la angiotomografía de 0.5%.
Los más beneficiados con la aplicación del nuevo punto de corte fueron los mayores de 75 años, en quienes se documentó incremento de 6.4 a 29.7% de casos en que se obvió la angio-TC y la anticoagulación, es decir, se descartó correctamente un caso embolia pulmonar por cada 3.4 pacientes de este grupo, sin poner en riesgo su seguridad (Cuadro 4).61
Cuadro 4 Resultados del estudio de manejo ADJUST-PE
| Técnica usada | Total | |||||||
|---|---|---|---|---|---|---|---|---|
| VIDAS | Innovance | STA-Llatest | HS-500 | Tina-quant 2ª generación | Cobas h 232 | |||
| Probabilidad preprueba baja o intermedia | 1345 | 838 | 389 | 185 | 128 | 13 | 2898 | |
| Dímero D < 500 µg/L | 423 | 202 | 132 | 32 | 26 | 2 | 817 | |
| Riesgo de TEP/TVP a 3 meses | Núm. de eventos/total pacientes | 0/417 | 1/202 | 0/132 | 0/31 | 0/26 | 0/2 | 1/8 |
| % (IC 95%) | 0 (0-0.9) | 0.5 (0.1-2.8) | 0 (0-2.8) | 0 (0-11) | 0 (0-12.9) | 0 (0-65.8) | 0.1 (0-0.7) | |
| Dímero D en zona gris | 130 | 103 | 49 | 23 | 32 | 0 | 337 | |
| Riesgo de TEP/TVP a 3 meses | Núm. de eventos/total pacientes | 0/127 | 1/103 | 0/47 | 0/23 | 0/31 | - | 1/331 |
| % (IC 95%) | 0 (0-2.9) | 1 (0.2-5.3) | 0 (0-7.6) | 0 (0-14.3) | 0 (0-11) | - | 0.3 (0.1-1.7) | |
TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
Las limitaciones del estudio incluyen: prevalencia de embolia pulmonar superior a la de estudios previos en Estados Unidos, el uso de dos reglas de predicción diferentes para la determinación de probabilidad clínica de embolia pulmonar y el uso de seis técnicas de laboratorio distintas para la medición del dímero D (Cuadro 4), aunque todas fueron de alta sensibilidad y han demostrado ser equivalentes.61
Estudios adicionales
Tras la publicación del estudio ASDJUST-PE, 15 estudios reportaron el uso del dímero D ajustado por edad con diversas técnicas y poblaciones, concluyendo su beneficio en cuanto a la reducción de la realización de estudios escanográficos adicionales, sin incremento en la tasa de falsos negativos (Cuadro 5).62-74 Asimismo, un metanálisis reciente de seis estudios con 7268 pacientes con sospecha de embolia pulmonar demostró que el uso de la escala Wells simplificada junto con el dímero D ajustado por edad muestra desempeño similar al reportado con la escala original, por lo que puede usarse en la práctica clínica.75
Cuadro 5 Nuevos estudios que han evaluado la utilidad clínica del dímero D ajustado por edad en el diagnóstico de embolia pulmonar
| Autor (año) | Tipo de estudio/país | Número de pacientes | Edad promedio (años) | Prevalencia de embolia pulmonar (%) | Prueba de dímero D | Resultados |
|---|---|---|---|---|---|---|
| Polo Friz y col. (2014) | Cohorte retrospectiva/Italia | 481 | 73 ± 16 | 22.5 | Innovance D-Dimer (Siemens Marburg Alemania) | En pacientes mayores de 80 años el dímero D ajustado por edad y un punto de corte de 1000 µg aumentaron la especificidad de la prueba manteniendo el valor predictivo de 100% |
| Mullier y col. (2014) | Cohorte retrospectiva/ Bélgica | 473 | 61 ± 18 | 4.9 | STA-Liatest DD (Diagnostica Stago Asnieres sur seine, Francia) AxSYM D-Dimer (Aboot Wieswaden Alemania) Vidas D-Dimer (BioMerieux) Innovance D-Dimer (Siemens Marburg, Alemania) y Hemosuil D-Dimer HS (Instrumentation Laboratory, Bedford Masasachusetts Estados Unidos) | Cuando se usó un punto de corte de 500 µg/mL las pruebas fueron diferentes en su capacidad para excluir embolismo venoso. El uso de un punto de corte ajustado por edad redujo esas diferencias y fue más costo-efectivo |
| Wooller y col. (2014) | Cohorte retrospectiva/Estados Unidos | 923 | 67 ± 12 | NA | STA Liatest D-dimer (Diagnostica Stago Parsippany, NJ, Estados Unidos) | Se realizó angio-TAC en todos los pacientes y el desenlace fue embolia pulmonar a 90 días. En los pacientes con puntuación de Ginebra ≤ 10 y dímero D convencional negativo la tasa de falsos negativos fue de 0% (IC95% 0-2.8%) y con dímero D ajustado por edad fue de 1.5% (IC95% 0.4-3.7%); se documentó reducción de 18.3% (IC95% 16-21%) en la proporción de pacientes que requerirían angio-TAC |
| Gupta y col. (2014) | Cohorte retrospectiva/Estados Unidos | 3063 | 53 | 9.3% | STA Liatest D-dimer (Diagnostica Stago Parsippany, NJ, Estados Unidos) | Se compararon dos estrategias de dímero D ajustado por edad, la fórmula validada y la misma pero usando cortes por décadas (600 ng/mL de corte para 61 a 70 años; 700 ng/mL para 71 años, etc.) con el punto tradicional, sin afectar significativamente la sensibilidad. Con la fórmula validada y la de punto de corte por décadas se habría evitado la realización de angio-TAC en 18.2 y 19.6% de los pacientes mayores de 50 años, respectivamente |
| Sharp y col. (2015) | Cohorte retrospectiva/Estados Unidos | 31094 | 65 ± 10 | 0.6 | ND | El dímero D ajustado por edad fue más específico (64 vs 54%), pero menos sensible (93 vs 98%) que el punto de corte tradicional y resultó en cerca de 20% menos falsos positivos que requeriría imágenes. En esta cohorte su uso perdería o retrasaría el diagnóstico de 26 casos de embolia pulmonar (ninguno fatal), pero evitaría 322 casos de nefropatía inducida por contraste, 29 casos de insuficiencia renal severa y 19 muertes relacionadas con nefropatía por contraste |
| Flores y col. (2015) | Análisis post hoc de cohorte | 362 | 60 ± 19 | 27 | VIDAS (bioMérieux Marcy l’Etoile, Francia) | Para el dímero ajustado por edad y el dímero D con el punto de corte tradicional la sensibilidad fue de 100%; la utilidad clínica (tasa de verdaderos negativos) fue mayor con el primero (37 vs 28%, respectivamente). La tasa de falsos negativos con el dímero D ajustado por edad fue de 0% (IC95% 0-1.1%) |
| Altman y col. (2015) | Cohorte retrospectiva/Alemania | 530 | 64 ± 16 | 26 | STA LIATEST D-Di (Roche Diagnostics Gmbh, Manheim, Alemania) | El uso de un dímero D ajustado por edad mostró una prueba negativa en 17 de 530 pacientes adicionales (3.2%). La proporción fue de 4.1% en mayores de 50 años. Ninguno de éstos fue diagnosticado con embolia pulmonar en angio-TAC, siendo la tasa de falsos negativos de 0%. El efecto se observó en pacientes ambulatorios (3.7%) y en hospitalizados (2.0%); p > 0.05 |
| Han y col. (2015) | Cohorte prospectiva/China | 594 | 57 | 32.8 (EV) | STA Liatest D-dimer (diagnostica Stago, Parsippany, NJ, Estados Unidos) | El aumento absoluto en la proporción de pacientes con un dímero D por debajo del valor de corte ajustado por edad en comparación con corte convencional fue de 5.9% (IC95% 3.8- 8.7%) sin casos de falsos negativos adicionales |
No obstante esta evidencia, dos trabajos recientes cuestionaron la utilidad del dímero D ajustado por edad en la exclusión de embolia pulmonar;76,77 el primero fue un análisis retrospectivo de los datos de dos estudios diagnósticos con 1649 pacientes, que no encontró diferencia en relación con el uso del dímero D sin ajustar, pero sin reporte de falsos negativos.76 El otro fue un reporte de caso en un paciente de 75 años de edad con sospecha de embolia pulmonar con Wells de baja probabilidad y con resultado de dímero D de 600, en quien posteriormente se documentó la enfermedad,77 probablemente relacionado con la tasa de falsos negativos reportada para el dímero D ajustado por edad de 0.3% (IC95% 0.1-1.7%), similar a la observada con el dímero D sin ajustar.
Asimismo, un reporte de opinión reciente señala la necesidad de conocer el tipo de unidades del dímero D, equivalentes de fibrinógeno o unidades de dímero D para la recomendación de su uso ajustado por edad, teniendo en cuenta que los resultados podrían variar, por lo que al usarlo en la práctica clínica sólo deberían usarse las pruebas evaluadas en los estudios clínicos con las recomendaciones de las guías del Instituto de Estándares de Laboratorio Clínico (CLSI) de Estados Unidos.78
PERC y dímero D ajustado por edad en las guías de práctica clínica de embolia pulmonar
El uso del dímero D ajustado por edad se recomienda en las dos guías más recientes de embolia pulmonar79,80 y en un documento de la utilidad del dímero D del Grupo de Estudio de Biomarcadores de la Asociación de Cuidado Cardiovascular Agudo (ACA, del inglés Acute Cardiovascular Care Association).81
La guía de la Sociedad Europea de Cardiología, publicada a finales de 2014, incluye como novedad la recomendación de considerar el uso del dímero D ajustado por edad de acuerdo con la fórmula propuesta [edad (años) x 10 µg/L] en pacientes mayores de 50 años en lugar del clásico punto de corte de 500 µg/L. 79
Asimismo, el Comité de Guías Clínicas del Colegio Americano de Médicos (ACP, del inglés American College of Physicians) en sus recomendaciones de buena práctica para la evaluación de pacientes con sospecha de embolia pulmonar, publicadas en septiembre de 2015, señala que el clínico debe usar el dímero D ajustado por edad en pacientes con probabilidad intermedia, así como en los pacientes con probabilidad baja y puntaje PERC positivo, como herramienta para evitar el sobreuso de imágenes diagnósticas.80 Este documento también recomienda en pacientes con baja probabilidad clínica de embolia pulmonar el uso de la escala PERC en lugar de usar el dímero D; en caso de encontrar las ocho preguntas negativas, el riesgo de padecer la enfermedad es igual o menor al reportado por dímero D negativo, por lo que podría descartarse la enfermedad (Figura 1).80
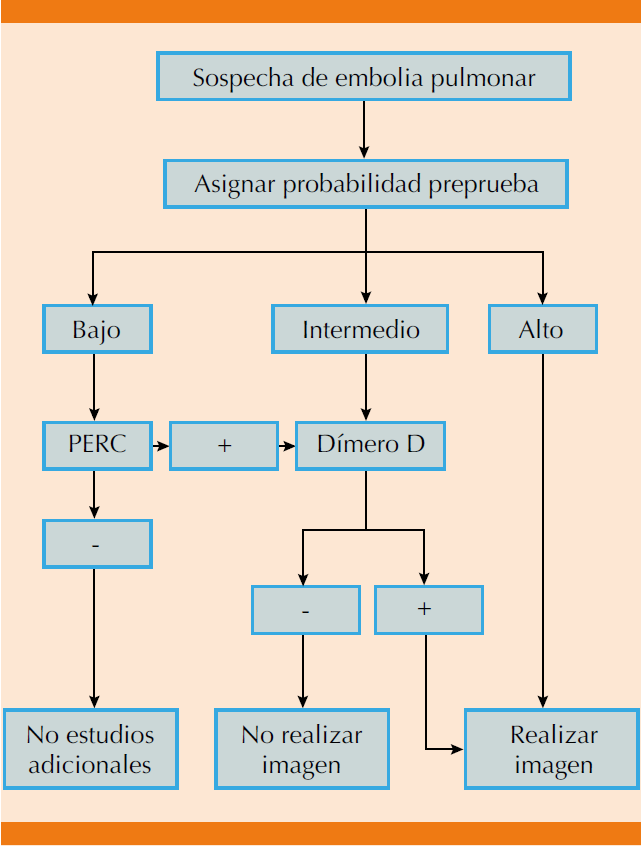
Figura 1 Algoritmo propuesto por el Colegio Americano de Médicos en caso de sospecha diagnóstica de embolia pulmonar.
Por último, en el documento de revisión de la ACCA se destaca como concepto clínico crítico que el dímero D ajustado por edad en mayores de 50 años mejora su capacidad diagnóstica, por lo que debería usarse.81
CONCLUSIONES
El uso de la escala PERC y el dímero D ajustado por edad son dos nuevas estrategias recomendadas en el abordaje diagnóstico del paciente con sospecha de embolia pulmonar. El uso de la escala PERC está indicado en pacientes con probabilidad clínica baja y al obtener puntaje de 0 permitiría descartar la enfermedad sin estudios adicionales. Asimismo, el ajuste del dímero D por edad se recomienda en sujetos mayores de 50 años con probabilidad clínica intermedia o en casos de probabilidad baja y PERC positivo.
La evidencia acerca de la utilidad de estas estrategias proviene de estudios prospectivos, metanálisis de buena calidad y, en el caso del dímero D ajustado, de un estudio de manejo, y ha sido incorporada por las guías más recientes de embolia pulmonar; en el caso de la escala PERC, en la actualidad se lleva a cabo un estudio aleatorio de validación.45,46
En nuestro medio, sería deseable la evaluación en la práctica diaria de la utilidad de la escala PERC y el dímero D ajustado por edad, así como de sus beneficios económicos.











 nueva página del texto (beta)
nueva página del texto (beta)


