ANTECEDENTES
El síndrome de supresión etílica se define como los signos y síntomas posteriores a la suspensión de la ingesta alcohólica que clásicamente se manifiestan en las primeras 48 horas en los individuos alcohol-dependientes, en distintos grados con una constelación amplia de datos clínicos neuropsiquiátricos.1 Las formas leves no necesariamente requieren tratamiento sintomático, las formas graves (como el delirium tremens) requieren soporte multiorgánico y vigilancia en la unidad de cuidados intensivos. El Cuadro 1 engloba los conceptos que definen el síndrome de supresión etílica según los lineamientos del DSM-5.2
El diagnóstico del delirium tremens se establece si el paciente cumple criterios de delirio y de síndrome de supresión etílica, según el DSM-5.1 Los criterios de delirium tremens se resumen en el Cuadro 2.
Cuadro 2 Criterios de diagnóstico de delirium tremens según el DSM-5
La historia clínica detallada orienta al clínico a pensar en ese estado confirmando el diagnóstico (Figura 1), de manera ordenada, clasificando la gravedad del cuadro, seleccionando un adecuado régimen de tratamiento, vigilando las comorbilidades subyacentes a la dependencia del alcohol (encefalopatía de Wernicke, caídas, traumatismo craneoencefálico, trastornos del estado de ánimo) y las alteraciones sistémicas concomitantes (desequilibrio hidroelectrolítico, desnutrición, disfunción renal, hepática, cardiaca [miocardiopatía dilatada enólica] y neuromuscular [neuropatía, miopatía por consumo de alcohol]) frecuentemente encontradas en estos pacientes.3
Epidemiología
El abuso del alcohol en las sociedades occidentales se aproxima a 20%, se estima que alguna vez en su vida 20% de los hombres y 10% de mujeres tendrán esta condición clínica, definida como problemas de repetición por abuso del alcohol en 2 de 11 áreas de la vida; 50% tiene alguna vez un episodio de síndrome de supresión etílica; el riesgo se incrementa linealmente con la cantidad y la frecuencia de la ingesta, es más común encontrarlo en casos de consumo de más de 8 copas al día por múltiples días continuos. El 40% de los pacientes con accidentes de tráfico que ingresan en una sala de urgencias tiene ingesta de alcohol o dependencia crónica del mismo. Sin embargo, las series internacionales señalan baja prevalencia del síndrome de supresión etílica, por ejemplo, en Estados Unidos se ha establecido un intervalo de 5 a 20%, aproximadamente 8 millones de personas con dependencia crónica según el reporte de 2013 de National Survey on Drug Use and Health. 4 En el Reino Unido se encuentran reportes menores a 5%, los costos hospitalarios anuales se aproximan a 1.5 mil millones de euros, con hospitalización promedio de 26 días.2,4 En México el alcohol es la sustancia psicoactiva más consumida.5 De acuerdo con la Secretaría de Salud 77% de la población mayor de 18 años consume alcohol y 6 millones de ellos son dependientes. Es causa de muerte de 4000 personas al año, lo que coloca a nuestro país entre los primeros con mayor mortalidad por alcoholismo en el mundo, es un verdadero problema creciente de salud pública que consume gran parte de los insumos hospitalarios debido a que se trata de pacientes de difícil manejo.6
Fisiopatología breve
La tolerancia al alcohol ocurre cuando su ingestión crónica induce cambios adaptativos que incrementan el consumo de la sustancia para producir el mismo efecto. Es dependiente de la dosis, duración y frecuencia de consumo, es el resultado de la adaptación farmacocinética (metabólico) o farmacodinámica (celular o funcional).7
El mecanismo de intoxicación por el alcohol y del síndrome de supresión etílica es complejo. Los efectos clínicos pueden explicarse por la interacción del etanol con varios neurotransmisores y receptores en diversas zonas del cerebro, incluyendo los receptores GABA, glutamato (NMDA) y opioides. Los cambios que resultan de la neurotransmisión inhibitoria y excitatoria producen el desequilibrio de la neurotransmisión central que causa los síntomas del síndrome de supresión etílica. La ingestión crónica inhibe los receptores glutamatérgicos NMDA y tiene un efecto agonístico GABAérgico en el receptor tipo A (canal de Cl-) postsináptico, provocando la regulación a la baja de los primeros y la sobreexpresión de los segundos, lo que incrementa la tolerancia. Debido a la supresión crónica de la transmisión excitatoria, el cerebro incrementa la producción de otros neurotransmisores excitatorios, principalmente en los núcleos noradrenérgicos, serotoninérgicos y dopaminérgicos, que explican muchos de los síntomas del síndrome de supresión etílica.8,9
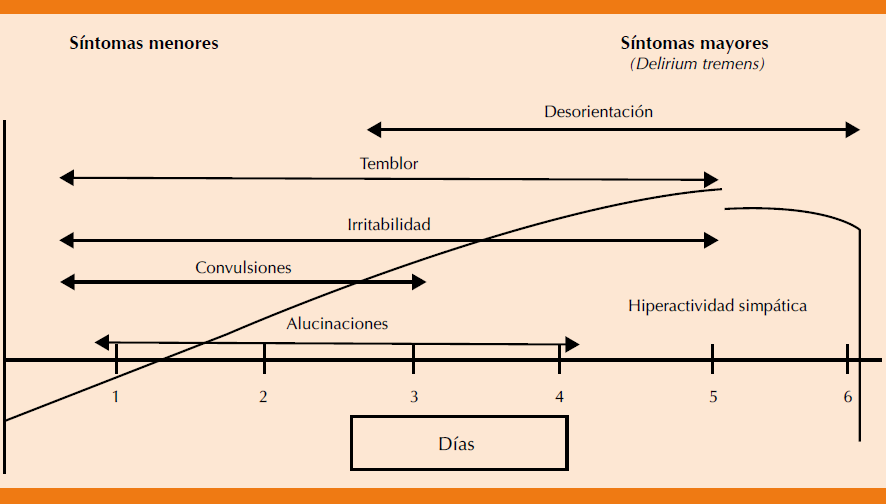
Los síntomas clínicos del alcohol pueden clasificarse como tempranos (24-48 horas), tardíos (más de 48 horas) o menores y mayores, la bibliografía refiere inicios más tempranos incluso en las primeras 8 horas después de la suspensión, el zenit de los síntomas ocurre a las 72 horas y el nadir en el día 5-7 de abstinencia.10,11 El nivel de hiperactividad autonómica y la existencia de delirio son los principales determinantes de la progresión in crescendo a los síntomas mayores (Figura 2). Las tres “T” (temperatura, temblor, taquicardia) del delirium tremens quizá sean los signos tempranos del síndrome de supresión etílica, a pesar de que el delirium tremens necesita las alteraciones cognitivas para establecer su diagnóstico. El insomnio, la inquietud, la agitación, la náusea, el vómito, las mialgias, el temblor, la hipertensión sistólica y la taquicardia pueden progresar a la desorientación y al deterioro cognitivo agudo. Si ocurren crisis convulsivas tónico-clónicas generalizadas, suceden en etapas tempranas del síndrome de supresión etílica y se consideran en la clasificación de epilepsia como crisis sintomáticas, remitiendo al terminar el cuadro agudo. La “alucinosis” puede ocurrir de manera temprana, especialmente en pacientes que han consumido alcohol de manera prolongada. Pueden tratarse de alucinaciones auditivas, aunque en algunos casos sobrevienen alteraciones múltiples de la percepción, el hecho de ser únicamente auditivas distingue los casos de los asociados con el delirium tremens.12,13
El tiempo en el curso del síndrome de supresión etílica y la severidad de los síntomas deben ser estrechamente vigilados para identificar los tratamientos más efectivos. En la práctica diaria esto puede hacerse con instrumentos de medición como el Clinical Institute Withdrawal Assessment of Alcohol Scale, revised (CIWA-Ar por sus siglas en inglés), que se muestra en el Cuadro 3. Los puntajes del CIWA-Ar establecen un intervalo de puntos de 0-67, puntajes menores de 8 indican un síndrome de supresión etílica leve que no requiere tratamiento sintomático, de 8-15 puntos se trata de pacientes con respuesta moderada al tratamiento con benzodiacepinas y los mayores de 15 tienen cuadros severos y probablemente cuadro de delirium tremens.14,15
Cuadro 3 Escala Clinical Institute Withdrawal Assessment of Alcohol Scale, revised (CIWA-Ar)
| Náusea y vómito. Preguntar: | Ansiedad. Preguntar si se siente nervioso. Observación |
| ¿Se siente mal del estómago? | 0 Tranquilo |
| ¿Ha vomitado? | 1 Ligeramente ansioso |
| 0 Sin náusea ni vómito | 4 Moderadamente ansioso |
| 2 Náusea ligera sin vómito | 7 Se mueve sin cesar |
| 4 Náusea intermitente a horcajadas | Trastornos visuales. Preguntar: ¿está viendo algo que le inquieta? |
| Temblor: observación | 0 No hay |
| 0 Sin temblor | 1 Sensibilidad leve |
| 1 Temblor no visible pero puede sentirse al tacto | 3 Sensibilidad moderada |
| 4 Temblor visible con las manos extendidas | 5 Alucinaciones graves |
| 7 Temblor severo incluso con las manos en reposo | 6 Alucinaciones continuas |
| Sudoración paroxística. Observación | Trastornos nociceptivos. Preguntar: ¿siente algo en la piel? |
| 0 Sin sudor | 0 No |
| 1 Sudor en las palmas | 1 Prurito, parestesias, adormecimiento |
| 4 Sudor visible en la frente | 2 Síntomas previos leves |
| 7 Sudoración profusa generalizada | 3 Síntomas anteriores moderados |
| Agitación. Observación | 5 Alucinaciones graves |
| 0 Actividad normal | 7 Alucinaciones continuas |
| 1 Actividad mayor a la normal | Trastornos auditivos. Preguntar: ¿está escuchando algo? |
| 3 Moderadamente inquieto | 0 No |
| Cefalea. No considerar mareo | 1 Intensidad para asustarse leve |
| 0 No hay | 3 Intensidad para asustarse moderada |
| 1 Muy leve | 5 Alucinaciones auditivas graves |
| 2 Moderada | 7 Alucinaciones auditivas continuas |
| 3 Moderadamente grave | Orientación y sensorio. Preguntar tiempo, lugar y espacio. |
| 4 Grave | 0 Orientado |
| 5 Muy grave | 1 No puede añadir datos en serie |
| 6 Extremadamente grave | 2 Desorientado para la fecha en menos de dos días |
| 3 Desorientado para la fecha en más de dos días | |
| 4 Desorientado en tiempo, lugar y persona |
Puntaje total de CIWA: __________
Los criterios de síndrome de supresión etílica y delirium juntos integran el cuadro de delirium tremens con base en los criterios de los Cuadros 1 y2. La verdadera prevalencia de este cuadro aún es controvertida, se estima que sólo 3 a 5% de los pacientes con síndrome de supresión etílica lo padecen. El cuadro comienza, en general, en el tercer día posterior a los síntomas menores del síndrome de supresión etílica con duración de incluso 8 días (promedio 2-3 días), tiene mortalidad de 4% durante la hospitalización, cuyas causas pueden ser la hipertermia, arritmias cardiacas letales, complicaciones de las crisis convulsivas y trastornos sistémicos agregados. Los factores más importantes en el pronóstico del delirium tremens son:15 puntajes de CIWA-Ar > 15, presión sistólica > 150 mmHg, frecuencia cardiaca > 100 lpm, crisis convulsivas generalizadas durante el episodio de delirium tremens (hasta 20% de los pacientes), edad avanzada y suspensión reciente de otros depresores del sistema nervioso central.
Los predictores tardíos del delirium tremens son las anormalidades hidroelectrolíticas (hipocalemia, hipomagnesemia), la trombocitopenia y enfermedades respiratorias, cardiovasculares y gastrointestinales concomitantes.15-17 En 2014 Maldonado y su grupo18 realizaron un estudio piloto prueba para la evaluación de una nueva escala denominada Prediction of Alcohol Withdrawal Severity Scale (PAWSS por sus siglas en inglés) para la predicción en la aparición de delirium tremens, además de clasificar a los pacientes que se benefician del tratamiento farmacológico, con 100% de sensibilidad, especificidad, valor predictivo negativo y positivo. Al momento los resultados de esa escala no se han valorado en otras series, por lo que la aparición del delirium tremens es impredecible.
Los diagnósticos diferenciales del síndrome de supresión etílica deben valorarse de acuerdo con el contexto clínico individualizado, las comorbilidades subyacentes y las principales causas de deterioro del estado de alerta dentro del contexto hospitalario. El Cuadro 4 incluye al menos 10 diagnósticos posibles neurológicos primarios, secundarios y sistémicos de acuerdo con las series internacionales revisadas que es obligado buscar y reclasificar en el diagnóstico del paciente con síndrome de supresión etílica.19
Cuadro 4 Diagnósticos diferenciales durante el protocolo del síndrome de supresión etílica
| Diagnóstico diferencial | Comentario |
|---|---|
| Hiponatremia | Debido a la escasa ingesta oral, deshidratación y uremia, se manifiesta como delirio hipoactivo |
| Encefalopatía | Ictericia, hematemesis, melena, asterixis, ascitis, inversión del ciclo circadiano |
| Neumonía | Fiebre, tos, hipoxemia, delirio antes de la supresión etílica |
| Encefalitis/meningitis | Fiebre, síndrome meníngeo y datos focales, resonancia magnética nuclear o tomografía computada anormales |
| Traumatismo craneal | Pérdida del estado de alerta, sangrado ótico o nasal, pupilas puntiformes, déficit neurológico focal |
| Tirotoxicosis | Antecedente de enfermedad tiroidea. Tiromegalia, exoftalmos, lago-oftalmos |
| Intoxicación por litio | Antecedente de enfermedad psiquiátrica, abuso de drogas, diarrea, fiebre, administración de AINEs o diuréticos |
| Atropina/intoxicación por tricíclicos | Fiebre, piel seca y caliente, pupilas dilatadas. Alteraciones del electrocardiograma (QT alargado) |
| Psicosis | Alucinaciones de larga duración. Alteraciones del sensorio |
| Intoxicación por antidepresivos | Administración de inhibidores de la recaptura de serotonina (ISRS), diarrea, mioclonos, alteraciones del sensorio |
| Encefalopatía subaguda + convulsiones relacionadas con el síndrome de supresión etílica | Días posteriores a la suspensión del alcohol; crisis focales con o sin deterioro del estado de alerta con parálisis de Todd concomitante; puede haber estado epiléptico no convulsivo o sólo hallazgos en el electroencefalograma (EEG). En el EEG con ondas lentas focales, patrón de descargas laterales, resonancia magnética con hiperintensidades reversibles en modo T2-FLAIR |
Tratamiento
La piedra angular del tratamiento es reducir la severidad de los síntomas y la prevención de la progresión del síndrome de supresión etílica al delirium tremens. Los fármacos sedantes-hipnóticos se recomiendan como primera línea de tratamiento y terapias coadyuvantes de soporte. El mejor tratamiento para la prevención del delirium tremens es la identificación y tratamiento de las comorbilidades per se crónicas subyacentes del paciente. Los puntos de relevancia en el tratamiento incluyen:15 control de la agitación, reducción y control de las crisis convulsivas, disminución de contusiones y riesgo de muerte, manejo y soporte sistémico, en casos posibles detoxificación y rehabilitación a largo plazo.
El protocolo de manejo en el delirium tremens incluye un examen físico detallado y los exámenes bioquímicos necesarios para identificar y tratar problemas que pueden contribuir a la progresión del síndrome de supresión etílica o al empeoramiento del delirium tremens. El manejo multisistémico es igual al de otro tipo de pacientes e incluye monitoreo cardiaco, medición de marcadores bioquímicos básicos, adecuada hidratación, corrección de la lesión renal aguda, control de focos infecciosos agregados, con nutrición oral-enteral, una línea central venosa periférica debe tenerse siempre disponible, las centrales deben reservarse para los casos graves, que ameriten un manejo avanzado multiorgánico, siempre tomando en cuenta que las crisis de hipoglucemia pueden precipitar una crisis aguda de encefalopatía de Wernicke o la cardiomiopatía dilatada símil al beriberi secundaria a la deficiencia de tiamina en pacientes con factores de riesgo de cardiopatía enólica. A pesar de que la tiamina (un esquema común son 500 mg IV en 30 minutos durante tres días) y los multivitamínicos están indicados por vía oral, no hay evidencia de que la reposición de magnesio prevenga la aparición de la encefalopatía de Wernicke. En caso de manifestarse el cuadro se recomiendan dosis altas de tiamina (500 mg/día vía durante cinco días). Los cuidados integrales de soporte deben ser idealmente en una habitación con adecuada entrada de luz, bien iluminada, ayudándole al enfermo a reorientarse en tiempo, lugar y espacio, con objetos de uso personal que le hagan sentir un entorno familiar.20
La piedra angular en el tratamiento del delirium tremens son las benzodiacepinas. Ninguno de los fármacos depresores del sistema nervioso central en monoterapia ha demostrado ser mejor que otro. En el Cuadro 5 se resumen los regímenes más comunes de la administración de benzodiacepinas, primordialmente diazepam y lorazepam. Las dosis pueden variar en cada situación individual, se han descrito requerimientos incluso tan altos de 2000 mg/día de diazepam; en la administración de dosis plenas de benzodiacepinas es preferente la vigilancia estrecha en la unidad de cuidados intensivos, que confiere mejor vigilancia neurológica y tratamiento de los efectos adversos de estos fármacos.20,21
Cuadro 5 Tratamiento sugerido del delirium tremens
Modificado de la referencia 14.
La mayor parte de las series en la bibliografía prefieren al diazepam sobre otras benzodiacepinas por la seguridad en su administración y la eficacia en el tratamiento del síndrome de supresión etílica, incluso sobre otros fármacos descritos, como carbamazepina, gabapentina, topiramato, quetiapina y baclofeno.22,23 Los puntos que respaldan su administración son:
El diazepam IV tiene inicio de acción y meseta de efecto sedante menores que el lorazepam, lo que sugiere que este agente debería ser el preferido para la remisión rápida de los síntomas menores del síndrome de supresión etílica.
Cuando se llega al control del síndrome de supresión etílica, la excesiva sedación secundaria a la administración de las benzodiacepinas es menor con diazepam IV por la meseta más breve que el lorazepam, lo que permite el asesoramiento continuo para la titulación en bolos pequeños evitando los efectos adversos observados con el lorazepam.
La sedación prolongada se evita cuando el diazepam se administra en el tratamiento del síndrome de supresión etílica, cuando se trata de pacientes añosos con enfermedad hepática, si la dosis se dosifica de acuerdo con los síntomas.
El fenómeno de rebote del síndrome de supresión etílica en los periodos interdosis es más frecuente con el lorazepam y oxazepam que con diazepam.
El diazepam oral tiene un efecto de acción más corto que el clorodiazepóxido, lorazepam u oxazepam, lo que agiliza el tratamiento del síndrome de supresión etílica y evita la infra-sobredosificación del fármaco.
Una revisión de Cochrane de 201724 de la administración de baclofeno en pacientes con delirium tremens en la que se incluyeron 141 participantes en un estudio con distribución al azar controlado comparado contra placebo no encontró diferencia estadísticamente significativa entre ambos respecto a las puntuaciones de CIWA-Ar. La comparación de baclofeno vs clorodiazepóxido tampoco demostró diferencias significativas en el CIWA-Ar en un estudio de 60 pacientes con baja calidad de evidencia, por lo que no se recomienda como tratamiento en estos pacientes.
Si bien históricamente las benzodiacepinas han sido el tratamiento estándar por el control del síndrome de supresión etílica en 3-5 días con dosis horarias, los estudios recientes demostraron que este régimen rígido no permite individualizar la cantidad del fármaco para el control sintomático, por lo que esquemas flexibles dependientes de síntomas han demostrado menor tiempo de tratamiento y disminución del puntaje del CIWA-Ar de pacientes tratados en hospitalización. Sin embargo, este régimen síntomas-dependiente puede ser inapropiado en pacientes con síndrome de supresión etílica o delirium tremens resistente al incrementar la dosis de benzodiacepinas y propiciar efectos adversos severos del fármaco.19,20,25
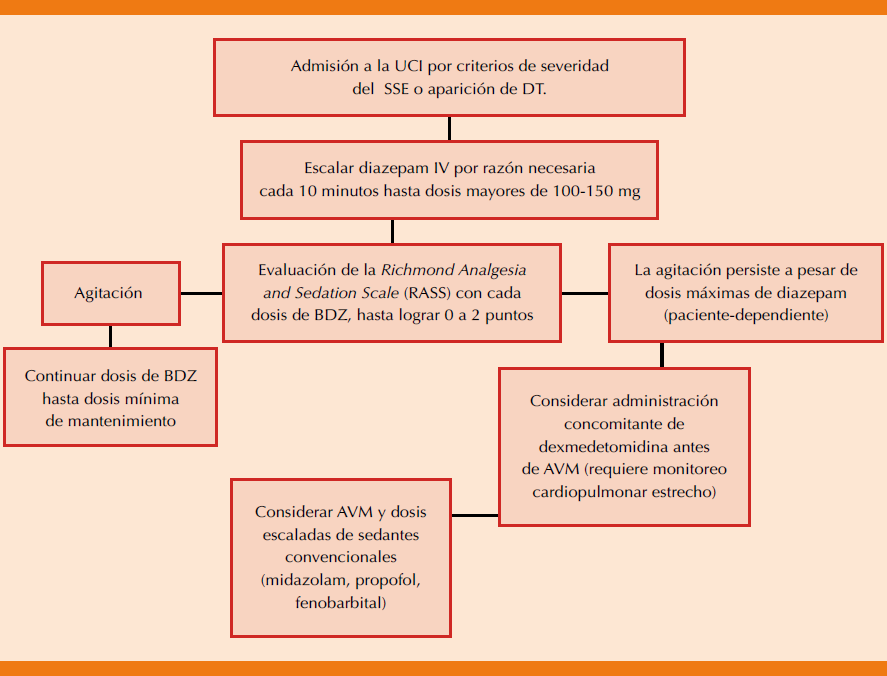
En el tratamiento de los pacientes con delirium tremens resistente (estado epiléptico, estado epiléptico resistente secundario, complicaciones sistémicas secundarias) o resistente a las benzodiacepinas (más de 200 mg de diazepam en las primeras tres a cuatro horas de tratamiento sin cumplir las metas de sedación adecuada), la terapia coadyuvante con polifarmacia ha demostrado mayor evidencia en el control de los síntomas al escalar fármacos no benzodiacepinas.
En estudios controlados con distribución al azar con adecuado nivel de evidencia, la administración de dexmedetomidina, propofol, fenobarbital y midazolam para la sedación en el apoyo ventilatorio mecánico (AVM) no produjo incremento en la mortalidad y la morbilidad de estos pacientes ni tampoco en las complicaciones relacionadas con el AVM.24,25 Un metanálisis de Brotherton realizado en 201626 de la administración de propofol en el síndrome de supresión etílica y el delirium tremens como fármaco en el mantenimiento de la sedación de forma coadyuvante no demostró diferencias significativas en el estado de AVM respecto a otros agentes sedantes de primera línea, con mayor tasa de hipotensión que el resto de fármacos evaluados. Los resultados fueron heterogéneos, no concluyentes en la administración coadyuvante a las benzodiacepinas, por lo que se reservó como tratamiento de tercera línea en los casos de delirium tremens resistente con estado epiléptico o estado epiléptico resistente de acuerdo con el tratamiento patrón de referencia de las guías de la Liga Internacional contra la Epilepsia 2016,27 obteniendo resultados similares a otros pacientes con causas distintas del síndrome de supresión etílica. Un metanálisis reciente de Mo y su grupo28 encontró respuesta adecuada al fenobarbital en casos de delirium tremens resistente con estado epiléptico o estado epiléptico resistente en caso de falla a la sedación de primera línea, aunque sin cambios en los tiempos de estancia en la unidad de cuidados intensivos o la morbilidad y mortalidad.
En 2007 Gold y colaboradores29 publicaron los resultados de su estudio retrospectivo de 95 pacientes que cumplían criterios de delirium tremens resistente donde se comparó el tratamiento estándar en la unidad de cuidados intensivos versus el tratamiento escalonado, en el que se observó menos apoyo ventilatorio mecánico (AVM: 21.9 vs 47.3%, p = 0.008), aunque no hubo diferencias en el desenlace global, los días de hospitalización ni en las complicaciones infecciosas. La limitación del estudio fue la pobreza del diseño en el estudio prospectivo.
Uno de los agentes con potenciales indicaciones terapéuticas más estudiados es la dexmedetomidina [DEX], agonista del receptor α2-adrenérgico central, cuyos efectos simpaticolítico y ahorrador de benzodiacepinas se suma a los esquemas de polifarmacia en pacientes sin AVM fuera de metas de sedación y en conjunto con otros agentes no benzodiacepinas durante el estado de AVM.25,30
Stewart y su grupo31 describieron una serie de 20 pacientes sin apoyo ventilatorio mecánico (AVM) con agitación severa con la administración de DEX al ingreso y a las 24 horas, encontraron disminución de 2 puntos en el CIWA-Ar, de la frecuencia cardiaca (ingreso 102.8 vs 79.3 a las 24 horas) y del promedio de presión arterial sistólica (142 vs 126 mmHg) con una dosis media de 0.53 mg/kg/h y duración total de 49.1 horas, sólo un paciente requirió AVM. La limitación del estudio a pesar del diseño adecuado fue la administración de DEX guiada a criterio del clínico, los efectos adversos esperados (hipotensión, bradicardia, deterioro del patrón respiratorio) fueron mínimos en las series de pacientes sin AVM, sin incremento de las complicaciones ni el manejo de la vía aérea mediante AVM versus otros fármacos no benzodiacepinas. En comparación con otros grupos farmacológicos, DEX disminuye rápidamente la hiperactividad autonómica mientras se evita la depresión respiratoria. De manera ortodoxa no tiene indicación de primera línea en los lineamientos internacionales de manejo, pero en experiencia personal de los autores se ha disminuido la tasa de complicaciones sistémicas con la administración de este fármaco y la estancia en la unidad de cuidados intensivos y en hospitalización de Medicina Interna. El algoritmo para el tratamiento del delirium tremens resistente utilizado por los autores (Figura 3) puede ayudar a la toma de decisiones en la unidad de cuidados intensivos donde a pesar de la administración de fármacos de primera elección no se yugulan los síntomas severos.
CONCLUSIONES
Debido al consumo frecuente de alcohol, el síndrome de supresión etílica representa un diagnóstico diferencial frecuente en el espectro de encefalopatías de origen metabólico en los hospitales de segundo nivel de atención en México. Las definiciones del padecimiento pueden generar confusión con otros trastornos neuropsiquiátricos, por la redundancia y subjetividad interobservador; sin embargo, una vez esclarecido el diagnóstico debe tratarse como una enfermedad sistémica que no se limita a las complicaciones neurológicas e incrementa la mortalidad en este grupo de pacientes. A pesar de que la evidencia soporta la administración de múltiples fármacos en su tratamiento, las benzodiacepinas permanecen como la piedra angular en su tratamiento y el inicial del delirium tremens. El protocolo escalonado de benzodiacepinas en combinación con otro agente no benzodiacepinas parece disminuir la estancia en la unidad de cuidados intensivos, a pesar de estar adecuadamente establecido el papel de la dexmedetomidina en el tratamiento, es preferible agregar dexmedetomidina de manera coadyuvante al tratamiento con benzodiacepinas en pacientes sin apoyo ventilatorio mecánico. En pacientes con delirium tremens y apoyo ventilatorio mecánico de primera elección debe administrarse fenobarbital, propofol o ambos de manera coadyuvante con las benzodiacepinas. El tratamiento del síndrome de supresión etílica siempre debe ser sistémico, cuyo tratamiento per se debe ser apoyado en la evidencia en manos del clínico experimentado.











 nueva página del texto (beta)
nueva página del texto (beta)