ANTECEDENTES
La microbiota gastrointestinal está compuesta por aproximadamente 1014 microorganismos vivos, diez veces el número de células eucariontes que forman parte del cuerpo humano. Esto ha dado lugar a que algunos investigadores usen el término “órgano microbiano” para referirse a ella, porque su tamaño sería similar al del hígado (1-1.5 kg de peso).1
Durante miles de años de coevolución, los microorganismos intestinales han logrado establecer relaciones benéficas con su huésped y actualmente se sabe que algunas funciones de la microbiota son fundamentales para mantener la homeostasia de diversos órganos y sistemas distales al intestino (Figura 1). Para ello, se requiere el equilibrio entre las diferentes especies de bacterias que habitan el lumen intestinal. La disbiosis es la ruptura de ese balance entre las especies de microorganismos que forman parte de la microbiota, que se asocia con enfermedades y se caracteriza por alteraciones en la diversidad y las proporciones en las especies de la microbiota.2
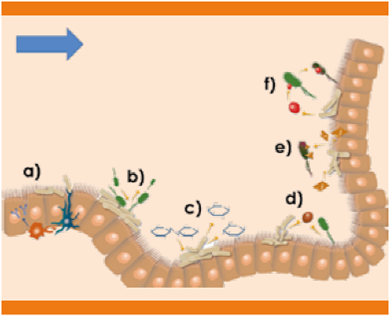
Figura 1 Funciones de la microbiota gastrointestinal. A.Estimulación y regulación del sistema inmunitario. B.Mantenimiento de las barreras físicas (antagonismo directo). C.Metabolismo de carbohidratos. D.Competencia de nutrientes. E.Producción de metabolitos. F.Producción de bacteriocinas.
Muchos factores pueden alterar la microbiota gastrointestinal, entre los que destacan el estrés físico y psicológico, la radiación, alteraciones en la peristalsis y cambios en la dieta. Sin embargo, la administración de antibióticos es, por mucho, la causa más común de disbiosis, ocasionando repercusiones en el huésped al favorecer la colonización por patógenos, lo que frecuentemente resulta en diarrea relacionada con la administración de antibióticos.1
Existe gran cantidad de información de los posibles efectos benéficos de diversas cepas de probióticos que son prescritos para modificar y restablecer la microbiota gastrointestinal. Su administración en un inicio se basa en investigaciones realizadas en animales o en ensayos in vitro (Figura 1). No obstante, en la actualidad existen algunos estudios clínicos en humanos que apoyan su utilidad como coadyuvantes del tratamiento médico de diversas enfermedades (Figura 2), que son motivo de esta revisión.
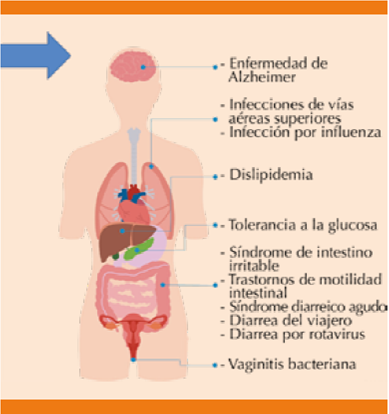
Figura 2 Enfermedades con potenciales implicaciones terapéuticas de la administración de probióticos.
Factores determinantes del establecimiento de la microbiota en el recién nacido
El estudio de los mecanismos del establecimiento de la microbiota intestinal es de gran relevancia debido a que pueden identificarse factores que alteran la diversidad de especies bacterianas presentes en el intestino desde el nacimiento. Entre ellos, la vía de nacimiento ha sido por mucho tiempo objeto de investigaciones debido a que se sabe que, durante el parto por vía vaginal, el neonato recibe gran cantidad de bacterias provenientes del aparato genital de la madre.
Al respecto, Grönlund y colaboradores estudiaron las diferencias en la diversidad de bacterias en la microbiota de neonatos nacidos por parto vaginal o por cesárea de madres que recibieron profilaxis microbiana; la microbiota fecal se registró durante seis meses y los signos gastrointestinales se registraron cada dos meses. Se observó mayor colonización por bifidobacterias en los lactantes nacidos por vía vaginal en comparación con los obtenidos por vía abdominal, aunque todos los infantes fueron colonizados por bacterias entéricas aerobias. Los rangos de colonización por bacterias tipo bifidobacteria y las bacterias del género Lactobacillus fueron menores en los nacidos por cesárea que en los nacidos por vía vaginal. La colonización por Clostridium perfringens fue significativamente mayor en el grupo nacido por cesárea que en los nacidos por vía vaginal al mes de edad. Los rangos de colonización por Bacteroides fragilis difirieron marcadamente entre los grupos de estudio. La colonización por bacteroides tuvo un intervalo de 52 a 79% en los niños nacidos por vía vaginal mientras que en los nacidos por vía abdominal los grados de colonización siguieron siendo significativamente menores en el grupo nacido por cesárea que en el grupo nacido por vía vaginal (36 vs 76%, p < 0.009) a los dos y seis meses de edad.3
Ese estudio mostró que la microbiota fecal de los lactantes nacidos por cesárea es muy diferente de la de los nacidos por vía vaginal, lo que podría tener repercusiones funcionales y riesgo de futuras enfermedades. No obstante, se ha demostrado que otras intervenciones médicas que modifican o repercuten en el curso normal de una gestación también tienen efecto directo en el establecimiento de la microbiota en el recién nacido, entre las que destaca la administración de antibióticos antes del parto. Además, gracias a la mayor proporción de mujeres gestantes con vida laboral activa, hoy día se ha incrementado el número de modificaciones en el cuidado del recién nacido que tienen influencia en la microbiota intestinal, de tal forma que se ha observado que prácticas como el consumo de fórmulas lácteas y el abandono de la lactancia materna conllevan al desequilibrio en la diversidad de bacterias en la microbiota.
Aunque no es motivo de esta revisión, lo anterior es de gran importancia porque existe suficiente evidencia para apoyar la idea de que el riesgo de enfermedades en el periodo inmediato y en el largo plazo después del nacimiento es influido de manera directa por la composición de la microbiota desde los primeros días de vida. Tal es el caso de la enterocolitis necrotizante, enfermedad inflamatoria intestinal, obesidad, desnutrición, asma y otras enfermedades atópicas, cuya incidencia parece estar relacionada con la disbiosis en el recién nacido.4
Prescripción de probióticos en la práctica clínica
Los probióticos son microorganismos vivos que actúan como poderosos biomoduladores con un efecto positivo en la salud humana. La definición oficial emitida por el comité de la FAO/WHO es: “microorganismos vivos que, cuando son administrados en la cantidad adecuada, confieren efectos benéficos al hospedero”.5
Algunas veces los probióticos son llamados “bioterapéuticos” o “farmacobióticos” debido al mal entendido de que son agentes farmacológicos con efecto específico en una enfermedad; sin embargo, actualmente las diferentes líneas de investigación dan información más sólida de su administración y sus posibles efectos en seres humanos.5
Para que éstos puedan comercializarse es necesario que se evalúen antes de su distribución y deben cumplir algunas características generales establecidas por diferentes normas5
Deben ser administrados en dosis con concentración mínima de 109 microorganismos vivos.
En cada cepa deben identificarse sus características genotípicas y fenotípicas.
Las cepas usadas no deben ser capaces de transmitir factores de patogenicidad.
Efectos de los probióticos en el recién nacido pretérmino
Un estudio realizado por Mohan y colaboradores tuvo como objetivo investigar el efecto de Bifidobacterium lactis Bb12 en el peso, la fermentación intestinal y los parámetros inmunológicos (concentraciones de calprotectina e IgA) en recién nacidos pretérmino. Para ello condujeron un ensayo con distribución al azar doble ciego y controlado por placebo. Se observó que los lactantes que recibieron el probiótico tuvieron ganancia de peso mayor en comparación con el placebo (p < 0.001), así como mayor concentración de ácidos grasos de cadena corta en materia fecal (p < 0.001), lo que implica mejor digestión en el grupo tratado en comparación con el placebo. La producción de lactato por la microbiota intestinal se incrementó 38% en el grupo tratado con el probiótico en comparación con el placebo (p < 0.05), lo que se correlacionó con el número de bifidobacterias en heces fecales (R = 0.336) y disminución en el pH de las heces fecales de los pacientes tratados con el probiótico en comparación con el placebo (5.68 vs 6.38, p < 0.001).6
Este estudio apoya la administración de probióticos como terapia concomitante a las medidas nutricionales de los recién nacidos pretérmino, lo que podría repercutir en su desarrollo y mejor ganancia ponderal, que resulta en menor riesgo de complicaciones asociadas con el bajo peso al nacer.
Probióticos y respuesta inmunitaria
Algunos componentes del sistema inmunitario, particularmente los que se encargan de la defensa de las mucosas, están constantemente en contacto con bacterias de la microbiota normal. Para evitar reacciones inmunológicas perjudiciales, es necesario que las interacciones entre la inmunidad y el microbioma sean estrictamente reguladas. Por ello, no resulta sorprendente el hecho de que la disbiosis tenga efectos en el sistema inmunológico de un individuo y es lógico suponer que la administración de probióticos para restablecer el equilibrio en la diversidad de especies de microorganismos intestinales también beneficie la inmunidad del huésped.
Al respecto, Kaila y colaboradores evaluaron el efecto de Lactobacillus GG en la respuesta inmunitaria en niños bien alimentados con diagnóstico de infección por rotavirus. Los lactantes se dividieron en dos grupos: uno con tratamiento con cepas de lactobacillus y otros con placebo. Se observó una respuesta antígeno no específica mayor durante la fase aguda de la diarrea en ambos grupos, pero esta respuesta fue dos veces mayor en el grupo con tratamiento que en el placebo, fenómeno que fue evidenciado al determinar las concentraciones de IgG, IgA e IgM en el suero de los niños en estudio. En la fase de convalecencia, la IgA antígeno específica contra el rotavirus fue significativamente mayor en el grupo tratado que en el placebo, porque 90% de los pacientes en el grupo de estudio tuvieron respuesta de IgA frente al rotavirus comparado con 46% del placebo, así como reducción significativa de la duración de la diarrea.7 Estos resultados indican que el tratamiento con probióticos como Lactobacillus GG funciona como coadyuvante a la respuesta inmunitaria en este caso al rotavirus, con significado clínico al reducir la duración de la diarrea.
Probióticos como coadyuvantes en el tratamiento de infecciones
Gran parte del mantenimiento de la microbiota se debe a relaciones de competencia y comensales que suceden al mismo tiempo entre las diferentes especies de microorganismos presentes en el intestino. De esta forma, la existencia y crecimiento de bacterias patógenas son controlados por la actividad de otras especies que coexisten en el mismo ambiente. Por tal motivo, la administración de ciertos probióticos podría limitar la incidencia de infecciones gastrointestinales o, bien, funcionar como agentes terapéuticos para el tratamiento de la diarrea infecciosa. Asimismo, los productos de la actividad de las bacterias usadas como probióticos podrían tener efectos en la motilidad intestinal.
Gaón y colaboradores realizaron un estudio para evaluar el efecto de las cepas de Lactobacillussp y Saccharomyces boulardii en niños con diarrea persistente de diversa causa, a 40% de los cuales se les aisló un organismo patógeno en las heces. En el grupo tratado con el probiótico se observó reducción en el número de deposiciones diarias. Este efecto fue más notorio en el día 5 en comparación con el placebo (p < 0.001). Se mostró que los pacientes tratados con Lactobacillussp y Saccharomyces boulardii tuvieron recuperación más rápida de la diarrea en comparación con los que recibieron placebo (duración de 2 y 4 en el grupo placebo vs 1.5 y 3.2 días en el grupo tratado; p < 0.025 y p < 0.002, respectivamente).8
Además del lumen intestinal, la homeostasia en otras mucosas también depende del equilibrio en la flora bacteriana que coloniza su superficie. Tal es el caso de la mucosa respiratoria y vaginal. Estudios realizados recientemente en los que se efectuó la administración vía vaginal e incluso por vía oral de Lactobacillus rhamnosusGR-1 y Lactobacillus fermentumRC-14 en comparación con un placebo demostraron efectos benéficos de los probióticos en mujeres sanas al modular la microbiota vaginal. Reid y colaboradores asignaron a un grupo de mujeres sin antecedente de infecciones urogenitales a recibir ambas cepas de Lactobacillus rhamnosusGR-1 y Lactobacillus fermentumRC-14 en una cápsula vaginal durante 90 días y las compararon con mujeres que recibieron placebo. Se tomaron cultivos vaginales los días 0, 28, 60 y 90 después del tratamiento para evaluar las especies de bacterias presentes en la mucosa vaginal mediante la tinción de Gram y estadificando la escala de Nugent (indicando flora normal, intermedia o vaginosis bacteriana). Las pacientes no reportaron ningún efecto adverso asociado con la terapia de probióticos, al tiempo 0 se encontró que 25% de las pacientes tenía vaginosis bacteriana asintomática. El 24% de las pacientes en el grupo placebo padeció vaginosis bacteriana a los 36 días y 16% más al día 56; en comparación con el grupo tratado con los probióticos en el que ninguna paciente padeció vaginosis bacteriana a los 56 días (p < 0.05). La escala de Nugent mostró que los lactobacilos estuvieron presentes en 94% de las mujeres en el grupo tratado al día 35 (p 0.08) y en 97% al día 56 (p 0.05) con respecto al control. Los cultivos demostraron que los lactobacilos vaginales a las cuatro semanas incrementaron significativamente (p < 0.01), reduciendo las levaduras y bacterias coliformes (bacilos gramnegativos, p < 0.01). Se reportó alivio de la vaginosis bacteriana en 59% en el grupo tratado en comparación con el placebo (p < 0.01).9
Estos resultados concuerdan con las observaciones de otro estudio realizado por Anukan y colaboradores en el que se incluyeron pacientes con diagnóstico de vaginosis bacteriana mediante citología y puntuación en la escala de Nugent. Un grupo de mujeres fue tratado con metronidazol y un placebo mientras que el resto de las participantes recibieron metronidazol y la suplementación con probióticos (Lactobacillus rhamnosusGR-1 y Lactobacillus fermentumRC-14). Después de 30 días de tratamiento 88% de las mujeres en el grupo tratado con antibióticos y probióticos tuvieron puntuación normal en la escala de Nugent en comparación con 40% en el grupo antibiótico y placebo (p < 0.001).10
En conjunto, ambos trabajos revelan la capacidad de los probióticos para restablecer la flora bacteriana de otras mucosas diferentes al intestino y de limitar el crecimiento de cepas patógenas, reduciendo la incidencia de infecciones.
Probióticos como antagonista de patógenos
Diferentes cepas de bacterias que habitan el tubo gastrointestinal tienen la capacidad de sintetizar diversos péptidos con actividad antimicrobiana, denominados bacteriocinas. Por ejemplo, sobrenadantes de cultivos de L. acidophillus han demostrado, incluso, tener actividad significativa contra P. aeruginosa resistente a múltiples fármacos.11
El mecanismo por el que las bacteriocinas afectan el crecimiento bacteriano ocurre en la membrana celular, alterando su estabilidad y permeabilidad al formar complejos con los canales iónicos que alteran el flujo de protones. Los sobrenadantes de lactobacilos han demostrado, incluso, disminuir las señales del quorum sensing mediante las que las bacterias patógenas se comunican para coordinar ciertas actividades, interfiriendo con la formación de biopelículas en el intestino, por lo que pueden ser una promesa ante la emergencia de cepas multirresistentes a antibióticos.11
Simbióticos en trastornos de la motilidad intestinal
Los prebióticos son pequeñas cadenas de carbohidratos que resisten la digestión que sirven como sustrato para las bacterias intestinales.9 Los simbióticos son productos que contienen pre y probióticos. De esta forma, los prebióticos favorecen selectivamente la proliferación de las cepas probióticas que los acompañan.12
En un estudio realizado por Malpeli y colaboradores para evaluar el tiempo de tránsito intestinal en mujeres sanas antes y después de consumir yogur con BifidobacteriumBB-12, Lactobacillus casei CRL 431 y fibra (simbiótico) en comparación con un placebo, se encontró que el consumo del simbiótico redujo en 27.6 y 40.9% el tiempo de tránsito intestinal a las 24 horas (p < 0.005) e, incluso, 48 horas (p < 0.001) después de su consumo, respectivamente. En pacientes con estreñimiento se observó reducción de 27.5% en el tiempo de tránsito intestinal a 19 horas (p < 0.05) con efecto clínico relevante al reducir la distensión abdominal (p < 0.05).12
Probióticos como coadyuvantes de la vacunación
Un ensayo clínico realizado por Rizzardini y colaboradores tuvo como objetivo primario determinar el efecto de cada una de las dos cepas de probióticos BifidobacteriumBB-12 y L. casei 431 en la respuesta de anticuerpos específica inducida por vacunación contra el virus de la influenza. El estudio fue con distribución al azar, doble ciego, controlado por placebo, en paralelo en adultos sanos voluntarios. Los productos fueron consumidos durante seis semanas, dos semanas antes y cuatro semanas después del reto inmunológico con la vacuna de influenza estacional. Se observaron concentraciones incrementadas de las subclases IgG1 e IgG3 de anticuerpos específicos contra influenza en los sujetos tratados con ambas cepas (p < 0.01), con mayor diferencia en el grupo tratado con BifidobacteriumBB-12 (p < 0.016) respecto a los sujetos que no recibieron los probióticos. La IgA específica inducida por la vacunación en saliva se incrementó en ambas cepas BB-12 (p < 0.017) y L. casei 431 (p < 0.035) en comparación con el placebo; la diferencia en el grupo tratado con BB-12 fue más significativa (p < 0.05).13
Lo anterior sugiere que los probióticos podrían incrementar la capacidad del sistema inmunológico de montar respuestas específicas contra diferentes patógenos. Sin embargo, el mecanismo por el que ocurre ese fenómeno aún es motivo de controversia.
Probióticos en la prevención de infecciones de las vías aéreas superiores
Un metanálisis de Cochrane realizado en 2013 analizó el resultado de 13 ensayos clínicos que incluyó 3720 niños en el que se comparó la administración de probióticos vs placebo y su efecto en la incidencia de infecciones agudas de vías respiratorias superiores (IAVRS). Se encontró reducción de 47% en el número de episodios de IAVRS, así como en su duración en los grupos tratados con el probiótico, además de reducción del consumo de antibióticos y del ausentismo escolar relacionados con IAVRS.14 Sin embargo, para interpretar los resultados debe considerarse la gran variabilidad de los grupos en los diferentes estudios analizados.
Probióticos y enfermedad de Alzheimer
Los estudios previos revelan que la terapia con probióticos por vía oral puede mejorar la homeostasia de mucosas que se encuentran distantes al intestino. En ese orden de ideas, algunos autores consideran que los efectos de la microbiota en el cuerpo humano pueden influir en la función de sistemas aún más lejanos, como es el caso del sistema nervioso central. De hecho, algunas observaciones han demostrado que las alteraciones en la microbiota intestinal pueden influir en el riesgo de padecer trastornos neurológicos crónicos.
Al respecto, Akbari y colaboradores evaluaron si el tratamiento con probióticos ayuda a mejorar el trastorno cognitivo y metabólico en pacientes de 60 a 95 años con enfermedad de Alzheimer. Un grupo recibió leche y otro, leche complementada con probióticos Lactobacillus acidophilus, Lactobacillus casei, Bifidobacterium bifidum y Lactobacillus fermentum (2x109 UFC) durante 12 semanas. En la evaluación de la miniprueba del estado mental (Mini-Mental State Examination, MMSE) a las 12 semanas del tratamiento se observó mejoría en la calificación del grupo tratado con el probiótico en comparación con el placebo (p < 0.001). Entre los parámetros metabólicos evaluados se encontró reducción de la proteína C reactiva altamente sensible (-17.6%, p < 0.001) en el grupo tratado, así como del índice HOMA (3.4%, p < 0.001) e incremento del índice QUICKI (por sus siglas en inglés, quantitative insulin sensitivity check index, p = 0.006). Se observó influencia en el perfil lipídico en el grupo tratado con el probiótico al encontrarse reducción en los triglicéridos (p = 0.003), así como en el colesterol-VLDL (p = 0.003). El tratamiento con el probiótico también se asoció con reducción de las concentraciones de malondialdehído (p < 0.001). No se reportaron efectos adversos en el grupo tratado con probióticos.15
Por tanto, la administración de probióticos podría beneficiar a los pacientes con enfermedad de Alzheimer, sobre todo, si éstos son diagnosticados de manera temprana. Los mecanismos responsables de los fenómenos observados en el estudio mencionado aún se están determinando.
CONCLUSIONES
Los probióticos son una promesa para el desarrollo de nuevas estrategias en el tratamiento de diferentes enfermedades pertenecientes a todas las ramas de la medicina, porque han demostrado su utilidad en varios estudios clínicos. Sin embargo, el conocimiento de los mecanismos implicados en sus efectos en la salud aún son tema de intensa investigación. No obstante, el acercamiento y la familiarización con la evidencia de su utilidad es de vital importancia entre los médicos para fomentar la búsqueda de nuevas estrategias dirigidas a mejorar el tratamiento de diversas enfermedades, muchas de las cuales han superado las medidas terapéuticas más novedosas. Asimismo, hace falta esclarecer la regulación por las entidades gubernamentales porque se encuentra ausente debido a que su comercialización nacional es como complementos alimenticios y los diversos beneficios que los probióticos prestan a la salud han demostrado en los diversos ensayos tener una relación dependiente de las características fenotípicas y genotípicas de las cepas bacterianas administradas. La seguridad de su administración en situaciones especiales es otro punto que hace falta esclarecer en los casos especiales; en los pacientes inmunodeprimidos, oncológicos, con enfermedades autoinmunitarias y con desnutrición debe tenerse especial precaución porque a pesar de que en los estudios no se han vinculado con efectos adversos, esos estudios sólo se han realizado en sujetos sin estas complicaciones y su prescripción en tales casos debe hacerse con precaución.











 nueva página del texto (beta)
nueva página del texto (beta)


