OBJETIVO
La reunión multidisciplinaria de expertos para el diagnóstico y tratamiento de la osteoartritis con actualización basada en evidencias tuvo como objetivo mantener la vigencia de las recomendaciones con base en la mejor evidencia científica y ser un marco de referencia para la toma de decisiones en cuanto al diagnóstico y tratamiento del paciente con osteoartritis. Entre sus principales objetivos, así como actualizaciones con respecto a la guía previa, se encuentran:
- Evaluar la asociación entre nuevos marcadores inflamatorios y hallazgos radiográficos.
- Mostrar el papel de las nuevas técnicas de resonancia magnética para determinar el grado de pérdida del cartílago articular.
- Evaluar el efecto de los neuromoduladores como duloxetina para el tratamiento del dolor.
- Identificar la evidencia científica de los fármacos modificadores de los síntomas (SMOAD -symptom modifying osteoarthritis drugs).
- Mostrar la importancia del manejo rehabilitatorio.
Mostrar la importancia de la aplicación de medidas preventivas y educación en salud como parte de un manejo integral del paciente con osteoartritis.
JUSTIFICACIÓN
Existe aumento de la prevalencia de la osteoartritis en todo el mundo, lo que representa una pérdida aproximada de 2.3 años de vida saludable.1 Es una de las 10 primeras causas de invalidez total en México, lo que incrementa la carga económica y social del país y se espera que su frecuencia se siga elevando debido al aumento de la esperanza de vida y a los hábitos poco saludables de la población.1 El tratamiento de la enfermedad tiene como objetivos: disminuir el dolor, mantener la movilidad articular y minimizar la discapacidad; por ello, la búsqueda de nuevos tratamientos se basa en el mayor conocimiento de la fisiopatología del fenómeno inflamatorio en el cartílago articular, teniendo como objetivo la interacción entre el condrocito y la matriz extracelular.
En 2011 se realizó la primera reunión para el desarrollo de la Guía de práctica clínica basada en la evidencia para el diagnóstico y tratamiento de la osteoartritis en México.2 Más tarde, en 2013, se realizó una segunda reunión donde se actualizó esa guía.3 En este documento se muestra una tercera actualización que se realizó tras una reunión de expertos efectuada en diciembre de 2016, donde se destacó la importancia de la implementación de medidas preventivas, establecer el diagnóstico temprano y el valor que tiene hoy día la imagen por resonancia magnética (IRM) y la manera de abordar la nueva evidencia del tratamiento farmacológico, así como la importancia de la rehabilitación en el manejo integral de la osteoartritis.
Conformación del grupo de trabajo
En la actualización de la guía de práctica clínica (GPC) se invitó a participar a los autores que integraron el documento inicial, con la colaboración de otros especialistas expertos en el área provenientes de diferentes ciudades de la República Mexicana. En la elaboración final del manuscrito participaron 14 especialistas en Medicina Interna, Reumatología, Ortopedia y Rehabilitación física, un bibliotecario y un experto en metodología para la elaboración de guías.
Delimitación del enfoque y alcances
Los integrantes del grupo de trabajo definieron que los principales aspectos a abordar por la guía son el diagnóstico y tratamiento de la osteoartritis en el primer, segundo y tercer niveles de atención médica.
Población objetivo
Adultos mayores de 18 años de edad, de uno y otro sexo, con sospecha de diagnóstico de osteoartritis de mano, cadera y rodilla.
Usuarios
La actualización basada en evidencias que se realizó tras la reunión multidisciplinaria de expertos para el diagnóstico y tratamiento de la osteoartritis está dirigida a médicos generales, internistas, reumatólogos, ortopedistas y rehabilitadores que estén implicados en el diagnóstico y tratamiento de la osteoartritis.
Desarrollo de la guía
Se realizó una revisión de la Guía de práctica clínica basada en la evidencia para el diagnóstico y tratamiento de la osteoartritis publicada en 2013 con el título “Reunión multidisciplinaria de expertos para el diagnóstico y tratamiento de la osteoartritis. Actualización basada en la evidencia”, para determinar los aspectos principales que se debían actualizar en esta guía, porque la nueva evidencia científica hacía necesario realizar ajustes relacionados con el diagnóstico, el tratamiento, la rehabilitación de la osteoartritis y el manejo integral del paciente. Para ello se elaboraron un total de 54 preguntas, todas ellas revisadas por un experto en metodología, que abarcaron los temas de clasificación, factores de riesgo, criterios diagnósticos, medidas preventivas, tratamiento con base en medidas generales, con paracetamol, antiinflamatorios no esteroides (AINE), inhibidores selectivos de la ciclooxigenasa (COX-2), opioides, fármacos sintomáticos de acción lenta (SYSADOA por sus siglas en inglés de symptomatic slow action drugs osteoarthritis), viscosuplementación, tratamiento quirúrgico y tratamiento a base de rehabilitación física. Con base en los temas revisados se realizaron búsquedas en extenso en PubMed de guías de práctica clínica, revisiones sistemáticas y metanálisis y ensayos clínicos controlados del diagnóstico y tratamiento de la osteoartritis en adultos mayores de 18 años de edad, de uno y otro sexo, en idioma inglés o español, de abril de 2012 a noviembre de 2016. Se excluyó en la búsqueda a población pediátrica y mujeres embarazadas. La búsqueda de guías de práctica clínica también se realizó en otros sitios web especializados abarcando el mismo periodo; los sitios web fueron: TRIPDATABASE, CMA INFOBASE, National Guideline Clearinghouse (NGC), National Health Service (NHS), National Institute for Health and Care Excellence (NICE), Alberta Medical Association Guidelines, American College of Physicians, ICSI, Australian Government. National Health and Medical Research Council, New Zealand Guidelines Group (NZGG), Singapore MOH Guidelines. De esta búsqueda se encontraron artículos.
A los médicos participantes se les entregaron las preguntas que les sirvieran de base para la actualización del tema específico de su revisión, así como los artículos previamente seleccionados con el fin de que obtuvieran de ellos el nivel de evidencia y el grado de recomendación establecidos por las guías NICE.4 En los casos donde los artículos médicos seleccionados no respondieran en su totalidad a las preguntas previamente establecidas, se realizó una evaluación completa de las referencias de la guía previa para dar la información más completa y con el mejor nivel de evidencia.
Exoneración
Este documento es una actualización de la guía de práctica clínica realizada en 2013 y se basa en la mejor evidencia científica disponible en el momento de su elaboración, pretende convertirse en una herramienta que permita agilizar la toma de decisiones de diagnóstico y tratamiento, considerando siempre las necesidades y preferencias individuales del paciente, así como la disponibilidad de los recursos locales del consultorio, institución o ambos. Los nuevos resultados de la investigación clínica proporcionan evidencias actualizadas que hacen necesario cambiar la práctica usual antes de la siguiente actualización.
Tipo de actualización. Parcial. Esta guía será actualizada en un plazo de cinco años o antes si existe evidencia científica que así lo determine.
Conflicto de interés. Los médicos participantes no declararon conflicto de interés para su contribución en la guía.
DEFINICIÓN
La osteoartritis es una enfermedad articular crónica degenerativa con componente inflamatorio caracterizada por degeneración y pérdida progresiva del cartílago hialino y hueso subcondral y daño del tejido sinovial, asociados con engrosamiento y esclerosis de la lámina subcondral, formación de osteofitos en el borde articular, distensión de la cápsula articular y cambios en los tejidos blandos periarticulares.
Efecto epidemiológico de la osteoartritis en México y en todo el mundo
Las enfermedades reumáticas constituyen un grupo de alrededor de 250 padecimientos que afectan al sistema músculo-esquelético y en algunos casos a otros órganos y sistemas. Entre ellas, la osteoartritis es la afección articular observada con más frecuencia en la población adulta, se ubica entre las primeras 10 causas de atención hospitalaria5 y es una de las principales causas de discapacidad en todo el mundo,6 aunque sus cifras de prevalencia varían según la localización geográfica, los distintos grupos étnicos, el sexo, la edad de las poblaciones estudiadas y la articulación afectada.6
Se ha estimado que la prevalencia de osteoartritis en México es de 10.5% (IC95% 10.1 a 10.9), es más frecuente en las mujeres (11.7%) que en los hombres (8.7%), aunque varía enormemente en las diferentes regiones del país; en Chihuahua la prevalencia es de 20.5%, en Nuevo León de 16.3%, en la Ciudad de México de 12.8%, en Yucatán de 6.7% y en Sinaloa de 2.5% (p < 0.01).7 En todo el mundo en la mano la prevalencia es de 43.3% (IC95% 42.7-42.9), en la rodilla es de 23.9% (IC95% 23.6-24.2) y en la cadera es de 10.9% (IC95% 10.6-11.2).8
Fisiopatología de la osteoartritis
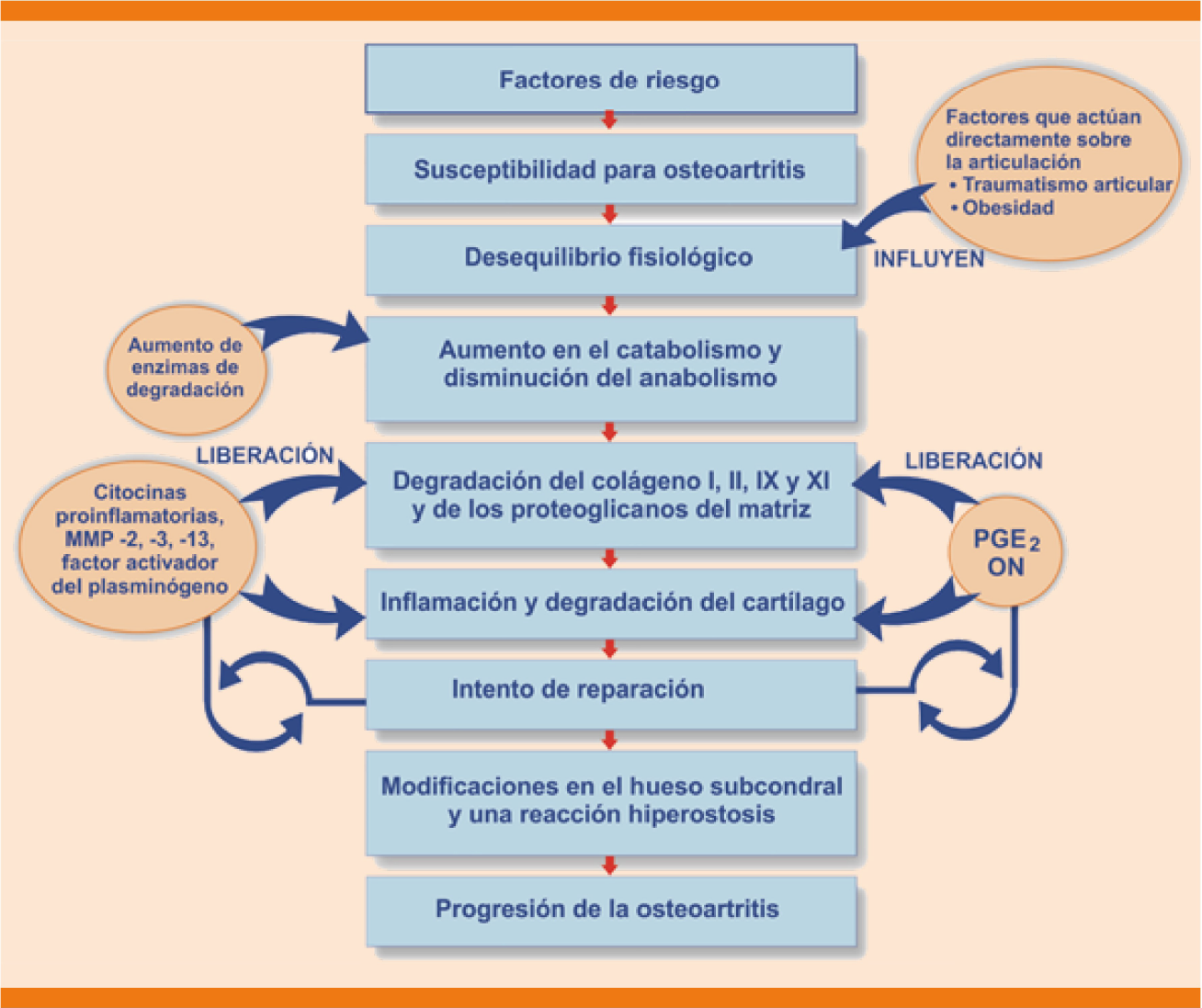
La combinación de factores como edad, predisposición genética, obesidad, ejercicios de alto impacto, traumatismos y mala alineación articular, entre otros, desencadenan un desequilibrio fisiológico en el cartílago articular, caracterizado por aumento en el catabolismo y disminución de su formación.3 Los factores proinflamatorios impulsan la producción de enzimas proteolíticas responsables de la degradación de la matriz extracelular que da como resultado la destrucción de los tejidos de unión.9 El proceso inflamatorio favorece la síntesis de óxido nítrico (ON), citocinas, proteasas y radicales libres, los que a su vez activan las metaloproteasas (MMP) e inducen la liberación de factor de necrosis tumoral alfa (TNF-α) e interleucina 1 (IL-1). La IL-1 es una citocina inflamatoria que participa en el catabolismo del condrocito, además, estimula la síntesis y activación de las MMP, principalmente 2, 3 y 13, que condicionan la degradación de la membrana extracelular del cartílago articular y la muerte de los condrocitos; a su vez, las MMP y las agrecanasas (como la catepsina B y ADAMT -a desintegrin and a metalloproteinase with thrombospondin motifs-) contribuyen al catabolismo de los proteoglicanos y de las proteínas de unión. Las prostaglandinas, específicamente la prostaglandina E-2 (PGE2) media los efectos proinflamatorios. El óxido nítrico activa las MMP, aumenta la producción de radicales libres e induce la apoptosis del condrocito por la alteración de la homeostasia iónica (Figuras 1 y 2).3 Aunque la destrucción y la pérdida del cartílago articular son un componente central de la osteoartritis, todos los tejidos articulares se ven afectados de alguna manera, lo que indica que la osteoartritis es una enfermedad de la articulación como un órgano en conjunto. Los factores mecánicos desempeñan ciertamente un papel clave en la osteoartritis y hay cierto debate en el campo en cuanto al efecto en que la osteoartritis es mediada por la mecánica anormal de las articulaciones.9 A medida que avanza la osteoartritis afecta a toda la articulación, lo que resulta en deterioro de todos los componentes. Sin embargo, la osteoartritis no progresa a una tasa similar en todos los individuos y no todos los que tienen una enfermedad temprana padecerán una osteoartritis más grave. La predicción de los pacientes que avanzarán a las etapas finales de la enfermedad sigue siendo un reto.9
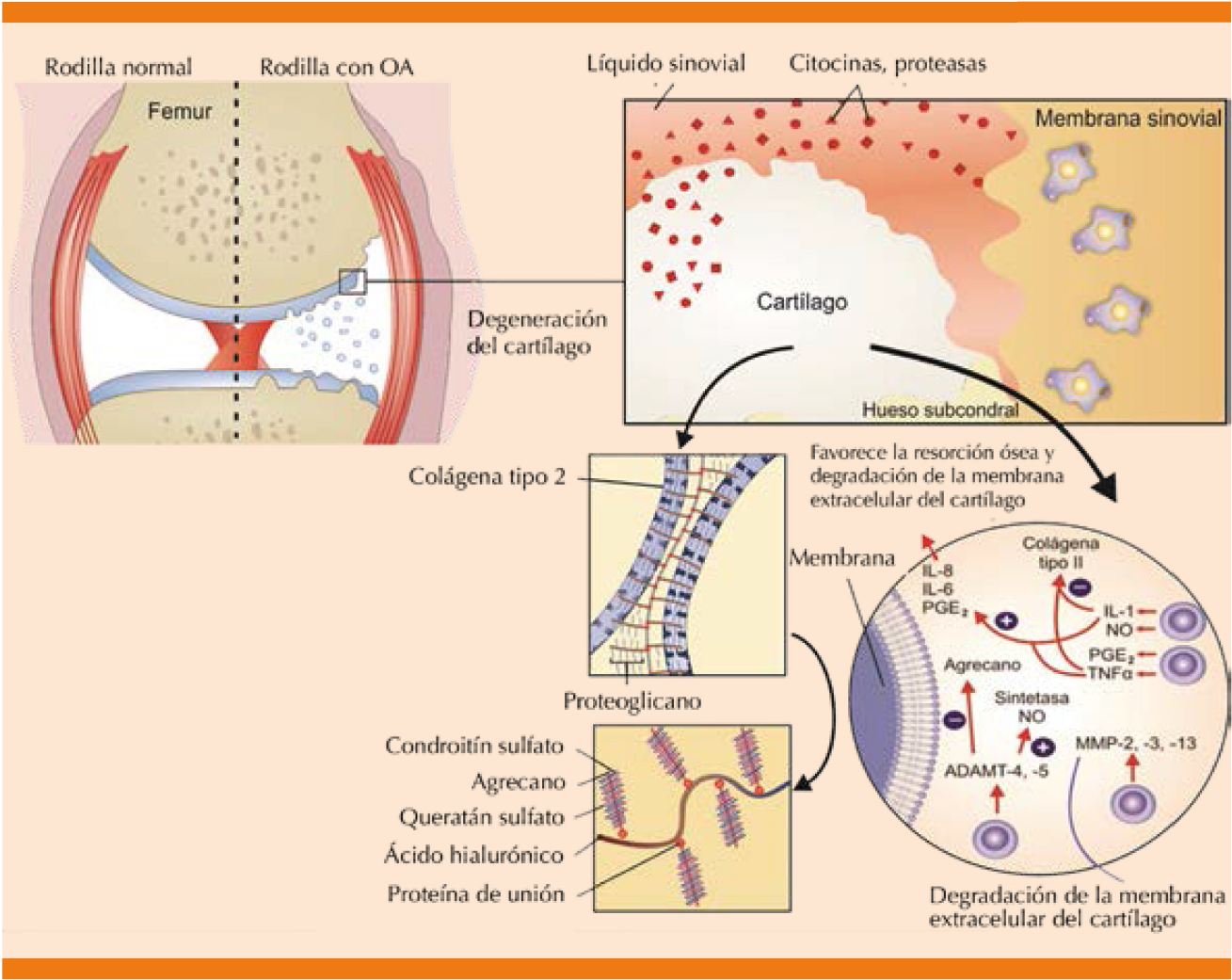
ADAMT: por sus siglas en inglés de a desintegrin and a metalloproteinase with thrombospondin motifs; IL: interleucina; MMP: metaloproteinasas; NO: óxido nítrico; OA: osteoartritis; PGE2: prostaglandina E-2; TNF-a: factor de necrosis tumoral alfa.
Figura 1 Fisiopatología de la osteoartritis.3
Preguntas clínicas. Diagnóstico
¿Qué criterios de clasificación son los más usados respecto a osteoartritis?
Evidencia: los criterios que se usan son los publicados por el Colegio Americano de Reumatología (ACR) para las tres articulaciones revisadas, mismos que aún son vigentes.
Los criterios para establecer el diagnóstico de osteoartritis de rodilla:10
- Con base en el interrogatorio dirigido, la exploración física y el laboratorio, tienen sensibilidad de 92% y especificidad de 75%.
- Con base en la clínica y las radiografías simples tienen sensibilidad de 91% y especificidad de 86%.
- Con base sólo en la clínica tienen sensibilidad de 95% y especificidad de 69%.
Los criterios para establecer el diagnóstico de osteoartritis de cadera11
- Con base en la clínica tienen sensibilidad de 86% y especificidad de 75%.
- Con base en la clínica, el laboratorio y las radiografías simples, tienen sensibilidad de 89% y especificidad de 91%.
Criterios para establecer el diagnóstico de osteoartritis de mano: ver el algoritmo para el diagnóstico de la osteoartritis (Figura 3).3
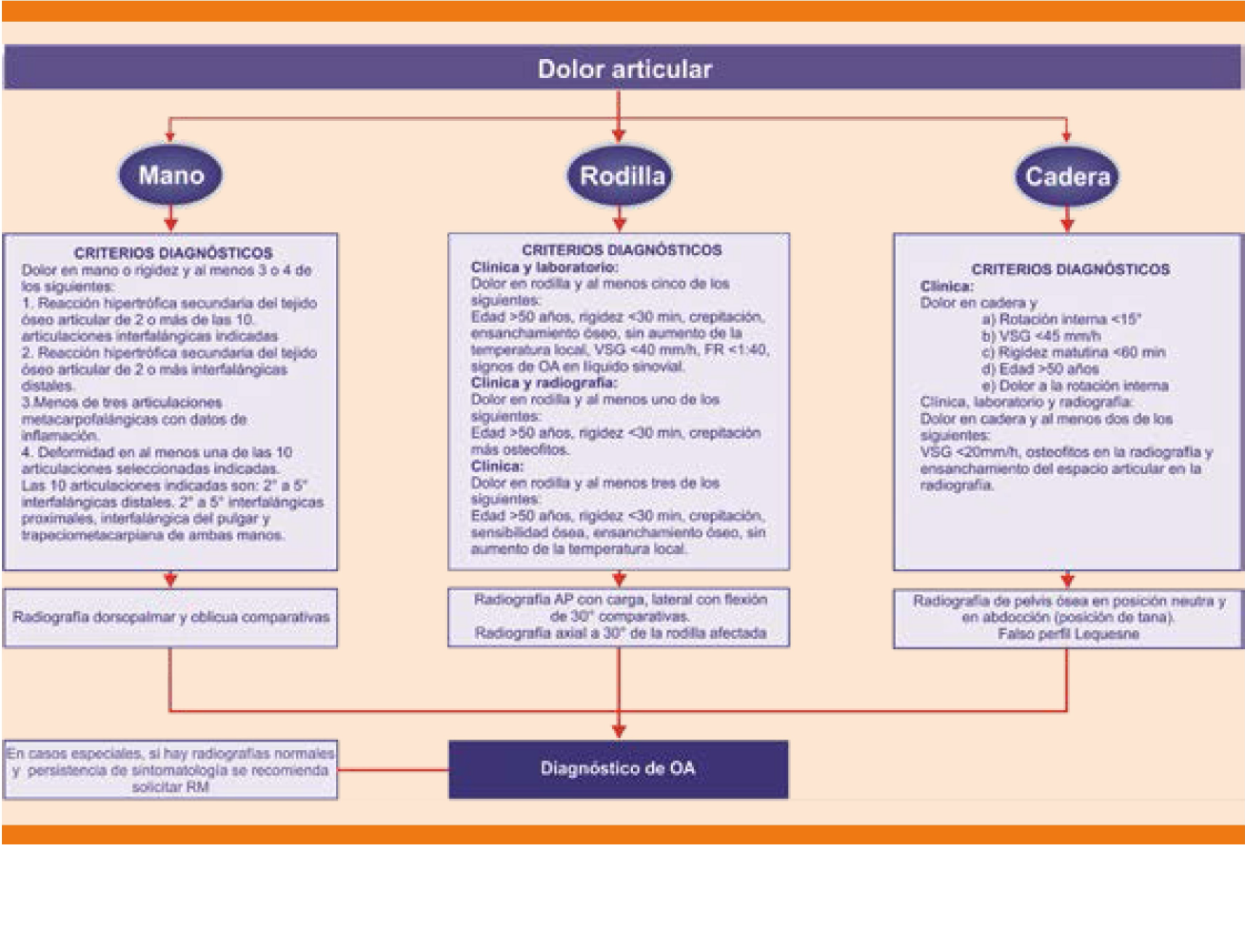
AP: anteroposterior; FR: factor reumatoide; OA: osteoartritis; RM: resonancia magnética; VSG: velocidad de sedimentación globular.
Modificada de la referencia 3.
Figura 3 Algoritmo para el diagnóstico de osteoartritis.
Recomendación: El consenso de grupo de expertos (CGE) establece que estos criterios son de clasificación, no de diagnóstico. Permiten diferenciar al paciente con osteoartritis de pacientes con otros padecimientos que cursan con síntomas similares y ayudan a establecer de manera uniforme un diagnóstico clínico o radiológico en la mayoría de los casos (GR D).
En pacientes adultos, ¿cuáles son los factores de riesgo reconocidos para la aparición y progresión de la osteoartritis?
Evidencia: factores de riesgo de aparición:
- Genética: alteraciones hereditarias de la colágena tipo II por mutación del gen COL2A1 (NE 2++).12
- Edad: más frecuente en población mayor de 50 años debido a la disminución en la síntesis y contenido de los proteoglicanos y de la matriz extracelular (NE 2-).13
- Sexo: prevalencia mayor de osteoartritis de rodilla en mujeres (27.3% IC95% 26.9-27.7, p < 0.01) vs hombres (21% IC95% 20.5-21.5, p < 0.01), prevalencia de osteoartritis de cadera en mujeres (11.6% IC95% 11.1-12.1) vs hombres (11.5% IC95% 11.0-12.1), prevalencia de osteoartritis de mano en mujeres (43.3% IC95% 42.6-44.0) vs hombres (44.5% IC95% 43.5-45.5) (NE 2++).8
- Factor hormonal: en la menopausia aumenta el riesgo por el déficit de estrógenos (NE 3).14
- Mal alineamiento articular: como anormalidades congénitas (displasia congénita de cadera, enfermedad de Legg-Calvé-Perthes) y secuelas de fracturas. En pacientes con rodilla en varo, se trasmite un exceso de peso en el compartimento medial de la rodilla. El mal alineamiento articular se relaciona con osteoartritis en 90% (p < 0.05) (NE 2++).15
- Daño articular previo: puede ser por enfermedades por depósito (hemocromatosis), traumatismo articular, etc. (NE 2+).16
- Obesidad: IMC a partir de 26.6 kg/m2 HR 1.03 (1.00, 1.06) (NE 2++).12
- Síndrome metabólico con producción de factores proinflamatorios sistémicos: un componente vs ningún componente de síndrome metabólico tiene razón de momios (OR) de 2.33 (IC95% 0.96-5.65, p 0.065), dos componentes OR 2.82 (IC95% 1.05-7.54, p 0.039), tres o más componentes OR 9.83, (IC95% 3.57-27.1, p < 0.001).16
Factores de riesgo de progresión (Figura 4)
- Mayor edad: OR 1.34 (1.15-1.57) (NE 2++).12
- Sexo femenino: OR 2.17 (1.13-4.15) (NE 2++).12
- Rigidez articular: OR 1.39 (1.09, 1.77) (NE 2++).12
- Gravedad de la enfermedad: OR 1.01 (1.00, 1.02) (NE 2++).12 Existencia de síndrome metabólico con producción de factores proinflamatorios sistémicos: existencia de dos componentes OR 2.29 (IC95% 1.49-3.54, p < 0.001), tres o más componentes OR 2.80 (IC95% 1.68-4.68, p < 0.001) (NE 2+).16
- Carga articular (NE 4).17
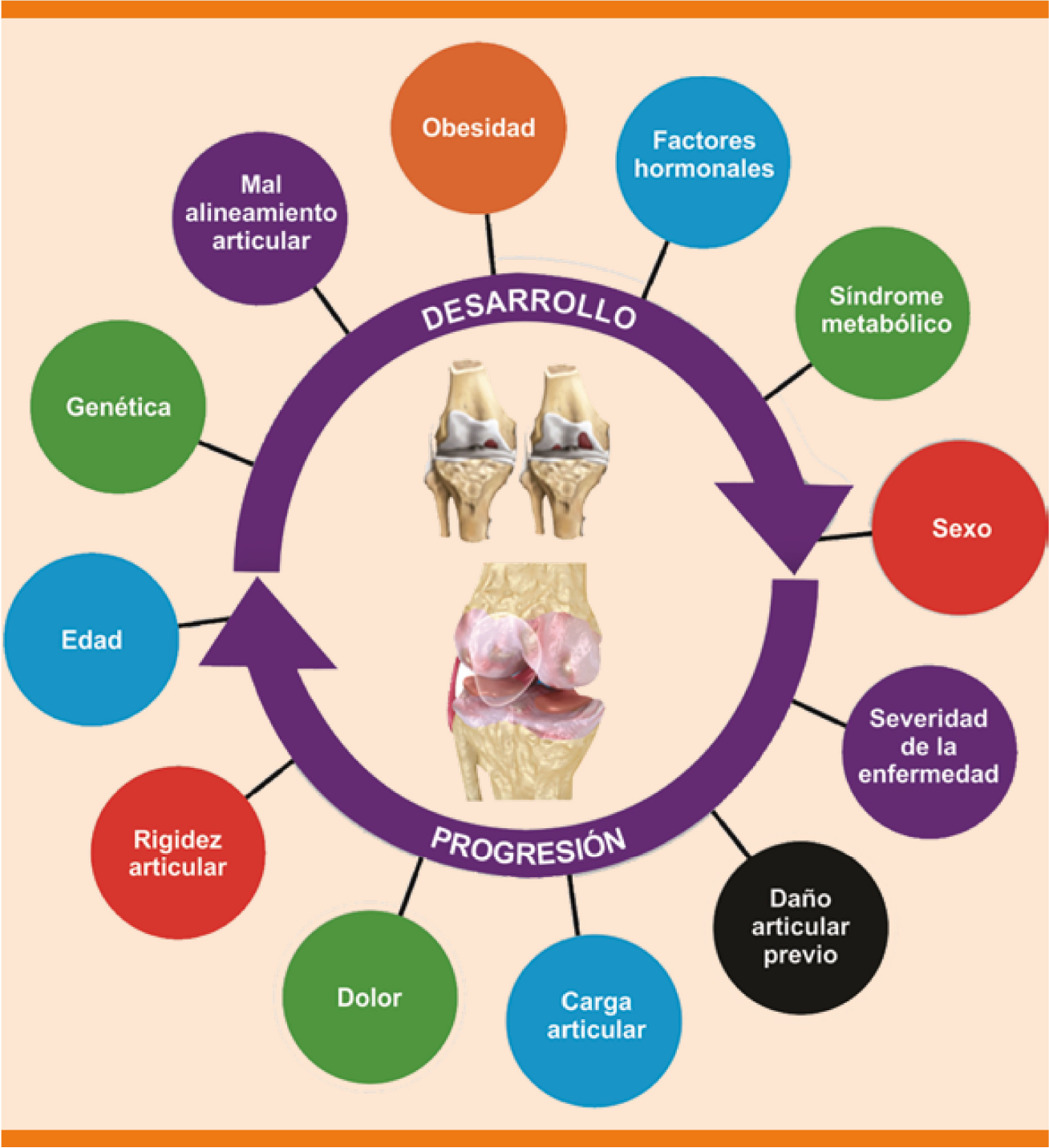
Modificada de la referencia 3.
Figura 4 Factores de riesgo de aparición y progresión de la osteoartritis.
En pacientes con sospecha de osteoartritis ¿cuál es el papel de la exploración física para establecer el diagnóstico clínico?
Evidencia: El diagnóstico de osteoartritis es clínico, por lo que la exploración física es fundamental. Debe considerarse evaluar el dolor a través de una escala visual análoga (EVA). Datos como rigidez (generalmente matutina y menor de 30 minutos), crepitación y dolor articular (sobre todo después de periodos de inactividad), limitación funcional e inestabilidad articular, sugieren fuertemente el diagnóstico (NE 3).13
Recomendación
En osteoartritis de mano deben evaluarse, además de la rigidez, existencia de nódulos en articulaciones interfalángicas distales (de Heberden) y proximales (de Bouchard) y la existencia de limitación funcional, que es menor que en otras enfermedades reumáticas. En osteoartritis, por lo general, no se afectan la articulación metacarpofalángica ni el carpo (GR C).
En la osteoartritis de rodilla debe evaluarse la existencia de sinovitis, edema o ambos, crepitación al movimiento, rigidez, limitación funcional, roce doloroso, formación hipertrófica ósea (osteofitos), hipersensibilidad ósea e inestabilidad articular. Puede afectar cualquier compartimento (patelofemoral o tibio-femoral lateral o medial) (GR C).
En la osteoartritis de cadera deben evaluarse la limitación a la abducción y rotación interna, flexión menor de 115° y rigidez. Es importante explorar la maniobra de Patrick, que consiste en la existencia de dolor ante la flexión, abducción y rotación externa de la articulación coxofemoral (GR D).
¿Cuáles son las escalas de utilidad para la evaluación del paciente con diagnóstico de osteoartritis?
Evidencia
- La escala visual análoga (EVA) evalúa sólo el grado de dolor.
- WOMAC (Western Ontario and McMaster Universities Arthritis Index): evalúa dolor, rigidez, estado funcional y actividades asociadas de las articulaciones de cadera y rodilla.2
- El cuestionario WOMAC es un índice da valoración funcional con gran utilidad en osteoartritis de cadera y rodilla. Consta de 24 reactivos que exploran tres aspectos: dolor (5), rigidez (2) y capacidad funcional (17). Cada dimensión recibe una puntuación de 0 a 4, 0 representa la ausencia del síntoma y 4 la máxima intensidad del mismo.3
- Los resultados se interpretan de la siguiente manera:
- Puntuación 3 a 7: discapacidad ligera a moderada.
- Puntuación 8 a 12: discapacidad severa.2
- Índice de Lequesne: evalúa el dolor y el estado funcional de la rodilla (Cuadro 1).
Cuadro 1 Índice de Lequesne
| Subescalas | Ítems | Puntos | Puntos paciente |
|---|---|---|---|
| Dolor | Durante el descanso nocturno | ||
| Sólo al moverse en ciertas posiciones | |||
| Sin moverse | 2 | ||
| Duración de la rigidez matinal o dolor al levantarse | |||
| Menos de 15 min | 1 | ||
| Más de 15 min | 2 | ||
| Si permanece parado durante 30 min aumenta el dolor | 1 | ||
| Dolor al caminar o pasear | |||
| Sólo después de caminar alguna distancia | 1 | ||
| Al comenzar a caminar | 2 | ||
| Cuando se levanta de la posición sentada sin la ayuda de las manos | 1 | ||
| Máxima distancia caminada | Más de 1 km, pero limitada | 1 | |
| Aproximadamente 1 km (cerca de 15 min) | 2 | ||
| De 500 a 900 m (cerca de 8 a 15 min) | 3 | ||
| De 300 a 500 m | 4 | ||
| De 100 a 300 m | 5 | ||
| Menos de 100 m | 6 | ||
| Caminando con un bastón o muleta | +1 | ||
| Caminando con dos bastones o muletas | +2 | ||
| Actividades de la vida diaria | ¿Puede subir un piso de la escalera? | 0 a 2 | |
| ¿Puede bajar un piso de la escalera? | 0 a 2 | ||
| ¿Puede agacharse en cuclillas? | 0 a 2 | ||
| ¿Puede caminar sobre un suelo en mal estado? | 0 a 2 | ||
| Total | 0 a 24 |
Las puntuaciones más bajas indican que el deterioro funcional es menor.10
En pacientes con sospecha de osteoartritis, ¿cuál es la utilidad de los estudios de laboratorio?
Evidencia: no existe un patrón de referencia para el diagnóstico de osteoartritis. Recientemente se estableció una relación entre algunos marcadores inflamatorios y los hallazgos radiográficos, como la proteína sérica oligomérica de la matriz del cartílago (sCOMP), que es un biomarcador de degradación de cartílago que se encuentra elevado en pacientes con osteoartritis, en comparación con sujetos sanos (NE 2++).18
Recomendación: se recomienda realizar perfil bioquímico completo, biometría hemática con velocidad de sedimentación globular (VSG), proteína C reactiva y examen general de orina para realizar el diagnóstico diferencial y de manera previa al tratamiento (CGE). No está indicada la realización de factor reumatoide, determinación de ácido úrico o algún otro examen de anticuerpos debido a que, en pacientes de edad avanzada, al igual que otros marcadores inflamatorios, suelen estar presentes o con valor aumentado (GR C).
En pacientes con sospecha de osteoartritis, ¿cuál es la utilidad de la radiografía simple?
Evidencia: la radiografía simple de la región afectada es el método básico para el diagnóstico y la evaluación en osteoartritis; por lo general, los cambios clínicamente significativos en las puntuaciones radiográficas pueden tomar por lo menos uno o incluso dos años en manifestarse (NE 3).9 Los principales hallazgos radiográficos son:13
Disminución asimétrica del espacio articular
Formación de hueso subcondral (osteofitos).
Esclerosis subcondral.
Existencia de quistes subcondrales (geodas).
Recomendación: las proyecciones adecuadas son (GR D):
Mano: dorsopalmar y oblicua, comparativas.
Rodilla: anteroposterior (AP) con carga (de preferencia con apoyo monopodal), lateral con flexión de 30 a 40°, comparativas.
En sospecha de enfermedad patelofemoral, la proyección deberá ser solicitada por el especialista (posición de Merchant: axial con flexión a 45º).
Cadera: pelvis ósea en posición neutra y en abducción (posición de rana). Proyección de falso perfil de Lequesne (paciente en posición de pie con rotación de pelvis de 65º, la placa radiográfica se apoya de manera lateral en la cadera en estudio).
La escala más utilizada en la valoración del daño estructural para la osteoartritis de rodilla es la de Kellgren y Lawrence, que incluye cinco categorías (GR D):
Grado 0: radiografía normal.
Grado I: posible pinzamiento del espacio articular y dudosa existencia de osteofitos.
Grado II: existencia de osteofitos y posible disminución del espacio articular.
Grado III: múltiples osteofitos de tamaño moderado, disminución del espacio articular y esclerosis subcondral moderada, con posible deformidad de los extremos óseos.
Grado IV: múltipless osteofitos con importante disminución del espacio articular, esclerosis severa y deformación de los extremos óseos.
En pacientes con sospecha de osteoartritis de rodilla ¿cuál es la utilidad de la imagen por resonancia magnética (IRM)?
Evidencia: la imagen por resonancia magnética no es necesaria en la mayoría de los pacientes con síntomas sugerentes de osteoartritis, características radiográficas típicas, o ambos; sin embargo, puede identificar la osteoartritis en etapas tempranas antes de que los cambios radiográficos se hagan evidentes. Estos cambios incluyen defectos del cartílago y lesiones de la médula ósea. La IRM también puede usarse para evaluar la enfermedad en otras estructuras de la articulación no visualizadas en la radiografía, como derrames, sinovia y ligamentos.19
La imagen por resonancia magnética es una herramienta no invasiva útil en etapas tempranas y tardías de la osteoartritis de rodilla, porque además de detectar cambios estructurales iniciales en el grosor del cartílago y en el espacio articular, ayuda a determinar la progresión de la enfermedad detectando el daño del menisco y en el cartílago en 84% (p < 0.05) (NE 2++).15 En la actualidad es posible obtener información adicional usando imágenes de resonancia magnética dinámicas, como las mediciones con T1ρ y dGEMRIC (delayed gadolinium-enhanced MRI of cartilage) que permiten evaluar los marcadores bioquímicos de la integridad del cartílago, como los glucosaminoglicanos para el estudio de la evolución de la enfermedad, así como para determinar la efectividad de las intervenciones terapéuticas de la osteoartritis (NE 3).20 Además, en estudios recientes se estableció que la secuencia T1ρ de la IRM permite detectar la degeneración del cartílago de manera cuantitativa y cualitativa por mapeo de imagen a color (NE 3).21
Se tienen como predictores en cambios estructurales:
- Erosión como factor de riesgo de la pérdida del cartílago articular de la articulación patelofemoral: OR 3.5 (IC95% 1.3-14.1) (NE 3).22
- Extrusión meniscal como factor de riesgo de pérdida del cartílago articular de la articulación tibiofemoral: OR 3.6 (IC95% 1.3-10.1) (NE 3).22
- Daño constante en el cartílago articular como factor de riesgo de pérdida del cartílago articular de la articulación tibiofemoral: OR 15.3 (IC95% 4.9-47.4) (NE 3).22
- Lesión a médula ósea, definida como el área de hueso trabecular mal delimitada y con baja intensidad en las secuencias T1 y alta en T2, que ha demostrado estar presente entre 50 y 60% de las IMR de pacientes con osteoartritis (NE 2+),23 aunque esta prevalencia puede aumentar hasta 80% si en lesiones meniscales existe exposición del hueso subcondral (NE 2++).24
¿Cuál es la importancia de la imagen por resonancia magnética en relación con la existencia de síntomas?
Evidencia. Aproximadamente 62% de los pacientes con síntomas relacionados con osteoartritis tienen cambios en la imagen por resonancia magnética (p < 0.05).15 Los pacientes con dolor articular muestran cambios en la imagen por resonancia magnética (IRM), como erosiones óseas y adelgazamiento del cartílago articular (p < 0.001). Las erosiones óseas que se muestran en la IRM se asocian con dolor (OR 9.99, IC95% 1.28-149) y con rigidez (OR 4.67, IC99% 1.26-26.1) (NE 2++).15
¿Cuál es la importancia de la imagen por resonancia magnética en relación con los cambios estructurales?
Evidencia. La sensibilidad y especificidad de la imagen por resonancia magnética para detectar anormalidades en el cartílago son de 60.5 y 93.7%, respectivamente. La sensibilidad es mayor a medida que aumenta el grado de las lesiones: 31.8% en el grado 1, 72.4% en el grado 2, 93.5% en el grado 3 y 100% en el grado 4. Ayuda a detectar cambios en los cartílagos femorotibiales laterales y mediales a pesar de que la radiografía simple los haya reportado como normales.15
En pacientes con sospecha osteoartritis ¿cuál es la utilidad del ultrasonido?
Evidencia. La ecografía es otra modalidad de imagen que puede identificar los cambios estructurales relacionados con osteoartritis y es útil para detectar inflamación sinovial, efusión y existencia de osteofitos. Las limitaciones de la ecografía incluyen que es dependiente del operador y no puede utilizarse para evaluar las estructuras articulares más profundas ni el hueso subcondral.19
El ultrasonido Doppler ofrece la ventaja de evaluar la vasculatura, así como integrar técnicas específicas para evaluar el grosor del cartílago;13 sin embargo, sólo se recomienda para la evaluación de tejidos periarticulares (partes blandas) y articulares en caso de afección localizada (rodilla y hombro). (CGE)
En pacientes con sospecha de osteoartritis ¿está recomendada la realización de artrocentesis?
Recomendación. La artrocentesis no está indicada para establecer el diagnóstico de osteoartritis y sólo debe realizarse cuando se sospecha otra enfermedad articular o artritis infecciosa (GR C).13
De igual manera, las complicaciones inherentes a este procedimiento (artritis séptica, osteomielitis) hacen que deba realizarse en un medio aséptico y por personal especializado.
En pacientes con sospecha de osteoartritis ¿cuál es la utilidad de la artroscopia?
Recomendación. El CGE no recomienda la artroscopia para fines de diagnóstico de osteoartritis; sin embargo, puede tener un papel importante en el diagnóstico en pacientes con gonalgia en quienes la osteoartritis es un diagnóstico diferencial porque ayuda a evaluar la integridad del cartílago articular (GR D).
Preguntas clínicas. Tratamiento
¿Es de utilidad modificar los factores de riesgo reconocidos de la osteoartritis?
Existen factores de riesgo modificables que pueden ayudar a prevenir la osteoartritis, incluso dar tratamiento en etapas tempranas que impida el progreso a etapas más graves. Estudios epidemiológicos sugieren que la obesidad está estrechamente relacionada con la aparición de la osteoartritis. Un estudio observó mayor riesgo de osteoartritis de rodilla en pacientes con índices elevados de masa corporal.25 En un estudio de seguimiento utilizando la misma población, el riesgo de osteoartritis se redujo después de la pérdida de peso, donde una pérdida de 10 libras de peso durante 10 años disminuyó la probabilidad de osteoartritis de rodilla en 50%. La relación entre el grado de pérdida de peso y la reducción de la incidencia de osteoartritis fue lineal, lo que sugiere que incluso una modesta pérdida de peso puede ser benéfica.25 La obesidad puede ser el factor de riesgo modificable más fuerte de osteoartritis, pero el riesgo varía según la articulación. La asociación es más fuerte para las rodillas y las manos, pero es menos consistente para la cadera. Es probable que incluso una modesta pérdida de peso proporcione algún beneficio en la modificación del riesgo.25
Las recomendaciones de ejercicio en pacientes con osteoartritis tienen como objetivo reducir el dolor en las articulaciones y mejorar la función física. La mayor parte de los estudios apoyan un programa de ejercicios como parte integral del manejo óptimo y multidisciplinario de la osteoartritis. Varios factores deben considerarse en la creación de un programa de ejercicio individualizado para un paciente con osteoartritis. Éstos incluyen la gravedad y manifestaciones específicas de la enfermedad en el paciente y la inactividad impuesta por la artritis.25
Abordar el efecto social y psicológico de la osteoartritis en el paciente es una preocupación terapéutica decisiva, como lo es en otras enfermedades crónicas. Pueden aparecer limitaciones físicas, sentimientos de frustración, dependencia y depresión clínica. Estos elementos pueden reducir la motivación del paciente para cumplir con los aspectos del plan terapéutico que incluyen dieta, ejercicio y apego al tratamiento farmacológico.25
La evaluación del paciente debe incluir los mecanismos para afrontar la enfermedad, como la negación. Evaluar al paciente en cuanto a los síntomas de depresión y proporcionar la información y la terapia antidepresiva cuando sea necesario también es importante para el tratamiento de los pacientes con osteoartritis. La educación de los pacientes debe incluir información de la enfermedad, las limitaciones físicas, las opciones terapéuticas y los riesgos y beneficios de los diferentes enfoques terapéuticos.25
Evidencia. Se ha demostrado que la pérdida de peso en pacientes con osteoartritis de rodilla alivia los síntomas y posiblemente mejore el pronóstico funcional en el largo plazo. El fortalecimiento muscular dirigido en pacientes con osteoartritis de rodilla puede ser benéfico en el control de los síntomas y probablemente en la disminución de la progresión de la enfermedad (NE 1+).26
Recomendación. Se recomienda que los pacientes con sobrepeso y síntomas de osteoartritis de rodilla disminuyan al menos 5% su peso corporal y se mantengan con un adecuado programa de ejercicio y alimentación (GR A).26
En pacientes con osteoartritis ¿cuál es la importancia del manejo psicológico como parte del tratamiento no farmacológico?
Evidencia. El manejo psicológico es un aspecto fundamental para el buen control y seguimiento en el paciente con osteoartritis porque es uno de los padecimientos que genera mayores episodios de ansiedad, angustia y, a largo plazo, depresión. Deberá consistir en:
- Involucramiento familiar.
- Participación en grupos de apoyo.
- Acompañamiento terapéutico: consiste en ayudar al paciente a aceptar su diagnóstico y acompañarlo durante su tratamiento.
El TEP (Technical Expert Panel) del Colegio Americano de Reumatología recomienda que los pacientes con osteoartritis de rodilla deben participar en programas de autoayuda que incluyan intervenciones psicosociales como parte del tratamiento no farmacológico (NE 2++).27
En pacientes con diagnóstico de osteoartritis ¿el paracetamol es el tratamiento de primera elección?
Evidencia. Se deben prescribir agentes farmacológicos para el tratamiento de la osteoartritis en pacientes con síntomas y que no han respondido adecuadamente a las medidas no farmacológicas iniciales. El principal fármaco prescrito en el tratamiento inicial de la osteoartritis es el paracetamol. El tratamiento no es necesario durante los periodos en que los síntomas están ausentes o son mínimos, porque la administración del fármaco no ha demostrado modificar el curso de la enfermedad; sin embargo, es posible iniciar un tratamiento con paracetamol basado en la necesidad de los pacientes cuando carecen de signos o síntomas de inflamación y si esto no es suficiente debe valorarse la administración de paracetamol de manera regular hasta tres o cuatro veces al día (NE 4).25 En la (Figura 5) se muestra el algoritmo para el tratamiento de la osteoartritis.
Existe gran diversidad de estudios que demuestran baja eficacia del tratamiento del dolor en comparación con los AINE; sin embargo, aún se considera de primera elección.28,29 Estudios recientes cuestionan el perfil de seguridad cardiovascular, renal y gastrointestinal del paracetamol, con incremento en la mortalidad y en el riesgo de eventos adversos cardiovasculares en estudios de cohortes en pacientes con más de 22 días/mes de administración de paracetamol (NE 2).30
Recomendación. El paracetamol constituye el fármaco de primera línea para el tratamiento del dolor leve a moderado en osteoartritis (GR A)13 Su máximo efecto sobreviene entre la primera y la cuarta semanas de administración.28 Las guías EULAR (European League Against Rheumatism) recomiendan el paracetamol para analgesia a largo plazo (GR A).31 Sus contraindicaciones relativas son en pacientes con hepatopatía, alcoholismo y los que reciben de manera concomitante anticoagulantes (debe vigilarse el tiempo de protrombina o INR en pacientes que toman warfarina) (GR A)32 Su contraindicación absoluta es la existencia de daño hepático severo. La dosis recomendada de paracetamol es de 500 a 1000 mg cada 6 horas (GR A).30
¿Cuándo debe considerarse la administración de otros analgésicos?
Evidencia. En pacientes que no muestren alivio de los síntomas con paracetamol debe considerarse la administración de otros medicamentos como los AINE (NE 1+, GR A).32
En pacientes con osteoartritis ¿son de utilidad los analgésicos tópicos para el control del dolor?
Evidencia: Una revisión sistemática de Cochrane de 2016 señala que el diclofenaco y el ketoprofeno tópicos pueden proporcionar buenos niveles de alivio del dolor en la osteoartritis, pero solamente para una minoría de pacientes (NE 1++, GR A).33
Recomendación. Se recomienda su administración en las primeras dos semanas del tratamiento (NE 1-, GR B).34 La OARSI (Osteoarthrtitis Research Society International) recomienda la administración de AINE tópico como analgésico para el tratamiento de la osteoartritis sintomática como terapia alternativa o complementaria en pacientes que no respondieron a paracetamol. Las guías EULAR los recomiendan en osteoartritis de mano. La AAOS (American Association of Orthopaedic Surgeons) los recomienda en osteoartritis de rodilla con riesgo elevado de hemorragia de tubo digestivo.35 Se recomienda la administración de metilsalicilato, dos a cuatro veces al día, en conjunto con otras medidas terapéuticas (NE 1-, GR B).36 El TEP (Technical Expert Panel) del Colegio Americano de Reumatología los recomienda en pacientes con osteoartritis en los que no se observó mejoría con una dosis tope de 4 g/día de paracetamol.13
En pacientes con osteoartritis ¿cuál es la utilidad de los AINE para el control del dolor?
Recomendación. Se recomiendan en pacientes en quienes el tratamiento con paracetamol no logró alivio de los síntomas y deben administrarse en la dosis mínima eficaz para evitar o reducir los efectos secundarios (NE 1+, GR A).36-38 Los pacientes con dolor moderado tienen mayor beneficio al recibir un AINE (Figura 5).39 El porcentaje de eficacia de los diferentes AINE no selectivos varía de acuerdo con la sal. Tienen efectos benéficos en el control del dolor, pero no disminuyen la progresión de la enfermedad. No hay estudios que demuestren que un AINE sea superior a otro en el control del dolor (NE 2+ GR A).34
Debe vigilarse la posibilidad de hemorragia digestiva, toxicidad renal, alteraciones en la coagulación y posible elevación de las cifras de presión arterial. Las contraindicaciones absolutas son: administración concomitante de anticoagulantes o en pacientes que se hayan sometido de manera reciente a cirugía de revascularización o bypass coronario.40
Evidencia: El diclofenaco y el ibuprofeno son los AINE con menor riesgo de generar hemorragia digestiva,41 aunque esto es controvertido y la evidencia reciente apunta que dosis altas de ibuprofeno (igual o mayores a 2400 mg) se relacionan con mayor riesgo de trombosis arterial (NE 4, GR D).42 También existe una advertencia de la Dirección de Alimentos y Fármacos de Estados Unidos acerca de que los AINE tradicionales incrementan los riesgos cardiovasculares, principalmente de infarto, por lo que se debe alertar a los pacientes en caso de tener dolor torácico o disnea.43
Se han realizado estudios con ciertos AINE para ver el tiempo en que inician su acción y se ha observado que ketoprofeno tiene una ventaja farmacocinética que le permite tener un efecto inicial analgésico/antiinflamatorio de 16 a 30 min y efecto analgésico de 12 a 24 h.44
Recomendación. El tiempo de administración recomendado es variable. Se recomienda durante el menor tiempo posible con estrecha vigilancia médica debido a su toxicidad gastrointestinal y renal. Para evitar afección gástrica es conveniente su administración con protectores de la mucosa o inhibidores de la bomba de protones (IBP) como omeprazol 20 a 40 mg/día o misoprostol 400 a 800 µg/día (NE 1+, GR A). Otros inhibidores de la bomba de protones, como pantoprazol y lanzoprazol, también son efectivos. Los antagonistas H2, como ranitidina, no han comprobado su eficacia en la protección de la mucosa gástrica.28,36,40 Hay estudios que comprueban que aun con la administración de un AINE con inhibidores de la bomba de protones puede haber hemorragia crónica del tubo digestivo y daño a la mucosa, especialmente en el intestino delgado; se ha demostrado que este riesgo es menor con la administración de COX-2 (NE 1+, GR A).45
Un estudio de casos y controles demostró que el riesgo de infarto agudo de miocardio no mortal varió entre los AINE individuales, la duración del tratamiento y el riesgo cardiovascular de fondo. Sin embargo, el riesgo varió entre los distintos AINE, con ibuprofeno (0.95; 0.78-1.16) en el intervalo inferior y aceclofenaco (1.59; 1.15-2.19) en el superior. Las dosis bajas de aspirina no modificaron el perfil de riesgo mostrado por los AINE individuales examinados. El paracetamol, el metamizol y los fármacos sintomáticos de acción lenta no aumentaron el riesgo en ninguna de las afecciones examinadas.46
¿Cuándo se considera la administración de inhibidor selectivo COX-2 sobre un AINE?
Evidencia. Se consideran los fármacos de primera elección en dolor moderado a severo o con componente inflamatorio donde los analgésicos simples no son efectivos o cuando el riesgo de hemorragia digestiva es muy elevado. Incluso muchos sujetos con osteoartritis requieren dosis bajas de ácido acetilsalicílico por sus efectos cardioprotectores, por lo que no es recomendable su administración concomitante con un AINE (NE 1+, GR A).45 Son especialmente útiles en los pacientes con tendencia a problemas gástricos pero sin trastornos cardiovasculares debido a un mejor perfil de seguridad gastrointestinal (CGE).
En el estudio SCOT se evaluó la seguridad del cambio de AINE a celecoxib en 7297 pacientes mayores de 60 años con osteoartritis o artritis reumatoide pero sin antecedente de enfermedad cardiovascular y que tomaban AINE tradicionales prescritos de manera crónica. Se tuvo media de seguimiento de tres años y se llegó a la conclusión de que los eventos cardiovasculares fueron poco frecuentes y similares entre celecoxib y AINE (NE 1+).47
En el estudio PRECISION, publicado en diciembre de 2016, se observó que el riesgo de eventos gastrointestinales o renales fue menor con celecoxib que con naproxeno, también se observó que con dosis moderadas de celecoxib en comparación con naproxeno e ibuprofeno, el riesgo de eventos cardiovasculares fue similar (NE 1+).48
Celecoxib y etoricoxib son los más prescritos en México. Un estudio con asignación al azar, multicéntrico, doble ciego e internacional, evaluó la eficacia de la administración continua de celecoxib vs intermitente. Demostró que 200 mg de celecoxib de manera continua fueron más eficaces que su administración intermitente en la prevención de episodios de exacerbación del dolor en pacientes con osteoartritis de rodilla o cadera. En general, los efectos adversos (que incluyeron trastornos gastrointestinales e hipertensión) fueron similares entre los dos grupos de tratamiento. Asimismo, el celecoxib en administración continua demostró mejoría de la función física y reducción del dolor (NE 2++).45 Se recomienda la administración de celecoxib a dosis de 100 a 200 mg cada 24 h o etoricoxib a dosis de 30 a 60 mg cada 24 horas.
En pacientes con osteoartritis ¿están indicados los analgésicos opioides?
Evidencia. Los prescritos con más frecuencia son tramadol, buprenorfina (su presentación en parche se recomienda para administración crónica) codeína y oxicodona. Tramadol ha demostrado ser una alternativa terapéutica a dosis de hasta 200 mg/día por vía oral (NE 1B).40 La administración de 300 mg de tramadol una vez al día en el tratamiento del dolor moderado a severo secundario a osteoartritis de rodilla, cadera o ambas se relacionó con mejoría significativa en comparación con placebo (NE 2++).49 La oxicodona ha demostrado que mejora la movilidad para la deambulación (NE 2++).50
Recomendación. Se recomienda sobre todo en cuadros dolorosos severos o exacerbaciones, así como en pacientes con contraindicaciones para recibir los inhibidores selectivos de COX-2 o AINE, además de pacientes que no han respondido al tratamiento oral previo (paracetamol, AINE o ambos) (GR A).49,51 También son útiles en pacientes con osteoartritis y cardiopatía isquémica. En un estudio realizado en población sin artritis inflamatoria o con osteoartritis sin artritis reumatoide, se administraron etoricoxib y diclofenaco para tratamiento del dolor; se encontró que se incrementaba el riesgo de eventos cardiovasculares en la población estudiada si el paciente ya tenía comorbilidades cardiovasculares; el riesgo de otro evento cardiovascular fue del doble que el de la población no afectada.52 Se recomienda su administración en pacientes con cuadros de dolor severo en quienes la cirugía está contraindicada (NE 3).32 Se recomienda la administración de tramadol a dosis de 50 mg cada 6 a 8 h o buprenorfina a dosis de 0.2 a 0.4 mg cada 6 a 8 h (GR A).49
La administración de los analgésicos opioides no se recomienda por periodos prolongados y generalmente no son bien tolerados debido a sus efectos secundarios, entre los que destacan náusea, vómito, somnolencia y estreñimiento (CGE).
En pacientes con osteoartritis ¿existe algún neuromodulador recomendado para el control del dolor?
Evidencia. La duloxetina ha demostrado alivio del dolor superior a 50% en osteoartritis de rodilla cuando se compara con placebo (p < 0.001) usando escalas como OMERACT-OARSI (Outcome Measures in Rheumatoid Arthritis Clinical Trials-Osteoarthrtitis Research Society International), MCII (Minimal Clinically Important Improvement) y PASS (Patient Acceptable Symptom State),48 y es el único neuromodulador aceptado por la Dirección de Alimentos y Fármacos de Estados Unidos como coadyuvante para el tratamiento de osteoartritis de rodilla a dosis de 60 a 120 mg cada 24 h (NE 1B).53 Entre sus reacciones adversas más frecuentes están hiperhidrosis, cefalea, náusea, estreñimiento, somnolencia y fatiga. No debe administrarse a pacientes con glaucoma ni de manera concomitante con omeprazol.54
En el tratamiento farmacológico de la osteoartritis ¿son de utilidad los fármacos sintomáticos de acción lenta (SYSADOA)?
Evidencia. Son medicamentos que en algunos estudios han mostrado la posibilidad de retrasar el progreso de la enfermedad, su administración ayuda a disminuir el dolor y mejorar la funcionalidad (NE 3).32
Recomendación. Su indicación es en osteoartritis temprana (GR D).32 Estos fármacos se clasifican en dos grupos: SMOAD (symptom modifying osteoarthritis drugs) y DMOAD (diseases modifying osteoarthritis drugs).
En el tratamiento farmacológico de la osteoartritis ¿cuál es la utilidad de los SMOAD (symptom modifying osteoarthritis drugs)?
Evidencia. Los SMOAD actúan sobre los síntomas sin modificar los tejidos articulares. Existe evidencia de que su administración durante seis semanas ayuda a la disminución del dolor y mejora la funcionalidad de la articulación (NE 2++).55,56 La mayor parte de los metanálisis han demostrado que proveen alivio sintomático mínimo y solamente en osteoartritis de rodilla (NE 1).26 Se ha comparado su efecto analgésico con paracetamol. En un estudio con distribución al azar, doble ciego, realizado en pacientes con oateoartritis moderada de rodilla, se encontró que el sulfato de glucosamina administrado a dosis de 1500 mg/día durante seis meses mostró 39.6% de respuesta favorable valorada por el cuestionario WOMAC (p 0.004 vs placebo) vs 33.3% con paracetamol (p 0.047 vs placebo) (NE 2++).57
En uno de los mayores estudios realizados en el que se compararon glucosamina, condroitín y celecoxib, cada uno y combinados, no hubo beneficio en el dolor, en cambio, celecoxib mostró ser superior que placebo mostrando 10% más alivio del dolor en comparación con placebo (NE 1+).58 Una revisión de ensayos con distribución al azar encontró que condroitín (solo o en combinación con glucosamina) fue mejor que placebo a corto plazo en cuanto a la disminución del dolor en pacientes con osteoartritis y tuvo menor riesgo de eventos adversos graves (NE 2++).59
Asimismo, el estudio MOVES publicó en 2016 los resultados de un estudio multicéntrico doble ciego en pacientes con osteoartritis de rodilla que mostró que el sulfato de condroitín a dosis de 400 mg combinado con hidrocloruro de glucosamina a dosis de 500 mg y tomado tres veces al día durante seis meses, tiene eficacia similar al celecoxib en cuanto al dolor, rigidez matutina, limitación de la movilidad por dolor y en el derrame articular (NE 1+).60 Otro estudio multicéntrico doble ciego controlado con placebo incluyó 605 pacientes de 45 a 75 años de edad con osteoartritis que se evaluaron durante dos años con cuatro esquemas: sulfato de condroitín a dosis de 800 mg, glucosamina a dosis de 1500 mg, la combinación de ambos y placebo. Se observó que la combinación de glucosamina-condroitín dio lugar a la reducción estadísticamente significativa en el estrechamiento del espacio articular a los dos años (diferencia media 0.10 mm [IC95%: 0.002-0.20 mm]). Mientras que en todos los grupos de asignación demostraron reducir el dolor en la rodilla durante el periodo de estudio, ninguno de los grupos de asignación de tratamiento demostró un beneficio sintomático significativo por encima del placebo (NE 1+).61
Un estudio observacional con distribución al azar y controlado con placebo evaluó pacientes con osteoartritis de rodilla durante cinco años a quienes se les administró glucosamina 1500 mg/día. Se observó que la incidencia de reemplazo total de rodilla (RTR) a cinco años en los pacientes que habían tomado durante al menos 12 meses sulfato de glucosamina fue menor que en los que habían recibido placebo (6.3 vs 14.5%) (p 0.0024) (NE 1+).51
En un metanálisis se concluyó que la administración de sulfato de glucosamina durante tres años retarda la progresión radiológica en los pacientes con osteoartritis de rodilla debido a su efecto protector del espacio articular (SMD -standard mean difference- 0.432, IC95% 0.235-0.628, p < 0.001), efecto no obtenido a los seis meses de su administración.62 Anteriormente un estudio analizó los cambios radiológicos en pacientes con osteoartritis a quienes se administró sulfato de glucosamina a dosis de 1500 mg/día vs placebo durante tres meses. Los resultados mostraron que los pacientes que recibieron placebo tuvieron estrechamiento del espacio articular a diferencia de los que recibieron sulfato de glucosamina, en quienes no se mostró diferencia del espacio articular antes y después de los tres años de tratamiento. Al finalizar los tres años de seguimiento, la diferencia del espacio articular entre ambos grupos fue de 0.36 mm (IC 95% 0.13-0.59 mm). Los cambios radiográficos del espacio articular se midieron en el compartimento medial de la articulación tibiofemoral (NE 2++).63
El sulfato de condroitín es el principal glucosaminoglucano del cartílago, que además de prevenir la pérdida del condrocito genera un equilibrio positivo en el anabolismo/catabolismo del cartílago y la matriz extracelular, disminuye los factores inflamatorios y la resorción de los osteoblastos en el hueso subcondral. Hay evidencia mínima en el control del dolor y pocos estudios, aunque son heterogéneos, han mostrado mejor pronóstico (NE 2++). Sus resultados son muy similares a lo reportado respecto a la glucosamina. En otro estudio piloto se mostró en imagen de resonancia magnética en pacientes con osteoartrosis de rodilla que la administración de condroitín se relaciona con cambios estructurales (p 0.03) a los seis meses de administrarse.64 Un metanálisis demostró que la administración de sulfato de condroitín durante dos años retarda la progresión radiológica de los pacientes con osteoartrosis de rodilla debido a su efecto protector del espacio articular (SMD 0.261, IC95% 0.131-0.392, p < 0.001).62 Otro estudio mostró que luego de su administración durante dos años a dosis de 800 mg, se observó disminución significativa (p < 0.0001) de la pérdida del espacio articular tibio femoral (error estándar de la media ± 0.07 ± 0.03 mm) vs placebo (-0.31 ± 0.04 mm). El porcentaje de pacientes con progresión radiográfica ≥ 0.25 fue menor en el grupo que recibió sulfato de condroitín vs placebo (28 vs 41%, p<0.0005), RR de reducción de 33% (IC95%16-46%) (NE 2++).64
Acerca de su mecanismo de acción se ha postulado que ejerce propiedades antiinflamatorias acoplándose a los receptores de membrana, como el CD44, TLR4 e ICAM1, con doble efecto resultante: impiden que los fragmentos de matriz extracelular se acoplen a estos receptores, causen reacción inflamatoria y bloqueen las vías de transducción de señales activadas por los fragmentos y disminuyan así la translocación nuclear de factores de transcripción proinflamatorios. También se señala que el condroitín es una molécula grande que no penetra en los condrocitos, sinoviocitos, osteoblastos, osteoclastos u osteocitos y pudiera ser más útil en etapas tempranas de la osteoartritis, asimismo, la glucosamina sí puede penetrar estas células y pudiera tener efectividad aún en las fases tardías de la enfermedad (NE 2+).65
En un estudio con distribución al azar, doble ciego, controlado con placebo, realizado en 2011 con 162 pacientes, se demostró que después de seis meses de tratamiento con una mezcla de condritín-4-sulfato y coindrotín-6-sulfato, los pacientes con osteoartritis sintomática severa en las manos mostraban reducción del dolor y de la rigidez matinal, además de mejoría de la actividad funcional.66 Asimismo, la evidencia apunta que la combinación de glucosamina más condroitín sulfato mostró mayor eficacia sintomática en comparación con la medición basal.67
Recomendación. El CGE que realizó esta actualización sugiere que el sulfato de glucosamina y el condroitín ejercen un efecto benéfico en los síntomas del paciente con osteoartritis de rodilla; sin embargo, la recomendación es que, si a los seis meses de tratamiento la mejoría no es notoria, deben suspenderse (CGE).
En el tratamiento farmacológico de la osteoartritis ¿cuál es la utilidad de los DMOAD (diseases modifying osteoarthritis drugs)?
Evidencia. En estudios experimentales se ha demostrado que los inhibidores de las agrecanasas disminuyen la fragmentación de los agrecanos y de los glucosaminoglucanos, pero no hay estudios de metanálisis o ensayos con distribución al azar al respecto que recomienden su administración (NE 4).68
La utilidad clínica de los inhibidores de las metaloproteinasas de matriz (MMP) ha sido limitada por los efectos adversos dependientes de la dosis y su duración. Los efectos adversos frecuentemente reportados son rigidez en las articulaciones, inflamación, dolor en las manos, los brazos y los hombros en un fenómeno denominado síndrome músculo-esquelético, que se revierte al interrumpir el tratamiento. Ninguna MMP específica se ha implicado y se cree que la inhibición no selectiva de múltiples MMP es la principal causa de esta toxicidad. Los datos de la MMP-13-transgénica en animales indican que la MMP-13 induce anormalidades características de la osteoartritis en humanos (NE 4).69
¿Cuál es la utilidad de la viscosuplementación en osteoartritis?
Evidencia. Existen dos tipos de viscosuplementos, los hialuronatos y el hilano G-F 20, ambos con resultados heterogéneos. Se han indicado como tratamiento coadyuvante en los pacientes que han tenido poca respuesta al tratamiento primario con AINE y fármacos sintomáticos de acción lenta (SYSADOA), así como en los pacientes con síntomas y que están en espera de cirugía de reemplazo articular. El fundamento clínico primordial de la viscosuplementación consiste en la inyección intraarticular de ácido hialurónico (AH) exogéno con el fin de reemplazar (subsanar) el déficit de éste que ocurre en la osteoartritis, estimular la producción de ácido hialurónico endógeno70 y, con ello, mejorar la calidad del fluido sinovial y la del cartílago articular.71 A esta restauración de las propiedades mecánicas del cartílago y el fluido sinovial se suman otros efectos biológicos bien documentados en pacientes osteoartríticos que reciben viscosuplementación,72 entre los que destaca la estimulación de receptores articulares específicos que contribuye con el estímulo para la síntesis de componentes de la matriz del cartílago articular, la reducción en la producción de enzimas condrodegenerativas inducidas por citocinas y la estimulación de un metabolismo sano de los condrocitos, la modulación de la acción antiinflamatoria y la promoción de efectos antioxidantes, y la producción de efectos analgésicos directos relacionados con el enmascaramiento de los nociceptores articulares.70,72
Cada uno de los diferentes tipos de viscosuplementos aprobados para administración terapéutica por la Dirección de Alimentos y Fármacos de Estados Unidos cuenta con propiedades que lo distinguen del resto; las características diferenciales entre viscosuplementos radican fundamentalmente en sus respectivos pesos y estructuras moleculares.73-75 Todos consisten en formulaciones de ácido hialurónico, aunque su estructura molecular puede ser lineal (por ejemplo, hialuronato sódico), reticulada (hilano G-F 20) o combinada (por ejemplo, con manitol o con condroitina);72 en función de su peso molecular, pueden ser de bajo peso molecular (BPM [0.5 a 3 millones de Da]: hialuronato sódico) o alto peso molecular (APM [> 3 millones de Da]: hilano G-F 20).73-75 La conjunción de un alto peso molecular intrínseco y una estructura molecular reticulada incrementa significativamente el peso molecular del compuesto (hasta 6 millones de Da), caso en el que se ubica el hilano G-F 20.
El estudio AMELIA evaluó el efecto del ácido hialurónico vs solución salina como inyección “placebo” en 306 pacientes con osteoartritis de rodilla (tiempo de evolución 7.5 años) y con calificación II-III en la escala de Kellgren-Lawrence. Los pacientes se distribuyeron al azar en cuatro ciclos de cinco inyecciones semanales. Se realizó el seguimiento durante seis meses posterior a la administración de los ciclos 1 y 2, y de un año después de los ciclos 3 y 4. A 40 meses de tratamiento, el grupo al que se administró ácido hialurónico tuvo mejor respuesta que el grupo placebo (22%, RR 1.22, IC95% 1.07 a 1.41). Además, el porcentaje de respuesta se incrementaba a medida que aumentaban los ciclos de administración de ácido hialurónico (71.1 a 80.5%), a diferencia del grupo placebo en quienes la respuesta fue muy similar a lo largo del estudio (67.8 a 65.8%). Los eventos adversos reportados fueron similares en ambos grupos de tratamiento, con incidencia aproximada de 8.3% (4.6% de eventos leves en el grupo que recibió ácido hialurónico vs 7.8% con placebo y 5.2% de eventos adversos moderados en el grupo de ácido hialurónico vs 1.3% con placebo), entre los más comunes se encontró sangrado en el sitio de la aplicación, dolor leve y en algunos casos reacción alérgica (NE 2++).76
Un metanálisis, cuyo objetivo fue evaluar el efecto terapéutico del ácido hialurónico intraarticular vs placebo en pacientes con osteoartritis de rodilla, demostró que a las cuatro semanas de tratamiento comienza a ser eficaz, a las ocho semanas alcanza su pico de eficacia y ejerce un efecto residual hasta la semana 24 de su administración. Asimismo, se ha demostrado que tiene mayor efecto pico (0.46, 0.28, 0.65) de analgesia en comparación con analgésicos (paracetamol [tamaño del efecto = 0.13, 0.04, 0.22], AINE [tamaño del efecto = 0.29, 0.22, 0.35], inhibidores de COX-2 [tamaño del efecto = 0.44, 0.33, 0.55]). Un tamaño del efecto por encima de 0.20 se considera clínicamente relevante en condiciones de dolor crónico, como la osteoartritis de la rodilla (NE 1+).77
Es probable que el ácido hialurónico tenga un efecto antiinflamatorio al interactuar, al igual que el condroitín, con diversos receptores de membrana (NE 2+).65,78
Un estudio controlado con placebo demostró en pacientes con osteoartritis de rodilla que una sola inyección intraarticular de 6 mL de hilano G-F 20 (más artrocentesis) generaba un alivio estadísticamente significativo del dolor (cambio absoluto desde el inicio a la semana 26 de -0.84) durante 26 semanas vs placebo (cambio absoluto desde el inicio a la semana 26 de -0.69, p 0.047, con porcentaje de cambio desde la basal de 29%) (NE 1+).79 Su efecto analgésico se evaluó en pacientes con osteoartritis que serían sometidos a reemplazo total de cadera, demostrando que debido al alivio sintomático que generaba, la probabilidad de progresar a un reemplazo total de cadera a 12, 24 y 60 meses disminuía en 92, 75.9 y 30.8%, respectivamente (NE 2++).80
También se han realizado estudios que relacionan su efecto analgésico con la conservación del cartílago. En un estudio en el que se administraron seis inyecciones mensuales de hilano G-F 20 en pacientes con osteoartritis sintomática de rodilla, se demostró su beneficio en la conservación del cartílago medido por el volumen y por la afectación del cartílago. Los cambios en el volumen del cartílago tibial, medial y lateral, después de 12 meses de su administración fueron de 1.4 ± 5.2% (p 0.21) y de 2.8 ± 6.8% (p 0.05), respectivamente vs 3.3 ± 4.4% (p < 0.001) y de 1.0 ± 5.9% (p 0.37) del grupo control.81 Un análisis de 18 estudios reportó la eficacia de la viscosuplementación en 3689 pacientes con osteoartritis de rodilla. Compararon la eficacia de la viscosuplementación con hilano G-F 20 contra otros productos de pesos moleculares bajo, alto y medio, corticoesteroides, AINE y terapia física. La suplementación con hilano G-F 20 demostró alivio del dolor de 71 ± 11.6 a 86.7 ± 11.6 vs 66.7 ± 11 a 86.6 ± 9.1 (grupo de bajo peso molecular) al finalizar el estudio (p 0.01). En cuanto al manejo del dolor, a las 12 semanas no demostró un efecto superior a los AINE, pero sí fue significativamente mejor a las 26 semanas de su administración (NE 2++).82
En un muy alto espectro de frecuencias de evaluación (0.001 a 10 Hz), hilano EG-F 20 tiene viscoelasticidad superior a la de las formulaciones de bajo peso molecular (BPM), y sus propiedades reológicas son las más semejantes (respecto del resto de viscosuplementos) a las del ácido hialurónico del fluido sinovial nativo de jóvenes humanos sanos.83,84 En tanto que las formulaciones de ácido hialurónico lineales y de BPM se unen rápidamente tras la infiltración a proteínas específicas denominadas hialaderinas -lo que modifica su conformación estructural y disminuye la potencia de sus propiedades fisicoquímicas y biológicas-, la estructura reticulada y el alto peso molecular de hilano G-F 20 atenúan la unión a hialaderinas, lo que resulta en que este viscosuplemento conserve durante más tiempo sus propiedades hidrofílicas, reológicas y viscoelásticas.73
Recomendación. La administración intraarticular de hilano G-F 20 y ácido hialurónico constituye un tratamiento seguro en los pacientes con osteoartrosis de rodilla, así como una opción terapéutica eficaz que también puede reducir los costos directos e indirectos relacionados con la enfermedad (GR B).82 La AAOS (American Association of Orthopaedic Surgeons), el Colegio Americano de Reumatología y la EULAR (European League Against Rheumatism) reconocen la ventaja de la administración de ácido hialurónico o hilano en los pacientes con respuesta inadecuada a pesar de las terapias no farmacológicas, analgésicos tópicos o AINE o en los que son incapaces de tolerar o no pueden tomar AINE/COX-2 (GR B).13
En pacientes con osteoartritis ¿cuál es el nivel de eficacia de la aplicación de glucocorticoides intraarticulares (GIA)?
Evidencia. Están bien establecidos los beneficios de los glucocorticoides intraarticulares en el corto plazo, pero, al igual que ocurre con los opioides, no ha sido posible evaluar sus efectos en tratamientos de largo plazo; los datos son consistentes sólo para las semanas 1 a 3 de tratamiento, pero confusos para las semanas 4 a 24 y los resultados más significativos provienen de los análisis de tratamientos de únicamente una semana, entre ellos el de mayor eficacia vs placebo para la reducción del dolor (DME: -17.79, favorable para los glucocorticoides intraarticulares [IC95%: 25.02 a 10.55]) y el de disminución -en la perspectiva del paciente, al final de la primera semana de tratamiento- en el riesgo de nuevos episodios de dolor (RR: 1.44; IC95%: 1.13 a 1.82),85 por ello, son eficaces en brotes inflamatorios agudos, sobre todo de afección monoarticular (NE 2+, GR B).26 Su eficacia puede mejorar mediante el reposo total en cama de la articulación tratada durante 72 horas (NE 3, GR B).82 Los más prescritos son dipropionato de betametasona y acetato de metilprednisolona. Los esteroides sistémicos no están indicados en pacientes con osteoartritis (NE 1+, GR A).51
No hay evidencia disponible para determinar el efecto benéfico clínicamente importante de los corticoesteroides intraarticulares más allá de las seis semanas ni de los efectos de éstos en la calidad de vida en comparación con el control.86 Las principales desventajas relacionadas con la administración de glucocorticoides intraarticulares son85,87
Su eficacia para la disminución del riesgo de nuevos episodios de dolor disminuye en el transcurso del tiempo: si bien al final de la semana 1 de la inyección el RR equivale a 1.44, a las dos semanas de tratamiento el riesgo se incrementa (RR: 1.81; IC95%: 1.09 a 3.00) y es todavía mayor a las tres semanas (RR: 3.11; IC95%: 1.61 a 6.01).
Estos fármacos no han demostrado eficacia suficiente para la mejoría de la función articular.
En pacientes con osteoartritis ¿son de utilidad los ácidos grasos no saponificados de soya y aguacate?
Evidencia: Hay estudios que han demostrado disminución del dolor en osteoartritis de rodilla y cadera, pero se efectuaron en cohortes pequeñas. La administración de estas sustancias no mejora el pronóstico de la enfermedad, aunque una ventaja es la ausencia de eventos adversos (NE 2+).88 Un metanálisis de Cochrane de 49 estudios con distribución al azar, controlados, seis de ellos con referencia al producto ASU Piasclidine®, mostró evidencia de calidad moderada en cuatro estudios (651 participantes) e indicó que ASU 300 mg produjo un pequeño y clínicamente cuestionable alivio de los síntomas y, probablemente, ningún aumento de los efectos adversos en comparación con el placebo después de 3 a 12 meses de tratamiento. No hubo mejoría radiográfica en comparación con el placebo. En este mismo metanálisis encontraron un estudio con moderada evidencia con 156 sujetos participantes donde 600 mg del producto ASU Piascledine® fueron superiores a placebo. Asimismo, en este metanálisis de Cochrane los autores encontraron otro estudio de baja calidad de 357 pacientes donde no hubo diferencia en los síntomas o eventos adversos en comparación con condroitín. No hay evidencia de que ASU Piasclidine® prevenga el deterioro del espacio articular (NE 1+).89
En pacientes con osteoartritis ¿cuál es la utilidad de la diacereína?
Evidencia. Es un fármaco inhibidor de IL-1 que ha mostrado disminución del dolor (0.24, IC95% 0.08 a 0.39) y mejoría de movimiento en osteoartritis de rodilla (NE 1b).51
En la revisión de Cochrane de 2014, los autores concluyen en su metanálisis que la fuerza de la evidencia es débil a moderada. Se confirmó que el beneficio sintomático, en términos de reducción del dolor con la diacereína, es mínimo. El beneficio observado en el estrechamiento del espacio articular es cuestionable y este beneficio solamente se observó en osteoartritis de cadera. Con respecto a los efectos adversos de la diacereína, la diarrea fue el más frecuente.90
Recomendación. El CGE establece su utilidad como una alternativa de tratamiento para pacientes con osteoartritis que no toleran otros analgésicos por sus reacciones secundarias o, bien, cuando el control del dolor ha sido nulo. Se asocia con mayor riesgo de diarrea y el beneficio a más de seis meses de administración se desconoce. La dosis recomendada es de 100 mg al día (GR D).
En pacientes con osteoartritis ¿cuál es la utilidad de los péptidos de colágeno bioactivo?
Evidencia. Varios suplementos nutricionales se han investigado para el tratamiento de los pacientes con osteoartritis y dolor articular. Entre los más estudiados está el péptido de colágeno bioactivo, que es un regenerador tisular que aumenta los proteoglucanos de manera experimental al incrementar de manera significativa la biosíntesis de colágena tipo II en los condrocitos de cultivo celular de cartílago bovino.91 Ha mostrado generar el aumento en la síntesis de proteoglucanos (hasta en 1.6 veces después del tratamiento, p < 0.05), así como incremento significativo en la expresión del ARN de los agrecanos (p < 0.05) y la acumulación pronunciada de agrecanos en la matriz extracelular (NE 2+, GR C).92Se ha demostrado que el colágeno hidrolizado aumenta la síntesis de macromoléculas en la matriz extracelular por los condrocitos (p < 0.05 vs grupo control). En una revisión de cuatro estudios abiertos y tres estudios doble ciego se demostró que el colágeno hidrolizado, además de ser seguro, proporciona reducción importante del dolor, del consumo de analgésicos y mejoría en la funcionalidad en pacientes con osteoartritis de rodilla al tomarlo durante 12 semanas (NE 2+, GR C).93
Recomendación. Los estudios preclínicos y clínicos sugieren que el colágeno hidrolizado llega al cartílago articular estimulando la producción de matriz extracelular a partir de los condrocitos (GR C).93 Sin embargo, al momento de redactar esta guía y debido a la poca evidencia que hay aún en nuestro país y en todo el mundo, ninguna guía de osteoartritis (ACR, EULAR, OARSI) ha recomendado su administración de manera generalizada (CGE).
En pacientes con osteoartritis ¿cuál es la utilidad de la colágena-polivinilpirrolidona?
Evidencia. Escasos estudios muestran aparente alivio sintomático y en la actualidad está en fase experimental. No hay modificaciones con respecto a la guía anterior.3
Recomendación. Con la evidencia con la que se encuentra actualmente, este CGE no recomienda su administración (GR D).
¿Cuál es la utilidad en osteoartritis del plasma rico en plaquetas?
Evidencia. No se han reportado diferencias en los valores encontrados durante el seguimiento en cuanto al dolor, rigidez y capacidad funcional medidos con el índice WOMAC (p < 0.0001) en sujetos que han recibido plasma rico en plaquetas, ni tampoco en la puntuación total, la distancia y las actividades de la vida diaria medidas con el Índice de Lequesne, cambios en la puntuación de la EVA de dolor o del dominio SF-36 de la salud física (NE 2+).94 No hay modificaciones con respecto a la guía anterior.3
Recomendación. Debido a su poca evidencia, el CGE no puede emitir recomendación. Se necesitan más estudios para confirmar estos resultados (GR D).
En pacientes con osteoartritis ¿cuál es la utilidad de las células madre?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE no puede emitir recomendación porque se encuentra a nivel experimental. En teoría, disminuye la destrucción del cartílago por limitación de la respuesta inmunológica, mejora la movilidad y disminuye el dolor (GR D).
En pacientes con diagnóstico de osteoartritis de rodilla y cadera ¿está indicado el tratamiento quirúrgico?
Evidencia. El tratamiento quirúrgico debe darse a pacientes con dolor crónico y limitación funcional moderada a severa, que sean resistentes al tratamiento no quirúrgico y la misma debe realizarse antes de que progrese y se establezca limitación funcional y dolor intenso (NE 1).36
Recomendación. Los pacientes con osteoartritis de cadera o rodilla que no han obtenido control adecuado del dolor y mejoría funcional con la combinación de tratamiento farmacológico y no farmacológico deberán ser considerados para cirugía de reemplazo articular (GR B).36
En pacientes con osteoartritis ¿cuándo está indicada la corrección de deformidades por medio de osteotomía?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE establece que la osteotomía y el reemplazo de la articulación deben considerarse en adultos jóvenes con osteoartritis sintomática de rodilla, cadera o ambas, especialmente si hay displasia o cuando existen factores mecánicos susceptibles de ser corregidos mediante este tipo de procedimientos (o en ambas situaciones, tales como displasia acetabular residual en cadera, genu valgo o genu varo en rodilla (GR D).
En pacientes con osteoartritis de rodilla ¿cuándo está indicada la técnica artroscópica?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE establece que debe realizarse sólo en los pacientes que tengan artrosis incipiente vinculada con lesiones intraarticulares susceptibles de corrección, como lesiones meniscales o inestabilidad de ligamentos (GR D).
En pacientes con osteoartritis ¿cuándo está indicada la sinovectomía total para corrección de deformidades?
Recomendación. Debido a que hay muy poca evidencia que establezca la realización de sinovectomía artroscópica en osteoartritis y que ésta tiene un efecto muy limitado, el CGE no puede emitir un grado de recomendación.
En pacientes con osteoartritis ¿cuándo está indicada la liberación del retináculo para la corrección de deformidades?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE establece que, aunque es una técnica específica para realizar en casos de mal alineamiento patelofemoral antes de la existencia de artrosis, no puede emitir un grado de recomendación (GR D).
En pacientes con osteoartritis de rodilla ¿cuándo está indicada la condroplastia?
Evidencia. Las mejoría en la función y el alivio de los síntomas se han observado a casi 10 años, lo que demuestra la durabilidad a largo plazo de la reparación. Los factores predictivos en el resultado incluyen la edad del paciente y el estado de compensación. Por lo general, los pacientes aptos para este procedimiento tienen un defecto focal del cartílago que implica solamente un lado de la articulación (NE 2-).95
Recomendación. Todos los pacientes, especialmente los de edad avanzada, deben mantener una expectativa realista de mejoría general y la posible necesidad de una segunda intervención. Es poco probable que esta técnica sea útil en pacientes con degeneración articular avanzada. La mayoría de los pacientes que han recibido este tratamiento son personas jóvenes con defectos condrales causados por traumatismos (GR D).95
En pacientes con osteoartritis de rodilla ¿cuándo está indicada la meniscoplastia?
Evidencia. La menisectomía artroscópica parcial es una opción en pacientes con osteoartritis sintomática de rodilla que también tienen signos primarios y síntomas de desgarro del menisco (NE 3, GR C).26
Recomendación. A pesar de estudios que justifican su realización, no existe evidencia que sustente este tipo de manejo en osteoartritis. El CGE recomienda su realización únicamente como factor corrector de una lesión que, de no manejarse, predispone y acelera el proceso artrósico (GR D).
En pacientes con osteoartritis de mano ¿cuál es la cirugía ortopédica indicada en rizartrosis (artrosis trapecio-metacarpiana)?
Recomendación. No hay modificaciones con respecto a la guía anterior (GR D).3
En pacientes con osteoartritis de cadera ¿cuándo está indicada la colocación de prótesis?
Evidencia. No hay modificaciones con respecto a la guía anterior.3 Existen metanálisis y guías que establecen que las artroplastias son indudablemente el método de elección ante la falla del tratamiento no quirúrgico (NE 1+).26
Recomendación. El CGE la recomienda ante la falla de tratamiento no quirúrgico. Para revisar los diferentes procedimientos se recomienda revisar la guía previa (GR D).3
En pacientes con osteoartritis ¿cuáles son las medidas recomendadas de protección articular?
Los principios en los que debe estar basada la protección articular son:
- Educar y orientar al paciente acerca de la actividad o ejercicio deportivo que puede realizar desde la infancia hasta la edad adulta.
- Conocer la mecánica corporal evitando posturas forzadas.
- Disminuir las actividades que provoquen estrés articular en las manos, la cadera, las rodillas y los tobillos.
- Equilibrar el trabajo y el descanso articulares.
- Reducir el esfuerzo requerido de la articulación.
- Mantener una buena relación entre movilidad y fuerza muscular.
- Utilizar una órtesis adecuada únicamente cuando exista indicación terapéutica.
Evidencia. El uso de una rodillera en pacientes con osteoartritis leve o moderada puede reducir el dolor, mejorar la estabilidad y reduce el riesgo de caídas, OR 76% (IC95% 69 a 83). En una revisión Cochrane y en un estudio con asignación al azar, controlado, que comparó el uso del aparato ortopédico en valgo con una funda de neopreno más tratamiento médico vs tratamiento médico solo, mostró que el uso del aparato ortopédico más el tratamiento médico proporcionan mejoría en las puntuaciones de los índices WOMAC y del cuestionario MACTAR, en comparación con el tratamiento médico solo (NE 1A).30 El uso de plantilla lateral en cuña puede ser benéfico para pacientes con osteoartritis sintomática del compartimento tibio-femoral medial disminuyendo el dolor y mejorando la marcha, OR 77% (IC95% 66 a 88). El uso de cuñas laterales del talón no se ha recomendado para pacientes con osteoartritis sintomática del compartimento medial de la rodilla (NE 2).30
Recomendación. El uso de plantillas laterales no se recomienda en pacientes con osteoartritis sintomática del compartimento tibio-femoral lateral (GR B).30 La asistencia ambulatoria debe indicarse al paciente con osteoartritis de rodilla y cadera para la disminución del dolor, sobre todo en los pacientes con afección bilateral (GR C).30 Las medidas de protección articular son parte del programa de educación del paciente con osteoartritis y deben recomendarse (GR A).51
¿Cuáles son las órtesis preoperatorias más adecuadas para los pacientes con osteoartritis?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. En general, el uso de órtesis preoperatorias está recomendado sobre todo en rodilla, porque ayudan a la disminución del dolor (GR B).96
¿Cuál es el papel de la rehabilitación en los pacientes con osteoartritis?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. No hay modificaciones con respecto a la guía anterior.3 La rehabilitación debe recomendarse en todos los pacientes con osteoartritis. Sus objetivos están dirigidos a mantener y restaurar una función disminuida (GR B).97,98
En pacientes con osteoartritis ¿cuál es la importancia de la reeducación funcional, misma que es parte de los procesos de la rehabilitación y terapia ocupacional?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. Todos los pacientes con osteoartritis deben ser informados de los objetivos de su tratamiento y recibir educación de la importancia de los cambios en el estilo de vida, el ejercicio, el ritmo de las actividades, la reducción de peso y otras medidas para disminuir el daño en la articulación (NE 1+, GR A).30,99
En pacientes con osteoartritis ¿cuál es la función de los ejercicios isométricos, isotónicos e isocinéticos?
Evidencia. Las guías clínicas actuales establecen que el fortalecimiento muscular a través de ejercicios isométricos, isotónicos e isocinéticos, concéntricos y excéntricos, producen mejoría clínica y estadísticamente significativa en pacientes con osteoartritis y también contribuyen a reducir el sobrepeso, el dolor y la discapacidad (NE 1++).32,51 El ejercicio isocinético tiene mayor eficacia en comparación con el isométrico para fortalecer al músculo y disminuir el dolor en pacientes con osteoartritis de rodilla (NE 2-).100
Recomendación. No hay modificaciones con respecto a la guía anterior.3
En pacientes con osteoartritis ¿cuál es la función de la estimulación nerviosa eléctrica transcutánea (TENS)?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. No hay modificaciones con respecto a la guía anterior.3 Se recomienda la electroestimulación para el tratamiento del dolor en pacientes con osteoartritis (GR B).32,51,99
En pacientes con osteoartritis ¿cuál es la función de la magnetoterapia?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
En pacientes con osteoartritis ¿cuál es la función de la mecanoterapia?
Evidencia. No hay modificaciones con respecto a la guía anterior.3 Existen numerosos estudios controlados con asignación al azar que demuestran los beneficios significativos de la mecanoterapia en pacientes con osteoartritis, principalmente de mano y rodilla (NE 2+).
Recomendación. La mecanoterapia es recomendable en pacientes con osteoartritis, principalmente en alteraciones funcionales de la mano y rodilla (GR B).51
En pacientes con osteoartritis ¿cuál es la función de la termoterapia?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. No hay modificaciones con respecto a la guía anterior.3 La termoterapia no es útil en el tratamiento de pacientes con osteoartritis; sin embargo, existen guías clínicas que recomiendan su uso, especialmente utilizando calor (GR D).32,51
En pacientes con osteoartritis ¿cuál es la función de la fototerapia?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
En pacientes con osteoartritis ¿cuál es la función del ultrasonido terapéutico?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE recomienda su uso siempre y cuando vaya acompañado de medidas farmacológicas y otras modalidades de rehabilitación (GR D).
En pacientes con osteoartritis¿cuál es el efecto de la hidroterapia?
Evidencia. No hay modificaciones con respecto a la guía anterior.3
Recomendación. El CGE recomienda su uso siempre y cuando vaya acompañado de medidas farmacológicas y otras modalidades de rehabilitación (GR D).
En pacientes con osteoartritis ¿cuál es la utilidad del vendaje funcional?
Evidencia. No hay modificaciones con respecto a la guía anterior (NE 2, GR B).3,26
CONCLUSIONES
Durante la reunión de expertos y tras la revisión de la bibliografía se concluyó que la osteoartrosis es una enfermedad compleja que implica múltiples factores de riesgo, como la edad, la ocupación, los traumatismos, etc. En actualidad la osteoartrosis es la forma más común de artritis y en la mayoría de los pacientes se manifiesta con dolor articular y limitación funcional, por lo que los objetivos del tratamiento deben ser controlar el dolor y la inflamación y minimizar la discapacidad. El tratamiento es multidisciplinario y debe incluir un enfoque no farmacológico que proporcione educación al paciente, rehabilitación y ejercicio y un tratamiento farmacológico basado en analgésicos, como el paracetamol, los AINE y otras terapias que se añadirán de acuerdo con los síntomas o etapa de la enfermedad en la que se encuentre el paciente. Debe insistirse en la necesidad de crear una cultura preventiva en los médicos tratantes de osteoartrosis, en la que se eduque y se dé información al paciente para evitar que la enfermedad progrese.
Exoneración
El nivel de evidencia y las recomendaciones sobre la Guía de práctica clínica basada en la evidencia para el diagnóstico y tratamiento de la osteoartritis fueron desarrollados por los especialistas reunidos con ese fin con apoyo irrestricto de Sanofi Aventis de México. El grupo de expertos mantuvo su autonomía e independencia para la revisión sistemática, la selección del panel de preguntas para el análisis de la evidencia científica y la emisión del documento final.











 nueva página del texto (beta)
nueva página del texto (beta)