ANTECEDENTES
La prevalencia mundial de sobrepeso (índice de masa corporal [IMC] 25-30 kg/m2) u obesidad (IMC > 30 kg/m2) en adultos se estima en 2100 millones de personas y ha aumentado en los países industrializados y en vías de desarrollo.1 Éste es un grupo poblacional particularmente importante y de suma preocupación para la salud pública. El Centro para el Control de Enfermedades de Estados Unidos estimó que la prevalencia de la obesidad entre los adultos fue de 37.7% en 2014.2 El efecto económico y en la salud de la obesidad son sumamente relevantes, con aumento de la mortalidad global3 y comorbilidades que incluyen: enfermedad coronaria,3-5 hipertensión,6 hiperlipidemia,7 diabetes mellitus tipo 2, apnea del sueño,8 osteoartritis9,10 y muchas formas de cáncer.11 Los costos asociados de atención médica por enfermedades relacionadas con la obesidad en Estados Unidos se estiman en 147-185,000 millones de dólares cada año.12,13
La obesidad es el factor de riesgo ambiental más importante de diabetes mellitus tipo 2 y puede encontrarse hasta en 90% de los pacientes. Los pacientes con IMC > 30 kg/m2 tienen riesgo de 40 a 50% de padecer diabetes mellitus tipo 2 y puede llegar a ser de 90% en pacientes con IMC > 40 kg/m2. Todos los pacientes con obesidad mórbida tienen intolerancia a la glucosa, se ha demostrado que 35% de éstos padecerán diabetes mellitus 2 en un lapso de 10 años.13,14
La cirugía bariátrica, también conocida como cirugía metabólica, es cada vez más reconocida como una de las intervenciones más eficaces contra la obesidad y comorbilidades, ayudando a los pacientes a lograr la pérdida de peso sostenible y a mejorar su salud en general. El número de procedimientos en Estados Unidos ha aumentado 24% desde 2011, alcanzando un total de más de 190,000 en 2015.14,15 A pesar de la realización creciente de la cirugía bariátrica, los mecanismos subyacentes no son bien comprendidos. En esta revisión, estudiamos los procedimientos bariátricos y los mecanismos que contribuyen a la pérdida de peso y a mejorar el control glucémico.
Tipos de cirugía bariátrica
Los primeros enfoques quirúrgicos para tratar la diabetes y la obesidad se desarrollaron en Suecia en 1952.16 Los procedimientos han evolucionado sustancialmente con el tiempo y ahora incluyen tres versiones dominantes: manga gástrica (Figura 1), bypass gástrico y en Y de Roux, tradicionalmente se ha considerado el procedimiento bariátrico de referencia. La cirugía en Y de Roux representó 26.8% de los procedimientos bariátricos realizados en Estados Unidos en 201414 y 38, 60 y 25% de las cirugías en Europa, América Latina y Asia-Pacífico, respectivamente, en 2013.17,20 La cirugía en Y de Roux es una pequeña bolsa de 15 a 30 mL que se crea a partir del estómago proximal; en esta bolsa se conecta un tramo del yeyuno, creando una gastroyeyunostomía. El resto del estómago y del intestino delgado proximal se deja intacto y se reanastomosa 80-120 cm distal a la gastroyeyunostomía, con lo que quedan aislados del flujo digestivo.18 La gastrectomía de manga larga se realiza cada vez más y representó 54% de los procedimientos bariátricos en Estados Unidos en 2015.15,19 La gastrectomía de manga larga consiste en eliminar 80% del estómago a lo largo de su curvatura mayor, creando un remanente de estómago tipo tubo, con el resto del intestino intacto. Por último, en la banda gástrica laparoscópica ajustable (LAGB), que representó sólo 6% de los procedimientos efectuados en Estados Unidos en 2015,15 se coloca una banda inflable alrededor de la porción superior del estómago, creando una bolsa gástrica pequeña proximal a la banda. La banda puede inflarse o desinflarse a través de una válvula. Otros procedimientos, como la derivación biliopancreática y de duodeno normalmente no se realizan.
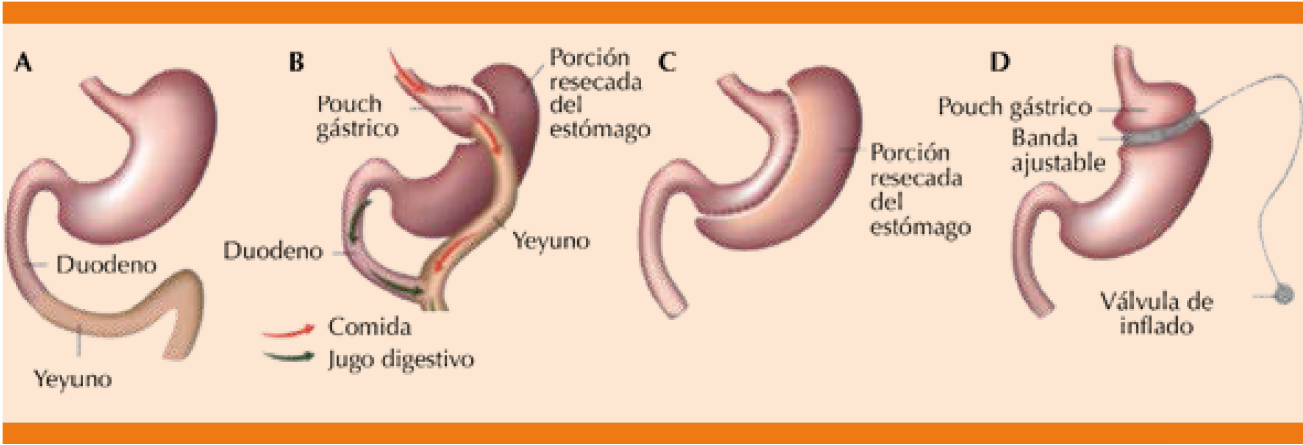
Figura 1 Anatomía normal y posquirúrgica del tubo gastrointestinal. A. Anatomía prequirúrgica normal. B. Cirugía en Y de Roux. C. Manga gástrica. D. Banda gástrica.
Hasta el momento, las metas para lograr el control glucémico adecuado a largo plazo en pacientes con diabetes mellitus tipo 2 mediante cambios en el estilo de vida y estrategias farmacológicas no se han alcanzado. No obstante que las modificaciones en el estilo de vida y el tratamiento farmacológico (sulfunilureas, metformina, glitazonas, inhibidores de la dipeptidilpeptidasa y agonistas del péptido 1 similar al glucagón, etc.) tienen un lugar bien establecido en el control de la diabetes mellitus, los algoritmos de tratamiento actuales no son suficientes para lograr el control glucémico adecuado en algunos casos. Hay tratamientos intensificados, que incluyen un esquema farmacológico complejo, que pueden inducir aumento de peso o mal apego.3 Está demostrado que la cirugía bariátrica es una forma de cirugía gastrointestinal diseñada para lograr y mantener una pérdida significativa de peso, es efectiva en la prevención y tratamiento de la diabetes mellitus tipo 2.20
Mecanismos de control de la diabetes mellitus tipo 2 de la cirugía metabólica
Los mecanismos descritos por medio de los que la cirugía bariátrica remite la diabetes mellitus 2 son: alteraciones en la anatomía gastrointestinal, malabsorción de macronutrientes, alteración en la función de las células beta del páncreas y una serie de cambios hormonales desencadenados por los cambios quirúrgicos.21
Después de realizar alguna de las cirugías bariátricas previamente expuestas la sensibilidad global a la insulina y las concentraciones de glucosa mejoran inmediatamente, se inicia un proceso importante de beta-oxidación y disminuye de manera importante la cantidad de grasa hepática y muscular, estos mismos cambios se observan en pacientes con procedimientos restrictivos, únicamente que se manifiestan de manera más retardada que con los procedimientos malabsortivos. Las dos hipótesis que explican estos fenómenos son: la hipótesis del intestino anterior que establece que la hiperestimulación del intestino anterior (estómago, duodeno y yeyuno) es un factor causal de la diabetes mellitus tipo 2 y, por tanto, las cirugías que derivan estas porciones del tubo digestivo disminuyen la estimulación de estas áreas, y se consigue mejor control glucémico.22,23 La segunda hipótesis que habla del intestino posterior sugiere que la estimulación del intestino delgado distal es el factor responsable. Al facilitar la presentación del contenido intestinal al íleo se incrementa la liberación de incretinas, en especial del péptido-1 semejante al glucagón y el péptido insulinotrópico dependiente de glucosa (GLP-1), lo que resulta en disminución significativa de la diabetes mellitus tipo 2.24,25
Un metanálisis reciente que analizó las concentraciones de GLP-1 en pacientes sometidos a cirugía en Y de Roux incluyó 24 estudios con 368 pacientes. Las concentraciones posprandiales de GLP-1 aumentaron después de la cirugía en Y de Roux (g de Hedge = 1.29, p < 0.0001), mientras que GLP-1 en ayunas no mostró cambios (p = 0.23). La glucemia en ayunas y las concentraciones de insulina disminuyeron después de la cirugía en Y de Roux (p < 0.0001). El estado de la diabetes, la cantidad de pérdida de peso, la longitud del segmento biliopancreático y el tiempo de medición no fueron predictores significativos (p > 0.05). Concluyeron que las concentraciones pospandriales de GLP-1 aumentaron posterior a la cirugía en Y de Roux, mientras que las concentraciones en ayuno permanecieron iguales, lo que sugiere uno de los mecanismos más importantes para el adecuado control glucémico en los pacientes posoperados.26
Está demostrado que las cirugías malabsortivas inducen mayor cantidad de cambios hormonales en comparación con los procedimientos meramente restrictivos. Después de la cirugía los cambios hormonales se relacionan con mejoría en la homeostasia de la glucosa.
Las incretinas son péptidos que se secretan en respuesta a la ingesta que induce la secreción de insulina. Rubino y colaboradores proponen que el aumento o inicio temprano de señalizaciones antiincretinas lleva a la pérdida de equilibrio de los mecanismos homeostáticos incretina-antiincretina que conllevan la alteración de múltiples órganos participantes en la regulación del metabolismo, incluidas las células beta pancreáticas, el tejido adiposo y el cerebro.21
El péptido posprandial plasmático Y es una hormona secretada y liberada a la circulación por las células L en el intestino proximal, después de las comidas. Esta hormona genera un efecto de saciedad, junto con el GLP-1, que disminuye la motilidad intestinal, el vaciamiento gástrico, el tránsito del intestino delgado y la ingesta.21
El péptido gástrico inhibitorio, otra hormona que participa en el control glucémico, es secretado por las células K del intestino delgado proximal y estimula la síntesis y secreción de insulina.
La leptina es una hormona derivada de los adipocitos con receptores en el hipotálamo; la estimulación de esta hormona disminuye las concentraciones del neuropéptido Y que suprimen el apetito e incrementan el metabolismo basal.21
La grelina es un estimulante del apetito que se secreta en el fundus gástrico. Puede tener propiedades estimulantes e inhibidoras de la secreción de insulina. Aunque las hormonas mencionadas juegan, al parecer, un papel importante en la homeostasia del peso corporal y en la glucemia, se requieren más investigaciones que dejen en claro su compleja interrelación.21
La cirugía bariátrica (llamada metabólica por su repercusión en el metabolismo de carbohidratos, lípidos y sensibilidad a la insulina) mejora la calidad de vida y disminuye las comorbilidades relacionadas con la obesidad, por ejemplo: apnea obstructiva del sueño y dislipidemia. La cirugía metabólica disminuye la mortalidad atribuible a enfermedades cardiovasculares, cáncer en la mujer y diabetes mellitus tipo 2.
Efecto de las diferentes técnicas de cirugía bariátrica que remiten la diabetes mellitus 2
Mientras la gastrectomía de manga se ha convertido en un procedimiento más popular, la eficacia de este procedimiento en la pérdida de peso y la remisión de la diabetes comenzó a ser examinada. Los estudios han comparado la efectividad de la gastrectomía de manga larga con la cirugía en Y de Roux en términos de remisión de la diabetes, y encontraron resultados comparables. Un estudio comparó sujetos con diabetes mellitus 2, obesos, después de someterse a gastrectomía de manga larga y cirugía en Y de Roux; encontraron alivio equivalente, 84.6% de ambas cohortes logró alivio de la diabetes mellitus 2 a un año (p = 0.618).27 Otro estudio comparó la cirugía en Y de Roux y banda gástrica en pacientes obesos, encontró una tasa de remisión de 22 y 21.5%, respectivamente, dos años después de la cirugía.28 Si bien se ha explorado el efecto de la cirugía en Y de Roux y banda gástrica en la diabetes, se requiere más investigación específicamente de los resultados de los pacientes dependientes de insulina. De los estudios comparativos entre pacientes dependientes de insulina y no dependientes de insulina se han encontrado resultados similares en pérdida de peso en dos años (39.56 ± 14.7 vs 40.36 ± 24.4 kg); sin embargo, los pacientes con diabetes mellitus 2 dependientes de insulina tuvieron mejoría significativa de las concentraciones de HbA1c y la administración de medicamentos (hipoglucemiantes, antihipertensivos y medicamentos hipolipemiantes; p < 0.0001), mientras que el grupo de diabetes mellitus 2 no insulinodependiente sólo experimentó disminución con la administración de medicamentos antihipertensivos.29 Otro estudio de pacientes con diabetes tipos 1 y 2 encontró mayor pérdida de peso (77.1 vs 68.3%, p = 0.14) y de remisión y mayores tasas de mejoría en los grupos de diabetes mellitus 2 frente a la diabetes mellitus 1 (55 y 45% vs 0 y 90%, respectivamente).30 Un estudio analizó las tasas de remisión después de la cirugía en Y de Roux y reveló una tasa de remisión similar de 49% en los pacientes con diabetes mellitus 2 dependiente de insulina y de 50% en los sujetos con diabetes mellitus 2 no dependiente de insulina, y notó que los que alcanzaron la remisión tenían mayor porcentaje de pérdida de peso.31 Al comparar la cirugía en Y de Roux con la banda gástrica para el alivio del síndrome metabólico, se encontró que los pacientes con diabetes mellitus 2 que recibían insulina lograron tasas de curación mayor que los que no requerían insulina.32 Otro estudio que estratificó a los pacientes en severidad de la diabetes mellitus 2 (por el tratamiento requerido para control glucémico de HbA1c) demostró que el aumento de la gravedad afecta negativamente la pérdida de peso.33 En la media de seguimiento de 20 meses, los pacientes con una enfermedad menos grave y cifras de glucosa en ayunas más alteradas experimentaron la mayor pérdida de peso, con promedio de 73% comparado con 65% para la dieta controlada; 57% para los que recibían agentes orales y 59% para los dependientes de insulina (p = 0.01).34
Una serie reciente incluyó 3668 pacientes con diabetes que se sometieron a cirugía bariátrica de enero de 2010 a febrero de 2017 de siete centros de excelencia bariátrica en Ontario, Canadá; 2872 pacientes fueron tratados con medicación farmacológica oral y 1187 con insulina; se observó que la pérdida de peso fue similar entre los dos grupos a los tres años; con media de pérdida de peso de 30.1% para el grupo de insulina vs 28.3% de no insulina (p = 0.0673). A tres años, 11.3% de los tratados con terapia oral y 59.6% de los insulinodependientes recibían medicación antidiabética (p < 0.0001). Entre los pacientes dependientes de insulina, la cirugía Y de Roux mostró mayor reducción con la administración de insulina con 26.5 y 40% en comparación con la manga gástrica a tres años. Los pacientes con terapia oral farmacológica experimentaron una remisión más completa de la diabetes en porcentaje de 66.5 frente a 18.5% (p < 0.0001) a tres años. La remisión completa en los pacientes con tratamiento con insulina fue mayor en el grupo Y de Roux que los pacientes con manga gástrica (p < 0.0001) en los años 1 y 2 (8.5 vs 5.4% y 24.4 vs 21.1%). La misma tendencia se encontró independientemente de la administración de insulina; con remisión completa más alta en pacientes con Y de Roux a uno y dos años [50.7 vs 39.8% (p < 0.0001) y 54.6 vs 49.1% (p < 0.0001)]. Se concluye que aunque los procedimientos de Y de Roux y manga gástrica representan un tratamiento eficaz para los pacientes con terapia insulínica en términos de pérdida de peso y diabetes; la incidencia de remisión completa en los pacientes dependientes de insulina es mayor con cirugía en Y de Roux en años anteriores.35
Un ensayo clínico prospectivo, con distribución, paralelo, doble ciego realizado en un solo centro de Auckland, Nueva Zelanda, desarrollado para estudiar el efecto de la manga gástrica y la cirugía en Y de Roux en la diabetes y la obesidad, en el que los pacientes elegidos eran de 20 a 55 años, con diabetes mellitus 2 de al menos seis meses de duración e IMC de 35 a 65 kg/m2 fueron asignados al azar 1:1 en el grupo de manga gástrica (n = 58) y en el grupo de cirugía en Y de Roux (n = 56). El resultado primario fue la remisión de diabetes mellitus 2 definida por diferentes umbrales de HbA1c a un año. Los resultados secundarios incluyeron pérdida de peso, calidad de vida, ansiedad y síntomas depresivos, complicaciones posoperatorias y mortalidad. La media ± desviación estándar (SD) preoperatorias de IMC fue de 42.5 ± 6.2 kg/m2, HbA1c 63 ± 16 mmol/mol (30% tratados con insulina, 28% había tenido diabetes durante 10 años). Las proporciones que alcanzaron HbA1c ≤ 38 mmol/mol, < 42 mmol/mol, < 48 mmol/mol y < 53 mmol/mol sin medicación de diabetes a un año en cirugía en Y de Roux vs manga gástrica fueron 38 frente a 43% (p = 0.56) vs 49% (p = 0.85); 75 vs 72% (p = 0.83) y 80 vs 77% (p = 0.82), respectivamente. El porcentaje medio ± desviación estándar de pérdida de peso total a un año fue mayor después de la cirugía en Y de Roux que con la manga gástrica: 32.2 ± 7.7 vs 27.1 ± 7.5%, respectivamente (p < 0.001). Las complicaciones gastrointestinales fueron más frecuentes después de la cirugía en Y de Roux (úlceras, fuga anastomótica, sangrado abdominal). La calidad de vida mejoró y los síntomas de depresión se redujeron significativamente en ambos grupos. En este estudio se concluyó que a pesar de una pérdida de peso significativamente mayor después de la cirugía en Y de Roux, hubo remisión de la diabetes mellitus 2 similar y mejoría psicosocial después de la manga gástrica que de la cirugía en Y de Roux a un año.36
La grelina es un péptido gastrointestinal implicado en la regulación del peso corporal y el equilibrio energético. Sin embargo, su comportamiento después de la cirugía bariátrica y su relación con la resistencia a la insulina siguen siendo controvertidos. Se realizó una evaluación simultánea de la asociación entre los cambios en las concentraciones de grelina y diferentes variables después de tres tipos de cirugía bariátrica. Las concentraciones de grelina se midieron en 103 sujetos obesos mórbidos antes y seis meses después de la cirugía en Y de Roux, desviación biliopancreática de Scopinaro y banda gástrica y 21 no obesos; se encontró que las concentraciones de grelina aumentaron después de la cirugía en Y de Roux (p < 0.05), se mantuvieron sin cambios después del bypass gástrico y disminuyeron después de la banda gástrica (p < 0.05).
El porcentaje de cambio en las concentraciones de grelina (Δ-ghrelina) se asoció con el tipo de cirugía en un modelo de regresión lineal múltiple (p = 0.017). Cuando el mismo análisis se realizó sólo en sujetos en los que se mantuvo el fondo gástrico (cirugía en Y de Roux y BPD), Δ-grelina se asoció negativamente con Δ-HOMA-IR (p = 0.001). En los sujetos con obesidad mórbida que se sometieron a cirugía en Y de Roux y BPD, la razón de momios de un Δ-HOMA-IR menor en pacientes con Δ-grelina en el cuartil Q1 versus sujetos con Δ-grelina en el cuartil Q4 fue de 8.74 (1.73-44.06) = 0.009. Se concluyó que los cambios en las concentraciones de grelina después de la cirugía bariátrica están relacionados con la existencia o ausencia del fondo gástrico. Después de la cirugía bariátrica, la disminución de la resistencia a la insulina se asoció con aumento de las concentraciones de grelina en los procedimientos en los que el fondo no está excluido.37
Una revisión sistemática, que consistió en un ensayo controlado con distribución al azar y nueve cohortes, en el que el objetivo fue evaluar los resultados a largo plazo (≥ 5 años) de la cirugía bariátrica en la remisión de la diabetes, los eventos microvasculares y macrovasculares y la mortalidad entre los pacientes con diabetes mellitus tipo 2, mostró que la cirugía aumentó significativamente la remisión de la diabetes (RR = 5.90; IC95%: 3.75-9.28), redujo los eventos microvasculares (RR = 0.37; IC95% = 0.30-0.46) y macrovasculares (RR = 0.52; IC95%: 0.44-0.61) y la mortalidad (RR = 0.21; IC95%: 0.20-0.21) en comparación con el tratamiento no quirúrgico. La evidencia disponible sugiere mejor remisión y menores riesgos de enfermedad microvascular y macrovascular y mortalidad en el grupo de cirugía en comparación con el grupo de tratamiento no quirúrgico en pacientes con diabetes mellitus 2 después de al menos cinco años de seguimiento.38
Determinantes clínicos y biológicos de la pérdida de peso y remisión de diabetes mellitus 2 después de la cirugía
Respecto a la pérdida de peso, la respuesta que se efectúa después de la ingesta de alimentos de la hormona intestinal (efecto incretina) no es pronóstico de la pérdida de peso inducida quirúrgicamente.39 Curiosamente, las concentraciones basales más altas del receptor soluble para los productos finales de glicación avanzada (sRAGE) se han asociado con mejor pérdida de peso después de la cirugía bariátrica (bypass gástrico, cirugía en Y de Roux y banda gástrica laparoscópica ajustable).40
Un gran número de estudios han tratado de explorar los mejores predictores biológicos y clínicos de la remisión de la diabetes mellitus 2 después de la cirugía bariátrica. En este contexto, la distinción entre remitentes, nunca remitentes y recaídas (definidos en el siguiente párrafo) después de la remisión inicial es decisiva. La remisión de la diabetes mellitus 2 debe definirse con precisión y uniformidad para facilitar la comparabilidad de los resultados entre los diferentes estudios.
La remisión completa de la diabetes mellitus 2 se define como glucosa plasmática en ayunas < 100 mg/dL, HbA1c < 6% (o ambas) durante al menos un año después de la cirugía, en ausencia de tratamiento farmacológico que reduzca la glucosa. La remisión parcial de la diabetes mellitus 2 se define como glucosa en ayunas < 126 mg/dL, HbA1c < 6.5% (o ambas) de medicación antidiabética durante al menos un año.41,42 La remisión de diabetes mellitus 2 prolongada completa, que se extiende más allá de cinco años, puede considerarse operacionalmente equivalente a curación.42 Sin embargo, un enfoque cauteloso se justifica cuando se utilizan estos términos, especialmente al proponer algoritmos de vigilancia y tratamiento de la diabetes mellitus 2. Con base en datos de ensayos a largo plazo, se estima que la mediana del intervalo libre de diabetes mellitus 2 después de la cirugía es de 8.3 años (cirugía en Y de Roux), mientras que la recaída de diabetes mellitus 2 retirando medicación antidiabética o glucosa en ayunas > 126 mg/dL, HbA1c > 6.5% (o ambas) puede observarse hasta en 20 a 30% después de la remisión inicial durante un periodo de seis años.43
Los datos de un estudio de cohorte retrospectivo efectuado en un gran número de pacientes con diabetes mellitus 2 sometidos a cirugía en Y de Roux muestran que hasta 70% puede experimentar remisión completa inicial en los primeros cinco años, pero entre éstos, 35% puede padecer diabetes mellitus 2 dentro de los cinco años después de la remisión.43
El efecto favorable de la pérdida de peso inducida quirúrgicamente en la remisión de la diabetes mellitus 2 parece ser independiente del IMC inicial. La acumulación de evidencia sugiere que el IMC preoperatorio dentro de la gama de obesidad no es capaz de predecir con fiabilidad cardiometabólica beneficios respecto de la prevención y la remisión de la diabetes mellitus 2, la incidencia y la mortalidad de las enfermedades cardiovasculares.41 Un metanálisis recientemente publicado que se realizó de ensayos clínicos con distribución al azar, ensayos clínicos controlados y estudios de cohortes, realizado en dos grupos distintos de IMC (< 35 y > 35 kg/m2), reveló tasas similares de remisión de la diabetes mellitus 2 en ambos grupos, independientemente del IMC basal.44 Al considerar que el IMC preoperatorio parece ser inútil como determinante de la mejoría metabólica, las trayectorias de cambio de peso corporal, es decir, el grado de reducción de peso, juegan un papel central en la predicción de los respondedores vs no respondedores.43 En los pacientes que experimentan pérdida de peso masiva después de la cirugía, las tasas de remisión de la diabetes mellitus 2 son considerablemente más altas en comparación con los sujetos con menos pérdida de peso profunda, independientemente de la clasificación basal del IMC,43 lo que sugiere que la pérdida de peso per se parece tener un efecto dominante.
La definición de la Federación Internacional de Diabetes del control metabólico óptimo puede ser más útil, porque el enfoque cambia de la remisión al control a largo plazo de todos los parámetros metabólicos. Como tal, los beneficios de la cirugía metabólica con respecto a la glucemia, hipertensión y dislipidemia son igualmente valorados. La administración complementaria de medicación también mejora y mantiene los beneficios metabólicos de la cirugía por más tiempo.
Más allá de la reducción de peso, la duración de la diabetes mellitus 2 basal, la administración preoperatoria de regímenes de insulina intensivos y el mal control glucémico se han asociado consistentemente con tasas más bajas de remisión de diabetes mellitus 2 y mayor riesgo de recaída.44,45 Sin embargo, muchos argumentan que éstos son los pacientes que realmente se beneficiarían más de la cirugía metabólica, porque pueden tener las mejorías más grandes en el control metabólico, incluso si no logran una remisión completa de la hiperglucemia. Estos pacientes deben ser priorizados sobre los que pueden ser fácilmente puestos en remisión, porque los primeros suelen tener morbilidad y mortalidad más altas.
Por el contrario, una duración más corta de la diabetes mellitus 2 (< 8 años), menor glucemia en ayunas preoperatoria y procedimientos quirúrgicos que implican desviación intestinal en lugar de procedimientos gástricos sólo pueden predecir independientemente mayores tasas de remisión de la diabetes mellitus 2 y menor riesgo de reincidencia.44 El descenso de la circunferencia basal de la cintura puede predecir, además, mayor reducción de HbA1c,44 mientras que el área de grasa visceral de base también se vincula con mejores resultados metabólicos, especialmente en los pacientes asiáticos con diabetes mellitus 2 con aumento de la grasa visceral, a pesar de IMC sólo ligeramente elevado. Por tanto, se hace evidente que una operación temprana combinada con mejor control de la glucemia basal se espera que sea benéfica, lo que provoca la necesidad del reconocimiento temprano de los pacientes aptos para someterse a cirugía.44,45
Resultados a corto y mediano plazos de la cirugía bariátrica en pacientes obesos con diabetes mellitus 2
En relación con la banda gástrica laparoscópica ajustable, un estudio australiano abierto efectuado en 60 pacientes obesos (IMC 30-40 kg/m2) con diagnóstico reciente de diabetes mellitus 2 comparó el tratamiento quirúrgico contra la terapia convencional de diabetes con insistencia en la pérdida de peso y la remisión de la diabetes mellitus 2 durante un periodo de seguimiento de dos años; los autores reportaron tasas de remisión de la diabetes mellitus 2 de 73% en el grupo quirúrgico en comparación con sólo 13% en el grupo control.46 La pérdida de peso después de la cirugía fue casi 10 veces mayor (20.7 vs 1.7%). En este estudio, la remisión de la diabetes mellitus 2 se relacionó con el grado de pérdida de peso y concentraciones basales de HbA1c. En otro ensayo clínico con distribución al azar de 50 pacientes con sobrepeso y diabetes mellitus 2 asignados al azar a la atención intensiva de la diabetes con o sin cirugía , la remisión de la diabetes mellitus 2 a dos años se logró en 50% de los pacientes con cirugía y en 8% en el grupo control.47
Sin embargo, en ambos estudios faltan datos de eficacia y seguridad a largo plazo. En contraste con los datos anteriores, otro ensayo clínico con distribución al azar efectuado en pacientes obesos con diabetes mellitus 2 que comparó la cirugía con un programa intensivo de control médico de peso, informó reducciones similares de HbA1c a 3 y 12 meses en ambos grupos, pérdida similar de peso a tres meses y cambios similares en la presión arterial, los lípidos séricos, las puntuaciones de riesgo cardiovascular y los resultados de salud reportados por el paciente después de ambas intervenciones, lo que cuestiona el potencial real de la cirugía para afectar poderosamente los resultados cardiometabólicos en esta población.48
En un ensayo clínico con distribución al azar italiano se observó que los tres procedimientos quirúrgicos utilizados en el tratamiento de la diabetes mellitus 2 (cirugía en Y de Roux, bypass gástrico y manga gástrica) de un solo centro, no cegado, 60 pacientes obesos con IMC > 35 kg/m2 y antecedente de al menos cinco años de diabetes mellitus 2 mal controlada se asignaron al azar a tratamiento médico convencional o cirugía en Y de Roux/BPD.49 La dosis de remisión de diabetes mellitus 2 a dos años se especificó como glucosa plasmática en ayunas < 100 mg/dL y HbA1c < 6.5% sin tratamiento farmacológico durante al menos un año y no fue alcanzada por ninguno de los pacientes tratados clínicamente, 75% de los pacientes tratados con cirugía en Y de Roux y 95% de los tratados con BPD.
En el análisis de regresión multivariante, la edad, el sexo, el IMC basal, la duración de la diabetes mellitus 2 y los cambios de peso corporal no fueron predictores significativos de la remisión de la diabetes mellitus 2 a dos años o mejoría del control glucémico a uno y tres meses.49 Los autores concluyeron que la cirugía bariátrica puede resultar en mejor control metabólico a corto plazo en pacientes con diabetes mellitus 2 mal controlados que el tratamiento médico de alto estándar, pero la adiposidad basal y la pérdida de peso no podrían predecir mejores resultados metabólicos.49
En un ensayo clínico con distribución al azar de diseño similar, que comparó el tratamiento médico intensivo (IMT) con el tratamiento médico más cirugía en Y de Roux o banda gástrica en 150 pacientes severamente obesos con diabetes mellitus 2 mal controlada (HbA1c 9% basal), el porcentaje de pacientes con remisión completa de la diabetes mellitus 2, HbA1c < 6%) a un año de seguimiento fue de 42% con cirugía en Y de Roux y de 37% en el grupo de banda gástrica, en comparación con sólo 12% en el grupo de tratamiento médico intensivo.50 El seguimiento prolongado hasta tres años después de la cirugía (resultados a medio plazo) mostró tasas de remisión de la diabetes mellitus 2 de 5% en el grupo de tratamiento médico intensivo, comparado con 38% en el grupo de cirugía en Y de Roux y 24% en el grupo de banda gástrica y administración significativamente menor de medicamentos para la reducción de la glucosa en los grupos quirúrgicos.51 Una diferencia importante en este estudio fue que a los pacientes se les permitió permanecer con hipoglucemiantes orales para lograr HbA1c < 6%, lo que sugiere que el beneficio de la cirugía puede ser mejorado con la administración de la medicación adecuada.
CONCLUSIONES
El tubo gastrointestinal representa un objetivo significativo para tratar la diabetes mellitus 2. Los procedimientos quirúrgicos con desviación intestinal y malabsorción subsecuente han demostrado consistentemente la capacidad de mejorar la homeostasia de la glucosa modelando las hormonas intestinales, más allá de reducir la ingesta de energía y el peso corporal. La manga gástrica laparoscópica ajustable, la cirugía en Y de Roux, el bypass gástrico y la derivación biliopancreática son los cuatro mejores procedimientos quirúrgicos estandarizados.
Los efectos metabólicos benéficos de la cirugía están parcialmente mediados por la pérdida de peso y restricción de energía severa, pero también hay mecanismos independientes de pérdida de peso. La mayor parte de éstos son efectos en la sensibilidad a la insulina de múltiples órganos, la función de las células β y la respuesta de la incretina, modificaciones de la microbiota intestinal, metabolismo intestinal de la glucosa y aumento de la actividad metabólica del tejido adiposo marrón.
Muchos estudios han intentado explorar los mejores predictores biológicos y clínicos de la remisión de diabetes mellitus 2 después de la cirugía. La distinción entre respondedores, nunca remitentes y recaídas después de la remisión inicial es decisiva. Una duración más corta de la diabetes mellitus 2, un mejor control glucémico preoperatorio, una HbA1c basal más baja, una circunferencia de cintura y una pérdida profunda de peso posquirúrgico se han asociado con mayores tasas de remisión de diabetes mellitus 2 y menor riesgo de recaída, pero el mayor beneficio puede ocurrir realmente en pacientes con mayor reducción de la HbA1c, aunque permanezcan medicados y no cumplan con los criterios de remisión. Curiosamente, el IMC preoperatorio no es de utilidad predictiva para los resultados metabólicos.
Muchos ensayos clínicos con distribución al azar y estudios prospectivos de cohortes de alta calidad han demostrado consistentemente efectos benéficos de la cirugía bariátrica en pacientes obesos con diabetes mellitus 2. Se ha visto que a corto y mediano plazos (hasta tres años después de la cirugía) se pierde una cantidad significativa de peso, la diabetes mellitus 2 puede remitir por completo y los factores de riesgo cardiometabólico disminuyen de manera importante. A largo plazo (más allá de cinco años), la cirugía puede lograr pérdida de peso duradera, prevenir la diabetes mellitus 2 y el cáncer, mejorar el control glucémico global (aunque la diabetes mellitus 2 podría repetirse en un porcentaje considerable de pacientes) y reducir la mortalidad total y específica de la causa. El gradiente de eficacia de los cuatro procedimientos establecidos para la pérdida de peso y la remisión de la diabetes mellitus 2 ocurrió en el siguiente orden: cirugía en Y de Roux, manga gástrica, banda gástrica laparoscópica ajustable.
De acuerdo con las directrices y recomendaciones recientemente publicadas, la cirugía metabólica debe recomendarse en pacientes aptos con obesidad de clase III, independientemente del control glucémico o de los regímenes de disminución de la glucosa y en pacientes con obesidad clase II con diabetes mellitus 2 inadecuadamente controlada a pesar del tratamiento óptimo, con obesidad clase I e hiperglucemia inadecuadamente controlada a pesar del tratamiento médico óptimo.
A pesar de la función bien establecida de la cirugía metabólica como herramienta terapéutica adicional contra diabetes mellitus 2, todavía queda por resolver una serie de cuestiones: la carencia de datos de eficacia y seguridad a largo plazo, la caracterización incompleta de los determinantes de la remisión de la diabetes mellitus 2 y la escasez de estudios que investigan terapias multimodales (intervenciones quirúrgicas y farmacológicas combinadas). A través de los diferentes estudios realizados queda demostrado que para que la cirugía metabólica repercuta en el tratamiento de la diabetes mellitus 2 es necesario examinar objetivamente los datos y reconocer las fortalezas, debilidades y oportunidades, porque aunque existe una gran cantidad de ciencia nueva y de alta calidad, el número de pacientes que se someten a cirugía como tratamiento contra la diabetes sigue siendo decepcionantemente bajo.











 text new page (beta)
text new page (beta)


