ANTECEDENTES
La infección por el virus de la inmunodeficiencia humana (VIH) es una enfermedad pandémica que afecta a más de 30 millones de individuos en todo el mundo y contribuye a más de dos millones de muertes anuales.1
El tratamiento antirretroviral está recomendado para todos los pacientes con infección por VIH (recomendación IA) y se les debe ofrecer a todos los pacientes con infección por VIH-1 temprana, en el (Cuadro 1) se muestran los esquemas de tratamiento. Se debe realizar una prueba de genotipo de resistencia farmacológica antes de empezar el tratamiento antirretroviral para guiar la selección del régimen.
Cuadro 1 Opciones de tratamiento
|
Opciones de régimen recomendadas Inhibidor de integrasa (IP) más dos inhibidores nucléosidos de transcriptasa reversa (NRTI): DTG/ABC/3TC* (IA)-Si HLA-B*5701 negativo DTG más TDF/FTC (IA) o TAF/FTC (IIA) EVG/c/TAG/FTC (IA) o EVG/c/TDF/FTC (IA) RAL más TDF/FTC (IA) o TAF/FTC (IIA) Inhibidor de proteasa (IP) reforzado más dos inhibidores nucléosidos de transcriptasa reversa (NRTI): DRVr más TDF/FTC (IA) o TAF/FTC (IIA) Opciones de régimen alternativo Inhibidor no nucléosido de transcriptasa reversa (NNRTI) más dos inhibidores nucléosidos de transcriptasa reversa (NRTI): EFV/TDF/FTC (IB) EFV más TAF/FTC (IIB) RPV/TDF/FTC (IB) o RPV/TAF/FTC (IIB) - Si RNA VIH <100,000 copias/mL y CD4 > 200 células/mm3 Inhibidor de proteasa (IP) reforzado más dos inhibidores nucléosidos de transcriptasa reversa (NRTI): (ATV/c o ATV/r) más TDF/FTC (IB) o TAF/FTC (IIB) DRV/c (IIIB) o DRV/r (IIB) más ABC/3TC-Si HLA-B*5071 negativo DRV/c más TDF/FTC (IIB) o TAF/FTC (IIB) |
Para el inicio de tratamiento de pacientes con VIH de diagnóstico reciente, los regímenes recomendados de primera línea son los que han demostrado eficacia virológica durable, perfil de toxicidad y tolerancia favorables, y de facilidad en su administración; mientras que los regímenes alternativos son efectivos y tolerables, pero tienen potenciales desventajas cuando se comparan con los regímenes de primera línea, tienen limitaciones de administración en ciertos grupos de población, o existe menos evidencia de estudios clínicos que respalde su prescripción. El efavirenz no forma parte de la primera línea de tratamiento.
DTG: dolutegravir; ABC: abacavir; 3TC: lamivudina; TDF: fumarato tenofovir disoproxil; FTC: emtricitabina; TAF: tenofovir alafenamida; EVG/c: elvitegravir; RAL: raltegravir; DRVr: darunavir/ritonavir; ATV/r: atazanavir/ritonavir.
La cardiomiopatía es una clara complicación de la infección por VIH y las manifestaciones clínicas son similares a las de la cardiomiopatía idiopática en los pacientes VIH negativos.2,3 Se ha observado incremento en la prevalencia de la prolongación del intervalo QT corregido (QTc) y un intervalo QTc más disperso se ha descrito entre los pacientes con VIH cuando se les compara con los VIH negativos.4
El intervalo QT en un electrocardiograma de superficie representa la suma del potencial de acción de los miocitos ventriculares. El potencial de acción refleja el flujo de la corriente iónica a través de la membrana celular mediante canales especializados (complejos de proteínas). La disfunción de estos canales lleva al incremento del potencial de acción y, por tanto, al incremento del intervalo QT.5
En pacientes con infección primaria se ha demostrado que un intervalo QTc prolongado es predictor independiente de eventos de enfermedad cardiovascular en pacientes infectados con VIH que reciben terapia antirretroviral.6
Algunos de los principales fármacos relacionados con estos efectos adversos son efavirenz (un inhibidor no nucléosido de transcriptasa reversa [NNRTI]) e inhibidores de proteasa.7 El efecto de efavirenz en el intervalo QTc se evaluó en un estudio abierto, con control placebo, en pacientes sanos enriquecidos con polimorfismos de CYP2B6. Se encontró una relación positiva entre la concentración de efavirenz y la prolongación del intervalo QTc.8
La toxicidad cardiovascular está relacionada principalmente con prolongación del intervalo QT, así como incremento de eventos isquémicos.9
Las enzimas hepáticas CYP2B6 y UGT2B7 juegan un papel principal en el metabolismo de efavirenz, nevirapina y zidovudina; sin embargo la información que compara la variación en ambos genes en todo el mundo es limitada. En un estudio efectuado en 2013, la mayor variación genética se encontró en la población de Nueva Guinea para CYP2B6, mientras que en población europea y asiática mostraron mayor variación para UGT2B7, se incluyeron pacientes con ascendencia mexicana, de Los Ángeles, California, con variación de CYP2B6 no significativa.10
La prolongación del intervalo QTc puede causar arritmias severas, incluyendo torsades de Pointes (taquicardia polimórfica) y fibrilación ventricular y, finalmente, muerte súbita.11,12 La prolongación de la repolarización ventricular a menudo lleva a oscilación en el potencial de membrana (posdespolarización temprana).13
Esto orienta hacia el papel que desempeña el electrocardiograma como una herramienta simple no invasiva en el tamizaje de enfermedades cardiovasculares en pacientes infectados por el VIH.14
Los fármacos azitromicina, eritromicina y claritromicina pueden incrementar seriamente el riesgo de arritmias ventriculares. Existen al menos siete reportes de caso de pacientes en tratamiento con azitromicina e intervalo QTc basal normal que tuvieron efectos adversos cardiovasculares relacionados con arritmias, que incluyen prolongación del intervalo QTc, torsades de Pointes y taquicardia ventricular polimórfica en ausencia de prolongación de intervalo QTc.15
Además del efecto de los fármacos, la prolongación del intervalo QTc en pacientes con VIH se ha vinculado con alteraciones en la inervación cardiaca debido a neuropatía autonómica.16
En este sentido, en el estudio realizado por Soliman y colaboradores en 2013,17 el riesgo de intervalo QTc anormal fue más elevado en pacientes con enfermedad renal crónica, hipertensión arterial y coinfección con virus de hepatitis C. Mientras que lo reportado por Florentini y colaboradores18 en 2012 indica que el género femenino, el tabaquismo y la diabetes mellitus son independientemente predictivos en la prolongación incidental del segmento QTc en individuos infectados por VIH.5
A pesar de esto, existen reportes que señalan que los pacientes con VIH que reciben tratamiento antirretroviral experimentan prolongación del QTc e incremento de la dispersión del intervalo QTc, independientemente de la disfunción autonómica y los fármacos antirretrovirales.6,14
Una vía a través de la que se producen estos cambios electrocardiográficos es por medio de toxicidad mitocondrial,19 generada por especies reactivas de oxígeno, secundaria a infección por VIH directamente o en ocasiones a algunos fármacos antirretrovirales.
La prevalencia mundial de estos cambios se desconoce. Petrosillo y colaboradores, en 2006,20 reportaron una frecuencia de 9.8% de prolongación del intervalo QTc en el total de la población con VIH estudiada (650 pacientes), mientras que Nordin y su grupo21 reportan 20.5%. Los factores asociados con la prolongación del intervalo QTc fueron tratamiento con metadona, cotrimoxazol, nelfinavir y efavirenz, éste último con razón de momios de 4.82.
En la actualidad no existe información disponible de la frecuencia de estos cambios en pacientes mexicanos.
MATERIAL Y MÉTODO
Estudio prospectivo observacional en el que se evaluaron aleatoriamente los expedientes de pacientes con diagnóstico de VIH, de 18 a 59 años de edad, previa autorización del Comité de Ética, de la Consulta Externa del Centro de Investigación en Enfermedades Infecciosas del Instituto Nacional de Enfermedades Respiratorias (INER), de marzo 2015 a mayo de 2016, que contaban con electrocardiograma de 12 derivaciones, con cifra de CD4 para estatificación, y que no hubieran padecido eventos cardiovasculares (infarto de miocardio, evento vascular cerebral). Se determinó el tiempo de diagnóstico y el tiempo de tratamiento. Se estudiaron dos grupos, el Grupo 1 incluyó pacientes con VIH, sin tratamiento antirretroviral; el Grupo 2 a pacientes con VIH, en tratamiento antirretroviral, que se dividieron en los que recibían NNTRI (inhibidores no nucléosidos de transcriptasa reversa); NTRI (inhibidores nucléosidos de transcriptasa reversa); inhibidores de proteasa e inhibidores de integrasa. Se registraron edad, sexo, fecha de diagnóstico e inicio de tratamiento, así como los valores de laboratorio de química sanguínea, que incluyó electrólitos séricos y pruebas de función hepática.
RESULTADOS
Se incluyeron 70 pacientes de los que 60 cumplieron los criterios de exclusión, mismos que contaban con un electrocardiograma al ingreso en la primera hospitalización en el caso de los pacientes sin tratamiento (reciente diagnóstico, n = 30), mientras que en el caso de los pacientes con tratamiento antirretroviral (n = 30), éste correspondía a la última hospitalización.
De acuerdo con el género se registraron 9 mujeres (15%) y 51 hombres (85%). Se encontraron 35 pacientes con intervalo QTc normal (58.3%) y 25 pacientes con intervalo QTc prolongado (41.6%), en este grupo todos fueron masculinos (Cuadro 2), y de éstos sólo 14 pacientes (56%) tenían tratamiento antirretroviral.
Cuadro 2 Comparación de pacientes con y sin tratamiento
| Fármacos | Pacientes sin fármaco | Media | Desviación estándar | Pacientes con fármaco | Media | Desviación estándar | Valor de p |
|---|---|---|---|---|---|---|---|
| Ritonavir | 42 | 0.44 | 0.05 | 18 | 0.46 | 0.05 | 0.29 |
| Atazanavir | 51 | 0.45 | 0.05 | 9 | 0.45 | 0.05 | 0.47 |
| Lopinavir | 55 | 0.44 | 0.05 | 5 | 0.49 | 0.03 | 0.19 |
| Darunavir | 56 | 0.45 | 0.05 | 4 | 0.48 | 0.05 | 0.31 |
| Tenofovir | 7 | 0.45 | 0.04 | 53 | 0.45 | 0.05 | 0.31 |
| Emtricitabina | 8 | 0.46 | 0.05 | 52 | 0.44 | 0.05 | 0.41 |
| Abacavir | 56 | 0.45 | 0.05 | 4 | 0.44 | 0.03 | 0.24 |
| Zidovudina | 58 | 0.45 | 0.05 | 2 | 0.46 | 0.1 | 0.36 |
| Lamivudina | 57 | 0.45 | 0.05 | 3 | 0.44 | 0.04 | 0.45 |
| Efavirenz | 30 | 0.45 | 0.05 | 30 | 0.44 | 0.42 | 0.43 |
| Raltegravir | 54 | 0.45 | 0.05 | 6 | 0.39 | 0.04 | 0.001 |
| Dolutegravir | 58 | 0.44 | 0.05 | 2 | 0.43 | 0.02 | 0.31 |
| TMP/SMX | 14 | 0.45 | 0.01 | 46 | 0.45 | 0.05 | 0.30 |
| Dotbal | 57 | 0.45 | 0.05 | 3 | 0.43 | 0.03 | 0.36 |
| Rifampicina | 59 | 0.45 | 0.05 | 1 | 0.41 | - | - |
| Etambutol | 55 | 0.44 | 0.05 | 5 | 0.48 | 0.07 | 0.12 |
| Aciclovir | 58 | 0.45 | 0.05 | 2 | 0.48 | - | - |
| Valganciclovir | 55 | 0.45 | 0.05 | 5 | 0.45 | 0.04 | 0.37 |
Se muestran la media y desviación estándar en el análisis de regresión simple, para determinar la asociación de cada fármaco antirretroviral, antibióticos y antifímicos, con la modificación en el intervalo QTc. Se hace hincapié en los inhibidores de proteasa, que de acuerdo con las revisiones internacionales, son los que muestran asociación significativa con prolongación del QTc, la razón de que en nuestra población no se observó este cambio puede encontrarse en el polimorfismo en las enzimas encargadas del metabolismo de fármacos como efavirenz. Asimismo, no hay reportes de cambios electrocardiográficos secundarios a la administración de raltegravir; sin embargo, en esta población mostró acortamiento no patológico de este intervalo, se desconocen los efectos clínicos de este hallazgo.
La edad promedio de los pacientes fue de 37 años en ambos grupos, con intervalo QTc promedio de 0.33 mseg en los pacientes sin tratamiento y 0.34 mseg en los pacientes con tratamiento.
En los pacientes con tratamiento antirretroviral, el promedio del tiempo desde el diagnóstico de infección por VIH fue de 6.5 años, mientras que el promedio de duración del tratamiento fue de 4.6 años.
Se analizaron los principales factores epidemiológicos mediante regresión logística; se encontró para edad OD 1.0, p = 0.8, con IC95% 0.95-1.0, y género OD 0.3, p = 0.15 (IC95% 0.06-1.53).
Mediante U de Mann-Whitney se compararon las medianas del grupo con tratamiento en pacientes con inhibidor de proteasa e inhibidor no nucléosido, sin encontrar diferencias al comparar en ninguno del primer grupo.
Se aplicó prueba exacta de Fisher o c2, según la distribución de los datos en la tabla 2 x 2 para el análisis de cada fármaco; se ubicó en la columna pacientes a los sujetos con tratamiento antirretroviral concomitante a la administración del fármaco a valorar.
Se calculó la variancia de cada fármaco para determinar su asociación con tratamiento antirretroviral (ARV); se obtuvo media y desviación estándar del intervalo QTc y su asociación entre ambos grupos mediante regresión simple (Cuadro 3).
Cuadro 3 Medicamentos asociados
| Medicamento | Pacientes sin fármaco | Media | Desviación estándar | Pacientes con fármaco | Media | Desviación estándar | Valor de p |
|---|---|---|---|---|---|---|---|
| Risperidona | 58 | 0.45 | 0.05 | 2 | 0.37 | 0.03 | 0.43 |
| Quetiapina | 59 | 0.45 | 0.05 | 1 | 0.36 | - | - |
| Prednisona | 57 | 0.45 | 0.05 | 3 | 0.45 | 0.09 | 0.42 |
| Clonazepam | 58 | 0.45 | 0.05 | 2 | 0.36 | - | - |
| Alprazolam | 59 | 0.45 | 0.05 | 1 | 0.48 | - | - |
| Citalopram | 59 | 0.45 | 0.05 | 1 | 0.44 | - | - |
| Metformina | 57 | 0.45 | 0.05 | 1 | 0.42 | 0.03 | 0.27 |
| Sitagliptina | 59 | 0.45 | 0.05 | 1 | - | - | - |
| Insulina | 59 | 0.45 | 0.05 | 1 | 0.39 | - | - |
| Pravastatina | 58 | 0.45 | 0.05 | 2 | 0.41 | - | - |
| Atorvastatina | 58 | 0.45 | 0.05 | 2 | 0.49 | - | - |
| Bezafibrato | 58 | 0.45 | 0.05 | 2 | 0.45 | 0.01 | 0.10 |
| Metoprolol | 59 | 0.45 | 0.05 | 1 | - | - | - |
| Amlodipino | 58 | 0.45 | 0.05 | 2 | - | - | - |
| Enalapril | 56 | 0.45 | 0.05 | 4 | 0.45 | 0.05 | 0.53 |
| Hidroclotazida | 59 | 0.45 | 0.05 | 1 | 0.39 | - | - |
| Espironolactona | 58 | 0.45 | 0.05 | 2 | 0.49 | - | - |
| Valproato de magnesio | 59 | 0.45 | 0.05 | 1 | 0.35 | - | - |
| Levetiracetam | 58 | 0.45 | 0.05 | 2 | 0.45 | 0.05 | 0.66 |
| Levotiroxina | 58 | 0.45 | 0.05 | 2 | 0.48 | - | - |
| Gabapentina | 55 | 0.45 | 0.05 | 5 | 0.38 | 0.04 | 0.001 |
Se muestran la media y desviación estándar, así como el valor de p, de diferentes fármacos prescritos en el tratamiento de las comorbilidades de los pacientes incluidos en el estudio. Ninguno mostró asociación significativa.
De los 30 pacientes en tratamiento con antirretrovirales, 20 (66.6%) recibían tratamiento con inhibidor de proteasa, todos en combinación con otros antirretrovirales (ritonavir 10 [33.3%], atazanavir [13.3%], lopinavir [13.3%] y darunavir [6.7%]); 27 pacientes (90%) tenían tratamiento con al menos un inhibidor nucléosido de transcriptasa reversa (tenofovir [83.3%], emtricitabina [80%], tenofovir/emtricitabina [80%], abacavir [6.7%], zidovudina [6.7%] y lamivudina [6.7%]); 12 pacientes (40%) tenían tratamiento que incluía un inhibidor nucléosido de transcriptasa reversa (efavirenz 40%) y 5 pacientes (16.7%) tenían régimen con un inhibidor de integrasa (raltegravir 13.3% y dolutegravir 3.3%).
De todos los fármacos estudiados en el primer grupo, incluidos los antibióticos (quinolonas, carbapenémicos, macrólidos), antifímicos, antirretrovirales, antivirales y antifúngicos, sólo los pacientes con raltegravir mostraron diferencia estadísticamente significativa en el cambio del intervalo QTc, media de 0.39 ± 0.04, IC95% 0.34-0.43, p = 0.001) vs aquellos sin el fármaco, media 0.45 ± 0.05, IC95% 0.44-0.46).
En este grupo se encontró, por tanto, que el intervalo QTc era más corto que en los pacientes sin raltegravir. Ningún otro antirretroviral mostró diferencias en los cambios en el QTc, incluso los inhibidores de proteasa.
En el segundo grupo de fármacos administrado (Cuadro 2), sólo gabapentina mostró relación con cambios estadísticamente significativos en el intervalo QTc para los sujetos que recibieron este fármaco, con media de 0.38 ± 0.04, IC95%) 0.33-0.43, comparado con aquellos sin fármaco (media 0.45 ± 0.05, IC95% 0.44-0.46) con p = 0.001.
La variancia de la asociación con coinfecciones se muestra en el Cuadro 4.
Cuadro 4 Resultados del análisis de las coinfecciones observadas en la muestra
| Coinfección | Pacientes sin infección | Media | Desviación estándar | Pacientes con infección | Media | Desviación estándar | Valor de p |
|---|---|---|---|---|---|---|---|
| Toxoplasmosis | 59 | 0.45 | 0.05 | 1 | 0.46 | - | - |
| Tuberculosis diseminada (M. bovis) | 56 | 0.45 | 0.05 | 4 | 0.42 | 0.3 | 0.13 |
| Tuberculosis diseminada (M. avium) | 53 | 0.48 | 0.05 | 7 | 0.48 | 0.05 | 0.34 |
| Neumonitis por PCP | 25 | 0.44 | 0.05 | 35 | 0.44 | 0.05 | 0.32 |
| Neumonía por P. aeruginosa | 58 | 0.45 | 0.05 | 2 | 0.45 | 0.05 | 0.40 |
| Neumonitis por citomegalovirus | 56 | 0.45 | 0.05 | 4 | 0.45 | 0.05 | 0.49 |
| Neumonía atípica | 54 | 0.45 | 0.05 | 6 | 0.41 | 0.03 | 0.03 |
| Aspergilosis pulmonar | 59 | 0.45 | 0.05 | 1 | 0.39 | - | - |
| Criptococosis pulmonar | 59 | 0.45 | 0.05 | 1 | 0.45 | - | - |
| Histoplasmosis sistémica | 59 | 0.45 | 0.05 | 1 | 0.35 | - | - |
| Enfermedad invasiva por neumococo | 58 | 0.45 | 0.05 | 2 | 0.48 | - | - |
| Retinitis por citomegalovirus | 53 | 0.45 | 0.05 | 7 | 0.44 | 0.07 | 0.09 |
| Uveítis por sífilis | 58 | 0.45 | 0.05 | 2 | 0.41 | - | - |
| Neurosífilis | 58 | 0.45 | 0.05 | 2 | 0.49 | 0.06 | 0.21 |
| Sarcoma de Kaposi sistémico | 57 | 0.45 | 0.05 | 3 | 0.46 | 0.08 | 0.35 |
| Sarcoma de Kaposi localizado | 57 | 0.45 | 0.05 | 3 | 0.47 | 0.04 | 0.48 |
| Linfoma no Hodgkin de células grandes | 59 | 0.45 | 0.05 | 1 | 0.44 | - | - |
| Molusco contagioso | 55 | 0.44 | 0.05 | 5 | 0.49 | 0.02 | 0.02 |
| Condilomatosis | 56 | 0.45 | 0.05 | 4 | 0.45 | 0.04 | 0.46 |
La mayor parte de las infecciones fueron secundarias a bacterias y virus, lo que muestra que la existencia de infección por molusco contagioso se relacionó con prolongación del intervalo QTc; sin embargo la vía por la que ésta se produce no está establecida y no se había reportado previamente.
Se encontró diferencia estadísticamente significativa en los valores del intervalo QTc en coinfección con neumonía atípica, sin especificar el germen en el expediente clínico; sin embargo, con IC95% de 0.44-0.47 vs 0.38-0.44 en pacientes sin esta coinfección.
Asimismo, en el caso de infección por molusco contagioso hubo diferencia significativa, con IC95% 0.47-0.51 vs 0.43-0.46 en los no infectados, por tanto, se encontró prolongación del intervalo QTc con media de 0.49. Otras infecciones sistémicas o severas no demostraron tener diferencia significativa en el valor del intervalo QTc en comparación con los pacientes que no padecieron éstas.
La (Figura 1) muestra el resumen de estos cambios, se muestran sólo los que fueron estadísticamente significativos; se observa que sólo en el caso de coinfección por molusco contagioso, el intervalo QTc mostró prolongación, mientras que la neumonía atípica por microorganismo no especificado y los fármacos gabapentina y raltegravir tuvieron menor intervalo en comparación con los pacientes que no los consumieron en algún momento durante la estancia intrahospitalaria.
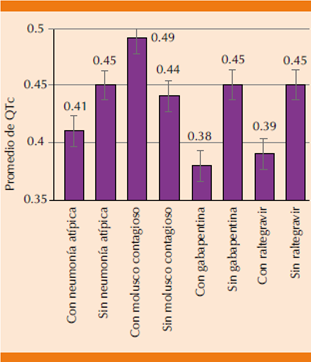
Se observan los factores que mostraron cambios significativos en el intervalo QTc, sin observar acortamiento patológico, aunque la coinfección por molusco contagioso se asoció con prolongación del intervalo QTc, la vía por la que ésta se produce no se conoce. La coinfección por neumonía atípica y la administración de gabapentina y raltegravir mostraron disminución del intervalo QTc, aunque se desconoce el significado clínico de estos hallazgos.
Figura 1 Cambios en el intervalo QTc estadísticamente significativos.
DISCUSIÓN
Este estudio realizado con pacientes del Centro de Investigación de Enfermedades Infecciosas (CIENI) del Instituto Nacional de Enfermedades Respiratorias permitió observar algunas de las características de la población con infección por VIH y cambios electrocardiográficos. Todos los pacientes incluidos con prolongación del intervalo QTc eran del género masculino. Al realizar el ajuste por edad y sexo de cada variable, no se encontraron diferencias significativas. Existe, en promedio, un retraso de hasta dos años desde el diagnóstico de infección por VIH y el inicio de antirretrovirales, y se requieren estudios adicionales debido al incremento en la mortalidad en estos pacientes.
El tratamiento con gabapentina y raltegravir se asoció con reducción en el intervalo QTc, la importancia clínica de este hallazgo aún no se conoce, y hasta el momento no existen reportes de efectos cardiovasculares o electrocardiográficos de raltegravir.
No encontramos diferencias estadísticamente significativas al comparar a los pacientes que reciben esquema que incluyera al menos un inhibidor de proteasa con aquéllos sin este fármaco, esto a pesar de lo reportado en varios estudios clínicos en los que la relación de los antirretrovirales de este grupo con la prolongación del intervalo QTc es clara e, incluso, forma parte de las recomendaciones de la Dirección de Alimentos y Fármacos de Estados Unidos en la prescripción de estos fármacos. Efavirenz es otro medicamento que se ha asociado con prolongación en el intervalo QTc, en parte por esta razón éste ya no forma parte de los regímenes recomendados ni alternativos para el tratamiento inicial en pacientes de diagnóstico reciente en las guías internacionales. Sin embargo, en nuestra población, aún permanece como uno de los fármacos más prescritos; en este estudio se encuentra que casi la mitad de los pacientes lo consumía. A pesar de esto, no encontramos relación estadísticamente significativa con prolongación del intervalo QTc. La toxicidad asociada con efavirenz en diversos reportes parece depender de polimorfismos de enzimas como CYP2B6, que tiene poca prevalencia en población iberoamericana y quizá puede explicar la ausencia de cambios electrocardiográficos en nuestra población.
Respecto a las coinfecciones, sólo el molusco contagioso se asoció de manera estadísticamente significativa con cambios en el QTc y fue el único factor que encontramos que producía prolongación. La neumonía atípica se asoció con reducción en el intervalo QTc, aunque sin que ésta fuera patológica. La vía fisiopatológica mediante la que éstas se asocian con cambios en el QTc no está clara y se requieren más estudios para determinar la importancia clínica de esta relación.
Ni los electrólitos séricos ni los lípidos se asociaron estadísticamente con cambios en el electrocardiograma.
A pesar de que todos los pacientes en este estudio que tenían tratamiento antirretroviral que incluía al menos efavirenz o inhibidor de proteasa no tenían electrocardiograma basal y, por tanto, sin electrocardiogramas subsecuentes, considerando la relación con la prolongación del QTc que se ha reportado en varios estudios. Algunos autores reportan una frecuencia de control con electrocardiograma en pacientes con VIH de menos de 20%, por lo que los efectos adversos pueden estar subdiagnosticados y esto contribuir a la elevada mortalidad en los pacientes con VIH secundaria a eventos cardiovasculares.











 text new page (beta)
text new page (beta)


