ANTECEDENTES
Los antiinflamatorios no esteroides (AINEs) no selectivos son un grupo variado y químicamente heterogéneo de fármacos que comparten actividades antiinflamatorias, analgésicas y antipiréticas, por lo que reducen los síntomas de inflamación, dolor y fiebre, respectivamente.
Los AINEs disponibles en el mercado actúan de manera similar mediante la inhibición de la enzima de la ciclooxigenasa 1 (cox-1) y la ciclooxigenasa 2 (cox-2) y, por tanto, la síntesis de prostaglandinas y tromboxanos. Se piensa que la inhibición de la cox-2, en parte, conlleva a la acción antiinflamatoria, analgésica y antipirética de los AINEs.
Este grupo de medicamentos fue prescrito por primera vez en 1917 con el descubrimiento de la aspirina y a partir del decenio de 1950 empezaron a producirse una gran cantidad de AINEs no selectivos.
Los AINEs constituyen uno de los grupos terapéuticos de más amplia prescripción en nuestro país y en el mundo; tan sólo en México se cuenta con más de 300 registros de medicamentos que dentro de su formulación contienen al principio activo denominado paracetamol.
En la actualidad los AINEs están disponibles en México, ya sea solos o en combinación con otros principios activos; estos medicamentos pueden adquirirse con receta médica y de venta libre, es decir, están disponibles en todas las farmacias de nuestro país.
En un estudio acerca de la automedicación se determinó que 68% de los medicamentos adquiridos fueron AINEs.
Estos medicamentos suelen ser de gran aceptación y demanda por parte de los prescriptores y de los consumidores porque comúnmente se administran para aliviar cualquier tipo de dolor leve a moderado, como dolores de cabeza, musculares, periodos menstruales, gargantas irritadas, dolores de muelas, de espalda, para reducir la fiebre y auxiliares en el tratamiento de la tos y la gripe, por lo que se considera un verdadero reto vigilar, investigar y establecer los perfiles de seguridad de estos medicamentos aplicando procedimientos de generación de señales.
La Organización Mundial de la Salud define una “señal” como la información de una posible relación causal entre una reacción adversa a medicamentos y un medicamento, la relación puede ser indeterminada o incompletamente documentada previamente.
Las señales suelen generarse en su mayor parte a partir del programa de notificaciones espontáneas, por lo que para poder detectar una señal, es necesario que se cuente con el reporte de reacciones adversas a medicamentos, lo que permitirá detectar en el menor tiempo posible problemas relacionados con la seguridad de los medicamentos, que no se habían observado previamente durante la realización de los ensayos clínicos debido a las limitaciones de los mismos, en lo que se refiere al número de pacientes, duración del estudio, tipo de población, cumplimiento del tratamiento, posibilidad de interacciones, padecimientos concomitantes, etc.
La identificación de señales en una base de datos de reacciones adversas requiere siempre la revisión cuidadosa de las notificaciones previamente reportadas y evaluadas, por lo que contar con información de buena calidad es la forma más rápida de identificar señales.
Al proceso de revisión de las notificaciones de reacciones adversas a medicamentos contenida en una base datos se le conoce como generación de señales.
Para generar una señal habitualmente se requiere más de una notificación. Sin embargo, el número de notificaciones necesario para conformar una señal depende de diferentes factores, entre los que pueden citarse los siguientes:
Medicamento (prevalencia de administración, tiempo que lleva en el mercado, existencia previa de una alerta acerca de él o del grupo terapéutico al que pertenece).
Reacción adversa (su incidencia basal, la gravedad, asociación frecuentemente con fármacos).
Notificaciones (número y calidad de la información contenida en las notificaciones).
Los métodos para llevar a cabo la generación de señales son el método cualitativo y el método cuantitativo.
Método cualitativo. Está orientado a revelar cuáles son las características de las reacciones adversas a medicamentos. Este método se centra en la calidad, por lo que para poder aplicarlo debemos contar con notificaciones con información completa que nos permita establecer vínculos causales entre un medicamento sospechoso y una reacción adversa a medicamentos mediante la aplicación de algoritmos, generalmente se necesita más de una notificación bien documentada para generar una señal, el Centro Nacional de Farmacovigilancia (CNFV) utiliza el diseño del (Cuadro 1).
Cuadro 1 Diseño del Centro Nacional de Farmacovigilancia para generar una señal
| Cierta | Probable | Posible |
|---|---|---|
| 3 | 0 | 0 |
| 2 | 2 | 0 |
| 2 | 0 | 4 |
| 1 | 4 | 0 |
| 1 | 0 | 8 |
Método cuantitativo. Este tipo de método está dirigido a determinar la cantidad de la información disponible. El método cuantitativo utilizado por el Centro Nacional de Farmacovigilancia para la generación de señales es la “razón de notificación proporcional (PRR) y el reporting odds ratio (ROR)”. Consiste en medir la proporción de notificaciones en la base de datos que contienen una combinación particular de un medicamento sospechoso y una reacción adversa a medicamentos de interés, y comparar esta proporción con la de las notificaciones con la misma reacción adversa a medicamentos, pero con el resto de los medicamentos contenidos en la misma base de datos. Si la PRR para una combinación de medicamento sospechoso y una reacción adversa a medicamentos de interés es significativamente alta, puede representar una señal.
Para poder llevar a cabo este método se utilizan las tablas de contención o tablas de 2 x 2 como sigue:
| Núm de reacciones de interés | Núm. de reacciones que no son de interés | Total | |
|---|---|---|---|
| Medicamento de interés | A | B | A + B |
| Otros medicamentos | C | D | C + D |
| Total | A + C | B + D | A + B + C + D |
Donde:
El valor A representa el número de reacciones adversas de interés que se han notificado y que se atribuyen al medicamento de interés.
El valor B representa el número de reacciones adversas distintas a las de interés que se han notificado y que se atribuyen al medicamento de interés.
El valor C representa el número de reacciones adversas de interés que se han notificado, pero están asociadas con otros medicamentos distintos al de interés.
El valor D representa el número de reacciones adversas distintas a las de interés que se han notificado y que están relacionadas con otros medicamentos distintos al de interés.
Para calcular la proporción de notificaciones del medicamento que contiene una reacción adversa a medicamentos de interés es: a/(a+b).
Para calcular la proporción de notificaciones de cualquier otro medicamento con una reacción adversa a medicamentos de interés es: c/(c+d).
El valor del PRR se calcula: PRR= a/ (a+b)//c/(c+d).
En este estadístico de desproporcionalidad, la hipótesis nula es que la proporción de notificaciones que contienen la reacción adversa a medicamentos de interés es la misma, independientemente de si contienen el medicamento sospechoso o no. En este caso el valor de PRR sería 1.
Así, si el PRR es superior a 1 y el límite inferior del intervalo de confianza a 95% significa que la proporción de notificaciones que contienen juntos el fármaco sospechoso y la reacción adversa a medicamentos de interés es mayor de la esperada, con base en el número de notificaciones de esa reacción adversa a medicamentos con otros medicamentos que existen en ese momento en la base de datos.
Existe otro método cuantitativo muy similar al PRR, que es el ROR (reporting odds ratio); en este otro planteamiento estadístico, la hipótesis nula se describe de forma similar como la razón entre las posibilidades de que una notificación cualquiera que contenga una reacción adversa a medicamentos determinada y de que no la contenga es la misma independientemente de que contenga o no el medicamento de interés.
Si el valor del ROR es superior a la unidad y el límite inferior del intervalo de confianza a 95% de probabilidad es superior a la unidad, significa que la probabilidad de que una notificación contenga juntos un medicamento y una reacción adversa a medicamentos determinados es mayor de la esperada con base en el número de notificaciones de la reacción determinada con otros medicamentos.
Así, el cálculo del ROR es: ROR = a/b//c/d
Donde a/b es la razón entre la probabilidad de que una notificación del medicamento de interés contenga la reacción de interés y la probabilidad de que no la contenga, y donde c/d es la razón entre la probabilidad de que una notificación de cualquier otro medicamento contenga la reacción de interés y la probabilidad de que no la contenga.
Además de compartir muchas actividades terapéuticas, los AINEs tienen en común varias reacciones adversas a medicamentos indeseables, principalmente gastrointestinales, la hemorragia gástrica es la más conocida. Sin embargo, en años recientes se han detectado nuevos riesgos atribuidos a la administración prolongada o de dosis excesivas de AINEs, como lo han anunciado la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), la Agencia Europea de Medicamentos (EMA) y la Dirección de Alimentos y Fármacos de Estados Unidos (FDA), que han emitido comunicados en sus páginas web alertando a su población de los riesgos cardiovasculares, hepáticos y gastrointestinales relacionados con la administración de algunos AINEs, estas reacciones adversas a medicamentos son de gran importancia debido a su gravedad que en algunos casos pueden llegar a ser fatales.
Como no existen estudios en población mexicana que puedan dar información del perfil de seguridad del consumo de los AINEs, y al considerar que la evaluación de la seguridad de medicamentos de alto consumo, como el caso de estos medicamentos es de principal preocupación, se realizó este estudio que tiene como finalidad obtener más datos del comportamiento de las reacciones adversas a medicamentos y los riesgos asociados con el consumo de AINEs en la población mexicana; hasta el momento en México sólo se han podido detectar daños hepáticos vinculados con la administración de nimesulida.
Para poder conocer los riesgos asociados con AINEs se utilizó la notificación espontánea, que es el método más utilizado en todo el mundo en los programas de vigilancia de los medicamentos, este sistema es barato, de fácil acceso, cubre todos los medicamentos y todas las reacciones adversas a medicamentos, además de permitir la generación de las señales. El método consiste en el reporte voluntario que realizan los profesionales de la salud en su práctica diaria, los cuales notifican posteriormente a su agencia regulatoria, una vez que la agencia regulatoria cuenta con la notificación de las reacciones adversas a medicamentos, éstas se clasifican en cuanto a su calidad de la información, gravedad/intensidad y causalidad, posteriormente se ingresan a una base de datos que permita en un determinado momento realizar los análisis estadísticos correspondientes con la finalidad de conocer cuáles son los medicamentos que pueden causar mayor riesgo a nuestra población, lo que permitirá a las autoridades regulatorias tomar acciones en etapas tempranas con la finalidad de disminuir el riesgo y con ello proteger la salud de la población mexicana.
El objetivo de este estudio es analizar las reacciones adversas a medicamentos asociadas con la administración de AINEs no selectivos reportadas al Centro Nacional de Farmacovigilancia durante el periodo 2011-2014 y con ello caracterizar los posibles riesgos en la población mexicana consumidora de estos medicamentos.
MATERIAL Y MÉTODO
Estudio en el que para el análisis descriptivo se utilizó la base de datos del Centro Nacional de Farmacovigilancia 2011-2014 que contiene las reacciones adversas a medicamentos asociadas con la administración de analgésicos provenientes de los diferentes integrantes del Programa Permanente de Farmacovigilancia, que se agruparon de acuerdo con: edad y sexo del paciente, procedencia de la reacción adversa a medicamentos, principio activo sospechoso, gravedad y causalidad de la reacción.
Para la cuantificación de los riesgos relacionados con la administración de AINEs no selectivos se aplicaron dos métodos estadísticos cuantitativos: el PRR (razón de notificación proporcional) y el ROR (reporting odds ratio).
RESULTADOS
Con la finalidad de conocer el número y las características de reacciones adversas a medicamentos que ocurrieron en la población mexicana relacionadas con la administración de analgésicos durante el periodo 2011-2014 se realizaron los filtros correspondientes en la base de datos del Centro Nacional de Farmacovigilancia que contiene en ese periodo 115,684 reacciones adversas registradas, tras haber concluido la realización de los filtros, se observó que 4553 reacciones adversas a medicamentos se asociaron con la administración de un AINE (3.9%).
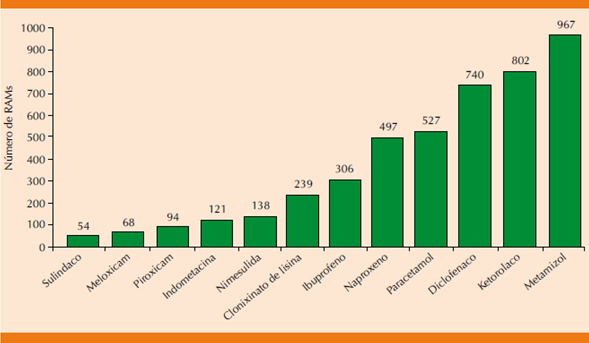
Como se muestra en la (Figura 1) el metamizol fue el más reportado con 21.1% del total de reacciones adversas registradas para este grupo de medicamentos.
El (Cuadro 2) muestra la frecuencia de las reacciones adversas a medicamentos asociadas con la administración de AINEs no selectivos y la frecuencia de las diferentes reacciones adversas a medicamentos que ocurrieron en nuestra población durante el periodo 2011 a 2014 con los diferentes analgésicos, de las que tras realizar la búsqueda bibliográfica se observó que 97% de las reacciones adversas a medicamentos se consideraron conocidas (reacciones adversas que ya están descritas en la información para prescribir del medicamento sospechoso).
Cuadro 2 Frecuencia de las reacciones adversas a medicamentos (RAMs) relacionadas con la administración de AINEs no selectivos (continúa en la siguiente página)
| RAMs | Núm. de RAMs | RAMs | Núm. de RAMs | RAMs | Núm. de RAMs |
|---|---|---|---|---|---|
| Erupción cutánea | 722 | Confusión | 8 | Neutropenia | 2 |
| Prurito | 481 | Bradicardia | 7 | Poliuria | 2 |
| Edema | 369 | Enzimas hepáticas aumentadas | 7 | Dolor en el riñón | 2 |
| Dolor abdominal | 297 | Choque anafiláctico | 6 | Rinorrea | 2 |
| Náuseas | 260 | Hiperemia | 6 | Varicela | 2 |
| Eritema | 195 | Malestar general | 6 | Hemorragia rectal | 2 |
| Hipotensión | 187 | Petequias | 6 | Agranulocitosis | 1 |
| Cefalea | 182 | Sensación de calor | 6 | Alucinación | 1 |
| Trastorno en la zona de aplicación | 158 | Agitación | 5 | Sensación de calor | 1 |
| Vómito | 154 | Estomatitis | 5 | Cara de luna llena | 1 |
| Disnea | 135 | Flatulencia | 5 | Coagulación intravascular diseminada | 1 |
| Mareo | 104 | Nerviosismo | 5 | Depresión | 1 |
| Taquicardia | 93 | Reflujo gastroesofágico | 5 | Dolor en cara | 1 |
| Urticaria | 92 | Úlcera gástrica | 5 | Dolor subesternal | 1 |
| Parestesia | 76 | Convulsiones | 4 | Encías sangrantes | 1 |
| Medicamento ineficaz | 73 | Hematuria | 4 | Esofagitis | 1 |
| Ansiedad | 68 | Letargia | 4 | Estridor | 1 |
| Somnolencia | 67 | Palidez | 4 | Extravasación | 1 |
| Diaforesis | 62 | Sialorrea | 4 | Síntomas tipo gripe | 1 |
| Diarrea | 54 | Síncope | 4 | Trastorno del habla | 1 |
| Irritación gástrica | 40 | Tos | 4 | Habones | 1 |
| Visión borrosa | 34 | Artralgia | 3 | Hematoma | 1 |
| Hipertensión | 33 | Ataxia | 3 | Hemorragia bucal | 1 |
| Estreñimiento | 28 | Calambres | 3 | Hepatitis | 1 |
| Melena | 28 | Disgeusia | 3 | Hígado, lesión | 1 |
| Debilidad | 23 | Epistaxis | 3 | Hiperactividad | 1 |
| Temblor | 23 | Fotofobia | 3 | Hipercaliemia | 1 |
| Anafilaxia | 21 | Laringospasmo | 3 | Hipertermia | 1 |
| Vértigo | 20 | Necrólisis epidérmica tóxica | 3 | Hipo | 1 |
| Boca seca | 19 | Paro respiratorio | 3 | Infarto cerebral | 1 |
| Hemorragia del tubo gastrointestinal | 19 | Síndrome de Stevens-Johnson | 3 | Infarto de miocardio | 1 |
| Rubefacción | 19 | Taquipnea | 3 | Insuficiencia hepática | 1 |
| Acúfenos | 15 | Afonía | 2 | Irritabilidad | 1 |
| Astenia | 15 | Anemia | 2 | Secreción anormal del lagrimal | 1 |
| Hematemesis | 15 | Artritis | 2 | Lengua aletargada | 1 |
| Dolor de garganta | 14 | Cianosis | 2 | Leucopenia | 1 |
| Dolor de tórax | 14 | Colecistitis | 2 | Melanosis | 1 |
| Escalofríos | 13 | Disestesia | 2 | Mucosa bucal áspera | 1 |
| Adinamia | 11 | Dolor de espalda | 2 | Oliguria | 1 |
| Pérdida de apetito | 11 | Estornudos | 2 | Cambio de color en la orina | 1 |
| Conjuntivitis | 11 | Faringe, trastorno | 2 | Otalgia | 1 |
| Fiebre | 11 | Glositis | 2 | Rigidez muscular | 1 |
| Hipotermia | 11 | Ictericia | 2 | Sensación de cuerpo extraño en la garganta | 1 |
| Insomnio | 10 | Insuficiencia renal aguda | 2 | Síndrome de Lyell | 1 |
| Mialgia | 10 | Insuficiencia respiratoria | 2 | Úlcera duodenal | 1 |
| Desvanecimiento | 9 | Lipotimia (no amnesia) | 2 | Administración fuera de indicación | 1 |
| Disfagia | 9 | Micción dolorosa | 2 | Vasculitis | 1 |
| Broncoespasmo | 8 | Muerte | 2 | ||
| Nasal, congestión | 2 |
Para observar la población que reportó más reacciones adversas a medicamentos por el consumo de AINEs, se estratificó por género y grupo etario. La población que tuvo el mayor número de reacciones adversas a medicamentos fue del género femenino con 3002 reacciones (66%), mientras que el porcentaje de reacciones adversas a medicamentos observadas en el género masculino fue de tan sólo 33.4% (1521 reacciones). Sólo 0.6% (n = 30) de las reacciones adversas a medicamentos recibidas por el Centro Nacional de Farmacovigilancia no especificaban el sexo del paciente que manifestó la reacción.
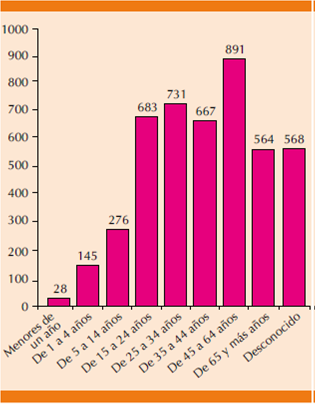
La (Figura 2) muestra la distribución de reacciones adversas a medicamentos por grupo etario en la que se observa claramente que el grupo de edad con más susceptibilidad de padecer reacciones adversas a los AINEs no selectivos fue el grupo de pacientes de 45 a 65 años de edad con 19.5% del total de las reacciones adversas a medicamentos registradas en la base de datos del Centro Nacional de Farmacovigilancia para este grupo terapéutico.
La (Figura 3) representa la distribución de reacciones adversas a medicamentos con base en su gravedad, para poder clasificar por intensidad/gravedad de las reacciones adversas a medicamentos asociadas con la administración de AINEs no selectivos registrados en la base de datos del Centro Nacional de Farmacovigilancia se utilizó la clasificación de eventos adversos, sospechas de reacción adversa y las reacciones adversas de los medicamentos disponibles en la Norma Oficial Mexicana NOM-220-SSA1-2012, Instalación y operación de la Farmacovigilancia. La (Figura 3) muestra que 59.6% (n = 2702) de las reacciones adversas a medicamentos se clasificaron como leves “ocurrencia médica que se manifiesta con signos y síntomas fácilmente tolerados, no necesitan tratamiento, ni prolongan la hospitalización y no necesariamente requieren la suspensión del medicamento sospechoso”.
En la (Figura 4) las reacciones adversas a medicamentos se agruparon con base en su causalidad. Para conocer la relación causal que existe entre la manifestación clínica y el medicamento sospechoso se evaluaron las reacciones adversas a medicamentos mediante la aplicación del algoritmo de Naranjo y las categorías probabilísticas de la OMS; las de mayor proporción fueron el grupo de reacciones adversas a medicamentos clasificadas como probables con 50.9% (n = 2320): “evento (manifestación clínica o un resultado anormal de una prueba de laboratorio) que sigue una secuencia de tiempo razonable posterior a la administración del medicamento y que difícilmente puede atribuirse a la evolución natural del padecimiento, enfermedades concomitantes o a la administración de otros medicamentos. Al suspender la administración del medicamento(s) sospechoso(s) se obtiene una respuesta clínica razonable”.
La (Figura 5) corresponde al número de reacciones adversas a medicamentos recibidas por cada integrante del Programa Permanente de Farmacovigilancia: industria químico-farmacéutica, centro estatal, centro institucional, paciente, profesional de la salud), estudios clínicos y unidades de farmacovigilancia hospitalaria, los principales notificadores de este grupo terapéutico fueron los Centros Estatales con 59.5% (n = 2711) seguidos de los Centros Institucionales con 27% (n = 1229).
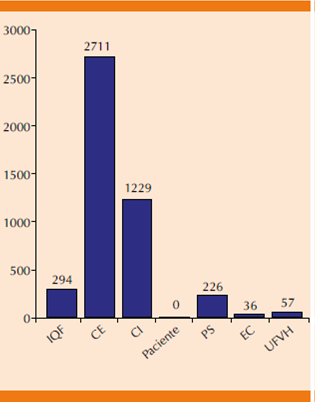
IQF: industria químico-farmacéutica; CE: centro estatal; CI: centro institucional; PS: profesional de la salud; EC: estudios clínicos; UFVH: unidades de farmacovigilancia hospitalaria.
Figura 5 Número de reacciones adversas a medicamentos por integrante del Programa permanente de farmacovigilancia.
Cuantificación de riesgos
La finalidad de todo programa de farmacovigilancia es generar señales, que permitirán conocer los riesgos vinculados con medicamentos en etapas tempranas de su comercialización y con ello lograr que la autoridad regulatoria competente pueda tomar medidas regulatorias que disminuyan los riesgos que conlleva la administración de determinado medicamento.
Las medidas regulatorias se toman con base en el riesgo, como se muestra en el (Cuadro 3).
Cuadro 3 Medidas regulatorias tomadas con base en el riesgo
| Tipo de riesgo | Medida regulatoria |
|---|---|
| Riesgo aceptable en condiciones de administración autorizadas | Vigilancia de rutina |
| Riesgo aceptable en ciertas condiciones | |
| Riesgo inaceptable en cualquier situación | Retirada: inmediata o progresiva |
Para conocer cuáles son los riesgos a los que se está expuesto cuando se consume un determinado AINE no selectivo se realizó el análisis descriptivo, los resultados fueron los siguientes: sangrado gastrointestinal, daño hepático y problemas cardiovasculares.
Posteriormente se aplicó el método cuantitativo razón de notificación proporcional (PRR) y el reporting odds ratio (ROR) con intervalo de confianza (IC) de 95%, con la finalidad de detectar qué AINEs no selectivos son los más propensos a causar estos problemas de seguridad.
Los Cuadros 4 y5 muestran los diferentes resultados obtenidos después de haber aplicado los métodos cuantitativos para determinar la probabilidad de los diferentes AINEs de producir sangrado gastrointestinal y daño hepático.
Cuadro 4 Cuantificación de riesgos gastrointestinales asociados con la administración de AINEs
| Medicamento | Sangrado GI | ROR | IC95% | PRR | IC95% |
|---|---|---|---|---|---|
| Sulindaco | 2 | 1.61 | 0.39-6.70 | 1.59 | 0.38-6.60 |
| Meloxicam | 3 | 1.94 | 0.60-6.29 | 1.9 | 0.59-6.15 |
| Piroxicam | 6 | 2.94 | 1.26-6.88 | 2.82 | 1.21-6.58 |
| Ibuprofeno | 9 | 1.29 | 0.64-2.56 | 1.28 | 0.64-2.55 |
| Naproxeno | 20 | 1.91 | 1.17-3.14 | 1.88 | 1.14-3.08 |
| Paracetamol | 9 | 0.7 | 0.35-1.39 | 0.7 | 0.35-1.40 |
| Diclofenaco | 37 | 2.81 | 1.87-4.23 | 2.72 | 1.81-4.09 |
Cuadro 5 Cuantificación de riesgos hepáticos asociados con la administración de AINEs
| Medicamento | Hepático | ROR | IC95% | PRR | IC95% |
|---|---|---|---|---|---|
| Nimesulida | 6 | 33.4 | 10.63- 104.94 | 31.99 | 10.19 - 100.46 |
| Paracetamol | 3 | 2.56 | 0.69-9.47 | 2.55 | 0.69-9.44 |
| Diclofenaco | 1 | 0.52 | 0.52 |
Con base en los resultados de PRR y ROR utilizando un IC95% los AINEs que parecen tener mayor probabilidad de causar sangrado gastrointestinal son piroxicam seguido de diclofenaco, el AINE que muestra menor probabilidad de riesgos gastrointestinales sigue siendo el paracetamol.
Respecto al daño hepático, la nimesulida sigue siendo el AINE más hepatotóxico seguido de paracetamol.
No se realizó el método estadístico para problemas cardiovasculares debido a que en la base de datos del Centro Nacional de Farmacovigilancia sólo existen dos casos de problema cardiovascular (un infarto de miocardio relacionado con la administración de diclofenaco y un infarto cerebral relacionado con la administración de ibuprofeno).
DISCUSIÓN
Los AINEs con más reacciones adversas a medicamentos reportadas al Centro Nacional de Farmacovigilancia por la población mexicana es el metamizol, ketorolaco, diclofenaco y paracetamol.
Las reacciones adversas reportadas al Centro Nacional de Farmacovigilancia para estos medicamentos se consideran conocidas (previamente descritas en la bibliografía).
La infranotificación sigue siendo un problema muy grande en México que dificulta tomar acciones que permitan garantizar la seguridad de estos medicamentos porque la incidencia de las mismas está muy por debajo de lo reportado en la bibliografía.
Los resultados obtenidos muestran que las mujeres tienen mayor susceptibilidad de padecer reacciones adversas a medicamentos por AINEs no selectivos, hecho que podría explicarse con los siguientes supuestos.
En México existe mayor población de sexo femenino en comparación con el masculino.
Las mujeres tienden a tener mayor cantidad de tejido adiposo, lo que permite mayor acumulación del medicamento en el sistema que a su vez favorece la aparición de reacciones adversas a medicamentos, así como mayor cantidad de hormonas.
La administración de analgésicos es mayor en la población femenina en comparación a la masculina.
El grupo etario más susceptible de padecer una reaccion adversa a medicamentos fue de 45 a 65 años. Existen varias justificaciones para explicar este suceso.
La población adulta es más susceptible de padecer una reacción por acumulación del medicamento dentro del organismo, este efecto de acumulación puede deberse a varios factores, entre los que se mencionan los siguientes: función hepática y renal disminuida, menor volumen de distribución, menor cantidad de proteína plasmática, etc.
En este grupo de población, generalmente las personas cursan con algún cuadro de dolor crónico, como artritis, artrosis, lumbalgia, etc., por lo que el consumo de AINEs se vuelve más frecuente durante esta etapa de la vida.
Los principales notificadores para este grupo de medicamentos fueron los centros estatales y centros institucionales, que brindan siempre un alto grado de calidad en la información contenida en las notificaciones, lo que facilita el establecimiento de una relación causal entre el medicamento y la manifestación clínica, lo que queda demostrado en la Figura 4 donde se observa que sólo en 3.33% no pudo establecerse una asociación causal.
La mayor parte de las reacciones adversas se clasificaron como leves o moderadas conocidas, la frecuencia de estas reacciones adversas a medicamentos se encuentra dentro de los valores encontrados en la bibliografía internacional para este tipo de medicamentos, lo que dificulta al Centro Nacional de Farmacovigilancia poder generar una señal.
Las reacciones adversas a medicamentos en piel fueron las más reportadas: erupción cutánea (n = 710), prurito (n = 481), eritema (n = 195), trastorno en la zona de aplicación (n = 158) y urticaria (n = 92). Una explicación para este suceso es que estas manifestaciones clínicas siempre se atribuyen al consumo de un medicamento además de ser fácilmente visibles.
El método cualitativo sigue siendo muy difícil de aplicar por el Centro Nacional de Farmacovigilancia debido a las siguientes situaciones:
Información ya conocida. Los principales notificadores de reacciones adversas a medicamentos para este grupo terapéutico son centros estatales y centros institucionales, que dan alta calidad de la información, lo que facilita la aplicación de algoritmos y poder establecer una asociación causal, la que generalmente se encuentra entre probable y posible. Sin embargo, el problema radica en que actualmente los centros estatales y centros institucionales reportan reacciones adversas conocidas, por tanto, no puede efectuarse la generación de señales. Derivado de lo anterior el Centro Nacional de Farmacovigilancia sigue realizando actividades de fomento a la notificación, con la finalidad de que los centros institucionales, centros estatales y profesionales de la salud no sólo reporten las reacciones adversas a medicamentos conocidas (erupción cutáneas, prurito, etc.) sino también lo que hasta el momento no se sospecha pueda atribuirse a un medicamento y que podría considerarse en un inicio reacción adversa a medicamentos no relacionada con el medicamento (problemas cardiovasculares, hepáticos, hematológicos, etc.). Esto es la finalidad de los programas de Farmacovigilancia, detectar reacciones adversas a medicamentos inesperadas, verificar si existe una relación causal y finalmente tomar medidas administrativas en pro de la salud de nuestra población.
Información incompleta. En la actualidad en nuestra base de datos existen reacciones adversas a medicamentos graves como muertes relacionadas con la administración de AINEs; sin embargo, esta información es proveniente de la IQF, en cuyas notificaciones no se establecen las causas que originaron la muerte, las fechas de inicio y término de tratamiento y de la reacción adversa a medicamentos, por lo que es imposible para el Centro Nacional de Farmacovigilancia establecer una relación causal.
Infranotificación. Se sabe que las señales pueden generarse por un incremento en reacciones adversas a medicamentos conocidas; sin embargo, en México el número de reacciones adversas a medicamentos reportadas está muy por debajo de lo esperado (tomando como base lo que indica la bibliografía) en relación con las grandes cantidades de medicamento que anualmente consume nuestra población.
Hasta el momento el método cuantitativo sigue siendo el más utilizado por el Centro Nacional de Farmacovigilancia para la generación de señales y ha generado los siguientes resultados:
Piroxicam y diclofenaco mostraron ser los AINEs con mayor riesgo de sangrado gastrointestinal, esto difiere de lo publicado por otras agencias regulatorias que mencionan que el AINE con mayor riesgo gastrointestinal es el naproxeno, asimismo, de acuerdo con la bibliografía internacional y con los resultados de este estudio el medicamento menos gastrotóxico sigue siendo el paracetamol, aunque es un problema del que no está totalmente exento.
En términos de daño hepático, la nimesulida sigue siendo el medicamento con mayor riesgo (la COFEPRIS emitió con base en la evidencia presentada por el Centro Nacional de Farmacovigilancia recomendaciones que implican no prescribir en población pediátrica, que deberán cumplir todos los titulares de registro sanitario que contengan medicamentos con este principio activo), seguido por el paracetamol (actualmente el Centro Nacional de Farmacovigilancia está realizando análisis de la información con la finalidad de emitir recomendaciones que garanticen la administración segura de los medicamentos que contengan este principio activo, hasta ahora se han emitido dos comunicados en la página de la COFEPRIS que informan a los profesionales de la salud y a sus consumidores de los riesgos hepáticos de este medicamento).
Debido a la infranotificación que existe en nuestro país, sigue siendo imposible para el Centro Nacional de Farmacovigilancia conocer cuál es el riesgo cardiovascular al que está expuesta nuestra población consumidora de AINEs no selectivos, por lo que trabajar en la estimulación del reporte sigue siendo una tarea prioritaria para todos los integrantes del Programa Permanente de Farmacovigilancia de México.
El metamizol fue el medicamento con más reacciones adversas a medicamentos reportadas, este medicamento se ha retirado en varios países por causar reacciones hematológicas, principalmente agranulocitosis; sin embargo, durante el periodo revisado sólo ocurrió un caso de agranulocitosis en el que no estaba implicado el metamizol.
Las reacciones dermatológicas de importancia (necrólisis epidérmica tóxica, síndrome de Stevens-Johnson y síndrome de Lyell) se manifestaron mayormente con nimesulida.
El Centro Nacional de Farmacovigilancia sigue haciendo las mismas recomendaciones que otras agencias regulatorias han emitido en sus páginas web con respecto a la administración segura de AINEs.
CONCLUSIONES
Este estudio permitió conocer los riesgos relacionados con AINES no selectivos en la población mexicana, así como cuáles son las reacciones adversas más frecuentes causadas por estos medicamentos. La infranotificación en nuestro país sigue siendo muy alta; sin embargo, este estudio da un posible comportamiento del perfil de seguridad de los AINEs no selectivos en nuestra población, esta información podrá ser utilizada por la agencia reguladora nacional con la finalidad de llevar a cabo acciones que permitan disminuir los riesgos y con ello proteger la salud de la población mexicana.











 text new page (beta)
text new page (beta)