ANTECEDENTES
La disección coronaria espontánea, también conocida como disección coronaria primaria,1 es causa poco reconocida de dolor precordial, síndrome coronario agudo, arritmias ventriculares y muerte súbita.2-4 Fue descrita por primera vez en 1931 por Pretty en el British Medical Journal, tras realizar la autopsia de una mujer de 42 años de edad que inició con dolor precordial, dolor abdominal y vómito, que posteriormente tuvo muerte súbita.2,5,6 A continuación comunicamos el caso de una paciente de 43 años que ingresó al Hospital Ángeles Pedregal, en quien se estableció el diagnóstico de disección coronaria espontánea.
CASO CLÍNICO
Paciente femenina de 43 años de edad, originaria y residente de la Ciudad de México, sin antecedentes heredofamiliares ni personales patológicos de importancia. Sedentaria, negó tabaquismo, alcoholismo y toxicomanías. Antecedentes gineco-obstétricos: menarca a los 11 años, telarca a los 13 años, fecha de última menstruación: 22 de agosto de 2015, ritmo de 26x4, negó dismenorrea o sangrado abundante, negó método de planificación familiar al momento, con un embarazo y una cesárea, ningún parto ni aborto, cursó con embarazo sin complicaciones con resolución quirúrgica por elección de la paciente, al momento de su ingreso cursaba el puerperio quirúrgico mediato, sin otros antecedentes personales patológicos.
Acudió a valoración al servicio de urgencias por padecer un cuadro caracterizado por disnea de medianos esfuerzos, diaforesis profusa, náusea sin llegar al vómito, asociado con dolor torácico opresivo en reposo de dos horas de evolución, intensidad 8/10, sin irradiaciones, exacerbantes o atenuantes. Signos vitales: presión arterial 100/60 mmHg, frecuencia cardiaca 85 lpm, frecuencia respiratoria 20 rpm, temperatura 37°C, saturación de oxígeno 91% al aire ambiente, índice de masa corporal 24.2 (peso 70 kg, talla 1.70 m). A la exploración no se encontraron hallazgos de relevancia, se inició estudio con toma de radiografía de tórax en la que no se observaron alteraciones pleuropulmonares, el ultrasonido abdominal tipo FAST no evidenció sangrado o hemorragia abdominal, se encontró útero en involución con coágulos endometriales. El ultrasonido Doppler de miembros pélvicos reportó permeabilidad venosa de miembros inferiores con ectasia venosa de predominio izquierdo, así como edema de tejidos blandos de predominio izquierdo sin datos de trombosis. Triage cardiaco con BNP de 260 y dímero D elevado (4200), los demás parámetros estaban en rangos normales. Estudios de laboratorio centrales: destacó la elevación de enzimas cardiacas con troponina I en 820.5, CPK 208, CPK-MB 12 y dímero D > 10,000, los demás estudios de laboratorio en rangos normales (biometría hemática y química sanguínea de 28 elementos). El electrocardiograma se encontró con elevación del segmento ST en cara anteroseptal (Figura 1) con normalización del segmento ST posterior a dosis única de isosorbide sublingual. El ecocardiograma transtorácico evidenció contractibilidad global y segmentaria del ventrículo izquierdo anormales (daño del tabique interventricular desde el tercio medio hasta el ápice), diámetro telediastólico con dilatación ligera y el espesor de las paredes normales. FEVI 44% y acortamiento de 22%. Válvula mitral con esclerosis ligera e insuficiencia valvular ligera. Insuficiencia pulmonar y tricuspídea, ambas funcionales y de grado ligero (presión sistólica de la arteria pulmonar 50 mmHg, hipertensión arterial pulmonar moderada), función del ventrículo derecho sin alteraciones (desplazamiento sistólico del plano del anillo tricuspídeo = 21.3 mm), ambas aurículas con diámetros dilatados: moderada aurícula derecha, moderada aurícula izquierda, sin trombos intracavitarios, sin alteraciones del pericardio.
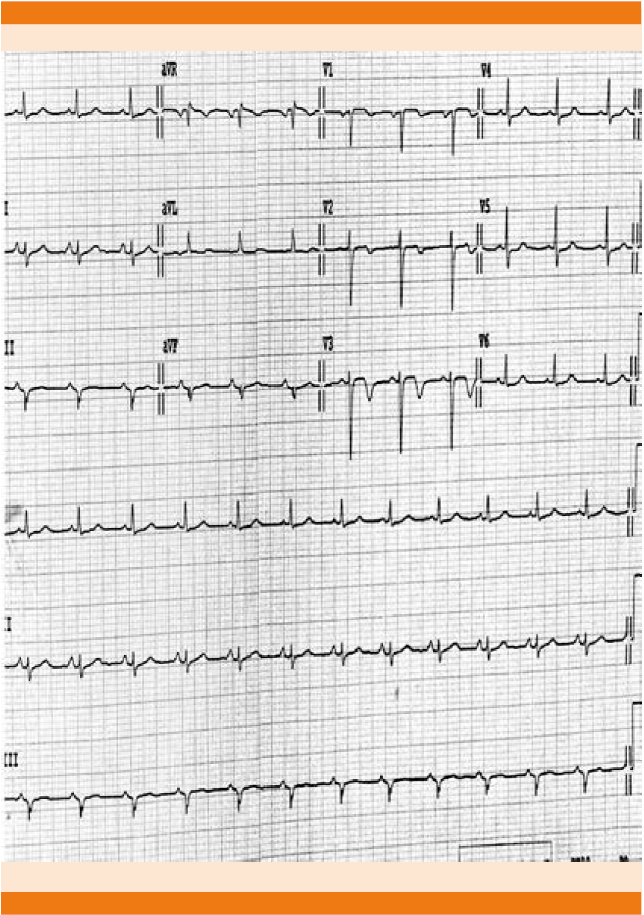
Figura 1 Electrocardiograma de 12 derivaciones en reposo que demuestra lesión subendocárdica en cara anteroseptal.
Se inició tratamiento con isosorbide, enoxaparina, clopidogrel, atorvastatina y nitroglicerina en infusión, se decidió realizar coronariografía diagnóstica mediante acceso radial derecho, con los siguientes hallazgos: tronco con lesiones flujo TIMI 3, la descendente anterior mostró al inicio de segmento proximal imagen de disección con flujo distal TIMI 0, circunfleja sin lesiones flujo TIMI 3, coronaria derecha en su rama posterolateral lesión en vaso con flujo < 50% flujo TIMI 3 (Figura 2).
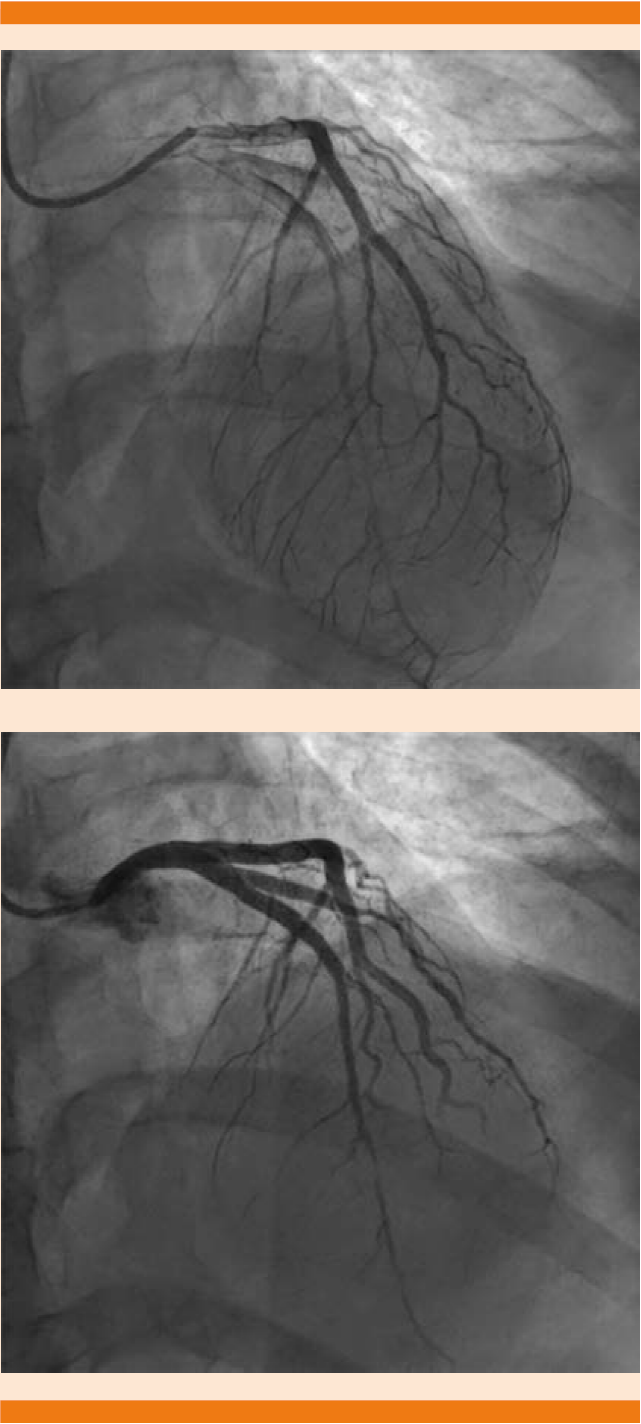
Figura 2 Se observa tronco con lesión flujo TIMI 3, descendente anterior en su segmento proximal con imagen de disección con flujo distal TIMI 0, coronaria derecha con rama posterolateral con flujo < 50%, TIMI 3.
Después del procedimiento la paciente pasó a la unidad de cuidados coronarios en donde se mantuvo hemodinámicamente estable, con signos vitales estables, sin requerir apoyo de aminas vasoactivas ni ventilación mecánica invasiva, se agregó al tratamiento carbegolina. Se mantuvo con adecuada evolución, bajo vigilancia durante cinco días sin eventualidades hasta el día de su egreso.
DISCUSIÓN
La disección coronaria espontánea es el resultado de la separación de las capas de la pared arterial por un hematoma intramural que crea un falso lumen, en ausencia de traumatismo o causa iatrogénica.2),(5 La separación puede ser entre la íntima y la capa media, o entre esta última y la adventicia. La hemorragia en el falso lumen puede afectar el flujo sanguíneo del lumen verdadero, causando isquemia miocárdica, angina inestable, infarto o muerte súbita.2
Se clasifica a menudo en dos grandes grupos: ateroscleróticos y no ateroscleróticos. El primer grupo afecta primordialmente al sexo masculino y a sujetos de edad avanzada. El grupo no ateroesclerótico afecta más comúnmente a mujeres jóvenes y a su vez se divide en: asociada con el embarazo, relacionada con enfermedades del tejido conectivo, vasculitis, ejercicio extenuante, drogas (cocaína) e idiopático.7 En esta revisión nos enfocaremos en la disección coronaria espontánea asociada con el embarazo y periparto.
La disección coronaria espontánea constituye la tercera causa de infarto agudo de miocardio durante el embarazo, e incrementa significativamente la morbilidad y mortalidad materno-fetal.8 La incidencia global de disección coronaria espontánea en series angiográficas varía entre 0.28 y 1.1% hasta 2% en algunos estudios;7 cada año se reporta una incidencia de 0.26 casos por 100,000 personas (0.33 en mujeres, 0.18 en hombres) en sujetos estadounidenses;1 sin embargo, la verdadera incidencia de disección coronaria espontánea puede estar subestimada debido a la asociación frecuente entre disección coronaria espontánea y muerte súbita.9
La relación hombre:mujer de disección coronaria espontánea es de 1:4.10 Afecta a 70% en mujeres jóvenes con media de edad de 39 años, entre 30 y 54% de los casos ocurren en el periparto.(2),(3) La disección coronaria espontánea es responsable de 27% de los infartos agudos de miocardio durante el embarazo, tasa que aumenta hasta 50% en el periparto, por lo que representa la principal causa de infarto agudo de miocardio.11 En promedio, los casos se manifiestan antes del parto (con media de 32.5 semanas de gestación, con intervalo inferior de 23 semanas de gestación) o después del parto (con media de 30 días posparto con intervalo superior de 90 días).12 La mortalidad a corto plazo se reporta en 38 a 40%;13 sin embargo, la supervivencia posterior al cuadro agudo predice un excelente resultado a largo plazo.14
La mayoría de los pacientes no tiene factores de riesgo cardiovascular;3 sin embargo se han identificado como posibles factores de riesgo los cambios hormonales, el estrés hemodinámico y los cambios autoinmunitarios relacionados con el periparto.2
Los mecanismos fisiopatológicos se desconocen en su totalidad.2 Se ha asociado con infiltrados eosinofílicos, que se han encontrado en la capa adventicia de las coronarias en autopsias de pacientes con diagnóstico de disección coronaria espontánea. Los gránulos eosinofílicos contienen numerosas sustancias líticas (colagenasa, peroxidasa, fosfatasa ácida, etc.), estas sustancias son las que, en teoría, conducen a la disección de las arterias coronarias. Durante el parto y el periodo periparto los eosinófilos infiltran el útero, la existencia de eosinófilos en las arterias coronarias pueden ser una manifestación sistémica de ese proceso. Además, se ha documentado que el estrógeno y la progesterona pueden inducir la liberación de gránulos por parte de los eosinófilos. También se cree que las sustancias liberadas en los gránulos de los eosinófilos desencadenan espasmos coronarios que, a su vez, son un factor que provoca la disección.2
Agregado a esto, existen diversos factores hormonales durante el embarazo y el puerperio que inducen la producción excesiva de hormonas que generan cambios microestructurales en las fibras elásticas, e incluyen pérdida de la ondulación normal de éstas, fragmentación de las fibras reticulares, degeneración de la colágena y producción deficiente de la misma, hipertrofia del músculo liso, disminución y cambios de composición de mucopolisacáridos.15
El aumento fisiológico en el volumen sanguíneo y el gasto cardiaco observado en el embarazo magnifican las fuerzas del flujo sanguíneo y estos cambios hemodinámicos favorecen la disección de arterias coronarias.15
En términos anatómicos, la arteria descendente anterior izquierda es la localización más frecuente que representa más de 63.9% de las disecciones coronarias,2,16 seguida por la arteria coronaria derecha (26.5%), la circunfleja izquierda (19.4%) y la arteria coronaria izquierda (6.5%). La afección de más de un vaso es menos frecuente; sin embargo, cuando se comparan hombres y mujeres, las mujeres padecen con mayor frecuencia daño de dos o tres vasos (12.3 a 17.5%).17
La forma de manifestación abarca todo el espectro en el que se manifiestan los síndromes coronarios agudos, pero el promedio de edad es menor y sin factores de riesgo cardiovascular;5 es decir, pueden ser desde asintomáticos hasta angina estable-síndrome coronario agudo sin elevación del segmento ST (SICASEST) en 20%, con elevación del segmento ST (SICACEST) en 80% e infarto agudo de miocardio o choque cardiogénico en 20%.9,14
El dolor torácico es el principal síntoma (91%), seguido de síncope (23%), disnea, diaforesis y náuseas.18 Los mareos y lipotimias rara vez son los síntomas de manifestación. En otros casos se manifiesta exclusivamente por disnea, que puede evolucionar rápidamente en el choque cardiogénico, secundario a la grave disfunción sistólica global.11 Las arritmias letales, taquicardia ventricular de respuesta ventricular media acelerada y fibrilación ventricular, como forma de manifestación, se han documentado en 8 a 14%.9
Los estudios de laboratorio no son muy orientadores porque en términos generales se encuentran dentro de parámetros normales (biometría hemática, tiempos de coagulación, algunos reactantes de fase aguda, perfil hormonal y anticuerpos). Algunos que demuestran elevaciones (velocidad de sedimentación globular, proteína C reactiva, fibrinógeno, leucocitos, factor reumatoide, homocisteína, IgA, IgG, anticardiolipina IgM y anticuerpos fosfolipídicos) son inespecíficos y no se han relacionado directamente con disección coronaria espontánea.19
El diagnóstico de disección coronaria espontánea es fundamentalmente incidental, al momento de realizar coronariografía por un cuadro compatible con angina/síndrome coronario agudo con o sin elevación del segmento ST.
Existe una clasificación propuesta por Saw que se basa esencialmente en tres formas de manifestación angiográfica20
Tipo 1: caracterizada por tinción de contraste de la pared arterial con múltiples defectos de llenado. Fácilmente diagnosticado mediante angiografía.
Tipo 2: caracterizada por cambios abruptos del diámetro del vaso, con demarcación del diámetro normal hasta estrechamiento difuso (> 20 mm) y la participación frecuente de los segmentos medio-distal. Habitualmente requiere otros estudios intravasculares (ultrasonido endoscópico o tomografía de coherencia óptica) para su identificación.
Tipo 3: caracterizada por ausencia de cambios ateroescleróticos en otras arterias, lesiones largas (11-20 mm) y estenosis. También requiere estudios intravasculares, por la apariencia muy similar a las lesiones ateroescleróticas.
Están descritas en la bibliografía técnicas invasivas y no invasivas para establecer el diagnóstico de disección coronaria espontánea. Las técnicas invasivas incluyen el ultrasonido endovascular, que puede definir con alta precisión el grado de oclusión del lumen verdadero, así como la distribución espacial y el grado de heterogeneidad del falso lumen; sin embargo, no muestra con precisión la superficie endotelial y hematomas intramurales más pequeños.21
La tomografía de coherencia óptica (TOC) es el patrón de referencia para evaluar las características morfológicas de la disección coronaria, identificar el desgarro de entrada, medir con alta precisión la extensión circunferencial y longitudinal de la lesión, definir la afección de ramas laterales y detectar cualquier trombo intraluminal asociado, tiene la capacidad para descartar todas las angiografías dudosas. Sin embargo, se debe usar con precaución porque para obtener las imágenes se usan volúmenes mayores de medio de contraste, con mayor velocidad, presión de flujo o ambas.21
En las técnicas no invasivas se encuentra la tomografía computada multidetección, que ha demostrado ser superior a la angiografía coronaria al mostrar los hematomas subadventiciales en las disecciones coronarias angiográficamente no visibles, esta técnica está recomendada cuando el paciente se encuentra hemodinámicamente estable y la probabilidad de requerir angiografía coronaria es baja.21 Los datos en relación con el uso de resonancia magnética son insuficientes, por tanto, no puede establecerse una recomendación clara.
En la actualidad no existen guías de recomendación para el tratamiento óptimo de la disección coronaria espontánea.4 La decisión de tratamiento debe tomarse según cada paciente, teniendo en consideración el estado clínico, los hallazgos ecocardiográficos, así como estudios angiográficos e imágenes endovasculares para reconocer la ubicación, extensión y características de la disección, el grado de deterioro del flujo o reducción del área luminal, así como la disponibilidad del tratamiento a prescribir.4,17 El tratamiento puede dividirse en tres grandes grupos: médico, endovascular y quirúrgico.
El tratamiento médico conservador se recomienda a los pacientes con disección coronaria < 50%, flujo TIMI 3 o pacientes asintomáticos; incluye antiagregantes plaquetarios, heparina, betabloqueadores, nitratos y diuréticos.13 El tratamiento antiplaquetario dual con ácido acetilsalicílico y un inhibidor del receptor de las plaquetas P2Y12 (clopidogrel), la administración de ASA a dosis baja 60-150 mg no ha mostrado mayor riesgo de efectos adversos en la madre o el bebé;22 asimismo, el clopidogrel en el posparto puede administrarse teniendo en cuenta que no se recomienda durante la lactancia.14 Inicialmente el tratamiento antiplaquetario dual se combina con heparina, ya sea no fraccionada o de bajo peso molecular, porque podría reducir el riesgo de formación y propagación del trombo, debido al tamaño molecular de ambas, no cruza la barrera placentaria y no plantea un riesgo teratogénico o hemorrágico para el feto.23 El tratamiento de antiagregación plaquetaria dual debe administrarse por lo menos durante un año y posteriormente se recomienda la administración de ácido acetilsalicílico como parte de la prevención secundaria. Los inhibidores de la glucoproteína IIb/IIIa están contraindicados.24
La anticoagulación oral, dada como tratamiento adjunto a la antiagregación dual, no se ha estudiado; la administración de anticoagulantes orales se realiza de manera empírica, tiene como fundamento la asociación entre disección coronaria y pseudoaneurismas trombosados.25
Del mismo modo, existe controversia con el uso de trombólisis porque lisar el trombo, si bien reestablece el flujo en el lumen verdadero, también podría generar una extensión del hematoma intramural, propagando la disección coronaria.25 Debe tenerse en cuenta que la administración de trombolíticos se asocia con 8.1% de complicaciones hemorrágicas maternas, como hematoma retroplacentario, abruptio placentae, sangrado uterino y hemorragia posparto,26 así como pérdida del embarazo de 5.8%, lo que genera la preocupación de que los trombolíticos puedan favorecer el parto pretérmino;26 por tanto, en el contexto de disección coronaria asociada con el embarazo, es mejor evitar la trombólisis, el embarazo es una contraindicación relativa para ésta en cualquier circunstancia.27
La administración de inhibidores de renina-angiotensina-aldosterona (IECA) y betabloqueadores puede desempeñar un papel en el alivio del estrés miocárdico, al disminuir la frecuencia cardiaca y, como consecuencia, disminuir el consumo miocárdico de oxígeno; sin embargo los IECAs están contraindicados en el embarazo.13,28 Otra opción terapéutica son los bloqueadores de canales de calcio porque pueden prescribirse para tratar el componente vasospásmico asociado con la disección coronaria.25 Al tener en consideración la fisiopatología de la enfermedad, en donde existe inflamación periadventicial eosinofílica, se ha sugerido la terapia inmunosupresora agresiva (prednisona y ciclofosfamida) que resulta en la cicatrización angiográfica de la disección; sin embargo, no se sabe si el alivio es atribuible a fármacos inmunosupresores o es espontáneo.28),(29 Las propiedades antiinflamatorias de las estatinas podrían ayudar al proceso de curación, pero se desconoce la eficacia de este tratamiento en la disección coronaria espontánea.28
En caso de optar por el tratamiento conservador, es necesario una estrecha vigilancia, con control angiográfico durante los primeros tres meses, porque la desaparición del hematoma intramural toma uno a tres meses, esto puede ser un punto de corte para valorar según el estado hemodinámico, clínico y el sitio de lesión si se requiere realizar tratamiento endovascular o quirúrgico.30
La evolución puede ser hacia cicatrización espontánea (en 50% de los casos), disección persistente con o sin isquemia o formación de un pseudoaneurisma.31
El tratamiento endovascular con colocación de stent debe considerarse en los pacientes inestables, con disecciones que provoquen un estrechamiento severo (70-99%), oclusión del vaso (flujo TIMI 0 o 1) o ambos. El stent proporciona una férula que asegura la canalización del vaso y sella el desgarro de entrada de la disección.32 Se desconoce si en el contexto de estos pacientes es mejor el stent liberador de fármaco en comparación con los convencionales.14
La tasa de éxito reportada con el tratamiento endovascular es muy variable, desde 65 hasta 90% según las diferentes fuentes de información.32 No debemos olvidar los inconvenientes o complicaciones que conlleva el procedimiento, en primer lugar existe hasta 11.6% de probabilidad de extender la disección del sitio afectado, pero sobre todo en las arterias sanas, esto último ocurre, incluso, en 50% en las pacientes embarazadas; en segundo lugar podría fomentarse el extravasado del medio de contraste y, tercero, meter la guía en el falso lumen.33 Al extenderse la disección se tiene la necesidad de colocar múltiples stents, con todos los riesgos que esto conlleva.32
La cirugía es el tratamiento preferido en pacientes estables con afectación de la bifurcación de la arteria coronaria izquierda, daño de múltiples vasos, tratamiento médico fallido o tratamiento endovascular ineficaz con lesiones progresivas.34 La cirugía de revascularización coronaria ha demostrado ser factible y eficaz, con resultados favorables y buen perfil de seguridad. A pesar de esto, debemos tener en consideración sus limitaciones, en primer lugar, no puede realizarse en pacientes en los que la disección se ha extendido hasta la periferia del árbol coronario; en segundo lugar, en múltiples ocasiones la inestabilidad del paciente lleva a la necesidad de realizar tratamiento endovascular de urgencia y, tercero, incluso 73% de los injertos se obstruyen, por el flujo competitivo posterior al alivio espontáneo de la disección.35,36
Aunque la supervivencia a largo plazo después de una disección coronaria espontánea es favorable, existe alta tasa de recurrencia que va desde 17 hasta 46%. El tratamiento de las recurrencias es mucho más agresivo; en primera instancia se prescribe tratamiento endovascular o quirúrgico.19
Los datos del mayor registro de disecciones coronarias espontáneas (87 pacientes) define una tasa de supervivencia de 98.9% a un año y de 93.3% a 10 años.8











 text new page (beta)
text new page (beta)


