ANTECEDENTES
Riñón de mieloma
Gran parte de los pacientes con mieloma múltiple inician con signos y síntomas relacionados con la infiltración de células plasmáticas en hueso u otros órganos o debido al daño causado por el exceso de cadenas ligeras kappa.
La enfermedad renal es común en el mieloma múltiple, su patología es heterogénea y puede involucrar diferentes mecanismos (Cuadro 1).1,2
CASO CLÍNICO
Paciente masculino de 79 años de edad, con antecedentes de relevancia, quien acudió a valoración por padecer un cuadro de un mes de evolución con dolor en la región inguinal derecha tipo urente, intensidad 5/10, con irradiación al glúteo y fosa poplítea ipsilaterales, que limitaban la bipedestación y deambulación, además de pérdida de 5 kg aproximadamente.
El paciente fue valorado de manera externa donde se solicitaron estudios de laboratorio e inició tratamiento con analgésicos, inhibidor de bomba de protones (diclofenaco, ácido acetil salicílico, tramadol y omeprazol), complejo B y deflazacort, 30 mg cada 12 horas por tres días sin mejoría, por lo que acudió a urgencias a valoración.
A su ingreso destacaba palidez generalizada, soplo sistólico en foco aórtico irradiado a carótidas, dolor a la palpación en la región inguinal derecha que se irradiaba a la región glútea y fosa poplítea ipsilaterales, sin datos de irritación peritoneal, con maniobra de Lasegue y de Bragard positivas; los estudios de laboratorio revelaron anemia macrocítica, normocrómica, hiperglucemia, hipercalemia moderada, elevación de azoados con tasa de filtrado glomerular de 6.5 mg/dL por CKD-EPI con relación BUN/Cr de 10.5 y examen general de orina con proteinuria significativa. Los datos de los estudios de laboratorio al ingreso se muestran en los Cuadros 2 y 3.
Debido a la insuficiencia renal, anemia y proteinuria se decidió su ingreso con los diagnósticos diferenciales de: mieloma múltiple, nefritis tubulointersticial por medicamentos, vasculitis asociada con p-ANCA, lesión renal aguda obstructiva por crecimiento prostático.
La cuantificación de proteínas en orina de 24 horas mostró proteinuria en rango nefrótico, así como anticuerpos antineutrófilos que descartaron vasculitis ANCA positiva (Cuadro 4).
La lesión renal, hipercalcemia, elevación de B-2 microglobulina y anemia orientaron hacia el diagnóstico de mieloma múltiple, por lo que se solicitó electroforesis de proteínas en sangre y orina; sin embargo, no se encontró elevación de paraproteína (Cuadros 5 a 7).
Ante la sospecha de mieloma múltiple, a pesar de la ausencia de paraproteína, se decidió realizar toma de biopsia renal que mostró depósito de cadenas ligeras kappa en la membrana basal tubular por inmunofluoresencia, lo que confirmó la sospecha de mieloma múltiple y nefropatía por cilindros de cadenas ligeras (Cuadro 8).
DISCUSIÓN
El termino riñón de mieloma o nefropatía de cilindros de cadenas ligeras se refiere a la existencia de grados variables de lesión renal, causada por la gran cantidad de cadenas ligeras monoclonales y su precipitación en los túbulos renales que casi lleva a insuficiencia renal crónica, con elevación de la concentración de creatinina sérica (> 2 mg/dL en aproximadamente 20% de los pacientes); de esta manera inicia hasta 50% de los pacientes, la causa es multifactorial debido a lesión tubular directa por sobrecarga proteica, deshidratación, hipercalcemia y la administración de medicamentos nefrotóxicos, incluidos los diuréticos de asa ampliamente prescritos para estimular diuresis y calciuria.1-5
Previo al advenimiento de la terapia dialítica, la enfermedad renal crónica era la segunda causa de mortalidad en pacientes con mieloma múltiple después de las infecciones.
Por definición, el diagnóstico de nefropatía de cilindros de cadenas ligeras kappa indica la existencia de mieloma múltiple y se considera un evento definitorio de la enfermedad.6,7
Patogénesis
En condiciones normales, las células plasmáticas sintetizan moléculas completas de inmuno-globulinas y cadenas ligeras libres. La cantidad habitual de cadenas ligeras sintetizadas por día es de 0.9 gramos, caracterizadas por su bajo peso molecular (22,000 kDa) y su rápida eliminación por filtrado glomerular con reabsorción en túbulos proximales y catabolismo lisosomal (99% de la producción diaria), con excreción mínima de cadenas ligeras en orina. Su catabolismo, dependiente de receptores localizados en el borde luminal de los túbulos proximales, es superado en casos de producción exagerada de cadenas ligeras o en casos de producción de cadenas ligeras anormales, como cadenas en forma de dímeros, tetrámeros o cadenas glucosiladas durante el proceso de secreción.7
Las cadenas ligeras se precipitan en los túbulos como resultado de su unión a la proteína de Tamm-Horsfall (uromodulina) favorecida por el ambiente ácido de la nefrona distal y la presencia de cloruro de sodio facilitando su agregación y llevando finalmente a la formación de cilindros intratubulares, obstrucción y extravasación de cadenas libres al intersticio, con la consecuente inflamación y fibrosis intersticial, aunado al cambio de fenotipo de las células del túbulo contorneado proximal, que migran hacia el espacio intersticial en donde adquieren morfología miofibroblástica e inician la producción de matriz extracelular.8-10 Se han descrito otros mecanismos de lesión tubulointersticial en el riñón de mieloma caracterizados por activación del factor nuclear κB que estimula la transcripción de genes codificando las proteínas responsables de la transición epitelio-mesénquima, particularmente interleucina 6, 8 y proteína quimiotáctica de macrófagos y monocitos. Las cadenas ligeras también activan la síntesis de factor de crecimiento transformador β (TGF-β), uno de los factores profibróticos mas importantes. Se ha documentado que las cadenas ligeras son activadores más potentes de TGF-β que la albúmina en el síndrome nefrótico y más potentes que incluso uno de los estimuladores más conocidos de su síntesis, la ciclosporina.11
La nefropatía por cilindros de cadenas ligeras está presente en 40 a 60% de los casos de las biopsias renales realizadas en pacientes con mieloma múltiple.7-10
Manifestaciones clínicas
Una proporción significativa de pacientes con concentración elevada de creatinina no tienen diagnóstico previo de mieloma múltiple, y éste será revelado como parte de la evaluación de la enfermedad renal. La proteinuria es una manifestación común de afección renal en mieloma múltiple, que se observa en más de 80% de los casos, de los que 15-20% la manifiestan en rangos nefróticos excediendo 3.5 gramos en 24 horas. La tira reactiva urinaria habitual no detecta el exceso de proteínas a pesar del exceso en su excreción debido a su detección selectiva de albúmina. El sedimento urinario, por lo general, no muestra hallazgos y ocasionalmente pueden observarse pocos cilindros granulosos. Otras anomalías bioquímicas incluidas en los hallazgos se relacionan con la disfunción tubular, incluyendo acidosis, hipercalemia e hiponatremia, puede llegar a ocurrir síndrome de Fanconi adquirido, la disfunción tubular proximal es probablemente la manifestación renal de mieloma múltiple más sutil, particularmente difícil de detectar y presente en casos en que la afección se debe al subtipo Vk1 de cadenas ligeras, llamada en estos casos nefropatía por inclusión cristalina de cadenas ligeras.12 Esta condición es particularmente poco frecuente (1% de los casos). Los estudios de imagen, a no ser que se trate de enfermedad renal crónica, no muestran alteraciones.1,13-16
La enfermedad renal crónica secundaria a riñón de mieloma confiere peor pronóstico con menor supervivencia comparada con otras causas.
Diagnóstico
A pesar de su progresión rápida, con incremento rápido en la concentración de creatinina sérica de uno a tres meses, el diagnóstico debe sospecharse en todos los pacientes mayores de 40 años con incremento en la concentración de creatinina en un lapso menor a seis meses a pesar de un sedimento urinario normal.
El diagnóstico definitivo se establece mediante biopsia renal; sin embargo, un diagnóstico presuntivo puede establecerse en presencia de cadenas ligeras séricas libres con valores mayores a 1500 mg/L y excreción urinaria baja de albúmina.
Se sugiere que en todo paciente con insuficiencia renal de menos de seis meses de evolución sin causa aparente se realicen los siguientes estudios (Cuadro 9):12
Cadenas ligeras libres
Cuantifica la concentración de cadenas ligeras circulantes kappa y lambda. La relación kappa/lambda normal sérica es de 0.26-1.25. Una concentración elevada de cadenas ligeras libres en asociación con una relación anormal de cadenas ligeras indica un proceso proliferativo plasmático monoclonal, la cuantificación sérica es más sensible que la urinaria.17
En 2014 el grupo de trabajo internacional de mieloma actualizó los criterios para el diagnóstico, en los que se implementó la relación de cadenas ligeras libres ≥ 100 como criterio de malignidad (relación cadena involucrada-cadena no involucrada).18
La interpretación de la cuantificación sérica de cadenas ligeras libres debe tomar en cuenta la tasa de filtrado glomerular porque su filtración disminuye directamente con ésta.17,19
Cuantificación de proteínas en orina de 24 horas y electroforesis
Proveen un estimado de la excreción de proteína y una relación de la proteína urinaria (albúmina/cadenas ligeras); sin embargo, a pesar de su alta sensibilidad, no diferencia de otros procesos como amiloidosis o enfermedad por cadenas ligeras.19
Electroforesis e inmunofijación de proteínas séricas
La electroforesis es un método que permite detectar y clasificar las proteínas globulares mediante la aplicación de un campo eléctrico que separa las globulinas en alfa, alfa2, beta y gammaglobulinas de acuerdo con su carga eléctrica. El resultado se muestra en una gráfica, por lo que una onda elevada con base angosta (“pico monoclonal”) en el área correspondiente a las gammaglobulinas sugiere la existencia de inmunoglobulinas monoclonales en exceso.
Inmunofijación
Es un método complementario a la electroforesis que utiliza antisueros dirigidos contra un tipo específico de cadena ligera o pesada, lo que permite identificar el subtipo de proteína monoclonal.
Biopsia renal
El diagnóstico de riñón de mieloma se basa en la demostración de cilindros formados por cadenas ligeras de inmunoglobulina en la porción distal de la nefrona, el tipo de cadena ligera del cilindro es el mismo que el encontrado en suero y orina. Mediante la técnica de inmunofluorescencia se pueden observar patrones de marcaje según el tipo de cadena ligera que predomine (Figura 1). En la composición de los cilindros, además de cadenas ligeras, pueden encontrarse inmunoglobulinas y restos.20
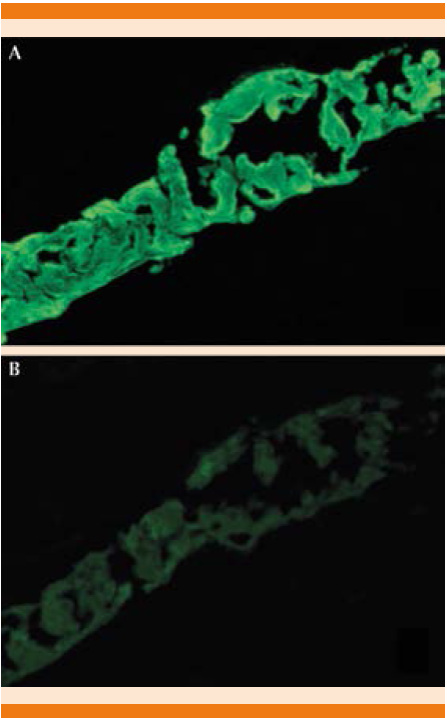
Figura 1 Técnica de inmunofluorescencia en la que se observa fuerte positividad (+++) para cadenas κ (A) y leve (+/-) para cadenas λ (B).
Las alteraciones histopatológicas más importantes del riñón de mieloma ocurren a nivel tubular y en el intersticio. Los cilindros varían en tamaño y tienen un aspecto rígido y quebradizo, con la tinción de hematoxilina y eosina se observan intensamente eosinofílicos (Figura 2) y frecuentemente están rodeados por macrófagos y células gigantes.20,21
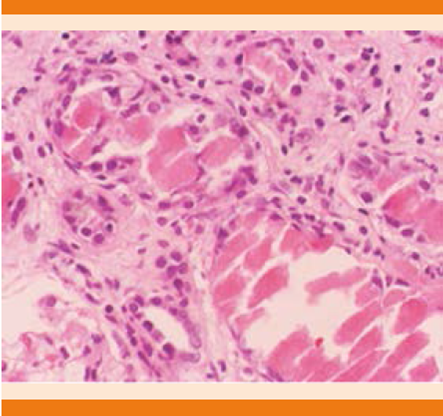
Figura 2 Nefropatía por cilindros, tinción de hematoxilina y eosina. Cilindros eosinofílicos que se observan “quebradizos”. Los túbulos se observan atróficos con aplanamiento epitelial, intersticio fibrótico con infiltrado linfocitario.
El epitelio tubular, por lo general, se encuentra atrófico, existan o no cilindros, en ocasiones se evidencia regeneración epitelial, lo que sugiere reversibilidad de la lesión tubular en caso de no existir atrofia. Las células epiteliales tubulares pueden contener cristales romboidales o en forma de aguja, en estos casos el proceso se asocia con la aparición de síndrome de Fanconi.
En el intersticio puede observarse inflamación y fibrosis, que ocurren como resultado de la expansión de los cilindros hasta generarse la ruptura del túbulo, condicionando nefritis intersticial. La extensión de los cilindros se relaciona directamente con el grado de daño túbulo-intersticial y la gravedad de la alteración en la función renal.
En algunos cilindros puede observarse amiloide, así como en el intersticio y los vasos sanguíneos, pero no parece estar relacionado con el daño renal.
No suele haber infiltración renal por células plasmáticas. Los glomérulos no están afectados o existen cambios inespecíficos, como hipercelularidad mesangial, engrosamiento de membranas basales o ambos.21
Tratamiento
La base del tratamiento del riñón de mieloma es la nefroprotección mediante hidratación del paciente, procurando volúmenes urinarios mayores a 3 L/día, además de evitar nefrotóxicos, como inhibidores del sistema renina-angiotensina-aldosterona, así como antiinflamatorios no esteroides, aminoglucósidos y medio de contraste; los diuréticos de asa disminuyen la solubilidad de la proteína de Tamm-Horsfall al incrementar el sodio intraluminal, por lo que también deben evitarse. La hipercalcemia debe corregirse con el fin prevenir la aparición de diabetes insípida nefrogénica secundaria a vasoconstricción y depleción de volumen, para lo cual los bisfosfonatos son especialmente efectivos; sin embargo, debe mantenerse vigilancia estrecha por la posibilidad de toxicidad renal.
El tratamiento temprano del mieloma, así como la reducción de la concentración sérica de cadenas ligeras se ha asociado con mayor tasa de recuperación renal para lo que los agentes quimioterapéuticos talidomida y bortezomib han mostrado ser efectivos.22,23
En los pacientes que inician con riñón de mieloma el inhibidor de proteosoma 26S bortezomib se ha convertido en el fármaco de elección, porque además de reducir las cadenas ligeras circulantes, inhibe vías dependientes del NF-κB (factor nuclear κB), reduciendo la liberación de citocinas e induciendo factores antiapoptósicos específicos de las células tubulares.22
CONCLUSIÓN
La enfermedad renal puede ser la primera manifestación clínica de mieloma múltiple, por lo que en los pacientes con enfermedad renal sin causa establecida, es necesario buscar elevación de gammaglobulinas en sangre y orina, incluidas cadenas ligeras; debe recordarse que la relación entre ellas igual o superior a 100 se considera criterio diagnóstico de malignidad.











 text new page (beta)
text new page (beta)


