ANTECEDENTES
El sueño en el paciente críticamente enfermo se caracteriza por alteraciones del ritmo circadiano y electroencefalográficas durante el sueño y la vigilia. Los pacientes críticamente enfermos son más susceptibles a los efectos adversos fisiopatológicos que imponen los trastornos del sueño y del ciclo circadiano en comparación con los pacientes ambulatorios. El estudio y la evaluación del sueño y de los patrones polisomnográficos en el enfermo grave imponen un verdadero reto ante la compleja interacción sueño-ritmos circadianos-enfermedad crítica.
Las alteraciones del sueño en el enfermo grave se asocian con una gran variedad de trastornos, de los que destacan disfunción del sistema inmunitario, mayor riesgo de infecciones, disfunción de los procesos anabólicos y regenerativos, disfunción neurocognitiva, delirio, estancia prolongada en la unidad de terapia intensiva (UTI) e incremento de la mortalidad.1
Este trabajo tiene como objetivo la revisión de la bibliografía científica relacionada con las alteraciones del sueño en los pacientes hospitalizados en la UTI; incluyendo investigaciones recientes acerca del efecto que genera la interacción ventilación mecánica-paciente en las características del sueño, sus mecanismos, las implicaciones clínicas y el potencial efecto terapéutico de la melatonina para su tratamiento, con la finalidad de alertar a nuestros colegas dedicados a la atención de los enfermos graves a tomar en cuenta este aspecto tan importante y poco evaluado, invitándolos a generar investigaciones futuras.
Fisiología del sueño
El sueño es un estado fisiológico, activo, recurrente y reversible en el que baja el nivel de vigilancia con disminución de la percepción y la capacidad de respuesta a los estímulos ambientales. Su condición de reversible lo diferencia del estado de coma. Esta aparente depresión funcional esconde un estado dinámico, con regulación propia, en el que se activan grupos neuronales que desempeñan funciones diferentes a las de la vigilia. Por su condición de proceso activo está en estrecha relación con la vigilia y es necesario para la salud general del organismo. Su disfunción es causa de trastornos físicos y psíquicos. El sueño tiene su propia regulación neurológica (consolidación de la memoria y función de algunos neurotrasmisores), endocrino-metabólica (regulación de la temperatura corporal y producción hormonal), inmunológica y cardiorrespiratoria. El sueño es un estado conductual, generalmente espontáneo, que precisa de un ambiente y postura adecuados y genera cambios electroencefalográficos que lo diferencian de la vigilia. En el sueño pueden diferenciarse distintos grados de profundidad con base en diferentes variables fisiológicas que cambian en sus diversas etapas. Algunos de los marcadores del sueño son el electroencefalograma, los movimientos oculares y el tono muscular. Mediante los estudios polisomnográficos se evalúan estos indicadores y se diferencian las distintas fases del sueño.2,3
Regulación de la vigilia y el sueño
En la regulación del ciclo sueño-vigilia interviene todo el sistema nervioso central, aunque existen áreas con mayor implicación. El sueño se produce por un proceso inhibidor activo. El ciclo sueño-vigilia se regula mediante una red neuronal compleja que induce la activación e inhibición de neuronas que dan como resultado la vigilia o el sueño. La vigilia se mantiene fundamentalmente gracias a la actividad del sistema reticular activador ascendente, el tallo cerebral y el hipotálamo posterior. Los principales neurotrasmisores implicados en este proceso son la noradrenalina, la dopamina y la acetilcolina. Es preciso, además, activar la corteza cerebral de forma difusa, función que realiza el tálamo mediante núcleos talámicos no específicos gracias a la liberación de glutamato. Otras estructuras implicadas en el mantenimiento o inducción de la vigilia son: el núcleo del rafe en el mesencéfalo, el locus ceruleus, el núcleo basal de Meynert, la amígdala, el núcleo supraquiasmático, el núcleo tuberomamilar del hipotálamo, la sustancia nigra, el área ventro-tegmental y los núcleos tegmentales ventrolateral y pedunculopontino. Los neurotrasmisores excitadores producidos por estos núcleos contribuyen en distinta medida a estimular la corteza cerebral, son activados por el sistema reticular activador ascendente, que a su vez recibe impulsos sensoriales externos (visuales, táctiles y auditivos) y estímulos internos (la adrenalina que pasa a través de la región postrema del bulbo). El sistema reticular activador ascendente activa la corteza cerebral por dos vías: una vía dorsal formada por los núcleos intralaminares del tálamo y una vía ventral a través del hipotálamo lateral y núcleos basales.4,5
Asimismo, los péptidos excitatorios sintetizados en la región posterior y lateral del hipotálamo llamados hipocretinas u orexinas son neuromoduladores cuyos receptores se encuentran fundamentalmente en lugares del sistema nervioso central relacionados con el despertar y el mantenimiento de la vigilia: locus ceruleus del tallo cerebral y núcleo tuberomamilar del hipotálamo. En diversos estudios se ha demostrado que las hipocretinas están relacionadas con la facilitación de la actividad motora y el tono muscular, con el despertar, con el sueño REM y tienen funciones de regulación metabólica, neuroendocrinas y vegetativas.
En resumen, los estímulos internos y externos activan el sistema reticular activador ascendente y las hipocretinas, poniendo en marcha la liberación de neurotrasmisores excitatorios que se activan simultáneamente de manera difusa provocando el estado de vigilia.5
El sueño de ondas lentas no REM (NREM) se origina cuando las neuronas que producen hipocretinas son inhibidas por descargas gabaérgicas originadas en el núcleo ventrolateral preóptico (VLPO) del hipotálamo, que actúa como una especie de interruptor para el comienzo del sueño. Intervienen también los núcleos serotoninérgicos del rafe del tronco cerebral, el núcleo del fascículo solitario y el prosencéfalo basal. Las neuronas serotoninérgicas bloquean la actividad motora y disminuyen la intensidad de las aferencias sensoriales. Asimismo, al inhibirse las hipocretinas se inhiben, aunque no completamente, las estructuras que mantienen la vigilia. Los núcleos tegmentales laterodorsales y pedunculopontinos responsables de los movimientos oculares rápidos sí se inhiben totalmente. De manera progresiva se va desactivando el sistema reticular activador ascendente permitiendo la aparición de ritmos recurrentes tálamo-corticales debido a la desaferentación de la corteza por la inhibición de las fibras sensoriales ascendentes, lo que da lugar a los husos de sueño. De este modo disminuye la actividad motora, desaparecen los movimientos oculares rápidos y se generan ondas lentas típicas del sueño NREM.
La fisiología del sueño REM es más compleja porque se producen simultáneamente fenómenos antagónicos. Existe depresión profunda del estado de vigilia, pero con un trazado en el electroencefalograma que muestra actividad cortical similar a la que se registra durante la vigilia con ojos abiertos. Asimismo, hay hipotonía generalizada junto con movimientos oculares rápidos, que dan su nombre a esta fase del sueño.
Estas funciones son controladas por diferentes núcleos del tronco cerebral, el lugar fundamental de generación del sueño REM es la protuberancia. En la porción más rostral del sistema reticular activador ascendente se encuentra el núcleo reticular pontis oralis que es el origen de la descarga de acetilcolina que activa la actividad cortical y produce los ritmos theta de hipocampo. Asimismo, el locus ceruleus productor de noradrenalina y el sistema serotoninérgico del rafe se encuentran silentes durante el sueño REM. Los axones de los núcleos tegmento-dorsolaterales y pedunculopontinos forman una vía que por el haz tegmento-reticular llega al bulbo medial liberando glutamato en el núcleo magnocelular (de Maghoun y Rhines) y acetilcolina en el paramediano. Desde ahí por el tracto reticuloespinal lateral llega a las células del asta anterior de la médula que son inhibidas por la liberación de glicina, lo que da lugar a una hiperpolarización e inhibición postsináptica que origina la atonía muscular. Los movimientos oculares rápidos se producen por activación de los núcleos tegmento-dorsolaterales y pedunculopontinos que estimulan a los núcleos abducens en la porción dorsomedial de la protuberancia. A veces se pueden acompañar de mioclonías faciales y en los miembros superiores por activación de los núcleos reticularis pontis caudalis y magnocelular.
Las ondas pontogeniculooccipitales aparecen de forma fásica durante el sueño REM por la estimulación del tegmento dorsolateral pontino, lo que da lugar a las “ondas en diente de sierra” y facilita los movimientos oculares rápidos.6-11
El sueño es un estado fisiológico complejo y necesario para la vida. Está constituido por dos fases: la fase de movimientos oculares no rápidos (NREM) y la fase de movimientos oculares rápidos (REM). Cada una de éstas difiere principalmente por sus características anatómicas, fisiológicas y conductuales. Cada periodo se compone de cuatro a seis ciclos en toda la noche con duración de 90 a 110 minutos en los que se progresa de un estado de alerta a sueño ligero y sueño profundo. Durante el estado de alerta un individuo con los ojos cerrados muestra actividad alfa en el electroencefalograma; el estado I representa la transición de alerta a sueño y se caracteriza por el reemplazo del patrón alfa por uno de bajo voltaje y patrón de frecuencia mixta; éste también se conoce como sueño ligero y corresponde a 3-8% del tiempo total de sueño. El estado II representa 40 a 55% del tiempo total de sueño y se caracteriza por incremento en la amplitud del electroencefalograma. El estado III corresponde a 20% del tiempo total de sueño y se distingue por transición en el electroencefalograma a ondas de amplitud alta. En el sueño REM se reduce la actividad muscular y ocupa 20 a 25% del tiempo total de sueño. En el paciente grave el patrón del sueño se caracteriza por la mala calidad y fragmentación de éste, despertares frecuentes con predominio durante las fases 1, 2 y REM, disminución de la fase 3 y del sueño REM. Un sueño inadecuado es la principal causa de fatiga y somnolencia diurnas, esto constituye una epidemia en todas las edades, la encuesta anual realizada por la Fundación Nacional del Sueño en Estados Unidos reveló datos alarmantes de incluso 64% de las personas de 30 a 64 años y 40% de 18 a 29 años con somnolencia diurna algunos días del mes, que interfiere con sus actividades sociales y laborales. Los adultos mayores duermen un promedio de 7 horas al día entre semana y 7.1 horas en promedio durante el fin de semana; los adultos jóvenes duermen un promedio 6.7 horas entre semana con aumento a 7.6 horas el fin de semana. Se necesita un promedio de 7.5 a 8 horas de sueño con pocas interrupciones para lograr un rendimiento óptimo. Esto debe tomarse en cuenta en pacientes en la unidad de cuidados intensivos (UTI) con alteraciones crónicas del sueño, porque la privación de éste se exacerba por la gravedad de la enfermedad y el ambiente de la UTI.12,13
Factores relacionados con la privación del sueño en pacientes críticamente enfermos
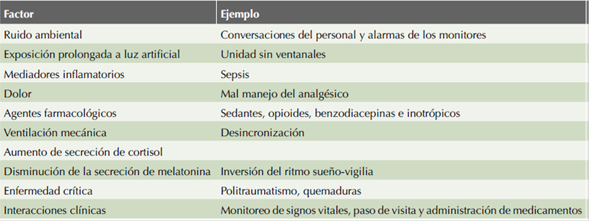
Se han descrito diferentes factores de riesgo asociados con la privación del sueño en la UTI, de los que destacan:14,15
Gravedad de la enfermedad. En diferentes estudios se ha demostrado que la gravedad de la enfermedad está relacionada con alteraciones del sueño en pacientes críticamente enfermos. Se observó que al aumento en el puntaje de APACHE II correlaciona de manera muy estrecha con mayor índice de despertar, menor tiempo de sueño y disminución del sueño de ondas lentas en comparación con voluntarios sanos.
Dolor. En una encuesta realizada a pacientes, familiares y profesionales de la salud, el dolor se identificó como uno de los principales factores generadores de estrés en el ambiente hospitalario. Los síndromes de dolor crónico producen importantes alteraciones en la continuidad del sueño, observadas hasta en 50% de estos pacientes.
Trastornos del sueño. Los pacientes con trastornos primarios del sueño reportan alteración de la continuidad del sueño con la consiguiente privación de éste de manera crónica. El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) se relaciona con dificultad para la liberación de la ventilación mecánica, arritmias cardiacas, isquemia cardiaca e insuficiencia cardiaca.
En el Cuadro 1 se muestran los factores que repercuten en la arquitectura del sueño.
Efecto en la alteración del sueño en las unidades de cuidados intensivos (UTI)
La Clasificación Internacional de los Trastornos del Sueño define al trastorno ambiental del sueño como la alteración de éste debido a un factor ambiental perturbador que provoca fatiga, insomnio y somnolencia durante el día. En la UTI se han identificado diversos factores asociados con el trastorno ambiental del sueño, de los que destacan:
Ruido excesivo. Se ha encontrado que el ruido excesivo en la UTI tiene efectos nocivos, entre los que destacan: aumento de la presión arterial sistémica, retraso en la cicatrización de heridas, alteración de la función inmunitaria, aumento de la frecuencia cardiaca y del estrés en general, también se ha documentado que el ruido afecta la eficiencia y la concentración mental en el personal médico, lo que pudiera contribuir al aumento en la tasa de errores médicos y en la duración de la hospitalización. Las alarmas de los monitores, teléfonos, televisores, beepers, máquinas de ventilación y las conversaciones del personal de salud son contribuyentes importantes del ruido ambiental en la UTI. Varios estudios han demostrado que el ruido en la UTI puede alcanzar su punto máximo por encima de los valores recomendados para el día (45 dB) y la noche (35 dB). En la actualidad las unidades de cuidados intensivos han implementado protocolos para tratar de reducir el ruido y sus efectos nocivos. Las medidas implementadas incluyen: proporcionar tapones de oídos, eliminar el uso de intercomunicadores, restringir el uso de teléfonos, reducir los volúmenes de las alarmas, cerrar la puerta de los cubículos y, en algunos casos, adecuar los horarios para la limpieza general de la UTI. 16
Luz artificial. La luz es la señal primaria ambiental responsable de establecer el ciclo circadiano. Se ha demostrado que los niveles de luz en el rango de 100 a 500 lux afectan la secreción nocturna de melatonina, los niveles de 300 y 500 lux tienen efecto en el marcapasos circadiano humano. Los niveles de lux en la UTI sobrepasan por mucho estos rangos. La desincronización de la secreción de melatonina producida en ambientes de luz excesiva es más común en pacientes graves sometidos a ventilación mecánica, condición frecuente en la UTI.17
Interacción personal de salud-paciente. A pesar de los modernos y complejos equipos de monitoreo, se producen un promedio de 41 a 52 interacciones personal de salud-paciente durante la noche, con promedio de 8 intervenciones por hora, la mayor parte debida a ajuste en las infusiones endovenosas, administración de medicamentos, aplicación de escalas de enfermería y determinación de signos vitales, todo ello interrumpe el sueño con la consiguiente alteración de éste.18,19
Medicamentos. Los medicamentos administrados con frecuencia en este grupo de pacientes, como benzodiacepinas, propofol y opioides, se relacionan estrechamente con alteraciones en los patrones fisiológicos de sueño. El tratamiento del dolor es fundamental con base en la adecuada estrategia terapéutica individualizada a cada enfermo. El dolor es potenciador de la fragmentación del sueño y factor de riesgo de delirio (Cuadro 2).
Ventilación mecánica y sueño
La ventilación mecánica en la UTI tiene varios objetivos, como mejorar el intercambio gaseoso y mantener en reposo los músculos respiratorios, estas dos condiciones generalmente se dan durante el sueño fisiológico. Además de los factores ambientales, severidad de la enfermedad, intensidad de la luz, ruido ambiental, medicamentos, la ventilación mecánica y sus diferentes modalidades son un factor de riesgo importante para reducir el tiempo y calidad del sueño; además, causan una arquitectura anormal del mismo. Las principales causas de las alteraciones del sueño son: colocación del tubo endotraqueal, la incapacidad de comunicación y la ansiedad.20
Pero la pregunta que debemos hacernos es: ¿tiene algún efecto en el sueño el uso de ventilación mecánica? Esta pregunta se responde de la siguiente manera: incluso en ausencia de sueño, existe un patrón circadiano y de control respiratorio que depende de la hora del día, la capacidad residual funcional, el volumen espiratorio forzado, la resistencia de las vías respiratorias y la forma de responder ante hipoxia o hipercapnia se modifica, por tanto, el uso de la ventilación mecánica crea un ambiente hostil en los pacientes ventilados.
La consecuencia más evidente en pacientes ventilados es la fragmentación del sueño porque estos enfermos pueden requerir sedación profunda con administración de relajantes musculares según el padecimiento asociado. Esta fragmentación del sueño representa un peligro en el bienestar psicológico y fisiológico del paciente. Además, la privación del sueño tiene varios efectos secundarios: incremento del catabolismo de proteínas, disminución de la función inmunológica y alteraciones de la mecánica respiratoria que condicionan el fracaso en el retiro de la ventilación mecánica. Durante el sueño, las necesidades metabólicas del paciente disminuyen, por tanto, la demanda de la ventilación mecánica también lo hace; de igual manera, en esta fase existe inhibición de estímulos corticales y la regulación ventilatoria depende casi exclusivamente de los quimiorreceptores; por tanto, la disminución en la presión parcial de CO2 en sangre arterial (PaCO2) es un potente inhibidor de la ventilación. Estas dos circunstancias podrían favorecer en pacientes predispuestos la hiperventilación durante el sueño. Si la PaCO2 disminuye por debajo del rango de apnea-hipopnea (determinado valor de PaCO2 que inhibe la ventilación), ocurre apnea central. Algunas enfermedades pueden favorecer la aparición de estas apneas, como el infarto cerebral y la insuficiencia cardiaca y las apneas centrales se ven reflejadas en el incremento de la fragmentación del sueño.20-23
El funcionamiento de un ventilador, incluidas sus alarmas, puede interrumpir el sueño y afectar negativamente a los pacientes críticos, lo que resulta en disminución de la inmunidad celular, de la respuesta fisiológica a la hipoxemia e hipercapnia, con efecto, sobre todo, en la duración de los días de ventilación mecánica. Según el modo de ventilación será la calidad del sueño en el paciente críticamente enfermo. Los pacientes con ventilación controlada por presión pueden tener mayor fragmentación del sueño porque se producen apneas centrales que son menos frecuentes en los pacientes que son ventilados por volumen. Las apneas centrales son responsables de los esfuerzos ineficaces y representan 10% del total de fragmentación del sueño. El porcentaje de esfuerzos ineficaces se relaciona con un soporte de presión bajo y con el incremento en el número de respiraciones asistidas. Para reducir el riesgo de esfuerzos ineficaces se debe incrementar la presión soporte para alcanzar un volumen corriente de 8 mL/kg de peso corporal predicho. Parece un enfoque razonable para reducir al mínimo este problema. Parthasarathy y Tobin observaron que las apneas centrales y los esfuerzos ineficaces eran responsables de 10% del total de fragmentación del sueño y esto se relaciona directamente con la inadecuada configuración del ventilador.24
Cooper señala que ningún paciente críticamente enfermo ventilado tiene un sueño normal y propone criterios que predisponen a la interrupción del sueño: Escala de Coma de Glasgow de 10, dosis de medicamento (lorazepam o morfina 10 mg/kg/h). Estos mismos pacientes tenían somnolencia diurna y deterioro cognitivo posterior a su egreso de la UTI. En conclusión, la selección de un modo de ventilador influye marcadamente en la calidad del sueño en un paciente en estado crítico y la respuesta del paciente a los parámetros del ventilador puede diferir considerablemente entre el sueño y la vigilia.25
White26 demostró que la respuesta a la hipercapnia y a la hipoxemia se reducía de manera significativa posterior a la privación de sueño. En el estudió de Chen y Tang27 se observó que después de 30 horas de privación de sueño, la eficiencia de los músculos respiratorios se reducía, lo que repercutía en su capacidad para el manejo de carga en un periodo, que a su vez se traducía en disminución del volumen corriente y del volumen espiratorio forzado en el primer segundo.
Efecto de la disfunción y fragmentación del sueño en el paciente grave
Son bien conocidos los efectos nocivos derivados de la disfunción y fragmentación del sueño en los pacientes internados en la UTI. La mayor parte de los protocolos implementados para el tratamiento del paciente grave repercuten de manera negativa en el sueño, favoreciendo su privación y la aparición de patrones electroencefalográficos alterados. Friese28 describió que la arquitectura del sueño se modificaba de manera significativa en los pacientes graves, en los registros evaluados encontró patrones anormales, dominando las fases 1 y 2 de sueño superficial con disminución de las fases 3 y 4 que representan sueño efectivo y reparador. También disminuye incluso 50% el tiempo total de sueño y sobreviene fragmentación e inversión del ritmo circadiano sueño-vigilia. En otro estudio se observó que el sueño nocturno se encontraba gravemente fragmentado, con predominio incluso de 50% del tiempo total de sueño fase 1, con disminución muy importante de la fase de movimientos oculares rápidos, la cual comprendía únicamente 3.6% del tiempo total del sueño. En otros estudios se demostró que la fase de movimientos oculares rápidos puede reducirse de 0.29 a 0.1%, lo anterior refleja la profunda disfunción del sueño con la que cursan los enfermos graves, hecho que tiene un efecto negativo en diferentes funciones orgánicas y en la evolución del paciente.29,30
De los efectos nocivos secundarios a la privación del sueño destacan:
Cardiovascular. En pacientes con privación del sueño ocurre aumento de la actividad simpática y reducción de la actividad parasimpática, así como pérdida del reflejo de inhibición a nivel de barorreceptores. Los despertares y la interrupción del sueño se asocian con aumento de la presión arterial sistémica y de la frecuencia cardiaca. La fragmentación del sueño incrementa el riesgo de un infarto agudo de miocardio secundario a la intensa actividad simpática.31
Alteraciones conductuales. Los cambios del estado de ánimo son una de las manifestaciones más frecuentes en pacientes con privación del sueño; los que se observan con más frecuencia son: depresión, ira, ansiedad y frustración. Es uno de los factores de riesgo de estrés postraumático. La privación del sueño se asocia con alteraciones del metabolismo de glucosa en la corteza prefrontal, esta zona es reguladora de las emociones, la personalidad y la inhibición de la conducta.31
Metabolismo y sistema endocrino. La privación del sueño induce cambios significativos en la respuesta neuroendocrina que se traduce en disfunción de los ciclos circadianos hormonales y en el metabolismo intermedio. Se ha demostrado que en términos metabólicos la privación del sueño aumenta el gasto energético, lo que da lugar a un equilibrio negativo y a un estado hipercatabólico a pesar del adecuado aporte de calorías y nitrógeno, incrementa la liberación de grelina y disminuye la secreción de leptina. Spiegel32 demostró que ocurre resistencia a la insulina, disminución de la tolerancia a la glucosa, disminución de las concentraciones de triptófano y elevación en el cortisol. Otros efectos nocivos de la privación del sueño son la acentuada alteración en los picos secretorios circadianos de hormona de crecimiento, variaciones en la síntesis de proteínas, incremento en el consumo de oxígeno y en las concentraciones de catecolaminas y alteraciones del pH, con dominio de una tendencia a la alcalosis respiratoria.33,34
Función inmunológica. La privación del sueño se ha asociado con disfunción inmunológica y con incremento en el riesgo de procesos infecciosos, este efecto se relaciona con aumento en la concentración de marcadores inflamatorios, como la interleucina (IL) 6, proteína C reactiva, factor de necrosis tumoral alfa y con disminución de la acción de los linfocitos asesinos naturales secundaria a la acción de citocinas. La fragmentación del sueño condiciona una importante disfunción de la respuesta inmunológica adaptativa y de la interrelación entre el sistema nervioso central y el sistema inmunológico. La IL-1 y el factor de necrosis tumoral regulan la fase no REM del sueño, lo que implica que la mera respuesta inflamatoria induce una profunda alteración del sueño. La actividad fagocitíca, linfocitaria y la asesina natural de los linfocitos se reduce de manera significativa durante los periodos de sueño no reparador. La disfunción del sueño per se se asocia con una actividad proinflamatoria y con disminución en la síntesis de inmunoglobulinas.35,36
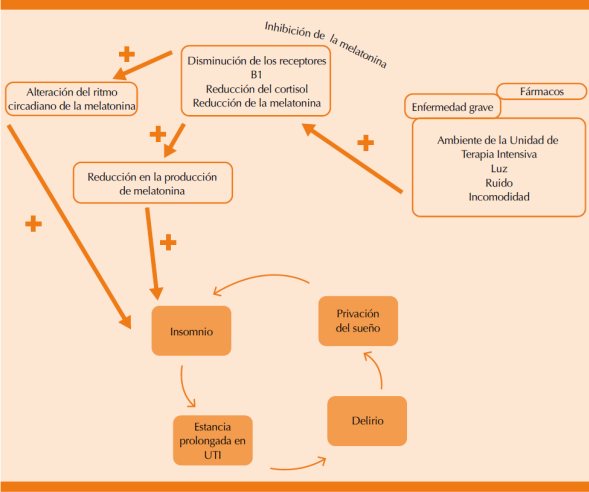
Delirio. Es una complicación frecuente en el enfermo grave, su prevalencia puede llegar a ser, incluso, de 80%, en especial en los enfermos con ventilación mecánica prolongada, sépticos y en los que han requerido infusión prolongada de sedantes, hipnóticos y opioides. Se ha postulado que la privación del sueño y su fragmentación son factores de riesgo de delirio. Sin embargo, en un estudio en el que se incluyeron 233 enfermos graves no se encontró una relación directa significativa entre la alteración en el patrón del sueño en los enfermos graves y la aparición de delirio. Por lo anterior, se requieren más estudios para confirmar o desechar esta asociación (Figura 1).37,38
Evaluación de los trastornos del sueño en el enfermo grave
En la actualidad no hay ningún método o escala clínica confiable para evaluar el sueño en los pacientes internados en la UTI, porque los trastornos del sueño son de índole multifactorial. Es posible realizar una evaluación clínica subjetiva del paciente; sin embargo, ésta es limitada y no es sensible ni específica en relación con las diferentes fases del estado sueño-vigilia. Por lo anterior, se han desarrollado estudios clínicos en los que se han analizado diferentes procedimientos para evaluar el sueño en los pacientes graves, de los que destacan:
Polisomnografía. Es un registro electrofisiológico múltiple que incluye electroencefalograma, electro-oculografía, electromiografía y evaluación constante de los signos vitales. El monitoreo continuo mediante el electroencefalograma permite la detección en tiempo real de la existencia de actividad convulsiva, el nivel de conciencia y la respuesta de la terapia de bloqueo neuromuscular. La polisomnografía es el método diagnóstico que con mayor exactitud evalúa el sueño y facilita el diagnóstico de sus alteraciones. Existen cuatro tipos de monitoreo para la polisomnografía, el tipo 1 se realiza durante toda la noche y es el patrón de referencia, incluye el monitoreo por medio de electroencefalograma, electromiografía, electro-oculograma, medición del flujo de aire respiratorio, el esfuerzo respiratorio, oximetría y electrocardiograma. Los tipos 2 al 4 son monitoreos portátiles que incluyen parcialmente los parámetros evaluados del tipo 1. Múltiples factores influyen en la especificidad y sensibilidad de la polisomnografía, de los que destacan el ambiente eléctrico que rodea al paciente, este elemento es imposible de eliminar por completo, sobre todo en la UTI, también puede modificarse si la evaluación del sueño se obtiene mediante algún programa computarizado o de manera manual, esta última es la más confiable, por lo que para su realización es necesario personal técnico especializado, lo que eleva su costo y su duración. El soporte y financiamiento de la polisomnografía, en términos de equipo de laboratorio y personal calificado, así como las dificultades para su realización, han llevado a la elección de otras técnicas diagnósticas en el área del paciente crítico. La realización de la polisomnografía condiciona interrupción del sueño por sí sola, sumándose a los múltiples factores que afectan o alteran el sueño del paciente crítico. Los pacientes en la UTI con frecuencia experimentan delirio, por tanto, el desplazamiento o eliminación de uno o más de los electrodos durante la grabación es un riesgo significativo y la cantidad de antipsicóticos requerida en estos pacientes puede incrementarse por su presencia. La mayor parte de los estudios polisomnográficos se han realizado en pacientes en estado crítico no sedados. Aunque hay algunas similitudes entre los estados de sueño y la sedación, como las vías de neurotrasmisores compartidas, también hay diferencias significativas, como la alteración temporal de ciclos circadianos durante la sedación. A pesar de estas diferencias, los pacientes con sedación tienen los mismos disturbios del sueño que los sujetos sin sedación. En comparación con la polisomnografía, los cuestionarios diseñados para evaluar la calidad del sueño, como el de Richards-Campbell, no han demostrado ser de utilidad, en especial cuando se intenta aplicarlos a pacientes sedados o con delirio.39-42
Índice biespectral (BIS). Es el análisis cuantitativo del electroencefalograma, calculado mediante un modelo estadístico multivariado obtenido algorítmicamente, proporciona una escala para el índice biespectral, en la que el valor cercano a 100 representa el estado de “despierto” y la equivalencia a 0 es el silencio electroencefalográfico. El estudio de sueño mediante el índice biespectral demuestra que sus valores caen durante el sueño fisiológico y se elevan durante el despertar. Los estudios en pacientes críticamente enfermos permiten determinar los siguientes valores: estado despierto (> 85), sueño ligero (60-85), sueño de ondas lentas (< 60) y sueño REM (> 60) con reducción de las ondas del electroencefalograma. El índice biespectral permite detectar el estado de dormido; sin embargo, no permite determinar las etapas del sueño. El uso de índice biespectral ha demostrado correlación con el estado neurológico en pacientes no sedados, por esto su uso se ha ampliado en pacientes con eventos vasculares cerebrales isquémicos; se ha observado que los sujetos con mejor función neurológica obtienen valores mayores, por tanto en pacientes con anormalidades neurológicas, se espera la reducción en los valores del índice biespectral. También se utiliza para la evaluación del estado de sedación y la respuesta adecuada de medicamentos administrados en el paciente crítico. Una de las ventajas del índice biespectral, por encima de la polisomnografía, es que no requiere que el personal técnico esté presente durante el monitoreo. El índice biespectral tiene el potencial de evaluar la profundidad del sueño, pero su implementación en la UTI no se ha validado.42,43
Actigrafía. Es un dispositivo colocado en la muñeca o tobillo del paciente que censa sus movimientos. Un acelerómetro detecta los movimientos en dos o tres planos durante periodos definidos que son procesados por sistemas computarizados, que cuentan con algoritmos que proporcionan datos de los periodos de sueño-vigilia; sin embargo, no proveen información del estado y la calidad del sueño. El estudio del uso de la actigrafía se ha enfocado a los pacientes que se encuentran dentro de la UTI, principalmente para la evaluación de intervenciones farmacológicas acerca de las características del sueño. La actigrafía tiende a sobreestimar el tiempo de sueño total comparado con la polisomnografía.42-46
Mediciones subjetivas del sueño
La validez de la observación del sueño puede estar sujeta al observador, lo que genera sesgos. Existen herramientas de evaluación de la sedación en las que se utilizan escalas numéricas descriptivas y son potencialmente más precisas. Los diarios o cuestionarios de registro del sueño son una medición importante en muchas alteraciones crónicas del sueño y su combinación con actigrafía provee una valoración del sueño comparable a los resultados con la polisomnografía. Sin embargo, en la UTI debe considerarse que existen factores que pueden modificar el juicio y el estado cognitivo del paciente. La valoración por el personal de enfermería radica en el registro observacional de las características del sueño del paciente, por 5 a 8 minutos al día. En comparación con la polisomnografía, las enfermeras han determinado la correcta valoración del estado de sueño del paciente en 82%. La principal limitante de esta medida es que en ocasiones el personal de enfermería no cuenta con el tiempo necesario y no tiene la experiencia para determinar el estado del sueño del paciente.47
Tratamiento
El tratamiento de las alteraciones del sueño en el enfermo grave es multifactorial y puede dividirse en no farmacológico y farmacológico.
Estrategia no farmacológica
Se fundamenta en la modificación de los factores extrínsecos asociados con la fragmentación del sueño, con lo que se logra mejoría en su arquitectura. Las guías de práctica clínica recomiendan la implementación de estas medidas sobre las farmacológicas.
Como parte de esta estrategia destaca mantener en lo posible un adecuado confort del paciente, evitar en lo posible medicamentos que fragmentan el sueño, como opioides, benzodiacepinas y propofol; eficientar la sincronía con el ventilador, mantener periodos prolongados de sueño fisiológico y evitar en lo posible los despertares, mantener una excelente analgesia, evitar el ruido y modular la intensidad de la luz, en especial durante la noche, mantener la relación sueño-vigilia, propiciar el apoyo psicológico temprano, movilizar al enfermo durante el día, implementar protocolos de relajación (masoterapia) y de musicoterapia.48-50
Estrategia farmacológica
En relación con la estrategia farmacológica para el tratamiento de la fragmentación del sueño en el enfermo grave es importante considerar la melatonina, un interesante hormona que muestra alteraciones significativas en el paciente grave. La melatonina se sintetiza en la glándula pineal y sigue un ritmo circadiano, con picos de predominio nocturno y en las primeras horas de la mañana. La secreción nocturna de melatonina está sincronizada con el ciclo de sueño-vigilia. En el paciente grave hay concentraciones bajas de melatonina y disfunción en el ciclo circadiano, lo que se traduce en ruptura de la arquitectura del sueño.51
La melatonina o N-acetil-metoxitritamina es sintetizada dentro de los pinealocitos a partir del aminoácido triptófano por la acción de la enzima N-acetiltransferasa (AA-NAT), que es activada por la oscuridad y modulada por diversas interacciones neuronales del núcleo supraquiasmático. La melatonina no sólo se produce en la glándula pineal, sino también en los testículos, la retina y el tubo gastrointestinal. La luz induce la lisis de la AA-NAT, lo que ocasiona la rápida disminución de la síntesis de melatonina. Las señales ambientales que regulan el reloj biológico de un organismo son predominantemente la alternancia diaria de luz y oscuridad que actúa a través de la retina y de las vías retino-hipotalámicas directamente en el sistema nervioso central. La secreción de melatonina se incrementa de forma proporcional a la duración de la oscuridad. El incremento de la intensidad de luz cambia el patrón de liberación a través del reloj circadiano (sincronización de la melatonina). En las personas con ceguera no existe sincronización de la liberación de melatonina, estado conocido como “corredor libre”. La melatonina endógena se libera al comenzar la noche alrededor de las 21 horas con un pico entre 2 y 4 am, para inhibirse entre 7 y 9 am, lo que coincide con el pico de cortisol endógeno. La concentración promedio de melatonina en plasma es de 60 a 70 pg/mL, con variación en las concentraciones solamente derivadas de la glándula pineal. El principal metabolito activo de la melatonina es 6 sulfatoximelatonina (MT6). El patrón típico de la excreción de MT6 tiene un pico después de media noche y el punto más bajo por la mañana, se observa una correlación estrecha entre las correlaciones plasmáticas y urinarias. La inervación simpática es responsable de la secreción rítmica de la melatonina endógena, estimulada por la norepinefrina a través de la vía de los receptores beta1 y alfa1. Los ciclos circadianos son regulados por marcapasos en el sistema nervioso central y modulados por estímulos periféricos. Mientras que la duración del día y de la noche son los principales desencadenantes ambientales para el cambio de este marcapaso, las variaciones en la liberación de melatonina son el estímulo fundamental para el mantenimiento del ciclo circadiano. En humanos es bien conocido que el pico en la liberación de melatonina se correlaciona con el punto más bajo de la temperatura central y el estado de alerta. La melatonina, además, tiene un papel antioxidante similar al del glutatión y tocoferol (vitamina E) al unirse a grupos hidroxil y neutralizar los radicales peroxil, lo que reduce el daño celular ocasionado por las especies reactivas de oxígeno.51-53
Estudios animales han demostrado que la melatonina puede retrasar la progresión de tumores dependientes de hormonas. Aunque el mecanismo preciso se desconoce, la represión de prooncogenes y la regulación del ciclo circadiano son dos de los mecanismos propuestos como efectos citoprotectores de la melatonina. Los modelos de lesión traumática cerebral sugieren que la melatonina puede tener un efecto neuroprotector mediado a través de la inhibición del daño excitotóxico, además de prevenir el daño por isquemia reperfusión. Asimismo, la melatonina reduce la temperatura corporal en humanos, lo que se ha asociado con mejoría de la función neurológica después del paro cardiaco, además de mejorar el flujo sanguíneo regional en modelos animales. Por lo anterior en la actualidad se considera que la melatonina es una hormona pleiotrópica.54
Melatonina en el paciente grave
Debido a la disminución en la secreción plasmática y concentraciones séricas de melatonina y a las alteraciones de su ritmo circadiano, la suplementación con melatonina se ha considerado una adecuada alternativa terapéutica. La melatonina puede administrarse por vía enteral o intravenosa, tiene vida media corta de 20 a 60 minutos. Estudios farmacocinéticos que administran 3 mg de melatonina a pacientes graves mostraron concentraciones 10 veces mayores que las plasmáticas, con aclaramiento lento comparado con sujetos sanos. Los efectos procinéticos de la alimentación enteral, en especial de las porciones lipofílicas, favorecen la absorción de melatonina, que es metabolizada en el hígado con un primer paso extenso. Su metabolito, el MT6, se produce por hidroxilación y conjugación. La excreción tiene un patrón bifásico; sin embargo, la farmacocinética es muy variable entre los individuos. Algunos autores han demostrado mejores efectos con dosis menores a 0.5 mg en comparación con dosis altas. Aunque los efectos de la melatonina en el sueño se han descrito en población general con un gran rango de dosis, la dosis óptima del paciente críticamente enfermo aún no se ha determinado con precisión. Bourne,55 en un pequeño estudio controlado que incluyó a 24 enfermos, demostró que la suplementación con melatonina en enfermos graves mejoraba la calidad y duración del sueño efectivo. Shilo56 demostró que en enfermos con enfermedad pulmonar obstructiva crónica la melatonina mejoraba la calidad del sueño. Bellapart57 recomienda la melatonina para el tratamiento del delirio y las alteraciones del sueño en los pacientes internados en la UTI a dosis de 3 mg, pero aun dosis tan pequeñas como 0.5 mg pueden ser efectivas. Mistralleti,58 en un estudio controlado con distribución al azar en el que comparó 3 mg de melatonina vs placebo, demostró que la melatonina, además de mejorar la calidad del sueño, disminuyó los requerimientos de sedación y mejoró los desenlaces neurológicos. Huang59 demostró en un modelo de ambiente simulado que semejaba una UTI que la melatonina es mejor que un antifaz y música para mantener una calidad adecuada de sueño.
CONCLUSIÓN
Los pacientes internados en la UTI tienen importantes alteraciones del ciclo circadiano y fases del sueño que se distinguen por su fragmentación, disminución del tiempo total de sueño nocturno, aumento anormal de las fases 1 y 2 y reducción significativa de las fases 3 y 4, en especial la de movimientos oculares rápidos. Estas alteraciones repercuten en la evolución del paciente, en especial con incremento de la morbilidad y mortalidad, días de estancia en la UTI, días de ventilación mecánica, aparición de delirio y costos de atención. Por lo anterior, es prioritario implementar en toda UTI un proceso que tenga como objetivo su evaluación y la implementación de medidas que faciliten un sueño fisiológico y reparador, que deberán estar encaminadas a evitar los mecanismos desencadenantes que favorecen su fragmentación, así como el desarrollo de algoritmos terapéuticos con base en maniobras no farmacológicas y farmacológicas, de éstas, la melatonina es un agente promisorio que ha demostrado efectividad y seguridad.











 text new page (beta)
text new page (beta)