ANTECEDENTES
La deshidrogenasa láctica (DHL) es una enzima implicada en la vía metabólica glucolítica, especialmente en condiciones anaerobias, encargada de la conversión de piruvato a lactato mediante la oxidación NADH a NAD+. En términos estructurales, se trata de un tetrámero compuesto por la combinación de dos subunidades activas (H y M), existiendo así cinco isoformas: DHL1 (HHHH), DHL2 (HHHM) hasta DHL5 (MMMM).1,2 Está presente en el citosol de prácticamente todas las células humanas, por lo que todos los tejidos muestran cantidades similares de DHL, aunque es importante notar que varía el porcentaje presente de cada isoforma, DHL1 y DHL2 se expresan primordialmente en el miocardio y los eritrocitos, mientras que en el hígado y el músculo se expresan DHL4 y DHL5, esta última también es la que predomina en células neoplásicas.2-4
La determinación sérica de DHL se usa para valorar daño tisular en pruebas de funcionamiento hepático, casos de pancreatitis y estudio de síndrome coronario agudo, por citar los ejemplos más comunes. Casi todos los laboratorios usan métodos colorimétricos (transformación de lactato a piruvato) para cuantificar la cantidad de DHL presente en la muestra, un reducido grupo de laboratorios usa técnica inversa (piruvato a lactato); la realización de electroforesis, única técnica para identificar con precisión la cantidad presente de cada isoforma de DHL, no se realiza de manera rutinaria y se reserva para estudios de investigación muy específicos.5,6
Debido a la gran correlación entre las concentraciones de DHL y el nivel de daño tisular que implica la ruptura de membranas celulares, justo como sucede en las infecciones virales, en 1961 se planteó su utilidad para evaluar la tasa de éxito en la infección de huevos de gallina inoculados con virus de influenza.7 Prahoveanu y colaboradores experimentaron con modelos de infección en huevos, mismos a los que suplementaron ATP, y observaron que exhibían mayor incremento de DHL, específicamente de DHL4 y DHL5 a las pocas horas de iniciada la infección, con lo que concluyeron que DHL es, además, un indicador de las partículas energéticas en las células, mismas que se elevan durante infecciones virales a fin de cubrir la demanda para realizar la síntesis de las nuevas copias virales.8 En líneas celulares humanas y con diferentes agentes virales se han hecho observaciones similares;9 sin embargo, se abandonó esta línea de investigación por un largo periodo hasta que se retomó y trasladó a la utilidad clínica, al identificarse las concentraciones séricas de DHL como predictor de mortalidad, especialmente en pacientes con infección por VIH/SIDA infectados por Pneumocystis jirovecii.10 Estas observaciones fueron validadas como predictor de severidad y en algunas series llegaron a utilizarse como herramienta diagnóstica.11,12
Asimismo, posterior a la pandemia de influenza ocurrida en 2009 existió un cambio drástico en las políticas de salud de los diferentes países afectados. En México, durante el periodo de abril de 2009 a febrero de 2010 se registraron 754 muertes asociadas con la neumonía A (H1N1) [5.53 casos por 100,000 habitantes], pero posiblemente la mortalidad fue muchísimo mayor que la reportada oficialmente.13 A la par de esto, hasta agosto de 2010 se habían registrado en el mundo 18,500 muertes asociadas con el virus, pero al combinar las complicaciones respiratorias y cardiovasculares la mortalidad se incrementó 15 veces.14 Este evento catastrófico sirvió para renovar el interés por identificar oportunamente los casos que requerían atención médica más acuciosa, de preferencia haciendo uso únicamente de los estudios que se realizan de manera rutinaria en el estudio de pacientes con neumonía adquirida en la comunidad.
El objetivo de esta investigación es determinar si los casos de neumonía debida a influenza A (H1N1) muestran alteraciones particulares en los estudios de laboratorio rutinarios, sobre todo en las concentraciones de DHL, y analizar la implicación pronóstica.
MATERIAL Y MÉTODO
Estudio de casos y controles anidado en una cohorte de pacientes con diagnóstico confirmado de neumonía por influenza A (H1N1) [caso], y pacientes con neumonía bacteriana (control) atendidos en el Hospital General de Cuautitlán del Instituto de Salud del Estado de México de diciembre de 2013 a julio de 2014. Todos los casos de neumonía por influenza A (H1N1) recibieron tratamiento con inhibidores de neuroaminidasa al momento de su ingreso.
Clasificación de la severidad
Para la identificación de la severidad se utilizó el índice PSI (Pneumonia Severity Index)15 estratificando a todos los pacientes en cuatro grupos diferentes: 1) edad menor o igual a 50 años, sin comorbilidades, alteraciones a la exploración física o de laboratorio; 2) puntaje PSI entre 51 y 70 puntos; 3) puntaje PSI entre 71 y 90; 4) puntaje PSI igual o mayor a 91, es decir, todos los pacientes que requerían ingreso hospitalario para su atención.
Análisis estadístico
Se utilizó el programa IBM SPSS Statistics para Windows versión 23 (Armonk, Nueva York, Estados Unidos) para ejecutar todos los análisis estadísticos. Las variables cuantitativas continuas se resumieron mediantes medias y se compararon entre grupos mediante la prueba t de Student. El contraste de hipótesis se realizó mediante la prueba de c2. Además, se obtuvieron las razones de momios para los principales factores de riesgo asociados. Para el análisis de supervivencia se utilizó el método de Kaplan-Meier, se consideraron significativas las diferencias que mediante la prueba log-Rank obtuvieran un valor de p < 0.05 a un intervalo de confianza de 95.
RESULTADOS
De los 73 casos estudiados, 31 pacientes cumplieron con los criterios de inclusión. La media de edad de toda la cohorte fue de 38 años (intervalo: 16-62 años), con predominio del género masculino (61%, n = 19). De los 31 casos, 45% (n = 14) tenía diagnóstico de neumonía por influenza A (H1N1), el 55% restante (n = 17) se consideró con un proceso infeccioso de tipo bacteriano. Las características generales de la población, al igual que el tratamiento de soporte recibido, se describen en el Cuadro 1.
Cuadro 1 Características generales de la cohorte retrospectiva compuesta por pacientes con diagnóstico de neumonía viral (caso) y bacteriana (control)
Diferencia de medias entre los estudios paraclínicos al momento del diagnóstico
Las concentraciones de DHL al momento del diagnóstico fueron, en promedio, de 578.77 UI/L (límites: 191-1096 UI/L), esta media aparentemente fue menor en el grupo con neumonía ocasionada por otros agentes diferentes a influenza A (H1N1) [573 vs 624.7 UI/L, p = 0.366]. En el resto de los estudios de laboratorio (química sanguínea, biometría hemática, tiempos de coagulación y gasometría arterial) no se logró establecer diferencias de medias de los valores al momento del diagnóstico entre los dos grupos (p > 0.05). Los resultados de estas comparaciones se detallan en el Cuadro 2.
Cuadro 2 Análisis comparativo del perfil bioquímico-hematológico entre pacientes con neumonía por influenza A (H1N1) y otro tipo de neumonía
BUN: nitrógeno ureico en sangre; CMHC: concentración media de hemoglobina corpuscular; HCM: hemoglobina corpuscular media; DHL: deshidrogenasa láctica; INR: International normalized ratio; TP: tiempo de protrombina; TPT: tiempo parcial detromboplastina; VCM: volumen corpuscular medio.
Asociación entre las concentraciones séricas de lactato deshidrogenasa y mortalidad
La mayor parte de las defunciones se registraron en pacientes con concentraciones séricas mayores de 350 U/L [91% en neumonías bacterianas y 100% en neumonía por influenza A (H1N1)], por lo que esta cifra se fijó como punto de corte para la prueba de contraste de hipótesis respecto a mortalidad temprana, y resultó significativa la asociación al considerarse la totalidad de casos (p = 0.050, IC95%), aunque al subanalizarse por pacientes portadores de influenza A (H1N1) y neumonía bacteriana no se apreciaron diferencias (p = 0.330 y p = 0.099, IC95%).
Se analizó si existía diferencia de medias entre las concentraciones de DHL al momento del diagnóstico y la determinación final en ambos grupos, sin apreciarse una diferencia significativa: no influenza A (H1N1): p = 0.366, influenza A (H1N1): p = 0.443.
Modelo de riesgo
Se calculó la razón de momios sobre el riesgo de muerte respecto a las variables analizadas de los pacientes. El índice de severidad, la administración de aminas vasopresoras o la ventilación mecánica fueron factores predictores de mortalidad, así como la elevación de DHL por encima de 350 UI/L al diagnóstico y durante el seguimiento (Cuadro 3).
Supervivencia
La media de supervivencia general fue de 18 días, notablemente menor en las neumonías que no eran debidas al virus de la influenza A (H1N1) con apenas 4 días contra los 25 días obtenidos en promedio para influenza A (H1N1) [p = 0.016]. Figura 1
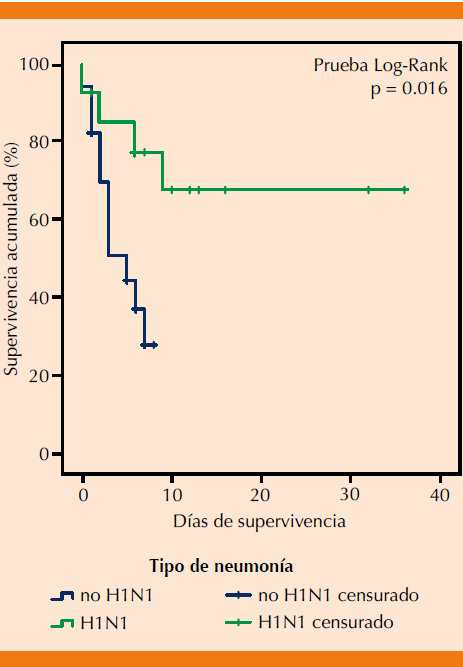
Figura 1 Curvas de supervivencia de pacientes con neumonía según el agente etiológico confirmado: influenza A (H1N1) vs agente bacteriano.
Al estimarse la supervivencia acorde con el puntaje obtenido con el PSI, aunque no hubo diferencias significativas (p = 0.347), evidentemente los pacientes con PSI elevado (91-130 puntos) tuvieron media de supervivencia menor (4 días); sin embargo, los casos con PSI no elevados no ameritaron ingreso hospitalario, por lo que el seguimiento fue deficiente y muchos casos fueron censurados (Figura 2).
DISCUSIÓN Y CONCLUSIONES
Chowell y colaboradores detectaron que cerca de 50% de los casos lograron recibir medicación durante el pico de la pandemia de influenza, reduciendo significativamente el riesgo de muerte (OR = 0.52, IC95%: 0.30-0.90).16 Los factores identificados para el incremento de la mortalidad fueron la coexistencia de diabetes (OR = 1.6), administración de inmunosupresores (OR = 2.3) o que los síntomas se prolongaran más de dos días (OR = 2.7).17 Bonmarin y su grupo, en un estudio similar, describieron los principales factores de riesgo identificados en Francia posterior a la pandemias de influenza (H1N1); la edad mayor de 65 años, la severidad clínica y la obesidad fueron los principales factores asociados con la mortalidad.18
En nuestro estudio la mortalidad asociada con neumonía A (H1N1) fue menor en comparación con la neumonía bacteriana. Una de las posibles causas de esta diferencia es el tipo de tratamiento, acorde con el metanálisis presentado por Muthuri y colaboradores, la administración temprana de los inhibidores de neuroaminidasa repercute positivamente reduciendo la mortalidad y las necesidades de soporte ventilatorio.19 Otra de las posibilidades para explicar la mayor mortalidad en el grupo de las neumonías bacterianas es la infección concomitante, porque a pesar de que Streptococcus pneumoniae es el principal agente causal, es posible aislar también Haemophilus influenzae, especialmente en casos de neumonía severa.20
El grupo encabezado por Quist evaluó la utilidad clínica de la determinación de DHL en infecciones respiratorias, como neumonías bacterianas y tuberculosis, identificó que su elevación se relaciona principalmente con neumonías asociadas con P. jirovecci (547 ± 157 UI/L) o con tuberculosis diseminada (569 ± 338 UI/L), con diferencia de los casos con tuberculosis pulmonar (258 ± 66 UI/L) o neumonías bacterianas (331 ± 139 UI/L) donde las cifras no fueron tan elevadas.21 Hace poco Kawamata y colaboradores identificaron que las concentraciones de ferritina y DHL se asociaron con la severidad de la neumonía y son de utilidad para identificar a los pacientes que requieren el inicio temprano de corticoesteroides.22 En infecciones virales, Wang y colaboradores describieron el perfil bioquímico y variables clínicas de pacientes hospitalizados con subtipos de influenza A H7N9, H5N1 y H1N1. Las concentraciones de DHL fueron significativamente mayores en las poblaciones con H7N9 y H5N1 (498 [388-661] UI/L y 1025 [334.8-1832.5] UI/L) en comparación de los portadores del subtipo H1N1 (307 [217-491] UI/L), aunque incluso 55% de los casos de H1N1 (1617/2922 casos) tuvieron cifras fuera del rango habitual.23
En conclusión, consideramos que la DHL, más que apoyar el diagnóstico, debe considerarse un biomarcador de progresión, pero se necesitan más estudios para identificar apropiadamente su utilidad pronóstica acorde con el tipo de agente infeccioso en las vías respiratorias.











 nueva página del texto (beta)
nueva página del texto (beta)



