ANTECEDENTES
La cardiomiopatía por estrés (síndrome de takotsubo) fue descrita por Sato en 1990 para designar la forma de acinesia apical del ventrículo izquierdo que mostraba el abombamiento de los segmentos apicales en telesístole, fue llamado así por su semejanza al contorno de una vasija utilizada en Japón para capturar pulpos.
Este evento genera una morfología característica que se evidencia por estudios de imagen que incluyen el ecocardiograma (de donde derivó su nombre), la coronarioangiografia y ventriculografía, estudios de resonancia magnética y estudios de medicina nuclear. En éstos se evidencia la acinesia, hipocinesia o discinesia del ápice cardiaco, que luce redondeado e hipocontráctil durante la sístole (daño que afecta de la misma manera a la mitad distal de las paredes cardiacas anterior, inferior y lateral), asociado con una base estrecha, debido a hipercinesia compensatoria de las paredes basales, con disminución de la fracción de eyección que puede ser reversible según la causa que lo originó y con supervivencia alta de controlarse el evento agudo. Sin embargo, el paciente neurocrítico con evento vascular cerebral que padece este tipo de cardiopatía tiene mala evolución clínica y se ha relacionado con mal pronóstico por incremento de la mortalidad y de la recuperación funcional.
La manifestación clínica de la cardiomiopatía por estrés en su variante típica o atípica depende de las respuestas variables y propias a la estimulación adrenérgica, considerando factores genéticamente heredables, como la síntesis, almacenamiento, liberación y catabolismo de la adrenalina que pueden variar de un individuo a otro.
De la misma manera se ha identificado un gran número de condiciones clínicas que constituyen factores de estrés fisiológico, entre ellas se enuncian: aturdimiento cardiaco neurogénico, insuficiencia respiratoria aguda, lesiones traumáticas, anafilaxia, sepsis, pancreatitis, intoxicación, rabdomiólisis, crisis hipertensiva, enfermedad tiroidea, hipertermia-hipotermia, entre otras. La insuficiencia cardiaca que afecta a enfermos con hemorragia subaracnoidea inicia con las características de un miocardio aturdido, posterior al incremento de las catecolaminas circulantes, lo que se observa de la misma manera en pacientes con accidente cerebrovascular isquémico, especialmente los que involucran la ínsula derecha.
CASO CLÍNICO
Paciente femenina de 68 años de edad, con antecedente de hipertensión arterial sistémica y cirugía de clipaje por hemorragia subaracnoidea 14 años antes. Ingresó por pérdida del estado de alerta, crisis convulsivas tónico-clónicas generalizadas y deterioro neurológico con puntaje de acuerdo con la escala de coma de Glasgow de seis puntos a expensas de: respuesta ocular: un punto, respuesta verbal: dos puntos y respuesta motora: tres puntos, de 12 horas de evolución. A su ingreso en el servicio de Urgencias se decidió dar manejo avanzado de la vía aérea, vasopresor e inotrópicos, así como cuidados de paciente neurocrítico. La tomografía de cráneo simple evidenció imagen hipodensa en la región frontotemporal derecha sugerente de infarto que correspondía al territorio de la arteria cerebral media derecha y cambios posquirúrgicos asociados (Figura 1). El electrocardiograma de 12 derivaciones mostró desnivel positivo en la cara anterior extensa, lesión subepicárdica en la cara anterolateral extensa, desnivel negativo en la cara inferior, lesión subendocárdica inferior, sin datos de isquemia o necrosis (Figura 2). Biomarcadores de lesión cardiaca: troponina 2.1, CK 232, CK-MB 33. Por los cambios encontrados en el electrocardiograma y el incremento de biomarcadores cardiacos se realizó coronariografía en la fase aguda para excluir oclusión coronaria que reportó ausencia de lesiones estenóticas o placas de ateromas en la circulación coronaria derecha e izquierda. En los ventriculogramas se observó dilatación apical fija e hipocinesia con movilidad conservada en las bases. Insuficiencia mitral leve. Presión telediastólica del ventrículo izquierdo de 18 mmHg y fracción de eyección del ventrículo izquierdo de 40% (Figura 3). El desenlace de la paciente lamentablemente fue funesto.
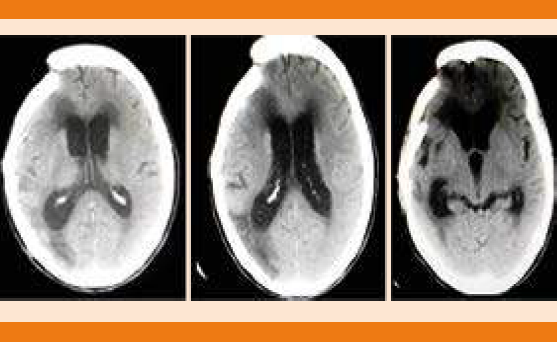
Figura 1 Tomografía de cráneo simple que muestra cambios posquirúrgicos por área de craniectomía frontoparietal derecha, dos imágenes hipodensas en sitio de la arteria cerebral posterior en la región parietooccipital derecha, ventriculomegalia, imagen lineal hiperdensa, encefalomalacia.
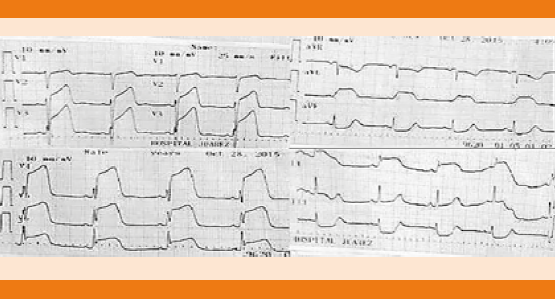
Figura 2 Electrocardiograma de 12 derivaciones, a velocidad de 25 mm/seg, ritmo sinusal, intervalo R-R regular, frecuencia cardiaca 65 latidos por minuto, QRS 80 mseg, PR 160 mseg, QT 200 mseg, desnivel positivo en la cara anterior extensa, lesión subepicárdica en la cara anterolateral extensa, desnivel negativo en cara inferior, lesión subendocárdica inferior, sin observarse datos de isquemia o necrosis.
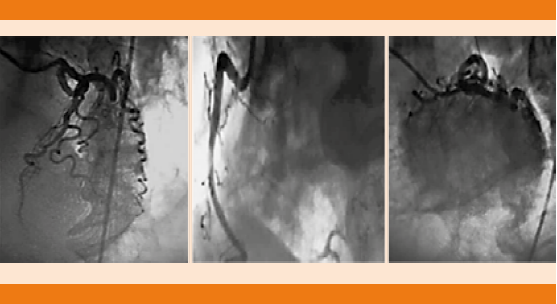
Figura 3 Coronariografía con los siguientes hallazgos: tronco bifurcado sin lesiones, descendente anterior que irriga hasta el ápex cardiaco, con tortuosidad severa y flujo lento coronario, sin lesiones. Circunfleja no dominante con tortuosidad severa y flujo lento, sin lesiones, coronaria derecha dominante sin lesiones. En los ventriculogramas (oblicua derecha e izquierda) se observa dilatación apical fija con movilidad conservada en las bases. Insuficiencia mitral leve. Presión telediastólica del ventrículo izquierdo 18 mmHg, FEVI 40%.
DISCUSIÓN
Con el reconocimiento y la gestión adecuada, casi todos los pacientes sobreviven a un evento agudo de miocardiopatía por estrés. Sin embargo, 5% de los pacientes puede padecer un segundo o tercer evento, aunque su incidencia es baja, incluso en circunstancias estresantes.
La disfunción sistólica suele aparecer en los primeros dos días después de un evento neurológico. En general, la prevalencia de disfunción diastólica del ventrículo izquierdo es de 10 a 28% en los pacientes con hemorragia subaracnoidea.
Los pacientes expresan concentraciones plasmáticas de catecolaminas (adrenalina, norepinefrina y dopamina) dos a tres veces mayor a la observada en pacientes con insuficiencia cardiaca aguda clase Killip-Kimball III.
El mecanismo fisiopatólogico se debe a la gran liberación de catecolaminas, que genera el incremento de la tensión de la miofibrilla cardiaca, que evoluciona a la necrosis por lesión miocárdica directa resultando en la disminución de inotropismo con incremento de la precarga, secundario a la vasoconstricción venosa e incremento de la poscarga cardiaca por vasoconstricción arterial periférica. Como consecuencia, el volumen sistólico disminuye y no puede ser compensado por la aparición de taquicardia refleja, esto conlleva a la disminución del gasto cardiaco, choque y falla ventricular izquierda. El aumento en la estimulación simpática del miocardio provoca aumento de las catecolaminas en el primer minuto con una relación entre enzimas cardiacas y la concentración pico de catecolaminas y disminución de la contractilidad cardiaca. Se observa necrosis celular miocárdica, también conocida como necrosis en bandas de contracción, que es distintiva de exposición a catecolaminas.
La activación de catecolaminas es el desencadenante principal. La concentración de catecolaminas como adrenalina y noradrenalina se ha reportado alta durante la fase aguda, lo que apoya el concepto de que las catecolaminas participan en la génesis de la enfermedad. Asimismo, los productos de oxidación de catecolaminas en la producción de la lesión miocárdica se han visto inmiscuidos. En estudios posteriores se ha demostrado la importancia de los efectos de la microcirculación, así como en el modelo de norepinefrina que da la primera alteración de la permeabilidad de la membrana del sarcolema, especialmente caracterizada por sobrecarga de iones calcio. Las cantidades excesivas de catecolaminas liberadas de las terminaciones nerviosas simpáticas, así como de la médula suprarrenal bajo condiciones de estrés, incrementan la producción de sobrecarga de calcio intracelular y disfunción cardiaca a través de la estimulación de receptores β1 adrenérgicos. Los mecanismos propuestos incluyen vasoespasmo epicárdico, disfunción microvascular, contractilidad hiperdinámica con obstrucción medioventricular o del tracto de salida y el efecto directo de las catecolaminas en los cardiomiocitos. Se ha propuesto como posible modelo reproducible para esta entidad, disfunción cardiaca y de las células miocárdicas, generando fuga de calcio debido a la hiperfosforilación de receptor de rianodina. Asimismo, hay evidencia de influencias genéticas individuales en respuesta a la estimulación adrenérgica con predominio de participación apical, puesto que tiene una concentración más densa de receptores adrenérgicos en esta área anatómica. Estas observaciones apoyan la hipótesis de que en momentos de tensión, cuando la epinefrina es la principal catecolamina circulante, genera estimulación de los receptores (32 adrenérgicos, lo que podría explicar la respuesta del miocardio.
El estrés oxidativo conduce a necrosis miocárdica, remodelación y trastornos de la contractilidad. La reducción univalente de oxígeno genera productos intermedios reactivos, como especies de oxígeno reactivas que pueden resultar en toxicidad del oxígeno, hay evidencia de que especies reactivas de oxígeno regulan la función de los canales de calcio. Las anomalías en la homeostasia del calcio subyacen arritmia cardiaca, disfunción contráctil y remodelación cardiaca. El vínculo estrecho entre el TNF-a, especies reactivas de oxígeno y el daño del ADN mitocondrial también desempeña un papel importante en la remodelación del miocardio y la insuficiencia cardiaca.
Se proponen tres mecanismos principales para el aturdimiento miocárdico: 1) generación de radicales de oxígeno, 2) sobrecarga de calcio y 3) desacoplamiento de la excitación-contracción secundaria a la liberación inadecuada de calcio por el retículo sarcoplásmico.
Los signos y síntomas característicos son dolor torácico con características de angina y disnea, éstos son los de manifestación más frecuente. También se han descrito paro cardiaco, síncope y arritmias. En los pacientes que ya están en estado crítico con otras afecciones médicas, una pista para el diagnóstico es el empeoramiento clínico.
A falta de una sola prueba de diagnóstico, se cuenta con los criterios diagnósticos de la Clínica Mayo. Los criterios están diseñados para ser prácticamente aplicados en el momento de la admisión. La necesidad de seguimiento de formación de imágenes está implícita con el fin de demostrar que la disfunción ventricular es transitoria:
Hipocinesia transitoria, acinesia, discinesia o segmentos mediales del ventrículo izquierdo, con o sin la participación apical; anomalías de la pared regional en movimiento que se extienden más allá de una distribución vascular epicárdica única; un desencadenante estresante sucede a menudo, pero no siempre está presente.
Ausencia de enfermedad coronaria obstructiva o evidencia angiográfica de la ruptura de la placa.
Las nuevas alteraciones electrocardiográficas (ya sea la elevación del segmento ST, la inversión de la onda T o ambas) o una ligera elevación de la troponina cardiaca.
Ausencia de feocromocitoma y miocarditis.
Es necesario realizar angiografía coronaria temprana porque el principal diagnóstico diferencial es la enfermedad coronaria inestable. Si hay elevación del segmento ST en el electrocardiograma con síntomas sugerentes de isquemia miocárdica debe realizarse la evaluación inmediata con angiografía coronaria para excluir oclusión coronaria. La angiografía coronaria puede ser completamente normal, pero la enfermedad coronaria aguda no excluye el diagnóstico de cardiomiopatía por estrés. De hecho, el infarto agudo de miocardio se considera un factor de estrés para la subsiguiente aparición de síndrome de takotsubo.
En la fase subaguda se observan los siguientes criterios electrocardiográficos: elevación inicial del ST, seguido de inversión transitoria de la onda T (1-3 días), recuperación de la onda T en algunos pacientes (días 2 a 6), seguida de una inversión gigante de la onda T asociada con prolongación del intervalo QT, que persistió por lo menos dos meses. También se ha demostrado onda T invertida profunda asociada con prolongación del intervalo QT, a menudo descritas como el electrocardiograma típico de miocardiopatía por estrés.
Se descubrió que prácticamente todos los pacientes con hemorragia subaracnoidea y pacientes neurocríticos tienen anomalías en el electrocardiograma que incluyen: cambios del segmento ST-T, prolongación del intervalo QT, aparición de ondas U patológicas y aparición de arritmias.
La cardiomiopatía por estrés se asocia con elevación de biomarcadores cardiacos que traducen necrosis. La descripción inicial realizada por Tsuchihashi informó elevación de la creatinina cinasa en 56% de los pacientes.
Otros estudios reportaron que la troponina cardiaca está elevada de manera universal debido a la mayor sensibilidad del biomarcador. El patrón de elevación de troponina difiere considerablemente del infarto de miocardio con elevación del segmento ST, con concentraciones de troponina T con elevaciones menores con media ~60 veces el límite superior de la normalidad (LSN, que se define como percentil 99) en contraposición a más de 400 veces el LSN para infarto agudo de miocardio con elevación del segmento ST agudo.
Se obtuvo la fracción de producto por expulsión de troponina (TEFP) calculando el producto a partir del pico de la concentración de troponina I y los obtenidos mediante ecocardiografía fracción de eyección. La fracción de producto por expulsión de troponina ≥ 250 tuvo sensibilidad de 95%, especificidad de 87% y precisión global de 91% para identificar infarto con elevación del segmento ST. El ProBNP es, por lo general, mayor en el síndrome de takotsubo que en infarto agudo con elevación del segmento ST. Es difícil establecer un valor de corte que diferencie miocardio aturdido secundario a un síndrome coronario agudo del síndrome neuro-cardiaco. Un estudio retrospectivo en hemorragia subaracnoidea reporta el valor de corte adecuado de concentraciones de troponina I en 2.8 ng/mL, mientras que la CK-MB no ayuda a diferenciar entre los dos tipos de lesión miocárdica. Las concentraciones más altas de troponina deberían hacer sospechar el verdadero infarto de miocardio y deben relacionarse con ecocardiografía.
Las alteraciones de la motilidad típicas de la miocardiopatía por estrés se demuestran en la ventriculografía izquierda. El esquema clásico es hipocinesia, acinesia o discinesia apical y de los segmentos medioventriculares que se extienden más allá de una sola distribución coronaria epicárdica.
La ecocardiografía transtorácica estándar proporciona información útil sobre la morfología del ventrículo izquierdo, así como la función sistólica y diastólica. Se permite la diferenciación de diferentes patrones morfológicos de ventrículo izquierdo de acuerdo con la localización de la anomalía de contractilidad. Un patrón circunferencial de la disfunción del miocardio del ventrículo izquierdo se caracteriza por alteraciones de la motilidad simétrica que afecta los segmentos medios de la anterior, inferior y paredes laterales. Debido a la evolución dinámica del síndrome, deben hacerse de manera sistemática exámenes ecocardiográficos seriados integrales.
La disfunción sistólica del ventrículo izquierdo y alteraciones de la contractilidad se encontraron en aproximadamente 20% de los pacientes con hemorragia subaracnoidea.
Este síndrome se manifiesta en mujeres posmenopáusicas con deficiencia de estrógenos, el cual se vincula con incremento y alteraciones del ritmo cardiaco y reducción de la función del ventrículo izquierdo.
Algunos informes en la bibliografía médica demuestran disfunción reversible del ventrículo izquierdo después de un esfuerzo repentino emocional.
En cuanto al tratamiento se ha demostrado que la administración de betabloqueadores disminuye el riesgo de recurrencia y es eficaz de manera profiláctica. En el accidente cerebrovascular agudo se ha reportado incremento de la actividad simpática. Algunos betabloqueadores, como carvedilol, generan un metabolito activo SB 211475 que se considera antihipertensivo-antioxidante, previniendo la oxidación de LDL, inhibiendo radicales de oxigenación-peroxidación lipídica de las membranas. El propranolol ha demostrado neuroprotección en la isquemia cerebral focal, disminuyendo el consumo de oxígeno con un efecto mínimo en el flujo sanguíneo cerebral, inhibe la agregación plaquetaria y la liberación de serotonina inducida por ADP, epinefrina, colágeno y trombina, asimismo, interfiere con la entrada de calcio mediante la reducción de canales operados por receptores y la abolición de la proteína cinasa dependiente de AMP cíclico mediada por fosforilación de la corriente de canales de calcio y reduce la fosfolipasa dependiente de calcio actividad A2 en las plaquetas.
La anticoagulación debe considerarse en el caso de disfunción sistólica severa para reducir el riesgo de tromboembolismo.
CONCLUSIONES
La miocardiopatía por estrés representa sólo 1 a 3% de todos los síndromes coronarios agudos y en mujeres posmenopaúsicas sucede en 6 a 9%, por lo que es un padecimiento poco frecuente; su fisiopatología se caracteriza por síntesis y liberación de citocinas proinflamatorias, sustancias quimiotácticas y catecolaminas con incremento del calcio intracelular en la célula cardiaca ocasionando disfunción de la misma, así como estimulación del sistema simpático perpetuando el daño miocárdico, cursando con incremento de biomarcadores de lesión cardiaca, por lo que es importante contemplarlo dentro del abordaje médico inicial. Debe realizarse una angiografía coronaria para descartar síndrome coronario agudo porque se comporta como simuladora. Las complicaciones tardías son poco frecuentes y generalmente sobrevienen en la fase aguda de la enfermedad, el síndrome de takotsubo es reversible y tiene buen pronóstico; sin embargo, es esencial individualizar cada caso y tomar en cuenta las comorbilidades de cada paciente que pueden repercutir en el pronóstico.











 text new page (beta)
text new page (beta)


