ANTECEDENTES
El consumo de los edulcorantes no calóricos data de hace más de un siglo; sin embargo, su consumo por amplios segmentos de la población se ha generalizado en las últimas décadas. Además, han surgido nuevos edulcorantes no calóricos con características sensoriales diferentes. Asimismo, su uso industrial y en una diversidad de productos ha aumentado y también se han generado nuevas mezclas que buscan mejorar su palatabilidad. A lo largo de este tiempo han surgido especulaciones acerca de posibles efectos adversos a la salud e incluso temores de que pudieran incrementar la preferencia por el sabor dulce, promover el aumento de peso y ser un factor contribuyente a la pandemia de la obesidad.
A diferencia de los medicamentos, la aprobación de un aditivo alimentario está basada no sólo en los estudios que demuestran su seguridad, sino también en las evaluaciones que determinan que no tienen ningún efecto fisiológico ya que se consumirán como alimentos. Estos compuestos deben ser inocuos y no tener ningún efecto más allá de su poder endulzante. Por ello, la opinión científica de las instituciones de evaluación de riesgo, como el Comité mixto FAO/OMS de Expertos en aditivos alimentarios (JECFA, por sus siglas en inglés) y la aprobación por las autoridades internacionales, como el Codex Alimentarius1 y las autoridades nacionales, es la base que sustenta su consumo como alimentos. Debido a que no ejercen ningún efecto fisiológico, no puede hablarse de su “efectividad” y, por supuesto, no puede evaluarse su efecto en la prevención y tratamiento de ninguna enfermedad. Las opiniones científicas de los comités de expertos internacionales son revisiones exhaustivas de todos los estudios de seguridad disponibles al momento de la evaluación, por lo que se consideran la fuente más completa de revisión y evaluación de la evidencia.
La evaluación de la seguridad de los edulcorantes no calóricos se basa en los procesos de análisis de riesgo. De acuerdo con la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), el análisis de riesgo se utiliza para elaborar una estimación del riesgo para la salud y la seguridad humanas, identificar y aplicar medidas adecuadas para controlar el riesgo y comunicarse con las partes interesadas para proporcionar información acerca de la seguridad y las medidas aplicadas para minimizar el riesgo. Los tres componentes principales del análisis de riesgo se definieron en el Codex de la manera siguiente: evaluación de riesgo, gestión de riesgo y comunicación de riesgo. Se considera que la evaluación de riesgo constituye el componente “científico” del análisis de riesgo, mientras que la gestión de riesgo es el componente en que se integran y ponderan la información científica y otros factores, como los de índole económica, social, cultural y ética para elegir las opciones preferidas de gestión de riesgo.
Algunos estudios realizados en el decenio de 1980 sugirieron que el consumo de estas sustancias podría estimular el hambre en humanos. Rápidamente surgieron evidencias en contra,2,3 pero hace poco reapareció este concepto, sobre todo en estudios observacionales,4 a pesar de que los ensayos de intervención en humanos con mejor diseño y calidad de evidencia han mostrado consistentemente que el consumo de edulcorantes no calóricos en diversas etapas de la vida no genera incremento de peso. El debate ha reaparecido al salir a la luz nuevos trabajos que reportan que algunas de estas sustancias, a pesar de su nulo o bajo contenido calórico, pueden estimular receptores desde la boca hasta diversas partes del tubo digestivo y modificar la liberación de hormonas, como insulina o incretinas, o bien, pueden generar cambios en el transporte de nutrimentos y de esta manera producir un efecto potencial en el metabolismo energético.5
Este trabajo es fruto de una revisión exhaustiva de la bibliografía y de las discusiones de un panel de expertos de diversas especialidades: toxicología, ginecoobstetricia, pediatría, endocrinología, nutrición, medicina interna, salud pública y medicina preventiva. Se analizó extensamente la bibliografía revisando una variedad de trabajos científicos que responden a las interrogantes que habitualmente se hacen los profesionales de la salud, o bien, que les son planteadas por sus pacientes. En este trabajo también se exploraron los cuestionamientos que habitualmente se hacen en foros públicos o académicos y que tienen implicaciones para los tomadores de decisiones sanitarias con efecto en la salud pública. Cada apartado de este documento representa la respuesta basada en la mejor evidencia disponible. En el Cuadro 1 se sintetizan los cuestionamientos que son el objetivo de este documento. Para fines de publicación en la Medicina Interna de México, se excluyó la sección que tiene que ver con embarazo y lactancia.
Seguridad de los edulcorantes no calóricos
Antes de que se someta un aditivo alimentario a estudios con modelos animales, se determina la potencial toxicidad in vitro, que incluye estudios de toxicidad, mutagenicidad y clastogenicidad en bacterias y líneas celulares.
El estudio completo de la posible genotoxicidad de una sustancia exige información acerca de su capacidad de inducir mutaciones genéticas, aberraciones cromosómicas estructurales y aneuploidía. Por lo general, se opta por un conjunto reducido de ensayos in vitro validados que cubren parámetros genéticos diferentes. La batería de pruebas comúnmente utilizada incluye un ensayo de mutagenicidad en bacterias (prueba de Ames, Salmonella/microsoma con y sin activación metabólica) y una o dos pruebas en células de mamíferos que permiten detectar mutaciones puntuales o daño cromosómico (efecto clastogénico/aneugénico).
Por lo general, para determinar la toxicidad sistémica (tanto de edulcorantes no calóricos como de la mayor parte de los compuestos farmacológicos) se realizan ensayos de corto y largo plazos. Estos estudios permiten identificar los órganos objeto de la toxicidad y pueden indicar la necesidad de realizar otras pruebas o pruebas más específicas (por ejemplo, de neurotoxicidad o inmunotoxicidad). Se examinan los efectos de la sustancia pertinente en relación con un amplio conjunto de parámetros de carácter observacional, funcional, bioquímico y patológico. Por lo general, los estudios se realizan en dos especies, un roedor y un animal que no sea roedor o dos especies de roedores y en animales de uno y otro sexo, para maximizar la posibilidad de hallar algún efecto (identificación del peligro). A menudo, los ensayos de largo plazo también incluyen pruebas de carcinogenicidad en dos especies de roedores. El uso de un método alternativo para reemplazar a un roedor puede ser aceptable según el caso. Se han incorporado diferentes pruebas alternativas de carcinogenicidad, en las que se intensifican las respuestas carcinogénicas y, por tanto, se acorta la duración de las biovaloraciones; por ejemplo, el modelo del ratón neonato y modelos de iniciación-promoción y en ratones transgénicos.
El destino metabólico de cada uno de los compuestos se conoce mediante los estudios de ADME (absorción, distribución, metabolismo y excreción) que se realizan con el compuesto marcado primero de manera radiactiva en un modelo animal. Una vez que culminan los estudios de toxicidad y se tiene clara la inocuidad del compuesto, se repite el estudio en humanos para establecer claramente las características de cada compuesto y asegurar que en ningún momento existe bioacumulación del compuesto o de sus metabolitos. De igual manera, estos estudios dan información clara del destino de cada compuesto y sus metabolitos en el cuerpo.
Los ensayos deben realizarse del modo que mejor permita encontrar datos toxicológicos relevantes que no siempre están relacionados con las condiciones de la exposición humana. En la selección de la dosis debe tomarse en cuenta la exposición humana prevista, su frecuencia y duración para tomar las dosis de partida. Sin embargo, las dosis se aumentan a niveles muy altos para obtener datos toxicológicos que permitan estimar los márgenes de seguridad de la exposición. En el diseño de todos los estudios debe prestarse especial atención al intervalo entre dosis, al número de grupos de estudio, la dosis máxima utilizada, la cantidad y la especie de animales de uno y otro sexo en cada grupo de dosis, la elección de los controles, la pauta de administración, la confirmación de la dosis administrada en relación con la nominal y la dosis ingerida (aceptabilidad, desperdicio de comida). Además de los ensayos de toxicidad sistémica general, debe evaluarse la posible genotoxicidad de una sustancia mediante un conjunto de pruebas in vitro y, si es necesario, in vivo.
Esta revisión, con conclusiones basadas en la mejor evidencia disponible y la gradación de los estudios que la generan, pretende llegar a conclusiones imparciales y evitar en lo posible asumir posiciones en defensa o en contra del consumo de estos aditivos alimentarios. Las conclusiones, que pretenden ser sintéticas, se desprenden del análisis racional proveniente de métodos propios de las ciencias de la salud basados en evidencia.
El análisis de la calidad de los estudios analizados para llegar a las conclusiones que a continuación se presentan se realizó con el auxilio del método y programa GRADE,6 que categoriza los desenlaces de interés y su importancia relativa. Se califica la calidad de la evidencia en cuatro categorías (A, B, C y D, de mayor a menor calidad) indicando hasta qué punto la estimación de un efecto es confiable (Cuadro 2). Para producir esa estimación, el método evalúa el riesgo de diferentes tipos de sesgo de los estudios y no solamente el diseño metodológico de cada estudio incluido. En este documento no se pretendió realizar un metanálisis por cada desenlace, sino únicamente utilizar el instrumento para evaluar la calidad de los trabajos científicos pertinentes para cada uno de los desenlaces planteados y para cada una de las preguntas a contestar.
Cuadro 2 Significado de los niveles de calidad de la evidencia
Adaptado del GRADE Working Group (último acceso 23/11/2015: http://www.gradeworkinggroup.org/publications/JCE_series.htm)
GENERALIDADES
Edulcorantes no calóricos aprobados y disponibles actualmente en México (Cuadro 3)
Cuadro 3 Edulcorantes no calóricos disponibles actualmente en México (Continúa en la siguiente página) Glicósidos de esteviol
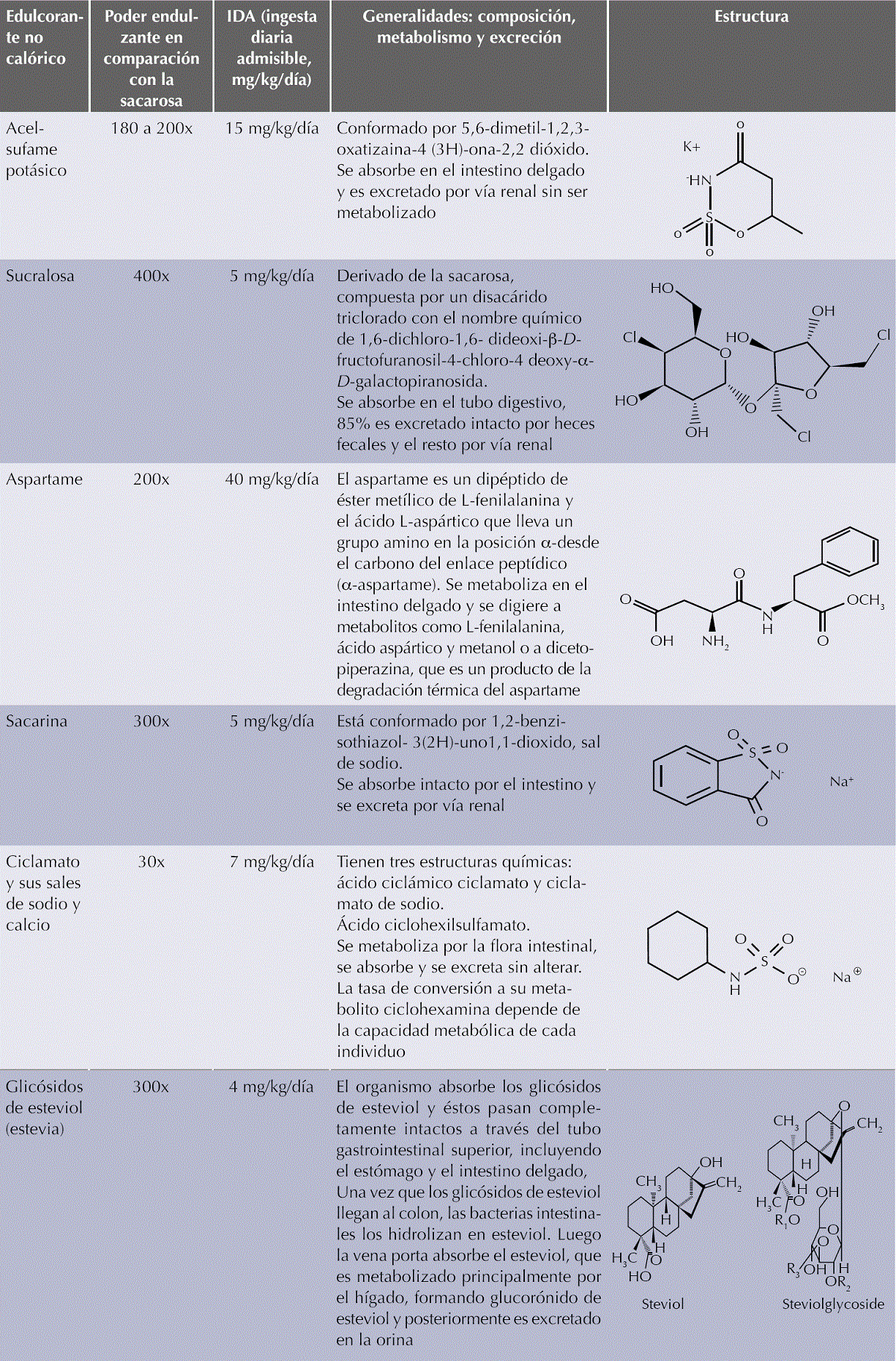
Los edulcorantes no calóricos aprobados en México son: aspartame, acesulfame potásico, aspartame-acesulfame, sucralosa, sacarina, glucósidos de esteviol, ciclamatos, alitame y neotame,7 además de advantame y alulosa aprobados recientemente, pero que no se incluyeron en esta revisión. Alitame y neotame, por su altísima intensidad de dulzor, se utilizan casi exclusivamente a nivel industrial.
Sacarina
Es conocida como el edulcorante no calórico de mayor antigüedad. Su grado de dulzor es de aproximadamente 300 veces respecto al de la sacarosa, pero deja un resabio metálico en la boca. Fue descubierta de manera casual en 1879 y su uso comercial data desde 1901 como endulzante de bebidas. En la actualidad está aprobada en más de 90 países.8 Aunque en el decenio de 1970 se le vinculó con la aparición de cáncer de vejiga en roedores de laboratorio, posteriormente más de 30 estudios en humanos demostraron que el resultado encontrado en los animales no fue relevante para humanos.9 En el año 2000, el Programa Nacional de Toxicología de los Institutos Nacionales de Salud de Estados Unidos decidió retirarla de la lista de carcinógenos potenciales. De manera reciente, estudios de modificación de la microbiota intestinal sugirieron que dosis relativamente altas de sacarina podrían producir alteraciones en la tolerancia a la glucosa.10 Más adelante en este documento se trata el análisis de ésta y otras evidencias.
Ciclamato
Se usa como sales de calcio o sodio del ácido ciclohexil-sulfámico, con un potencial de dulzor 30 veces mayor respecto al de la sacarosa. Se descubrió en 1937 y su uso está respaldado por la Autoridad Europea de Seguridad Alimentaria (EFSA).8 Su consumo se suspendió en Estados Unidos desde 1970 hasta la fecha debido a un estudio en roedores en el que se administró ciclamato combinado con sacarina arrojando riesgo potencial de cáncer de vejiga. Sin embargo, la EFSA ha revisado el tema de su seguridad sin encontrar carcinogenicidad ni efectos adversos en parámetros reproductivos, tema que fue de particular interés por sospechas de afectación en la fertilidad en animales machos. La Organización Mundial de la Salud (OMS) la considera libre de perjuicios para la salud. Debido a la variabilidad encontrada en humanos en la tasa de la conversión de ciclamato a su metabolito ciclohexamina, su ingesta diaria admisible (IDA) se redujo de 0 a 7 mg/kg de peso corporal al día.11
Aspartame
Se sintetizó en 1965 dentro de un programa de investigación de péptidos para su uso farmacéutico. Está constituido por los aminoácidos ácido aspártico y fenilalanina en forma de un metiléster. La Dirección de Alimentos y Fármacos de Estados Unidos (FDA) autorizó su consumo en 1983. Es 200 veces más dulce que el azúcar y no resiste el calentamiento. Su consumo está limitado en personas con fenilcetonuria y un reporte de la EFSA arrojó de nuevo una evaluación favorable a su consumo en 2013.8,12 Se ha especulado acerca de potenciales daños neurológicos y en otros sistemas por sus metabolitos, como el metanol. Sin embargo, como puede verse en el Cuadro 4, la concentración de estos metabolitos derivados de su consumo en bebidas endulzadas con aspartame es incluso inferior a la encontrada en alimentos de origen natural y de consumo común.
Cuadro 4 Concentraciones de fenilalanina, acido aspártico y metanol en alimentos comunes
*aminoácidos
Adaptado de EFSA Journal 2011;9(2).
Acesulfame K
Fue descubierto en 1967. Tiene 180 a 200 veces más poder endulzante que la sacarosa. Es estable al calor y puede combinarse con otros edulcorantes. Resalta la percepción de sabor y frescura. No se metaboliza en el cuerpo por lo que se excreta intacto y no contiene sodio.8 Está autorizado por la FDA y por EFSA.13
Sucralosa
Edulcorante semisintético obtenido en 1976 en Inglaterra. Tiene 400 a 600 veces más poder endulzante que el azúcar, su aporte calórico es nulo, es soluble en el agua y destaca su estabilidad al calentamiento, por lo que es apropiado para su uso en la cocina incluso en procesos de cocción.8 Se aprobó para su consumo en Estados Unidos en 2004. Algunos estudios destacan que no es una molécula inerte en términos metabólicos y que podría modificar la composición de la microbiota. Los alcances y la significación de lo anterior se discutirán más adelante.14,15
Glicósidos de esteviol
Estas sustancias provienen de plantas de la familia de los girasoles y son originarias de América del Sur. La “hierba dulce” (Stevia rebaudiana) se ha usado en Paraguay como parte de la tradición herbolaria desde la era precolombina.8 El extracto de alta pureza, que es el único aprobado para su consumo generalizado como aditivo en humanos, es cerca de 300 veces más dulce que la sacarosa.16 Las hojas de la planta son tan sólo 10 a 15 veces más dulces que el azúcar; sin embargo, en dosis altas el extracto crudo de la planta se ha vinculado con subfertilidad o infertilidad, efectos en la glucemia y la presión sanguínea debido a que contiene otros compuestos con actividad biológica. Estos compuestos no están en los extractos altamente purificados.17
Edulcorantes no calóricos en la niñez y la adolescencia
Edulcorantes no calóricos y “compensación aguda” en la ingestión energética en niños y adolescentes
En términos históricos se ha debatido si el consumo de edulcorantes no calóricos en forma de precargas (administrados previo al consumo de alimentos) genera aumento de la ingesta energética. A ese potencial incremento se le denomina “efecto compensatorio”.
Birch en 1988 y Anderson en 1989 realizaron ensayos clínicos en niños evaluando precargas con edulcorantes no calóricos, comparándolos con cargas de sacarosa antes de la ingestión ad libitum de alimentos.18,19 No se encontró que el ciclamato o el aspartame afectaran la proporción de los macronutrimentos de la dieta ni que incrementaran las calorías ingeridas tras la precarga, éstos fueron los “desenlaces duros” de estos estudios. Al utilizar una medición subjetiva (“desenlace blando”), como las escalas análogas visuales de hambre y saciedad (aplicadas cinco minutos antes de iniciar el almuerzo), se encontró un incremento significativo en la sensación de hambre, en el deseo de consumir alimentos y disminución de la sensación de saciedad con el aspartame. Sin embargo, esta sensación no modificó la ingesta. De manera adicional, el estudio de Birch mostró que administrado en forma de precarga, el aspartame produce, incluso, menor incremento del apetito sobre la cuantificación de la ingesta cuando se le compara con el agua. Cuando se compara con azúcar, de manera similar al agua, el aspartame tiene menor efecto de saciedad que la sacarosa, como es de esperarse por el casi nulo contenido energético del edulcorante no calórico. Podemos concluir que por sí mismo, el aspartame no generó incremento de la ingesta de alimentos en estos experimentos en niños.
Rogers y colaboradores en 2015 realizaron una revisión sistemática que incluyó una serie de estudios con 476 niños; compararon precargas en solución acuosa de diferentes edulcorantes no calóricos contra sacarosa antes de un tiempo de comida. El resultado del metanálisis mostró que la ingesta energética acumulada se redujo con las soluciones con edulcorantes no calóricos, en contraste con las precargas de sacarosa. Sin embargo, los autores reportaron un alto grado de heterogeneidad en los métodos de los estudios incluidos. El promedio de reducción de la ingesta a favor de los edulcorantes no calóricos representa una reducción de -39 kcal.20
Conclusión con base en la evidencia. En niños y adolescentes, los edulcorantes no calóricos (ciclamato y aspartame) no parecen afectar la ingestión ni producir una sobrecompensación energética cuando se administran antes de un tiempo de la comida. Calidad de la evidencia: A.
Edulcorantes no calóricos y variación del peso en niños y adolescentes
En 2006, Ebbeling realizó un ensayo clínico con distribución al azar en 105 adolescentes con sobrepeso u obesidad; comparó el efecto del reemplazo de bebidas azucaradas por bebidas con edulcorantes no calóricos durante 25 semanas, contra otro grupo sin reemplazo de las bebidas azucaradas.21 Se controló la posibilidad de cambios de la actividad física y la ingesta energética en ambos grupos para que solamente difirieran en el consumo o no de bebidas azucaradas contra endulzadas con edulcorantes no calóricos. Hubo reducción del peso y del índice de masa corporal (IMC) en el grupo con reemplazo de bebidas azucaradas por las bebidas con edulcorantes no calóricos, pero únicamente entre los participantes que se encontraban en el tercil superior de IMC. De igual manera, se observó reducción ponderal en los sujetos con mayor consumo previo de bebidas azucaradas.
En otro estudio que incluyó a 32 adolescentes (11 a 15 años) con obesidad, en el que no hubo sustitución calórica y en el que a los dos grupos se les controló la dieta en 1,500 calorías, a un grupo se le permitió el consumo restringido de bebidas azucaradas, mientras que al otro se le permitió el consumo ilimitado de bebidas endulzadas con edulcorantes no calóricos. A diferencia del estudio previo, en este ensayo no hubo sustitución con bebidas sin calorías. Aunque ambos grupos bajaron de peso, no se encontró diferencia significativa en la reducción de la pérdida de peso entre ambos grupos. Este estudio sugiere que lo relevante en la pérdida de peso es la energía ingerida y no necesariamente la composición de la dieta. También sugiere que los edulcorantes no calóricos per se no inducen pérdida de peso, a menos que se evite la compensación energética a partir de otros alimentos y bebidas.22
Ruyter y colaboradores realizaron un ensayo clínico en 641 niños (4 a 11 años) con peso normal y con seguimiento de 18 meses.23 A un grupo se le administró una bebida azucarada (104 kcal) y al otro grupo se le sustituyó con una bebida endulzada con edulcorantes no calóricos (sucralosa y acesulfame-K), ambos del mismo volumen y dulzor. Los resultados mostraron menor ganancia de peso (que es normal en el crecimiento) en el grupo que consumió la bebida con edulcorantes no calóricos vs la bebida azucarada.23
Conclusión con base en la evidencia. El consumo de edulcorantes no calóricos en niños y adolescentes puede ser coadyuvante en los programas de reducción y mantenimiento del peso y estilo de vida saludable acompañados de un plan de alimentación correcto y adecuado para cada individuo, siempre y cuando se evite la compensación energética. En contraste, el consumo libre de edulcorantes no calóricos sin un programa de sustitución energética tiene un efecto neutro sobre el peso. Calidad de la evidencia: A.
Edulcorantes no calóricos en niños y adolescentes y alteraciones en la conducta y déficit cognitivo
Al revisar la bibliografía existente se han reportado casos anecdóticos aislados de afectación cognitiva o de alteraciones de la conducta posiblemente asociados con el consumo de edulcorantes no calóricos en niños y adolescentes. Debido a lo anterior, se analizaron estudios de casos y controles, así como ensayos clínicos controlados en una revisión extensa que Butchko y colaboradores realizaron acerca del tema.24 En los estudios de mejor calidad de diseño se descartó que existiera causalidad entre el consumo de edulcorantes no calóricos y convulsiones, cefalea, alergia, tumores cerebrales, alteraciones cognitivas y del aprendizaje en niños.
Uno de los ensayos descritos y con mejor diseño, aunque de corta duración, es el estudio doble ciego de Wolraich, realizado en 1994 en niños preescolares (3 a 5 años) y escolares (6 a 10 años) que se expusieron a tres tipos de dieta: una dieta alta en sacarosa, otra alta en aspartame y otra alta en sacarina durante tres semanas.25 Se evaluaron 39 parámetros del comportamiento que incluyó variables del desarrollo cognitivo y se encontró que en ningún parámetro medido hubo diferencia significativa entre los tres grupos.
Conclusión con base en la evidencia. El consumo de edulcorantes no calóricos (aspartame y sacarina) en niños y adolescentes no parece favorecer la aparición de trastornos de la conducta o déficit cognitivo. Calidad de la evidencia: B.
Edulcorantes no calóricos en niños y adolescentes y convulsiones en epilepsia
En la misma revisión de Butchko y colaboradores,24 se describen varios ensayos clínicos con distribución al azar acerca del consumo de edulcorantes no calóricos y la aparición de convulsiones en niños y adolescentes con epilepsia. Los autores concluyeron que con base en los estudios de mayor calidad, no existen pruebas de causalidad para producir o ser un factor detonante de convulsiones en niños que ya padecen epilepsia.
Conclusión con base en la evidencia. El consumo de edulcorantes no calóricos no favorece la aparición de convulsiones en niños y adolescentes con epilepsia ni genera crisis convulsivas. Calidad de la evidencia: A.
Edulcorantes no calóricos en niños y adolescentes y neoplasias
Dos polémicos estudios realizados en Italia por Soffritti relacionaron el consumo de aspartame con linfoma y leucemias en ratas cuando este edulcorante se administra a dosis altas desde la etapa gestacional, continúa en la lactancia y se mantiene en los animales a lo largo de toda su vida.26,27 Por su relevancia, estos estudios fueron evaluados exhaustivamente por agencias regulatorias, como la Autoridad Europea de Seguridad Alimentaria, la Dirección de Alimentos y Fármacos y el Instituto Nacional de Cáncer, ambos de Estados Unidos. Los grupos de expertos convocados por estas instituciones llegaron a la conclusión de que estos estudios tienen serios errores metodológicos que invalidan sus conclusiones.28
En relación con los estudios en humanos, existe una serie de ensayos en niños con o sin tumores, la mayor parte de ellos con diseño de casos y controles, en los que se evalúa la asociación entre el consumo de edulcorantes no calóricos y la existencia de neoplasias. Organismos internacionales enfocados en el estudio del cáncer determinaron que no hay elementos para sugerir alguna relación dosis-respuesta basada en la edad del primer consumo, el número de años de consumo o la frecuencia del mismo de edulcorantes no calóricos, sustentada en estos estudios en humanos. Además, no se han encontrado pruebas de asociación entre el consumo de aspartame y tumores, aun cuando el análisis se estratifica por subgrupos histológicos con diversos tipos de neoplasias malignas.24
Conclusión con base en la evidencia. La evidencia de mejor calidad científica existente hasta ahora no sugiere que el consumo de edulcorantes no calóricos favorezca la aparición de neoplasias en niños o en otras etapas de la vida. Calidad de la evidencia: B.
Edulcorantes no calóricos en niños y adolescentes y urticaria o angioedema
En un ensayo multicéntrico doble ciego cruzado, en el que participaron niños y adultos (n=21) que habían tenido un evento de urticaria o angioedema atribuido potencialmente al consumo de aspartame, se les proporcionó aspartame en cápsulas (50, 300 y 600 mg) en días separados y en otro día se les administró placebo.29 Dos participantes en el grupo del placebo y dos en el grupo de aspartame tuvieron alergia. No hubo diferencias estadísticamente significativas (p=0.289) entre el aspartame y el placebo para efectos adversos de aparición de urticaria o angioedema. Este estudio disminuye su calificación en el sistema GRADE por sesgo de publicación, ya que lo financió la industria de aditivos, aunque también los Institutos de Salud (NIH) de Estados Unidos. El valor del estudio radica en un buen diseño y en que se trabajó en una población seleccionada con riesgo alto de manifestar el desenlace y en la que pretendidamente se había responsabilizado al edulcorante de uno o varios eventos previos de alergias.
Conclusión con base en la evidencia. En esta revisión no se encontró ninguna evidencia de calidad de que los edulcorantes no calóricos (aspartame) causen algún tipo de alergia, urticaria o angioedema en niños, adolescentes o adultos, incluso en población que haya tenido estos síntomas con anterioridad. Calidad de la evidencia: B.
Edulcorantes no calóricos en niños y adolescentes y su efecto en concentraciones de fenilalanina en fenilcetonuria
Caballero y colaboradores realizaron un diseño de pre y posadministración de aspartame realizado en niños y sus padres que tenían fenilcetonuria (PKU), hiperfenilalaninemia atípica y en portadores de fenilcetonuria (heterocigotos), comparados con un grupo control de adultos sanos en el que se les proporcionaron 10 mg/kg de aspartame y posteriormente se les midieron aminoácidos plasmáticos.30 No hubo cambios significativos en las concentraciones de esos aminoácidos. Estos datos indican que 10 mg/kg de aspartame pueden ser consumidos con seguridad aun por personas con hiperfenilalaninemia o fenilcetonuria que no mantienen una dieta restringida en fenilalanina. Sin embargo, no se abordó la cuestión de los efectos a largo plazo del consumo de aspartame ni las consecuencias de consumir dosis altas del mismo, solo o con otros alimentos. Lo relevante de este estudio es que aun en sujetos con riesgo alto de elevación de fenilalanina, el consumo de dosis moderadas de aspartame no modifica de manera relevante sus concentraciones. Por supuesto, lo antes descrito no implica que en esta población, y sobre todo en fenilcetonúricos homocigotos, se deba dejar de tener especial vigilancia en el consumo de alimentos que contengan aspartame y otros alimentos comunes que contienen fenilalanina, como la leche y el huevo.
Conclusión con base en la evidencia. Aun en personas con riesgo alto de padecer elevaciones de fenilalanina, el consumo de dosis moderadas de aspartame no produce elevaciones clínicamente relevantes de sus concentraciones. Su consumo en homocigotos con fenilcetonuria está restringido de acuerdo con su dieta terapéutica. Calidad de la evidencia: B.
Edulcorantes no calóricos y equilibrio energético
Efecto de los edulcorantes no calóricos en hormonas de saciedad y apetito
En un estudio de Steinert, realizado en 2011, se evaluó la respuesta hormonal a la administración por vía nasogástrica de glucosa, fructosa, sucralosa, aspartame y acesulfame-K en sujetos sanos, en concentraciones equivalentes en dulzor a 50 g de glucosa, utilizando agua como control.31 Los edulcorantes no calóricos fueron equivalentes al agua y no repercutieron en las concentraciones hormonales de grelina, péptido YY (PYY) y del péptido similar al glucagón tipo 1 (GLP1) ni en la escala visual análoga aplicada para medir hambre y saciedad. Ma, en 2012, realizó un estudio similar con sucralosa en sujetos sanos y con normopeso midiendo polipéptido inhibidor gástrico (GIP), GLP1, glucosa, insulina y velocidad de vaciamiento gástrico, sin encontrar diferencias cuando se comparó la solución de sucralosa con solución salina.32 Algunos estudios reportan variaciones mínimas, aparentemente sin relevancia clínica, en valores de GLP1, particularmente con sucralosa y con bebidas dietéticas endulzadas con una mezcla de sucralosa y acesulfame-K.33< Sin embargo, este resultado no ha sido constante en todos los estudios, como puede comprobarse en las referencias.34 Hay una serie de estudios que utilizan escalas visuales análogas para evaluar el efecto del consumo de edulcorantes no calóricos en el hambre y la saciedad, que no muestran que estas sustancias aumenten la sensación de hambre o el apetito o que produzcan efectos en el equilibrio energético.19,31,35
Conclusión con base en la evidencia. La administración de edulcorantes no calóricos (sucralosa, aspartame y acesulfame-K) tiende a producir un efecto neutro o con mínimas variaciones en la mayor parte de las hormonas intestinales reguladoras del hambre y la saciedad. En algunos estudios se apreciaron incrementos en las concentraciones de GLP1 cuya significación clínica está por aclararse. Calidad de la evidencia: B.
Efecto de los edulcorantes no calóricos en la variación del peso
Otro de los elementos controvertidos en el debate académico de los últimos años es si el consumo de edulcorantes no calóricos puede favorecer la ganancia ponderal reflejada en incremento del IMC. Uno de los trabajos que mejor ilustra el contraste entre los estudios observacionales4 y los estudios de intervención controlados es la revisión sistemática con metanálisis de Miller realizada en 2014.36 En la primera parte de su revisión exhaustiva se analizan nueve estudios prospectivos de cohorte. En ellos se aprecia que la ingesta de edulcorantes no calóricos no se asocia con incremento del peso corporal o de la masa grasa, pero sí se relaciona con aumento discreto en la asociación cuando el parámetro del desenlace es el IMC. Por el contrario, en la segunda parte del metanálisis se revisan 15 ensayos clínicos con distribución al azar. En ellos se evalúa el consumo de diferentes edulcorantes no calóricos y su utilización experimental en programas de reducción de peso. La evaluación del desenlace mostró reducción modesta de todos los desenlaces, incluido el peso corporal, la masa grasa y la circunferencia de la cintura.
Rogers y colaboradores, en 2015, publicaron una nueva revisión sistemática con metanálisis dividida en tres secciones: la primera reúne siete estudios observacionales, la segunda agrupa 43 estudios de intervención aguda o de corto plazo y la tercera conjunta 12 publicaciones de ensayos clínicos controlados.20 En el apartado de los estudios epidemiológicos-observacionales se encontró una ligera tendencia a la asociación entre el incremento en el IMC y el consumo de edulcorantes no calóricos; sin embargo, esta asociación no alcanzó significación estadística y esa tendencia suele explicarse por la hipótesis de la “causalidad inversa”. Posteriormente se muestran los datos provenientes de estudios que analizan el consumo de precargas con edulcorantes no calóricos antes de la ingestión, con el objeto de demostrar si en una temporalidad aguda o de corto plazo existe o no tendencia a aumentar el consumo de alimentos (efecto compensatorio), posterior a esa precarga. El resultado es que no se produce incremento en el ingreso calórico con el consumo de edulcorantes no calóricos. Incluso se aprecia una tendencia a reducir el ingreso energético, que no llega a ser significativa. En sentido estricto, al analizar los estudios con mejor nivel de diseño, el efecto del consumo de los edulcorantes no calóricos no parece estimular mecanismos que aumenten la ingesta de una mayor cantidad de alimentos. En la última sección, los autores incluyen los ensayos clínicos con distribución al azar a largo plazo. El análisis final del desenlace permite apreciar que los edulcorantes no calóricos aplicados en programas de reducción de peso que sustituyen a la sacarosa o a otros edulcorantes con contenido energético favorecen la pérdida de peso de manera modesta, pero significativa (p=0.004).
El análisis de los ensayos controlados con distribución al azar18,19,21,22,31,32,35,37 es razonablemente consistente y el contraste de sus resultados con los arrojados por los estudios observacionales graduados como de menor nivel es evidente,38,39 ya que en los ensayos controlados con distribución al azar se evita un sinnúmero de variables de confusión.
Conclusión con base en la evidencia. El consumo ad libitum de los edulcorantes no calóricos mantiene un efecto neutro en el peso corporal. Su consumo racional en programas de control de peso con sustitución de endulzantes calóricos puede contribuir a la reducción ponderal en programas supervisados de pérdida y mantenimiento del peso y estilo de vida saludable. Calidad de la evidencia: A.
Edulcorantes no calóricos en diabetes
Consumo de edulcorantes no calóricos en personas con diabetes y cambios en el control glucémico
Se ha publicado un buen número de estudios con diferentes diseños metodológicos y de diversa duración en cuanto al consumo de edulcorantes no calóricos en personas con diabetes tipo 1 o 2.35,40 41 42 Asimismo, también se han realizado trabajos para determinar si estas sustancias pueden incrementar o disminuir la incidencia de diabetes o alteraciones en el metabolismo de la glucosa.43,44 Todos estos estudios pretenden evaluar el efecto del consumo de uno o varios de estos edulcorantes en los valores de la glucosa en ayuno y en la posprandial, en la curva de tolerancia a la glucosa o determinar variaciones en la insulina plasmática o la sensibilidad a la misma. En otros ensayos se evalúa su efecto en la hemoglobina glucosilada (HbA1C).39,40,45,46 También se ha buscado determinar la influencia de estas moléculas en personas sin alteraciones de la glucosa para detectar modificaciones en el corto, mediano y largo plazos, tratando de dilucidar si los edulcorantes no calóricos inducen cambios metabólicos que favorecen o no la aparición de diabetes o alteraciones en la tolerancia a la glucosa.35,47,48
En estudios epidemiológicos individuales (no experimentales),43 así como en revisiones sistemáticas con metanálisis que incluyen exclusivamente trabajos observacionales, en muchos de ellos se exhibe un vínculo entre el consumo de edulcorantes no calóricos y la aparición de diabetes o de intolerancia a la glucosa. Sin embargo, cuando se eliminan las variables de confusión, esta asociación estadística se disipa total o parcialmente en la mayor parte de estos estudios. Para ilustrar lo anterior se tomó este ejemplo: una revisión sistemática reciente con metanálisis de 17 estudios de cohorte38 obtuvo un riesgo relativo (RR) de 1.25 de incidencia de diabetes en consumidores de edulcorantes no calóricos. Ello significaría un incremento de 25% del riesgo de padecer diabetes en los consumidores habituales a diferencia de quienes no los consumen. Sin embargo, al eliminar la variable de confusión de obesidad, este RR disminuye a 1.08, lo que implicaría un incremento del riesgo menor de sólo 8%. Además, el metanálisis muestra alta heterogeneidad entre estudios (I2= 64%), lo que indica que los mismos son muy diferentes entre sí. En otros estudios similares este efecto se disipa por completo al eliminar los factores de confusión.44 Asimismo, no puede establecerse una relación causa-efecto entre diabetes y el consumo de edulcorantes no calóricos con base en los estudios con este diseño. Los estudios observacionales tienen la limitante de que únicamente establecen una asociación (no necesariamente causal) entre el consumo de edulcorantes no calóricos y la incidencia de diabetes. Al eliminar algunos factores de confusión esta asociación claramente tiende a disiparse. Es muy importante considerar el llamado “efecto de causalidad inversa”, que presupone que personas con factores de riesgo de diabetes (o con diabetes establecida) tienden a consumir con más frecuencia bebidas endulzadas con edulcorantes no calóricos que la población sin diabetes o sin obesidad. Ello implicaría que el consumo de edulcorantes no calóricos podría ser consecuencia de tener diabetes o de tener sus factores de riesgo, más que la causa de la misma. Asimismo, puede pensarse que aunque fuese tan sólo 8% el incremento de riesgo, éste podría tener alguna relevancia clínica. Debido a que en los estudios de mayor calidad de diseño (ensayos clínicos con distribución al azar) no se ha encontrado relación alguna con la producción de intolerancia a la glucosa o diabetes, podría afirmarse que aun ese 8% es probable se deba a variables de confusión no detectadas por los autores del estudio.
A continuación se sintetizan los resultados de los ensayos clínicos con distribución al azar.33,35,41,45,46,49,50 La práctica de la medicina basada en la evidencia considera al ensayo clínico con distribución al azar el patrón de referencia para valorar la eficacia, la seguridad y sobre todo la relación causa-efecto con mayor validez para tomar decisiones sanitarias. Los estudios de este tipo calificados en nuestro análisis con bajo riesgo de sesgos mostraron un efecto neutro en el metabolismo glúcido cuando se les comparó con placebo o con agua.
Varios investigadores estudiaron el efecto en las hormonas intestinales y el metabolismo de la glucosa. Algunos edulcorantes no calóricos pudieran no ser inertes en términos endocrinológicos. Se han mostrado efectos in vitro e in vivo en la respuesta cefálica en las concentraciones de insulina por el estímulo en los receptores del dulzor en la lengua, modificaciones en las concentraciones de hormonas intestinales, como el GLP1 al contacto con receptores del dulzor en el intestino, cambios en el transporte de glucosa en el enterocito o incluso pequeñas modificaciones en el área bajo la curva (AUC) de insulina.33 Sin embargo, aunque algunos de estos hallazgos alcanzan significación estadística, a juicio de la mayoría de los expertos en endocrinología y metabolismo, estos cambios son tan pequeños que no parecen tener relevancia clínica alguna ni a favor ni en contra de la salud humana. Es indispensable continuar investigando esta área del conocimiento y es preciso distinguir entre la relevancia estadística y la significación clínica, de acuerdo con la magnitud del efecto en cuestión.
Conclusión con base en la evidencia. En algunos estudios observacionales se reporta asociación entre el consumo de edulcorantes no calóricos y la incidencia de diabetes. Sin embargo, este efecto estadístico puede atribuirse a un efecto de causalidad inversa, porque cuando se eliminan los factores de confusión, tiende a disiparse. Calidad de la evidencia: B. Como se verá en el siguiente párrafo, los estudios de mayor jerarquía en su diseño sugieren que esta asociación no es causal.
En ensayos clínicos controlados, en sujetos sanos y en diabéticos, los edulcorantes no calóricos tienen un efecto neutro en el control glucémico.51 Más aún, en ensayos clínicos con distribución al azar que estudian la sustitución de azúcares simples por edulcorantes no calóricos se observa una tendencia a mejorar el control metabólico en diabéticos tipo 1 y 2. Con base en lo anterior, no puede establecerse un vínculo causal entre edulcorantes no calóricos y la aparición de diabetes. Calidad de la evidencia: A.
Consumo de edulcorantes no calóricos y su efecto en la microbiota intestinal: implicaciones en el metabolismo de la glucosa
Aunque ésta es un área del conocimiento que en años recientes ha despertado un enorme interés, son escasos los trabajos con diseño y calidad satisfactorios en relación con los edulcorantes no calóricos y su efecto en la microbiota intestinal y los datos existentes han generado confusión debido a varios factores. Es pertinente precisar que en ocasiones no se toman en cuenta las características genéticas y de hábitos alimentarios de los sujetos de estudio, ni la especificidad bacteriana en relación con los géneros y las especies de los microorganismos detectados en cada estudio. Algunos investigadores generalizan divisiones simplistas entre “bacterias buenas y bacterias malas”; en realidad el espectro de los microorganismos es mucho más complejo de acuerdo con las afecciones que se estudien y la abundancia y tipo de microbiota.52,53
En 2014, una publicación encabezada por Suez, en Israel, tuvo una secuencia de estudios realizados en ratones y en humanos.10 Se administraron diversas dosis de sacarosa y glucosa y se compararon con sacarina, sucralosa y aspartame en ratas de 10 semanas de vida con peso normal. En resumen, a los animales a los que se les administraron estos tres edulcorantes no calóricos tuvieron intolerancia a la glucosa; este efecto fue marcadamente mayor con la sacarina. Estos efectos se repitieron en ratas obesas y se encontró alteración metabólica independientemente del índice de masa corporal. Sin embargo, en el resto de los estudios sólo se usó sacarina como “modelo”, por lo que las conclusiones no pueden extrapolarse a los otros dos compuestos.
Se administraron antibióticos para modificar la microbiota intestinal y se encontró que la sacarina aumentaba la población de bacteoridetes y disminuía la de firmicutes, con modificación desfavorable en la producción de ácidos grasos de cadena corta, caracterizada por incremento del acetato y propionato en relación con mayor consumo de sacarina. En síntesis, en los ratones con dosis de sacarina en límites superiores de la IDA para humanos se produjeron cambios en la microbiota, a los que se atribuyó el deterioro en la tolerancia a la glucosa. Curiosamente, los autores luego extrapolaron estos efectos también a los otros edulcorantes no calóricos, efectos que en su experimento no se encontraron.
En el mismo artículo también se presenta un estudio transversal en humanos que comparó consumidores a largo plazo contra no consumidores de edulcorantes no calóricos. Se les realizaron evaluaciones de la microbiota intestinal y se encontraron diferencias cuantitativas y cualitativas, así como mayor frecuencia de alteraciones asociadas con el síndrome metabólico en los consumidores habituales. La interpretación de estos hallazgos se vuelve incierta en función del mencionado factor de “causalidad inversa” propio de los estudios observacionales no controlados. Además, no se tipificaron las características genéticas y de estilo de vida de cada paciente.
Por último, el artículo muestra un experimento en el que en 4 de 7 voluntarios sanos se reportó deterioro en la curva de tolerancia a la glucosa al administrar durante una semana 360 mg/día de sacarina, también administrada al límite superior de la IDA. Los autores concluyeron que los edulcorantes no calóricos se vinculan con intolerancia a la glucosa y, por tanto, con la génesis de diabetes a través de un mecanismo de disbiosis intestinal.
Al analizar el método reportado en esta publicación, resulta inadecuado extrapolar los resultados de un edulcorante (sacarina) a otros, en los que no se encuentra el efecto nocivo en el metabolismo de la glucosa. Las características de los animales de estudio en algunos aspectos son diferentes a los de la vida real: animales alimentados con 60% de su energía proveniente de grasas en algunos casos, patrones de alimentación bajos en fibra y proteína que también influyen en la población bacteriana. En algunas partes de los experimentos los roedores se encontraban libres de gérmenes por exposición a antibióticos, además de que se les administraron dosis atípicamente elevadas de sacarina, entre otras situaciones.
En cuanto a los experimentos efectuados en humanos por el grupo de Suez, la primera parte se realizó a través de un estudio observacional. Este diseño habitualmente tiene el inconveniente de no eliminar por completo las variables de confusión; en otros estudios los consumidores de edulcorantes no calóricos muestran otros patrones de alimentación y salud en contraste con los no consumidores, por los que los cambios en la microbiota y sus características metabólicas también pueden ser diferentes por otros factores más allá del consumo de edulcorantes no calóricos. En todo caso existe una asociación estadística y no necesariamente una relación de causalidad. Por otro lado, no se especifica qué tipo y dosis de los diversos edulcorantes existentes consumían estos 381 sujetos, lo que hace difícil la interpretación de los resultados.
Otra consideración pertinente es que la muestra en la que se evaluaron experimentalmente las alteraciones de la tolerancia a la glucosa con la sacarina en humanos y sus cambios en los microorganismos intestinales fue muy reducida (siete sujetos) y no tuvo un grupo control que permitiese la comparación. Por último, llama la atención que la sacarina se haya utilizado como patrón representativo de los edulcorantes no calóricos cuando actualmente es de los menos utilizados y generalmente se consume a dosis mínimas mezcladas con otros edulcorantes no calóricos.
Conclusión con base en la evidencia. Parece razonable hipotetizar que el consumo de ciertos edulcorantes no calóricos (a excepción del aspartame, ya que se considera que los aminoácidos esenciales de los que está compuesto no llegarían al intestino) a dosis altas pueda producir cambios en la microbiota intestinal. La pregunta que deriva de estos hallazgos es si existe algún efecto en el metabolismo de los carbohidratos. Llama mucho la atención que estos resultados no concuerdan con los ensayos controlados con distribución al azar que con mejor diseño, mejores controles y mayor población también miden desenlaces similares: concentraciones de glucemia, HbA1C y otros relacionados. Estos ensayos controlados con distribución al azar se han realizado en poblaciones más amplias, aleatorizadas y con mejor control de factores de confusión. El papel de la disbiosis como factor causal de la intolerancia a la glucosa deberá evaluarse y estudiarse con más profundidad. Ésta es un área de investigación interesante y promisoria, pero aún en etapas muy incipientes para su clara interpretación. A raíz del estudio de Suez, actualmente se realizan algunos ensayos clínicos con un diseño más adecuado para contestar la pregunta de si los edulcorantes no calóricos modifican favorable o desfavorablemente la microbiota en relación con el metabolismo energético. Calidad de la evidencia: D.
Edulcorantes no calóricos en diferentes enfermedades
Edulcorantes no calóricos en fenilcetonuria
La presentación comercial de aspartame para uso de mesa y los productos que lo contienen deben tener en su envase individual una advertencia que en general señale: “contiene aspartame, su consumo en fenilcetonuria no es recomendado”.
Un bolo único de aspartame administrado a dosis altas produce cambios en algunos parámetros bioquímicos, incluyendo concentraciones de aminoácidos en plasma y de neurotrasmisores en el sistema nervioso central. Los análisis de seguridad en animales y humanos, incluidas personas heterocigotas para fenilcetonuria, no han arrojado efectos adversos de estos dos aminoácidos que lo componen ni de sus productos de descomposición, como el metanol o la dicetopiperazina, ni cambios en la fisiología corporal aun a dosis tan altas como 4,000 mg/kg/día. Las concentraciones séricas de sus componentes metabólicos, a dosis de 50 mg/kg, no exceden las encontradas después de una alimentación normal.39,54 Incluso en personas homocigotas para fenilcetonuria (niños y adultos), es bien tolerado un consumo menor a 45 mg/kg/día.55 56,57 58
En el caso de personas homocigotas con fenilcetonuria, la restricción de aspartame deberá ir de acuerdo con los lineamientos generales de una dieta especial, que por lo común restringiría fuentes naturales de alimentos con fenilalanina, como huevo, leche, carne, pescado y algunas leguminosas como las lentejas.
En general, el consumo de productos que contengan aspartame durante la gestación se considera seguro para fenilcetonúricos, tanto para las mujeres sanas como para las heterocigóticas. Las mujeres con diagnóstico establecido de fenilcetonuria (homocigóticas) deben continuar absteniéndose de consumir aspartame. Otros componentes del aspartame como el metanol no son tóxicos para el feto a las dosis de aspartame consumidas en humanos. Aparte del aspartame, no existe restricción alguna para los otros edulcorantes no calóricos en fenilcetonuria.
Conclusión con base en la evidencia. En individuos con diagnóstico de fenilcetonuria homocigótica deberá restringirse el consumo de aspartame. En personas heterocigóticas para fenilcetonuria (niños y adultos) es bien tolerado un consumo menor a 45 mg/kg/día; sin embargo, esta cantidad debe reducirse de acuerdo con la cantidad de fenilalanina contenida en la dieta especial para estos sujetos. Calidad de la evidencia: A.
Edulcorantes no calóricos en enfermedad renal
En el rubro de la enfermedad renal se encuentra de nuevo una aparente divergencia entre estudios observacionales/epidemiológicos contra lo encontrado en trabajos de mayor calidad en la gradación de la evidencia, como los ensayos controlados con distribución al azar. Una revisión sistemática con metanálisis de estudios observacionales analizó a una población de personas que consumían refrescos endulzados con edulcorantes no calóricos o con azúcar, comparándola con controles que no consumían o que tenían muy bajo consumo.59 Los resultados mostraron aumento de 33% en el riesgo de padecer disminución del filtrado glomerular o elevaciones de las concentraciones de creatinina en los consumidores de bebidas con edulcorantes no calóricos, comparado con los controles no consumidores (RR de 1.33, CI 0.82-2.15). La composición de los estudios incluidos mostró alta heterogeneidad entre ellos (12 de 84%). Asimismo, la asociación positiva entre consumo de edulcorantes no calóricos y el deterioro renal no fue estadísticamente significativa (p=0.25). Además, los consumidores de bebidas con azúcar mostraron asociación positiva de mayor intervalo (de 1.58) para padecer daño renal que los no consumidores. Esta asociación entre bebidas azucaradas y el daño renal sí fue significativa, aunque limítrofe (p=0.05). Es de subrayarse que en ambos análisis estadísticos se encontró gran heterogeneidad entre los estudios, tanto en la manera de evaluar el nivel de consumo de bebidas azucaradas como en la manera de medir el deterioro de la función renal. Como puede observarse en el caso de los edulcorantes no calóricos, los intervalos de confianza (IC) fueron muy amplios y cruzaron la frontera de la unidad. Como en el caso de los estudios observacionales de edulcorantes no calóricos en asociación con obesidad y diabetes, la tendencia observada en estos estudios epidemiológicos parece deberse a los fenómenos de causalidad inversa.
En personas diabéticas con insuficiencia renal crónica, posterior a su procedimiento periódico de hemodiálisis, se realizó un ensayo controlado con distribución al azar en el que después del consumo de aspartame se evaluó un aumento significativo de fenilalanina y tirosina una y dos horas después de su administración, comparadas con la administración de 300 mL de leche y placebo.60 Este estudio mostró que los incrementos en fenilalanina fueron iguales a los que se produjeron después de la administración de leche como comparador. Las elevaciones de aminoácidos ocurrieron en el intervalo habitual que se observa en el estado posprandial en sujetos sanos. La dosis administrada fue superior a la habitual (equivalente a 10 sobres de aspartame).
Conclusión con base en la evidencia. Se concluyó que en los estudios observacionales en los que se evaluó una asociación potencial entre el consumo de edulcorantes no calóricos y la aparición de insuficiencia renal crónica no se encontró consistencia estadística suficiente siquiera para establecer una asociación. Calidad de la evidencia: C.
El aspartame puede consumirse con seguridad por pacientes con insuficiencia renal crónica, incluso por los que están en hemodiálisis. No se ha reportado ninguna restricción para los otros edulcorantes no calóricos. Calidad de la evidencia: A.
Edulcorantes no calóricos y neoplasias
A pesar de que algunos estudios en animales, ya mencionados en otras secciones de este documento, sugieren alguna asociación entre el consumo de edulcorantes no calóricos y la generación de tumores hematológicos o en el sistema nervioso central, los estudios epidemiológicos (incluidos los ensayos de casos y controles o prospectivos en humanos con grandes cohortes) no muestran evidencia de asociación entre el consumo de edulcorantes no calóricos y la aparición de cáncer en algún tejido.34,61 62,63 64
Un ejemplo es el análisis que hace el Instituto Nacional del Cáncer en Estados Unidos. Esta organización examinó los datos del estudio de alimentación y salud de un grupo de más de un millón de jubilados (NIH-AARP Diet and Health Study). El aumento en el consumo de bebidas que contienen edulcorantes no calóricos no se asoció con linfoma, leucemia o cáncer cerebral.65
Conclusión con base en la evidencia. La información científica aportada hasta ahora por las organizaciones mundiales no muestra asociación entre consumo de edulcorantes no calóricos y neoplasias en humanos. Calidad de la evidencia: B.
Edulcorantes no calóricos en hepatopatías
El consumo de diversos edulcorantes no calóricos en personas con daño hepático no parece generar su restricción en las guías de manejo. Sin embargo, por su composición de aminoácidos se ha estudiado con mayor atención al aspartame.
Comparados con el consumo de aspartame, se encontraron cambios significativos que empeoraron el índice de encefalopatía únicamente tras la ingestión de leche. Al medir las concentraciones de metanol y ácido fórmico, éstos no fueron diferentes que el placebo en el caso de consumo de aspartame. Se encontraron elevaciones significativas de fenilalanina con la ingestión de aspartame, comparada con la leche y el placebo, así como disminución de los aminoácidos de cadena ramificada y aminoácidos aromáticos. La conclusión es que aunque el consumo de dosis moderadamente altas de aspartame incrementa las concentraciones de fenilalanina en pacientes con insuficiencia hepática, no se generan efectos en encefalopatía y puede consumirse con seguridad por pacientes con encefalopatía que estén clínicamente estables.66
Conclusión con base en la evidencia. A pesar del contenido de aminoácidos, el consumo de aspartame está permitido en encefalopatía hepática, ya que no altera el patrón de aminoácidos. Calidad de la evidencia: A.
Infertilidad masculina
En el pasado se tomaron algunas precauciones en el consumo de ciclamato por evidencias de la disminución en la fertilidad en animales machos. En atención a ese antecedente, un estudio de casos con hombres infértiles versus controles sanos evaluó la existencia de ciclamato y sus metabolitos en la orina, así como su consumo a través de encuestas de frecuencia de alimentos, sin encontrar ninguna asociación entre el consumo o la existencia de ciclamato en la orina entre los casos y los controles.11,24
Conclusión con base en la evidencia. El consumo de ciclamato no parece estar asociado con infertilidad en varones humanos. Calidad de la evidencia: B.
Edulcorantes no calóricos y caries
En ensayos clínicos controlados in vivo e in vitro (en animales y en humanos) y en estudios de casos y controles no se encontró causalidad entre la exposición a edulcorantes no calóricos y caries.67,68 Más aún, ante el incremento del consumo de azúcares que contribuye a la caries dental, los edulcorantes no calóricos aparecen como una opción debido a que no son metabolizados por las bacterias orales y, por tanto, no son cariogénicos. Incluso alguno de ellos, como estevia, parece inhibir el metabolismo bacteriano. Un polialcohol, el xilitol, también ha demostrado interferir con el crecimiento bacteriano y reducir la incidencia de caries.8
Conclusión con base en la evidencia. Los edulcorantes no calóricos (compuestos puros sin los acarreadores -por ejemplo, dextrosa- que normalmente se usan en los productos comerciales) no causan caries y su consumo puede ser recomendable como alternativa al consumo de sacarosa, jarabes de alta fructosa, fructosa y maltosa para la prevención de caries. Calidad de la evidencia: A.
RESUMEN Y CONCLUSIÓN FINAL
La posición de la Academia de Nutrición y Dietética es que los consumidores pueden disfrutar de manera segura de una amplia gama de edulcorantes nutritivos y no nutritivos cuando se consumen dentro de un plan de alimentación guiado por las recomendaciones de nutrición federales actuales, como los Lineamientos Dietarios de Referencia, así como los planes y metas de salud individuales y la preferencia personal.
Todos los edulcorantes no calóricos y bajos en calorías consumidos en la actualidad han pasado por estrictas pruebas de inocuidad. El proceso regulatorio por el que pasan los edulcorantes no calóricos es escrupuloso y obtener la autorización para su consumo es un proceso científico robusto que llega a tomar hasta 20 años. Todos los aditivos tienen una ingesta diaria admisible (IDA) que representa un lineamiento cuantitativo para propósitos de seguridad y salud.
La evidencia científica actual indica que no existe relación entre el consumo de edulcorantes no calóricos y la aparición de enfermedades no contagiosas. Estudios muy recientes realizados con humanos analizaron la posible relación epidemiológica entre el consumo de edulcorantes no calóricos y diferentes tipos de cáncer, sin encontrar ningún tipo de relación o tendencia. Su consumo no se relacionó con enfermedades cardiovasculares, neurológicas o alguna alteración o efectos relacionados con el embarazo. Por tanto, su consumo en las cantidades indicadas no representa un riesgo a la salud a la luz de la evidencia científica disponible.
A pesar de que los edulcorantes no calóricos comparten características comunes, como su intenso sabor dulce, cada una de las moléculas disponibles en México tiene características individuales, por lo que no es conveniente hacer generalizaciones de todas como si fueran iguales, sin atender a sus cualidades particulares. Los estudios moleculares de la última década muestran que estos aditivos no son metabólicamente inertes; es decir, pueden modificar algunos ejes hormonales y también podrían influir en la microbiota intestinal. En apariencia, algunas de estas modificaciones pudieran tener significación estadística, pero su relevancia clínica no se ha demostrado en ensayos clínicos controlados con distribución al azar ni en las revisiones sistemáticas con metanálisis de ensayos clínicos aleatorizados. Los avances de la investigación en este campo seguramente despejarán las interrogantes que se plantean.
La educación del consumidor acerca de estos productos debe fortalecerse de manera rigurosa y objetiva, basada en la mejor evidencia científica y en procesos regulatorios. Las administraciones y sociedades científicas responsables deben difundir información clara y objetiva acerca de los edulcorantes no calóricos en sus páginas web y redes sociales y publicar materiales educativos que contribuyan a esclarecer las dudas y eliminar la desinformación prevalente.











 nueva página del texto (beta)
nueva página del texto (beta)


