Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.29 no.1 Villahermosa abr. 2013
Artículos
Concentración y composiciones orgánica y proximal de dos especies de diatomeas bentónicas a diferentes salinidades
Concentration and organic and proximate compositions of two benthic diatoms species at different salinities
Sylvia Leal1, María Alejandra-Medina2, Martín Alejandro-Guerrero3, Pablo Piña4, Mario Nieves5, Rafael Curbelo6
1 Centro de Investigaciones Marinas, Universidad de La Habana, Calle 16 No. 114, Paya, CP 11300, Ciudad Habana, Cuba. Correo electrónico:sylvia@cim.uh.cu
2, 3, 4, 5 Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa, Mazatlán, Sinaloa, México.
6 Centro de Producción de Postlarvas de Camarón "Yaguacam", Cienfuegos, Cuba.
Artículo recibido: 10 de diciembre de 2012
Aceptado: 13 de febrero de 2013
RESUMEN
Navicula germanopolonica y Amphora sp, diatomeas bentónicas aisladas en Cuba, se pueden utilizar en la alimentación de postlarvas de camarón, de ahí la importancia de conocer las condiciones óptimas de su cultivo. En esta investigación se evaluó el efecto de la salinidad sobre la concentración y las composiciones orgánica y proximal de las mismas. Se ensayaron cinco salinidades (20, 25, 30, 35, 40 ups). La concentración se determinó por conteo directo. Se halló el peso seco y orgánico filtrando un volumen determinado de muestra por filtros de fibra de vidrio, al igual que la cantidad de proteínas, carbohidratos y lípidos. Los porcentajes se determinaron por métodos clásicos. N. germanopolonica mostró su mayor concentración a 30 ups. La cantidad de proteínas, carbohidratos y lípidos es mayor a salinidades bajas, encontrándose a 20 ups, 26 %, 11 % y 26 % respectivamente. Amphora sp alcanzó las concentraciones más altas a 35 ups. La composición proximal tuvo sus valores más altos a 20 ups. N. germanopolonica alcanzó mayores densidades y valor proteico, sin embargo, al ser una célula más pequeña son necesarios cultivos muy concentrados para su utilización en alimentación. El contenido lipídico de las dos especies fue alto comparado con otras especies de microalgas planctónicas. N. germanopolonica dio mejores resultados a salinidades menores de 25 ups y Amphora sp a salinidades alrededor de 30 ups.
Palabras clave: diatomeas bentónicas, cultivos de microalgas, salinidad, composición orgánica, composición proximal, Navicula, Amphora.
ABSTRACT
Navicula germanopolonica and Amphora sp, benthic diatoms isolated in Cuba, may be used to feed shrimp postlarvae, thus the importance of establishing optimum conditions for cultivation. This study evaluated the effect of salinity on the concentration and the organic and proximal composition of these species. Five salinities were tested (20, 25, 30, 35, 40 ups). Concentration was recorded by direct count. Dry and organic weight were recorded by filtering a certain volume of sample through fiberglass filters, together with the quantity of proteins, carbohydrates and lipids. Percentages were determined following the usual methods. N. germanopolonica presented its greatest concentration at 30 ups. The quantity of proteins, carbohydrates and lipids was greatest at low salinities, with 26 %, 11 % and 26 % respectively at 20 ups. Amphora sp reached its greatest concentration at 35 ups. The proximal composition recorded its greatest values at 20 ups. N. germanopolonica recorded greater densities and protein values, however, having smaller cells, the cultures need to be very concentrated to be used in feeding. The lipid content in both species was high compared with other planctonic microalgae species. N. germanopolonica provided best results at salinities below 25 ups and Amphora sp at salinities around 30 ups.
Key words: benthic diatoms, microalgae cultures, salinity, organic composition, proximal composition, Navicula, Amphora.
INTRODUCCIÓN
Las diatomeas, que pertenecen a la Clase Bacillariophyceae, son organismos eucariontes, unicelulares, fotosintéticos, cuya pared celular está compuesta por dos valvas de sílice. Este grupo ocupa una amplia gama de ambientes acuáticos (dulceacuícolas y marinos), tanto en el plancton como en el bentos. Entre sus diversas aplicaciones está utilizarlas en la alimentación de organismos en cultivo. Particularmente, las diatomeas bentónicas marinas han sido usadas en el cultivo de moluscos, camarones, erizos y pepinos de mar. Además de ser un buen alimento en camarones (Griffith et al. 1992; Curbelo et al. 2006; Leal et al. 2010) inducen el asentamiento larval en abulones (Roberts 2001, Searcy-Bernal et al. 2003), erizos (Xing et al. 2007) y pepinos de mar (Ito & Kitamura 1997), además de ser de utilidad para mejorar la calidad del agua en sistemas de cultivo (Khatoon et al. 2007). Para obtener cultivos masivos de microalgas, en este caso de diatomeas, es necesario estudiar su crecimiento y su composición bioquímica ya que la producción de biomasa y la calidad nutricional varían según las condiciones de cultivo. El valor nutricional de un alga es un factor muy importante para la dieta de los animales marinos (Knuckey et al. 2002). La variación en la composición química de las microalgas depende de factores como la intensidad luminosa, salinidad, pH, temperatura y concentración de nutrientes. Abalde et al. (1995) señalan que la variabilidad bioquímica de las microalgas puede ser utilizada para producir células con un contenido bioquímico previamente determinado. Muchos autores coinciden en que, en dependencia de las condiciones de cultivo, así será el valor nutricional de las especies y la producción de varias moléculas como pigmentos, antibióticos y otros, que dependiendo de las condiciones a que son sometidas (luz, intensidad luminosa, disponibilidad de nutrientes, pH, temperatura, etc.) así será la cantidad y calidad de su producción (Lebeau & Robert 2003). Entre los factores que regulan el crecimiento de los cultivos de diatomeas, la salinidad es uno de los más importantes, sobre todo en países tropicales donde las temperaturas altas, la evaporación y las lluvias suelen afectar este parámetro y con ello la producción y calidad de las células (Khatoon et al. 2010). El presente estudio contribuye al conocimiento de cómo la salinidad influye en la producción de dos especies de diatomeas que se utilizan en la alimentación de postlarvas de camarón. El objetivo del presente trabajo fue determinar el efecto de la salinidad sobre las concentraciones celulares y las composiciones orgánicas y proximal de dos especies de diatomeas bentónicas Navicula germanopolonica y Amphora sp., aisladas en Cuba, en condiciones controladas de cultivo.
MATERIALES Y MÉTODOS
Las especies sometidas a estudio fueron Navicula germanopolonica Witkowski & Lange Bertalot (Lange-Bertalot 1993) y Amphora sp, diatomeas bentónicas pertenecientes a la Clase Bacillariophyceae, aisladas en Cuba de los tanques de reproductores del Centro de Producción de Postlarvas de Camarón "Yaguacam", en la provincia de Cienfuegos. Para la preparación de los cultivos, el agua de mar utilizada se filtró a través de cartuchos de 5 y 1 μm de retención y finalmente por carbón activado. Posteriormente se cloró por 24 horas con hipoclorito de sodio comercial al 5 % y se neutralizó con tiosulfato de sodio a razón de 0.06 g L-1. Los ensayos se realizaron con medio de cultivo Guillard h (Guillard 1975), en recipientes plásticos de 3 L, los cuales se colocaron en estantes preparados al efecto donde recibían entre 120-130 /µ mol m-2 s-1 de intensidad y temperatura de 24 ± 1 °C. Se realizaron cinco tratamientos a las salinidades de 20, 25, 30, 35 y 40 ups con cuatro réplicas cada uno. Para reducir la salinidad se adicionó agua destilada y para aumentarla se empleó NaCI. Los inóculos fueron previamente preparados a cada una de las salinidades de los diferentes tratamientos y se ajustaron las concentraciones en cada una de las unidades experimentales a 19 x 103 cel ml-1en el caso de Amphora sp. al inicio de cada experimento. Se determinaron las concentraciones celulares diariamente hasta el día 4. Las composiciones orgánica y proximal se hallaron en la fase exponencial de los cultivos. La concentración se realizó por conteo directo, con la ayuda de un microscopio biológico marca Olimpus, modelo BH-2, utilizando una cámara Neubauer. Se tomaron dos submuestras de cada unidad experimental y se contaron los cuatro cuadrantes de las esquinas de cada uno de los dos cuadriculados que tiene la cámara, para un total de ocho conteos por muestra de 10 mi. En el caso de Amphora sp. se adicionó pentano al 5 % en cada muestra para disgregar las biopelículas y así facilitar el conteo (Leal et al. 2012). Para valorar el peso seco se utilizaron 200 mi de muestra pasados por filtros de fibra de vidrio Wathman GFC de 47 mm de diámetro, con porosidad de 1.2 µm, previamente lavados con agua destilada y desecados hasta llevarlos a peso constante. Las muestras se lavaron con formiato de amonio al 3 % para eliminar los residuos de sales y se incubaron en una estufa Barnstead, modelo 3513, a 60 °C donde se dejaron por siete días hasta que se secaran. Los filtros fueron pesados en una balanza analítica digital Denver Instrument, de 0.01 mg de precisión, hasta llevarlos a peso constante. Después de determinar el peso seco se pusieron en una mufla Barnstead, modelo F48020-80, por 12 horas, a 450 °C y se volvieron a pesar para hallar el contenido de cenizas. La composición orgánica se determinó de acuerdo a lo descrito por Sorokin (1973). La cantidad de proteínas se determinó por el método de Lowry et al. (1951) para lo que se filtraron entre 15 y 20 mi de cultivo. La cantidad de carbohidratos y lípidos se determinaron por los métodos de Dubois et al. (1956) y de Bligh & Dyer (1959) respectivamente, filtrando entre 30 y 40 mi de cultivo. Los filtros utilizados fueron de fibra de vidrio Wathman GFC de 25 mm de diámetro y 1.2 µm de porosidad. Las muestras fueron inmediatamente congeladas a -70 °C en un ultracongelador Thermo Fisher Scientific, modelo U86-13D41, hasta su procesamiento. Para cada una de las determinaciones se tomaron tres muestras de cada unidad experimental por lo que se procesaron un total 12 muestras por tratamiento. Las lecturas de absorbancia fueron realizadas en un espectrofotómetro Hach modelo DR 5000, a las longitudes de onda que describe cada método. Los datos se analizaron mediante ANOVA de una vía donde se comprobó la normalidad de los mismos y la homogeneidad de varianzas. La comparación de medias se realizó mediante Prueba Tukey o Dunn's según la prueba a aplicar fuera paramétrica o no. Los valores porcentuales de la composición proximal fueron transformados a  para su comparación. Se trabajó a un nivel de significación de 0.05 y se utilizó el software SigmaStat Versión 3.5.
para su comparación. Se trabajó a un nivel de significación de 0.05 y se utilizó el software SigmaStat Versión 3.5.
RESULTADOS
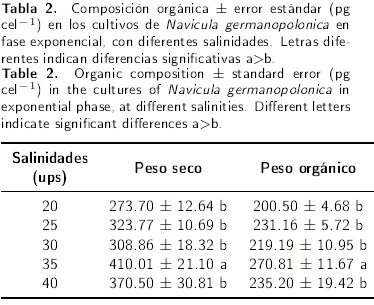
Los cultivos de N. germanopolonica tuvieron una fase de latencia bien marcada que duró un día (Figura 1). La salinidad influyó sobre esta especie a partir del tercer día. Al primer día comenzó la fase exponencial y al segundo día todavía no existían diferencias significativas (F = 2.985, p = 0.054) entre las concentraciones obtenidas en los diferentes tratamientos (Tabla 1). Aunque se observa cierta estacionalidad a partir del segundo día, las salinidades de 30 y 35 ups manifiestan un ascenso en sus concentraciones. Las concentraciones celulares a 30 ups resultaron las mayores y significativamente diferentes del resto de los tratamientos los días 3 (F = 7.954, p = 0.01) y 4 (H = 17.442, p = 0.002). Los pesos secos y orgánico fueron mayores a la salinidad de 35 ups (Tabla 2) y resultaron diferentes del resto de los tratamientos (H = 21.98 y 19.12, con p < 0.001 respectivamente). La cantidad de proteínas, lípidos y carbohidratos, en base al peso seco, fueron mayores a la salinidad de 20 ups (Tabla 3).



Los cultivos de Amphora sp. no tuvieron fase de latencia (Figura 2) y los que estaban a 35 ups mostraron siempre las mayores concentraciones. Al segundo día de cultivo no se encontraron diferencias significativas entre las concentraciones (F = 3.027, p = 0.051) (Tabla 4), sin embargo al tercer día, en las salinidades de 30 y 35 ups las concentraciones fueron las mayores y difirieron del resto de los tratamientos (F = 8.147, p = 0.001). Al cuarto día se obtuvo la mayor concentración de esta especie a 35 ups, que fue diferente significativamente del resto de las salinidades ensayadas (F = 6.343, p = 0.003). El peso seco fue mayor a la salinidad de 40 ups (Tabla 5) y diferente del resto de los tratamientos (H = 21.19, p < 0.001), sin embargo, el peso orgánico fue mayor a 20 ups que no difirió del encontrado a 25 y 40 ups (H = 24.48, p < 0.001). La 20 ups (Tabla 6). Las proteínas, con un 19 %, fueron diferentes del resto de los tratamientos (H = 38.69, p < 0.001). Los carbohidratos (7 %) no difirieron de los de 30 y 35 ups (H = 9.97, p = 0.041) y los lípidos no tuvieron diferencias entre 20 y 30 ups (F = 12.68, p < 0.001).




DISCUSIÓN
Las microalgas en general y particularmente las marinas pueden tolerar un amplio rango de salinidades. Por sí sola, la salinidad no es un factor fuertemente condicionante, pero asociado a otros factores puede ser muy importante (Abalde et al. 1995). El efecto de la salinidad adquiere más influencia cuando se relaciona con otras variables como la temperatura, luz, fuente de nitrógeno y concentración de nutrientes (Fábregas et al. 1984, 1985, 1986).
Ghezelbash et al. (2008) plantean que entre los muchos factores ambientales, la salinidad limita el crecimiento y la productividad de los organismos. Las microalgas pueden soportar salinidades desde 3.4 a 34 ups (Taylor et al. 2001) y aunque este es un criterio bastante generalizado, hay autores como Laing & Ayala (1990) que plantean que los mejores crecimientos de los flagelados marinos están entre 20 y 25 ups y para las diatomeas entre 15 y 20 ups. En el presente estudio se confirma la tolerancia que tienen las dos especies estudiadas, independientemente de que existen unas salinidades donde se desarrollan mejor que en otras. Las concentraciones que se alcanzaron no resultaron altas, aspecto que se le atribuye a la temperatura en que se desarrollaron los cultivos. Leal et al. (2010) alcanzaron concentraciones de Amphora sp. de 1 x 106 cel mi-1 a 28 °C, que fue la misma especie con que se trabajó en este estudio, sin embargo Plasencia et al. (2004) obtuvieron densidades de 500 x 103 cel ml-1 a temperaturas entre 23 y 25 °C para el mismo género.
Por otra parte, Curbelo et al. (2006) obtuvieron concentraciones de Navicula sp. de 600 x 103 cel mi-1 a 27 °C. En el caso de N. germanopolonica, si bien su concentración celular estuvo favorecida entre 30 y 40 ups y su composición orgánica a 35 ups, el valor nutricional, dado por la cantidad de proteínas, carbohidratos y lípidos, fue mayor a las salinidades más bajas experimentadas. En el caso de Amphora sp. las concentraciones fueron mayores a 35 ups y el peso seco y orgánico a 40 ups, sin embargo, el peso orgánico de las células no tuvo diferencias con 20 y 25 ups. La composición proximal de esta especie también fue mejor a salinidades bajas. Es importante y beneficioso el hecho de que ambas especies tengan sus mayores valores nutricionales a las salinidades más bajas ensayadas, porque cuando se utilizan para alimentar postlarvas tempranas de camarón, las mismas se crían a 25 ups, por lo que el alimento que suministramos está en su valor óptimo y así se mantiene en los reservónos de cultivo. La obtención de mayores biomasas con el aumento de la salinidad está reportado también por otros autores. Ghezelbash et al. (2008) plantean las mayores biomasas a 40 ups para el flagelado Tetraselmis chuii. Khatoon et al. (2010) obtuvieron las mayores biomasas de Navicula sp. a 35 ups al igual que para Amphora sp. Los valores obtenidos en la composición bioquímica son similares a los que ofrecen otros autores para microalgas marinas. Así, Brown et al. (1998) plantean que los valores de proteínas están de 6 - 52 %, los de carbohidratos de 5 - 23 % y los lípidos de 7 - 23 %. En otros estudios, Olivera (2002) cita rangos entre 10 y 57 % para proteínas, de 4 a 37 % en carbohidratos, de 2.8 a 28 % en lípidos y de 7 -57 % en cenizas. Khatoon et al. (2010) plantean, para Navicula sp. y Amphora sp., valores entre 40 y 50 % de proteínas y de 20 - 25 % de lípidos a salinidades entre 15 y 25 ups, no encontrando en ninguna de las dos especies diferencias significativas en cuanto a los carbohidratos. Los valores de proteínas que se encontraron en el presente estudio no fueron tan altos como reportan estos autores y eso puede deberse a que las condiciones de cultivo no fueron idénticas y no sabemos si se trata de las mismas especies. No obstante, coincidimos en que los valores más altos de proteínas y lípidos se encuentran a bajas salinidades. Hay autores, como Courtois et al. (2012) que obtienen para cuatro especies de diatomeas bentónicas [Amphora sp., Navicula incerta, Nitzschia sp. y Proschkinia sp.) valores altos de carbohidratos, entre 18 y 28 %, sin embargo registran cantidades de proteínas entre 8 y 19 % y de lípidos entre 4 y 7 %. Las condiciones en que desarrollaron sus cultivos fueron con medio Guillard f/2 más la adición de 1 mg L-1 SiO3, luz continua a 60 µmol m-2 s-1 y 35 ups de salinidad. Esto confirma el criterio de que no sólo la salinidad influye sobre la composición proximal sino que hay que tener en cuenta la interacción de otros factores que inciden en el cultivo. El contenido lipídico de las dos especies que se sometieron a estudio es alto, incluso comparado con otras diatomeas bentónicas, aspecto éste muy importante debido a la necesidad de lípidos que muestran algunos organismos en cultivo como las postlarvas de camarón. Hay autores que plantean que la inclusión de diatomeas bentónicas en la dieta de las postlarvas constituyen una valiosa fuente de alimento para estos organismos y su valor nutricional más importante es el alto contenido de lípidos que poseen (Griffith et al. 1992), por lo que las dos especies pueden utilizarse como alimento de postlarvas de camarón, N. germanopolonica cultivándose a salinidades no mayores de 25 ups y Amphora sp. a salinidades alrededor de 30 ups. Si comparamos las dos especies podemos decir que N. germanopolonica alcanza mayores concentraciones y tiene mayor valor proteico, sin embargo al ser una célula más pequeña que Amphora sp. necesitamos cultivos muy concentrados para poder utilizarla en alimentación de organismos en cultivo como moluscos y crustáceos.
AGRADECIMIENTOS
Los autores agradecen el apoyo brindado por la Red Temática "Desarrollo y manejo sustentable de sistemas de producción acuícola", integrada por varios grupos de investigación y cuerpos académicos de México y Cuba, aprobada por la Secretaría de Educación Pública de México en diciembre del 2009 y dirigida por el Cuerpo Académico "Ecofisiología de Organismos Acuáticos y Cultivos de Apoyo" perteneciente a la Universidad Autónoma de Sinaloa en México. También agradecemos profundamente la ayuda brindada por el Dr. Oscar U. Hernández y a la MC. Dora Huerta, de CINVESTAV, Unidad Mérida, por la identificación de Navicula germanopolonica.
LITERATURA CITADA
Abalde J, Cid A, Fidalgo JP, Torres E, Herrero C (1995) Microalgas: Cultivo y aplicaciones. España, Universidade da Coruña, Monografías 26, 210 pp. [ Links ]
Bligh EG, Dyer WJ (1959) A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology 37: 911-917. [ Links ]
Brown MR, McCausland MA, Kowalski K (1998) The nutritional value of four Australian microalgal strains fed to pacific oyster Crassostrea gigas spat. Aquaculture 165: 281-293. [ Links ]
Courtois de Viçose G, Viera MP, Huchette S, Izquierdo MS (2012) Improving nursery performances of Haliotis tuberculata coccínea: Nutritional value of four species of benthic diatoms and green macroalgae germlings. Aquaculture 334-337: 124-131. [ Links ]
Curbelo R, Leal S, Núñez N, Almaguer Y (2006) Alimentación de las primeras postlarvas de camarón Litopenaeus schmitti con una especie de diatomea bentónica. Revista de Investigaciones Marina 27(3): 231-236. [ Links ]
Dubois M., Gilles KA, Hamilton JK, Rebars PA, Smith F (1956) Colorimetric method for determination of sugar and related substances. Analytical Chemistry 28: 350-356. [ Links ]
Fábregas J, Abalde J, Herrero C, Cabezas B, Veiga M (1984) Growth of the marine microalga Tetraselmis suecica in batch cultures with different salinities and nutrient concentrations. Aquaculture 42: 207-245. [ Links ]
Fábregas J, Herrero C, Abalde J, Cabezas B (1985) Growth, chlorophyll a and protein of the marine microalga Isochrysis galbana Parke in batch cultures with different salinities and high nutrient concentrations. Aquaculture 50: 1-11. [ Links ]
Fábregas J, Herrero C, Cabezas B, Liaño R, Abalde J (1986) Response of the marine microalga Dunaliella tertiolecta to nutrient concentration and salinity variations in batch cultures. Plant Physiolgy 125: 475-484. [ Links ]
Ghezelbash F, Farboondnia T, Heidari R, Agh N (2008) Growth and biochemical variability of the marine microalgae Chlorella stigmatophora in batch cultures with different salinities and nutrient gradient concentration. British Phycological Journal 22: 269-276. [ Links ]
Griffith DRW, Laborde E, Wigglesworth JM (1992) Biological and economic of penaeid larval rearing using benthic diatoms. Memorias I Congreso Ecuatoriano de Acuicultura, Escuela Superior Politécnica del Litoral, Ecuador, pp: 101-105. [ Links ]
Guillard RRL (1975) Culture of phytoplankton for feeding marine invertebrate. In: Culture of Marine Invertebrate Animals (W.L. Smith y M.H. Chanley, eds). Plenum Publishing, N.Y. pp: 29-60. [ Links ]
Ito S, Kitamura H (1997) Induction of larval metamorphosis in the sea cucumber Stichopus japónicas by periphitic diatoms. Hydrobiologia 358: 281-284. [ Links ]
Khatoon H, Yusoff FM, Banerjee S, Shariff M, Mohamed S (2007) Use of periphytic cyan o bacterium and mixed diatoms coated substrate for improving water quality, survival and growth of Penaeus monodon Fabricius postlarvae. Aquaculture 271: 196-205. [ Links ]
Khatoon H, Banerjee S, Yusoff FM, Shariff M (2010) Effects of salinity on the growth and proximate composition of selected tropical marine periphytic diatoms and cyanobacteria. Aquaculture Research 41: 1348-1355. [ Links ]
Knuckey RM, Brown MR, Barrett SM, Hallegraeff GM (2002) Isolation of new nanoplanktonic diatom strains and their evaluation as diets for juvenile Pacific oysters (Crassostrea gigas). Aquaculture 211: 253-274. [ Links ]
Laing I & Ayala F (1990) Commercial mass culture technique for producing microalgae. In: Introduction to Applied Phycology (I Akatsuka, ed), SPB Academic Publising Bv, The Hague, pp: 447-477. [ Links ]
Lange-Bertalot H. 1993. 85 neue taxa und Liber 100 weitere neu definierte Taxa ergãnzend zur Süsswasserflora von Mitteleuropa, Vol. 2/14. Bibliotheca Diatomologica. 27: 164 [ Links ]
Leal S, Miranda A, Curbelo R, Hernández J (2010) Las diatomeas bentónicas como fuente de alimento en el cultivo larvario de camarón y otros organismos acuáticos. En: X Simposio Internacional de Nutrición Acuícola. México, Nuevo León, CD-ROM. pp: 559-580. [ Links ]
Leal S, Curbelo R, Vega X, Núñez N, Hernández J (2012) Método de dispersión de biopelículas en cultivos de la diatomea bentónica Amphora sp. para facilitar el conteo directo. Serie Oceanológica 10: 23-29. [ Links ]
Lebeau T, Robert MR (2003) Diatom cultivation and biotechnologically relevant productus. Part. I. Cultivation at various scales. Applied Microbiology and Biotecnology 60: 612-623. [ Links ]
Lowry OH, Rosebrought NJ, Farr AL, Randall RJ (1951) Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry 193: 265-275. [ Links ]
Olivera A (2002). Valor nutricional das microalgas. Revista da ABCC. 4(2): 63-68. [ Links ]
Plasencia AH, Leal S, Voltolina D. Curbelo R (2004) Cultivo de una diatomea bentónica Amphora cf. marina con una zeolita natural enriquecida. Revista de Investigaciones Marinas 25(2): 151-158. [ Links ]
Roberts (2001) A review of settlement cues for larval abalone (Haliotis sp.). Journal of Shellfish Research 20(2): 571-586. [ Links ]
Searcy-Bernal R, Anguiano-Beltrán C, Esparza-Hernández A (2003) The effect of irradiance of the survival and growth of abalone postlarvae Haliotis fulgens fed Navicula incerta. Aquaculture 228: 237-248. [ Links ]
Sorokin C (1973) Dry weight, packed cell volume and optical density. In: Handbook of Phycological Methods, Culture methods and growth measurement (J Stein, ed), Cambridge University Press, pp: 321-343. [ Links ]
Taylor R, Fletcher RL, Raven JA (2001) Preliminary studies on the growth of selected green tide algae in laboratory culture: effects of irradiance, temperature, salinity and nutrients on growth rate. Botánica Marina 44: 327-336. [ Links ]
Xing RL, Wang CH, Cao ZB, Chang YQ (2007) The potential value of different species of benthic diatoms as food for newly metamorphosed sea urchin Strongylo centrotus intermedius. Aquaculture 263: 142-149. [ Links ]














