Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.28 no.3 Villahermosa dic. 2012
Artículos
Balance energético del rotífero Brachionus rotundiformis Tschugunoff 1921, alimentado con cuatro especies de microalgas
Energy budget of the rotifer Brachionus rotundiformis Tschugunof 1921, fed four species of microalgae
AH Rojo-Cebreros1, JC Román-Reyes1*, GA Rodríguez-Montes de Oca1, M Nieves-Soto1, P Piña-Valdez1, MA Medina-Jasso1
1 Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa. Paseo Claussen s/n Apdo. Postal 610 C.P. 82000 Mazatlán, Sinaloa. México. Correo Electrónico: jocrore@yahoo.com.mx
Recibido: 8 de diciembre de 2008
Aceptado: 26 de octubre de 2012
Resumen
Se estimó el balance energético del rotífero Brachionus rotundiformis alimentado con las microalgas Nannochloropsis spp. (Nano), Chaetoceros muelleri (Cham), Isochysis spp. (Iso) y Phaeodactylum tricornutum (Phat) a temperatura y salinidad de 29 °C y 35 ups, respectivamente. Nano e Iso constituyen dietas frecuentes durante el cultivo de B. rotundiformis. Cham y Phat se incluyeron a fin de evaluarlas como posibles dietas alternativas para el cultivo de la especie. Con base en la ecuación P = A − (R+U), en unidades de mJ rot−1 h−1; el balance energético de B. rotundiformis alimentado con las cuatro dietas puede resumirse de la siguiente manera, Nano: P = 0.67 − (0.05 + 8.48×10−5) = 0.62; Iso: P = 0.76 − (0.06 + 8.33×10−5) = 0.61; Cham: P = 0.41 − (0.07 + 2.94×10−5) = 0.33; Phat: P = 0.72 − (0.06 + 12.05×10−5) = 0.65. Esto indica que los campos de crecimiento (P) fueron diferentes (p < 0.05), con valores mayores y de igual magnitud con las microalgas Nano, Iso y Phat; mientras que con Cham, el campo de crecimiento fue aproximadamente un 50 % menor que el resto de las dietas probadas. Los resultados de este trabajo confirman la importancia de Nano e Iso como mejores dietas para mantener cultivos estables de rotíferos. No obstante, los balances energéticos positivos obtenidos con Cham y Phat, mayor en esta última, indican que ambas microalgas pueden ser utilizadas en el cultivo masivo del rotífero B. rotundiformis.
Palabras clave: Chaetoceros muelleri, Balance energético, Isochrysis spp., Nannochloropsis spp., Phaeodactylum tricornutum, rotífero.
Abstract
The energy budget was estimated for the rotifer Brachionus rotundiformis fed the microalgae Nannochloropsis spp. (Nano), Chaetoceros muelleri (Cham), Isochysis spp. (Iso) and Phaeodactylum tricornutum (Phat) at 29 °C and 35 ups. Nano and Iso are frequent diets in the culture of B. rotundiformis. Cham and Phat were included in order to evaluate them as possible alternative diets for the culture of this species. Based on the equation P = A − (R+U), with mJ rot−1 h−1 as the energy unit, the energy budget of B. rotundiformis fed the four diets may be summarized as follows: Nano: P = 0.67 − (0.05 + 8.48×10−5)= 0.62, Iso: P = 0.76 − (0.06 + 8.33×10−5)= 0.61, Cham: P = 0.41 − (0.07 + 2.94×10−5)= 0.33 and Phat: P = 0.72 − (0.06 + 12.05×10−5)= 0.65. The results indicate that growth (P) was different (p < 0.05), with higher values and of equal magnitude for the microalgae Nano, Iso and Phat, whereas for Cham, the growth calculation was approximately 50 % smaller than that for the other diets. The results of this study confirm the importance of Nano and Iso as the best diets to maintain stable rotifer cultures. Nevertheless, the positive energy budgets obtained with Cham and Phat, greater for the latter, indicate that both microalgae may be used in the massive culture of the rotifer B. rotundiformis.
Key words: Chaetoceros muelleri, energy budget, Isochrysis spp., Nannochloropsis spp., Phaeodactylum tricornutum, rotifer.
Introducción
El cultivo de rotíferos y su contribución al desarrollo biotecnológico para el cultivo de ciclo cerrado de varias especies marinas en cautiverio, se originó a principios de 1960, cuando se descubrió que podían ser utilizados para alimentar estadios tempranos de larvas de peces marinos (Ito 1960 & 1968, Hirata & Mori 1967). Desde entonces, el éxito de la industria mundial dedicada al cultivo larvario de muchas especies marinas depende principalmente del cultivo masivo de los rotíferos Brachionus plicatilis y Brachionus rotundiformis (Lubzens et al. 2001). Los rotíferos constituyen un grupo de organismos herbívoros, planctónicos, multicelulares, de tamaño microscópico (125 a 300 µm) y muy prolíficos, que se alimentan por filtración en la columna de agua. Estas características le permiten ser cultivados a densidades altas al ser alimentados con levaduras, microalgas unicelulares, alimentos preparados y además, pueden ser enriquecidos con ácidos grasos y antibióticos (Lubzens et al. 1989).
En lo que respecta a los modelos bioenergéticos, cuando son parametrizados correctamente, constituyen herramientas eficaces para predecir procesos relevantes, tales como tasas de alimentación, los límites de crecimiento impuestos por diferentes condiciones ambientales y los factores que influencian la variabilidad del crecimiento (McNair et al. 1998). Cuando estos procesos se relacionan con la nutrición, permiten predecir con qué régimen de alimentación se produce la mayor biomasa y ayudan a explicar las razones por las cuales los animales son más eficientes en presencia de distintos componentes nutricionales (Morten et al. 2006). En acuicultura, este conocimiento permite optimizar las estrategias de cultivo de las especies acuícolas; ya que el éxito en la producción de cantidades adecuadas de rotíferos permite alimentar larvas de muchos organismos y realizar estudios de aspectos biológicos y fisiológicos básicos, que permiten conocer el campo de respuesta óptimo y determinar las condiciones de cultivo más apropiadas.
Materiales y métodos
Cultivo de microalgas
Se utilizaron las cepas NN-X-1, CH-M-1, IS-X-1 y PH-T-1 de las microalgas Nannochloropsis spp., Chaetoceros muelleri, Isochrysis spp. y Phaeodactylum tricornutum, (en lo sucesivo identificadas como Nano, Cham, Iso y Phat, respectivamente), las cuales se mantienen en la colección del Laboratorio de Ecofisiología de Organismos Acuáticos y Cultivos de Apoyo para la Acuicultura, de la Facultad de Ciencias del Mar de la Universidad Autónoma de Sinaloa. Para la preparación del medio de cultivo se usó la formulación F (Guillard & Ryther 1962) y agua de mar con una salinidad de 35 ups. Estas microalgas fueron utilizadas como alimento para rotíferos y se cultivaron con la técnica semi-continua, la cual consiste en realizar diluciones del 30 % diariamente, reponiendo el volumen cosechado con medio de cultivo fresco (López Elías & Voltolina 1993).
Cultivo de rotíferos
La cepa de B. rotundiformis se obtuvo en el laboratorio mencionado anteriormente. Esta cepa fue utilizada para inocular recipientes de volumen progresivamente mayor, proporcionando alimento a saciedad. Antes de cada experimento con cada especie de microalga, los rotíferos fueron adaptados al nuevo tipo de alimento por al menos ocho días. La temperatura y salinidad se mantuvieron constantes a 29 °C y 35 ups, respectivamente; y el pH osciló entre 7.8 y 8.4. Para la producción masiva de rotíferos se utilizó un sistema de contenedores de plástico (tipo cubeta) con capacidad de 18 L, con alimentación continua de microalgas, fluyendo por gravedad desde cinco recipientes alimentadores, cada uno con 18 L de microalgas. Cada uno de estos recipientes tiene una salida ubicada en el fondo que descarga un flujo constante en los contenedores con rotíferos. El recambio constante de agua de los contenedores de cultivo de rotíferos se realizó por medio de la eliminación del volumen excedente al introducir las microalgas. Antes de cada cosecha, se verificó la concentración de rotíferos en cada recipiente, realizando conteos diarios con la ayuda de una cámara de Sedgwick-Rafter de 1 mL.
Diseño experimental
Durante el estudio se realizaron dos experimentos por cada especie de microalga para determinar la tasa de ingestión, consumo de oxígeno (O2) y excreción amoniacal (NH4+); mientras que para el estudio de la eficiencia de asimilación se efectuaron un total de cinco experimentos por dieta. Las raciones de alimentación se calcularon en base a la recomendación de Hino et al. (1997) con Nano (6 × 106 cél mL−1 y no menor de 3 × 106 cél mL−1) para una concentración de 200 rot mL−1 (Tabla 1). En este intervalo de alimentación se obtienen tasas de ingestión y crecimientos estables y al máximo nivel (Aoki & Hino 1996, Hino et al. 1997). Se determinó el contenido orgánico unitario de las microalgas utilizadas, así como sus equivalencias en biomasa orgánica. Por lo tanto, los rotíferos recibieron en su alimentación las mismas raciones en términos de biomasa orgánica cuando se trató de una u otra dieta.

Evaluación de las tasas fisiológicas
Los rotíferos presentes en los recipientes de cultivo se concentraron en un tamiz de 55 µm de luz de malla y se lavaron con agua filtrada a 1 µm para eliminar las microalgas y las heces. A continuación se transfirieron a un recipiente con un volumen aforado a 10 L, procurando obtener una concentración 200 rot mL−1 y la concentración de microalgas asignada para cada uno de los experimentos. Durante este proceso, también se procuró mantener el pH por debajo de 8.5 para no estresar a los organismos experimentales. Previamente, se tomaron muestras para registrar la concentración de amonio y de oxígeno inicial en el medio experimental. Posteriormente, el contenido del recipiente se homogenizó cuidadosamente y se tomaron cinco alícuotas de 1 mL para verificar mediante conteo directo la concentración requerida de microalgas y rotíferos. Inmediatamente después, rotíferos y microalgas fueron transferidos a botellas transparentes BOD con tapón esmerilado y con un volumen promedio de 311 mL, que funcionaron como respirómetros cerrados. Los respirómetros se colocaron en baño maría, y para mantener la temperatura a 29 °C se utilizó un calentador y un termorregulador. Debido a la necesidad de utilizar respirómetros cerrados y con el fin de evitar una excesiva disminución de la concentración del oxígeno disuelto en el medio, lo cual es una fuente adicional de estrés, se efectuaron mediciones de la ingestión, consumo de oxígeno y excreción de amonio cada media hora durante dos horas. Pruebas preliminares indicaron que la duración máxima de estos experimentos no debía exceder las dos horas. Se realizaron cinco repeticiones por tratamiento, además de dos grupos testigo sin rotíferos, para verificar eventuales cambios debidos a la actividad biológica de los microorganismos (bacterias y/o microalgas) presentes en el agua utilizada para llenar las unidades experimentales, y para verificar los posibles cambios en la concentración de microalgas debido a natalidad o mortalidad natural. Después de transcurrido cada periodo de experimentación se obtuvieron muestras para determinar la concentración de microalgas (cel mL−1) utilizando un contador de partículas Spectrex Láser Modelo PC-2000, oxígeno disuelto (mg O2 L−1) con el oxímetro MicroxTX2 (PreSens GmBH) y excreción de amonio (mg de NH4+ L−1) por medio de un multianalizador de iones marca Orion EA modelo 940 en cada uno de los respirómetros, cuyos valores fueron corregidos por diferencia considerando la concentración en los grupos testigo. Finalmente, los rotíferos presentes en cada respirómetro fueron colectados para determinar la biomasa seca y orgánica total, por individuo.
Eficiencia de asimilación
Los rotíferos colectados se concentraron en un tamiz de 55 µm de luz de malla y se lavaron con agua filtrada a 0.2 µm (filtro whatman polycap 2742c) para eliminar microalgas y heces. A continuación se transfirieron a un recipiente con un volumen de 10 L, con agua filtrada a 0.2 µm. Los rotíferos se alimentaron por dos horas en esas condiciones y posteriormente fueron lavados y puestos a evacuar en otro recipiente con 10 L de agua limpia filtrada a 0.2 µm. Ensayos previos indicaron que dos horas fueron convenientes para colectar la cantidad suficiente de heces para los análisis. Por lo tanto, después de dos horas, las heces fueron colectadas por medio de tamizado y retención de rotíferos.
Balance energético
Fue evaluado de acuerdo a la ecuación propuesta por Winberg (1960): C − H = A = R + U + P ó P = A − ( R + U ); donde C es la cantidad de energía consumida del alimento, H representa la energía perdida en las heces, A es la energía absorbida del alimento, R es la energía gastada por el proceso fisiológico de respiración, U es la energía invertida en la excreción de amonio y P es la ganancia de energía; la cual es transformada en crecimiento somático y producción de huevos (Campo de crecimiento). Para calcular el campo de crecimiento P se requiere transformar todos los términos que componen la ecuación en unidades de energía por individuo (mJ rot −1 h−1). En este sentido, la energía consumida se evaluó de acuerdo a la ecuación C = I · E(PO), donde I es la tasa de ingestión en miligramos de biomasa orgánica del alimento consumido por hora (mg h−1) y E(PO) es el valor energético en joules por miligramos de biomasa orgánica (J mg −1 PO) del alimento ingerido. La energía absorbida (A) se calculó multiplicando la energía absorbida (C, mJ rot −1 h−1) por la proporción de la eficiencia de asimilación (EA). La energía perdida por el proceso de respiración se obtuvo multiplicando la cantidad de oxígeno consumido (R) por su equivalente energético de 14.06 J mg −1 (Crisp 1971), mientras que la energía invertida en el proceso de excreción de amonio fue obtenida como el producto de la cantidad de amonio excretado y la equivalencia energética 24.87 J mg−1 propuesto por Elliot & Davison (1975).
Análisis estadístico
Los datos fueron procesados mediante las técnicas de análisis de covarianza o de varianza de una vía. Previamente, los datos de cada una de las tasas, fueron sometidos a las pruebas de normalidad de Lilliefors (Conover 1999) y homocedasticidad de Bartlett (Zar 1999, Sokal & Rholf 2000). Cuando los datos cumplieron con estas condiciones, se procedió a aplicar procedimientos paramétricos, en caso contrario se aplicaron métodos no paramétricos. Consecuentemente, si el estadístico de prueba en este nivel de análisis resultó significativo (p<0.05), entonces se aplicaron pruebas de comparaciones múltiples paramétricos o no paramétricos según fue el caso.
Resultados
Características bioquímicas y contenido energético de las microalgas utilizadas como alimento
En la Tabla 1 se presenta la biomasa seca unitaria (PSU) y la biomasa orgánica unitaria (POU) obtenidos durante este estudio y las características bioquímicas y energéticas de las microalgas que se emplearon en los tratamientos, cuyos valores promedio fueron obtenidas de la literatura y corresponden a las mismas cepas y condiciones de cultivo utilizadas durante este estudio. Las cuatro microalgas describen diferencias en el peso seco y la biomasa orgánica unitaria, y en general, fueron muy semejantes a las reportadas en la literatura para las mismas cepas y condiciones de cultivo. La información de la biomasa orgánica unitaria (POU) de las microalgas fue primordial para la estructuración del diseño experimental, en especial, para determinar las dietas experimentales empleadas; mientras que el contenido energético por unidad de biomasa orgánica, permitirá definir la cantidad de energía disponible para las funciones vitales de la especie.
Protocolo de alimentación para estimar las tasas fisiológicas de B. rotundiformi
El protocolo de alimentación se basó en la dieta óptima de 6 × 106 cél mL−1 de la microalga Nannochloropsis spp., estimada en pruebas de alimentación de B. plicatilis en la literatura. A partir de las raciones determinadas para Nannochloropsis spp. y utilizando la biomasa orgánica unitaria de la Tabla 1, se elaboró la Tabla 2, la cual muestra las raciones de alimentación en términos de la concentración celular de cada microalga, equivalente a 33.9 × 106 pg mL−1 de biomasa orgánica.
Oxígeno disuelto en los respirómetros experimentales
El oxígeno disuelto disminuyó linealmente con el tiempo de duración del experimento en todos los tratamientos, desde una concentración media de entre 7.41 y 8.37 mg O2 L−1 hasta una concentración de entre 1.32 y 1.43 mg O2 L−1. El modelo general de análisis de covarianza explicó el 92 % de la variabilidad (ANCOVA, F7,192 = 262.43, r2 = 0.92, p < 0.05. Figura 1). Por cada media hora de incremento en la duración del experimento, las tasas de descenso fueron 1.42, 1.29, 0.94 y 1.32 mg O2 L−1 para las microalgas Cham, Iso, Nano y Phat, respectivamente. El análisis de paralelismo indicó que las pendientes fueron estadísticamente diferentes (AN-COVA, F3,195 = 9.92, p < 0.05); sin embargo, las comparaciones múltiples indicaron que las tasas de disminución del oxígeno disuelto no fueron diferentes entre Cham y Phat (Bonferroni, p = 0.4770) cuyos valores fueron de mayor magnitud, mientras que Nano presentó la tasa de descenso menor, seguido de Iso (Figura 1).

Tasas fisiológicas de B. rotundiformis alimentado con las cuatro microalgas
La Tabla 3 muestra las tasas fisiológicas estimadas en los diferentes tiempos de incubación. La tasa media de ingestión de biomasa orgánica de Cham, por B. rotundiformis, disminuyó significativamente con el tiempo de incubación, desde un valor máximo de 59.20 ng PO rot−1 h−1 a las 0.5 h, hasta un mínimo de 31.22 ng PO rot−1 h−1 a las 2.0 h; no se observaron diferencias en los dos primeros intervalos de tiempo, así como tampoco a las 1.0 y 1.5 h (Kruskal-Wallis, H = 23.58, gl = 3, p < 0.05; comparaciones múltiples de Dunn). Lo anterior indica que la tasa de ingestión no se modificó significativamente durante los dos primeros intervalos de tiempo, y probablemente tampoco después de 1.5 h de incubación. El tiempo de duración del experimento tuvo un efecto significativo sobre la tasa de consumo de oxígeno de los rotíferos (Kruskal-Wallis, H = 31.46, gl = 3, p < 0.05; comparaciones múltiples de Dunn), las cuales disminuyeron gradualmente desde un valor máximo de 10.44 ng O2 rot−1 h−1, durante la primera media hora, hasta un mínimo de 2.47 ng O2 rot−1 h−1 durante 2.0 h de incubación.
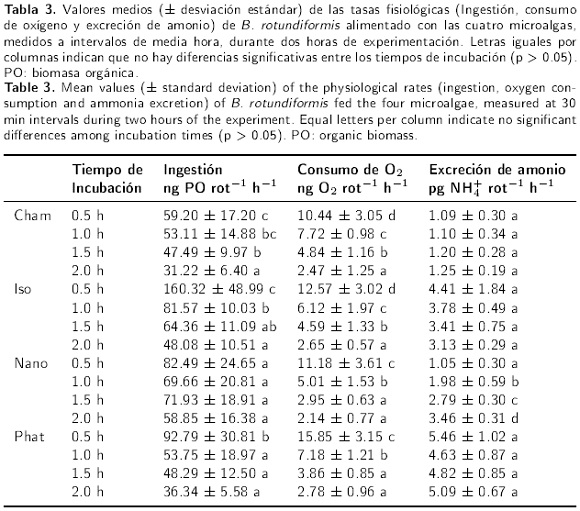
En lo que respecta a la tasa de excreción amoniacal, los valores fueron desde un valor mínimo promedio de 1.09 pg NH4+ rot−1 h−1 en la primera media hora, hasta un máximo de 1.25 pg NH4+ rot−1 h−1 a las 2 h y no se observaron modificaciones importantes durante los periodos de incubación (Kruskal-Wallis, H = 95.02, gl = 3, p = 0.33). Las tasas de ingestión de B. rotundiformis alimentado con Iso fueron estadísticamente significativas (Kruskal-Wallis, H = 15.45, gl = 3, p < 0.05). Las comparaciones múltiples de Dunn indicaron que durante la primera media hora, la tasa de ingestión promedio (en ng PO rot−1 h−1) fue máxima (160.32), disminuyendo casi a la mitad a las 1.0 h (81.57), para posteriormente mantenerse constante a las 1.5 h (64.36) y descender ligeramente hasta un valor medio de 48.08 a las dos horas de incubación. La falta de diferencias estadísticas entre los dos últimos periodos de incubación, y entre las 1.0 y 1.5 h, indican que las tasas de ingestión no presentaron modificaciones importantes después de la primera hora de incubación. La tasa de consumo promedio de oxígeno presentó diferencias significativas en todos los periodos de incubación, con tendencia a disminuir progresivamente desde los 12.57 hasta 2.65 ng O2 rot−1 h−1 (Kruskal-Wallis, H = 47.40, gl = 3, p < 0.05; comparaciones múltiples de Dunn, p < 0.05). Por otra parte, las tasas de excreción de amonio no presentaron diferencias estadísticas significativas (Kruskal-Wallis, H = 3.99, gl = 3, p = 0.26), lo cual significa que esta tasa se mantuvo constante con respecto al tiempo, con valores que fluctuaron entre 3.13 a 4.41 pg NH4+ rot−1 h−1.
La tasa de ingestión de Nano por los rotíferos, no fue significativa entre los tiempos de incubación (ANAVA: F3,21 = 1.42, p = 0.26), con valores máximos y mínimos promedio de 82.49 y 58.85 ng PO rot−1 h−1, respectivamente. Además, las tasas de consumo de O2 mostraron una tendencia a disminuir significativamente con el tiempo de incubación (Kruskal-Wallis, H = 30.56, gl = 3, p < 0.05), con un valor máximo promedio de 11.18 ng O2 rot−1 h−1 registrado en la primera hora de incubación, mientras que a las 0.5 h se presentó una reducción sustancial en relación a la primera media hora, cuya tasa fue de 5.01 ng O2 rot−1 h−1. A partir de las 1.5 h y hasta las 2.0 h, la tasa de consumo de oxígeno se mantuvo sin cambios apreciables con valores de 2.95 y 2.14 ng O2 rot−1 h−1 (comparaciones múltiples de Dunn, p = 0.37). La excreción de amonio presentó un comportamiento inverso a las tasas de ingestión y consumo de oxígeno, con tendencia a incrementarse con la duración del experimento (Kruskal-Wallis, H = 16.48, gl = 3, p < 0.05; comparaciones múltiples de Dunn, p < 0.05). El valor menor se presentó a las 0.5 h (1.05 pg NH4+ rot−1 h−1) y posteriormente se incrementó gradualmente hasta registrar el valor mayor de 3.46 pg NH4+ rot−1 h−1 a las 2.0 h.
Las tasas de ingestión del rotífero B. rotundiformis fueron significativamente diferentes cuando se alimentaron con la microalga Phat (Kruskal-Wallis, H = 13.36, gl = 3, p < 0.05). Las tasas disminuyeron progresivamente con el tiempo de incubación, con valores de 92.79, 53.75, 48.79 y 36.34 ng PO rot−1 h−1 para las 0.5, 1.0, 1.5 y 2.0 horas, respectivamente. Las comparaciones múltiples de Dunn señalaron que las tasas de ingestión no fueron diferentes a las 1.0, 1.5 y 2.0 h, y el valor significativamente mayor se presentó en la primera media hora de incubación, lo que indica que esta tasa se estabilizó después de la primera hora de incubación. Las tasas de consumo de O2 también presentaron tendencias a descender con el tiempo de incubación. La tasa máxima promedio se registró a las 0.5 h con una valor de 15.85 ng O2 rot−1 h−1, mientras que el valor de 7.18 ng O2 rot−1 h−1 registrado a las 1.0 h indicó una descenso importante, con una aparente estabilización a las 1.5 y 2.0 h con valores respectivos de 3.86 y 2.78 ng O2 rot−1 h−1. Las pruebas estadísticas confirmaron esta tendencia al señalar diferencias significativas entre las tasas de consumo de oxígeno en los diferentes periodos de incubación (Kruskal-Wallis, H = 34.07, gl = 3, p < 0.05); sin embargo, las diferencias entre las tasas a las 1.5 y 2.0 horas no fueron estadísticamente diferentes (comparaciones múltiples de Dunn, p > 0.05). La tasa de excreción de amonio presentó valores de 5.46, 4.63, 4.82 y 5.09 pg NH4+ rot−1 h−1 correspondientes a las 0.5, 1.0, 1.5 y 2.0 horas de incubación; sin embargo, las diferencias no fueron estadísticamente significativas (ANAVA, F3,36 = 1.78, p = 0.17), lo cual indica que esta tasa no se modificó con el tiempo de incubación en los respirómetros.
Eficiencia de asimilación de B. rotundiformis alimentado con las cuatro microalgas
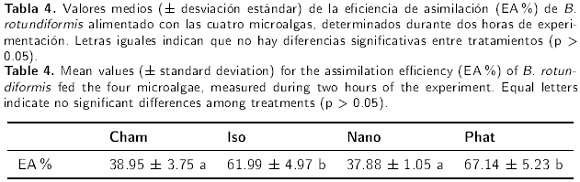
La eficiencia de asimilación promedio de las cuatro dietas probadas, durante dos horas de experimentación, se presentan en la Tabla 4. Estas variaron desde valores respectivos de 37.88 y 38.95 % para las microalgas Nano y Cham, hasta 61.99 y 67.14 % para las microalgas Iso y Phat, respectivamente. Las pruebas estadísticas señalaron que las diferencias no fueron significativas entre Cham y Nano, y entre Phat e Iso (Kruskal-Wallis, H = 8.89, gl = 3, p < 0.05; comparaciones múltiples de Dunn).
Componentes del balance energético y el campo de crecimiento de B. rotundiformis alimentado con las cuatro microalgas
La Tabla 5 muestra los componentes del balance energético y el campo de crecimiento (en mJ rot−1 h−1) de B. rotundiformis alimentado con las cuatro microalgas, en intervalos de media hora, durante dos horas de experimentación. Cuando fueron alimentados con Nano, la energía consumida disminuyo con el tiempo de incubación, aunque fueron relativamente estables durante las 0.5, 1.0 y 1.5 h, con valores de 2.16, 1.98 y 1.72, respectivamente. Durante el tiempo de incubación de 2.0 h se registró un valor de 1.39, pero no fue muy diferente al registrado durante las 1.5 h (ANAVA, F3,23 = 3.71, p < 0.05; comparaciones múltiples de Newman-Keuls). La energía absorbida, con una eficiencia de asimilación del 38.95 %, indicó que no hubo diferencias durante las 0.5, 1.0 y 1.5 h de incubación. A las 2.0 horas la energía absorbida fue significativamente menor, pero no muy diferentes de la energía absorbida a las 1.5 h (ANAVA, F3,23 = 3.57, p < 0.05; comparaciones múltiples de Newman-Keuls). La energía respirada fue significativamente mayor a las 0.5 h (0.16), presentando una disminución de aproximadamente 56 % relativo a las 0.5 h, con un valor de 0.07. Posteriormente, aunque se presentó una pequeña reducción en el consumo energético por respiración a las 1.5 h, ésta resulto ser significativa en relación a las 1.0 h, pero no fue diferente del consumo energético que se suscitó a las 2.0 h, indicando que no hubo modificaciones aparentes en estos dos últimos periodos (Kruskal-Wallis, H = 30.56, gl = 3, p < 0.05; comparaciones múltiples de Dunn). En lo que respecta al gasto energético por excreción de amonio, aunque con valores muy inferiores en relación al gasto por respiración, los resultados señalan que los cambios fueron notables. Las pruebas estadísticas indicaron que las diferencias fueron significativas y la tendencia fue al incrementó con la duración del tiempo de incubación (ANAVA, F3,16 = 58.75, p < 0.05; comparaciones múltiples de Newman-Keuls). El gasto energético por este proceso fisiológico fue mayor a las 2.0 h de incubación, con valor de 11.16 × 10−5, mientras que el de menor magnitud fue de 2.62 × 10−5 y se presentó a las 0.5 h. Los valores registrados a las 1.0 y 1.5 h fueron de 4.94 × 10−5 y 8.92 × 10−5, respectivamente. En relación al balance energético (representado por el campo de crecimiento, P), los valores registrados fueron siempre positivos y no presentaron modificaciones aparentes con el tiempo de incubación (ANAVA, F3,19 = 1.56, p = 0.23; comparaciones múltiples de Newman-Keuls), con valores fluctuantes de 0.68, 0.70, 0.63 y 0.51 obtenidos a las 0.5, 1.0, 1.5 y 2.0 h, respectivamente.
La energía consumida por los rotíferos alimentados con Iso, disminuyó significativamente con el tiempo de incubación, en todos los casos (ANAVA, F3,16 = 40.30, p < 0.05; comparaciones múltiples de Newman-Keuls). Los valores registrados fueron 2.16, 1.55, 1.19 y 0.90, para los tiempos de incubación respectivos de 0.5, 1.0, 1.5 y 2.0 h. La eficiencia de absorción, asumiendo el 61.99 % de eficiencia de asimilación, fue significativamente diferente a través del tiempo de incubación. El valor mayor fue de 1.34 a las 0.5 h, mientras que el mínimo (0.56) se registró a las 2.0 h, con una reducción de aproximadamente el 58 % del valor registrado a las 0.5 h (ANAVA, F3,16 = 73.82, p < 0.05; comparaciones múltiples de Newman-Keuls). El gasto energético por respiración disminuyó con el tiempo de incubación, registrándose el descenso de mayor magnitud entre las 0.5 y 1.0 h, con valores de 0.18 y 0.09. Los valores promedio de consumo de oxígeno para las 1.5 y 2.0 h fueron de 0.06 y 0.04, respectivamente, y aunque con pequeñas diferencias, no fueron estadísticamente iguales (Kruskal-Wallis, H = 47.40, gl = 3, p < 0.05; comparaciones múltiples de Dunn). Las pérdidas energéticas por excreción amoniacal, fluctuaron irregularmente con el tiempo de incubación con valores que fueron desde 7.78 × 10−5 a 9.26 × 10−5 mJ rot−1 h−1; sin embargo, las diferencias no fueron significativas (ANAVA, F3,13 = 0.78, p = 0.52). El campo de crecimiento de B. rotundiformis fue positivo y con tendencias a disminuir con el tiempo de incubación. El valor mayor (1.16) se registró a las 0.5 h, disminuyendo un 25 % a las 1.0 h con un valor de 0.87. El valor de 0.68, registrado a las 1.5 h no fue estadísticamente diferente del registrado a las 1.0 h, mientras que a las 2.0 h, el valor de 0.52, aunque significativamente menor al valor registrado a las 1.0 y 0.5 h, permaneció estable en relación al campo de crecimiento de las 1.5 h (Kruskal-Wallis, H = 15.45, gl = 3, p < 0.05; comparaciones múltiples de Dunn).
Cuando fueron alimentados con Cham, la cantidad de energía consumida por el rotífero fue disminuyendo con el tiempo de duración del experimento. Los valores medios fueron de 1.45, 1.32, 1.16, 0.77 mJ rot−1 h−1, para las 0.5, 1.0, 1.5 y 2.0 h respectivamente. Las diferencias no fueron significativas en los tres primeros periodos de incubación, mientras que a las 2.0 h, la energía consumida fue significativamente menor (Kruskal-Wallis, H = 23.70, gl = 3, p < 0.05; comparaciones múltiples de Dunn). La eficiencia de absorción, asumiendo el 37.8 % de eficiencia de asimilación de la materia orgánica consumida, permaneció sin cambios aparentes durante los primeros dos intervalos de tiempo de incubación, con valores respectivos de 0.55 y de 0.50 durante las 0.5 h y las 1.0 h; posteriormente, a las 1.5 h, se registró un ligero descenso hasta 0.44, sin ser estadísticamente diferente del valor de las 1.0 h. A las 2.0 h, la eficiencia de absorción se redujo significativamente a 0.29 (Kruskal-Wallis, H = 23.58, gl = 3, p < 0.05; comparaciones múltiples de Dunn). Por otra parte, las pérdidas energéticas por respiración disminuyeron a razón de 0.04 por cada media hora de incremento en el tiempo de incubación, registrando valores de 0.15, 0.11, 0.07 y 0.03 para las 0.5, 1.0, 1.5 y 2.0 h, respectivamente. Las pruebas estadísticas indicaron que los valores promedios registrados en cada periodo de incubación fueron significativamente diferentes (Kruskal-Wallis, H = 31.47, gl = 3, p < 0.05; comparaciones múltiples de Dunn). En lo que se refiere a las pérdidas por excreción de amonio, su tendencia fue al incremento con el tiempo de duración del experimento, con valores que variaron desde un mínimo de 2.70 × 10−5 a las 0.5 h hasta un máximo de 3.12 × 10−5 a las 2.0 h, con valores que no fueron diferentes (Kruskal-Wallis, H = 3.40, gl = 3, p = 0.33; comparaciones múltiples de Dunn). El campo de crecimiento registró valores positivos que fluctuaron desde 0.36 a 0.28 y no presentó diferencias significativas con el tiempo de incubación (ANAVA, F3,35 = 1.99, p = 0.13).
La energía consumida por B. rotundiformis al ser alimentado con Phat presentó un valor máximo promedio significativo de 1.83 a la media hora de incubación; posteriormente, a las 1.0 h disminuyó significativamente hasta un valor de 1.24, sin cambios aparentes a las 1.5 h de incubación (1.12). La energía consumida menor (0.83) se registró a las 2.0 h, sin embargo, no fue estadísticamente diferentes del valor registrado a las 1.5 h (Kruskal-Wallis, H = 13.26, gl = 3, p < 0.05; comparaciones múltiples de Dunn). La energía absorbida (asumiendo el 67.15 % de eficiencia de asimilación), disminuyó gradualmente con el tiempo de incubación. El valor máximo significativo se presentó a la media hora (1.23) y fue diferente al resto de los valores registrados a las 1.0, 1.5 y 2.0 h, cuyos valores fueron de 0.83, 0.75 y 0.56, los cuales no fueron estadísticamente diferentes (ANAVA, F3,25 = 10.42, p < 0.05; comparaciones múltiples de Newman-Keuls). El gasto energético respiratorio disminuyó con la duración de la incubación. El valor máximo fue de 0.22 a las 0.5 h y fue significativamente diferente de los valores registrados a las 1.0, 1.5 y 2.0 h. A las 1.0 h se registró un gasto energético por respiración de 0.10, cuyo valor fue diferente a los registrados en los periodos de incubación subsiguientes. A partir de las 1.5 h no parecen ocurrir cambios importantes en el gasto energético por respiración, cuyos valores fueron de 0.06 y 0.04 para las 1.5 y 2.0 horas de incubación respectivamente (Kruskal-Wallis, H = 34.07, gl = 3, p < 0.05; comparaciones múltiples de Dunn). Las pérdidas energéticas por excreción amoniacal fluctuaron con valores entre 11.51 × 10−5 y 13.59 × 10−5; sin embargo, no fueron estadísticamente diferentes conforme transcurrió el tiempo de incubación (ANAVA, F3,36 = 1.78, p = 0.17). El campo de crecimiento promedio de B. rotundiformis fue máximo en la primera media hora de incubación (1.01) y fue estadísticamente diferente a los obtenidos en los tiempos de incubación posteriores. A las 1.0, 1.5 y 2.0 h de incubación, el campo de crecimiento fue estable y no mostró cambios notables aparentes (Kruskal-Wallis, H = 9.91, gl = 3, p < 0.05; comparaciones múltiples de Dunn).
Comparación del campo de crecimiento de B. rotundiformis alimentado con las cuatro microalgas
De acuerdo a los resultados obtenidos en la estimación del balance energético de B. rotundiformis alimentado con las cuatro especies de microalgas, los datos señalan que a pesar del efecto de la reducción del oxígeno disuelto (y sobre las tasas fisiológicas, en general) en los repirómetros cerrados, durante el tiempo de incubación, el campo de crecimiento de los rotíferos se mantuvo sin modificaciones aparentes a través del tiempo, como fue el caso con Cham y Nano, y a partir de una hora de incubación, como fue el caso con Phat. Los resultados obtenidos con Iso parecen ser la excepción; sin embargo, la falta de diferencias entre los periodos de incubación de 1.0 y 1.5 h y entre 1.5 y 2.0 h parecen sugerir una característica común en el comportamiento de los rotíferos cuando se mantuvieron en las condiciones experimentales probadas. Adicionalmente, los valores notablemente mayores de las tasas fisiológicas y el campo de crecimiento que fueron obtenidos durante la primera hora de incubación, como en el caso de los rotíferos alimentados con Iso y Phat, parecen indicar que el efecto de la manipulación inicial durante la preparación de los experimentos es un hecho real. En consecuencia, para evitar el efecto de la manipulación inicial y reducir la variabilidad en las comparaciones del balance energético del rotífero alimentado con las cuatro microalgas, se excluyeron de los análisis los datos del balance energético obtenidos durante la primera media hora de incubación, para todos los tratamientos, y los datos obtenidos a partir de la primera hora de incubación se combinaron para formar cuatro grupos correspondientes al balance energético calculado para cada microalga. La Figura 2 muestra los promedios generales del campo de crecimiento por tratamiento y los resultados de las comparaciones estadísticas. Las pruebas estadísticas indicaron que las diferencias no fueron significativas entre los campos de crecimientos promedio registrados para los rotíferos alimentados con Nano, Iso y Phat, con valores respectivos de 0.62, 0.61 y 0.65 mJ rot−1 h−1, mientras que el campo de crecimiento con Cham (0.33 mJ rot−1 h−1) fue significativamente menor al resto de las dietas probadas (Kruskal-Wallis, H = 49.81, gl = 3, p < 0.05; comparaciones múltiples de Dunn). Lo anterior indica que el campo de crecimiento de B. rotundiformis no experimentó modificación alguna cuando se le suministraron las dietas a base de las microalgas Nano, Iso y Phat; sin embargo, cuando fue alimentado con Cham, el campo de crecimiento fue aproximadamente 50 % menor al registrado con las otras dietas probadas.

Discusión
El tiempo de incubación en respirómetros cerrados tuvo influencia sobre las tasas fisiológicas de B. rotundiformis, especialmente en los tiempos iníciales de experimentación, por lo que debe ser tomado en cuenta en los estudios de la fisiología de rotíferos. Durante la primera media hora de experimentación se observó el mayor efecto sobre la tasa de ingestión, siendo más evidente con las dietas basadas en Cham, Iso y Phat; mientras que para Nano se mantuvo estable. La tasa metabólica se redujo significativamente a través del tiempo de incubación con Cham e Iso, pero se estabilizó a partir de las 1.5 h para Nano y Pham. En lo referente a la excreción amoniacal, ésta se mantuvo sin cambios aparentes con Cham, Iso y Phat, pero se incrementó significativamente con Nano conforme transcurrió el tiempo de incubación; sin embargo, las tendencias observadas en las tasas fisiológicas de B. rotundiformis con respecto al tiempo de incubación, no representan un factor de estrés significativo por estar dentro de los valores que no presentan problemas en los cultivos de rotíferos (Doohan 1973; Serra 1987; Esparcia et al. 1989; Hoff & Snell 1999). El tiempo de duración del experimento tuvo también un efecto significativo sobre los componentes del balance energético de B. rotundiformis en la mayoría de los casos. Sin embargo, el balance energético, representado por el campo de crecimiento P (ganancia de energía), no presentó cambios significativos aparentes durante las dos horas de incubación, cuando se utilizó como alimento Nano y Cham. Cuando la dieta fue Phat e Iso, a las 0.5 h se observaron valores significativamente mayores, pero se estabilizaron a partir de las 1.0 h. El campo de crecimiento de B. rotundiformis, alimentado con Nano, Cham, Iso y Phat, fue siempre positivo. Su magnitud fue mayor y similar cuando se sumistraron las dietas Nano, Iso y Phat, mientras que con Cham, el campo de crecimiento fue aproximadamente un 50 % menor que el resto de las dietas probadas. La calidad del alimento en términos de sus características bioquímicas y estructurales pueden explicar estas diferencias, aún cuando el contenido de biomasa orgánica de Cham fue mayor que el reportado por la mayoría de las microalgas probadas, la eficiencia de asimilación fue menor, debido probablemente a su baja digestibilidad. A diferencia de las otras dietas, Cham es una diatomea muy resistente debido a que posee una pared de sílice que dificulta su digestión (Poulet et al. 1994). Kleppel (1993) señala que por sí solas las diatomeas constituyen una dieta insuficiente para la reproducción de zooplancton, mientras que otros estudios han reportado que algunas especies de diatomeas reducen la tasa de eclosión de huevos del zooplancton (Ianora et al. 1996).
La microalga que presentó una eficiencia de asimilación similar a Cham fue Nano; sin embargo, el campo de crecimiento de los rotíferos no fue diferente a los registrados para Iso y Phat, esto indica que estas microalgas poseen algunas particularidades que son de importancia en la fisiología energética de B. rotundiformis. Además del tamaño de la célula, ausencia de toxicidad, digestibilidad y el contenido energético, la composición bioquímica es otro factor que determina la calidad nutritiva de la microalga y su utilidad como alimento (Brown et al. 1997). Muchos estudios han demostrado que la composición bioquímica de la dieta, particularmente los ácidos grasos esenciales, tienen una influencia importante sobre el crecimiento del zooplancton, dentro de estos, los ácidos grasos poliinsaturados de cadena larga (DHA) y el ácido eicosapentaenoico (EPA) tienen una función importante en el crecimiento, reproducción y otras funciones fisiológicas. Stanley-Samuelson (1987) señalan que los ácidos grasos poliinsaturados son precursores de las hormonas que regulan la producción, maduración y eclosión de los huevos en los invertebrados.
Por otra parte, el valor nutricional de Nano se basa en ser fuente de vitamina B12 y de ácidos grasos poliinsaturados (EPA), además tiene compuestos nutricionales como esteroles (Rocha et al. 2003). Iso es rica en vitaminas B, C, D y K, la célula es asimilada fácilmente debido a su tamaño pequeño y a la ausencia de valvas resistentes, no posee toxinas y constituyen una fuente potencial de DHA (Jeffrey et al. 1994), por esta razón la microalga es muy utilizada para el enriquecimiento de los rotíferos, especialmente con vitamina C (Hoff & Snell 2004). Phat es una diatomea unicelular que no tiene valvas de sílice y que está empezando a ser utilizada para enriquecedor el contenido de EPA en artemia y rotíferos (Okauchi & Tozuda 2003). Cham también posee niveles importantes de EPA (Nhu 2004). Sin embargo, Lacoste et al. (2001) señalan que algunas diatomeas inhiben la viabilidad y eclosión de los huevos de especies zooplanctónicas, lo cual está relacionado con la producción de aldehídos.
Los resultados de este trabajo resaltan y confirman la importancia de Nano e Iso como unas de las mejores dietas para mantener cultivos estables de rotíferos. No obstante las controversias que existen sobre el uso de diatomeas en los cultivos de zooplancton, los balances energéticos positivos obtenidos con Cham y Phat indican que ambas microalgas pueden ser utilizadas en el cultivo masivo del rotífero B. rotundiformis.
Agradecimientos
Se agradece al Programa de Fomento y Apoyo a Proyectos de Investigación (PROFAPI-06-154) y al Cuerpo Académico Ecofisiología y Cultivo de Organismos Acuáticos (UAS-CA-162), de la Facultad de Ciencias el Mar de la Universidad Autónoma de Sinaloa, por el financiamiento y apoyo otorgados para la realización del presente trabajo, y por la beca para la realización de tesis de licenciatura otorgada al primer autor. Se agradece también a los revisores anónimos, por sus acertadas sugerencias.
Literatura citada
Aoki S, Hino A (1996) Nitrogen flor in a chemostat culture of the rotifer Brachionus plicatilis. Fisheris Science 62: 8-14. [ Links ]
Ben-Amotz A, Fishler R, Schneller A (1987) Chemical composition of dietary species of marine unicellular algae and rotifers with emphasis on fatty acids. Marine Biology. 95: 31-36. [ Links ]
Brown MR, Jeffrey SM, Volkman JK, Dunstan GA (1997) Nutritional properties of microalgae for mariculture. Aquaculture. 151: 315-331. [ Links ]
Conover WJ (1999) Practical nonparametric statistics. 3rd ed. John Wiley y Sons, Inc. 584pp. [ Links ]
Crisp DJ (1971) Energy flow measurements. En: Methods for the study of marine benthos. Holms NA & Mcintyre AD (Ed.) Blackwell Scientific Publications, Oxford. 197-279. [ Links ]
Doohan M (1973) An energy budget for adult Brachionus plicatilis Muller (Rotatorial). Oecologia (Berl.). 13: 351-362. [ Links ]
Elliott SM, Davison W (1975) Energy equivalents of oxygen consumption in aninal energetic. Oecologia. 19: 195-201. [ Links ]
Enríquez Álvarez JC (2001) Alimentación del rotífero Brachionus plicatilis con la microalga Isochrysis sp cultivada en presencia de tres productos zeoliticos. Tesis de Licenciatura. Facultad de Ciencias del Mar. Universidad Autónoma de Sinaloa. [ Links ]
Esparcia A, Miracle MR, Serra M (1989) Brachionus plicatilis tolerance to low oxygen concetrations. Hydrobiologia. 186/187: 331-337. [ Links ]
Guillard RRL, Ryther JH (1962) Studies of marine planktonic diatoms, I. Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. Canadian J. Microbiol. 8: 229-325. [ Links ]
Hino A, Aoki S, Ushiro M (1997) Nitrogen-flow in the rotifer Brachionus rotundiformis and its significance in mass cultures. Hydrobiologia. 358: 77-82. [ Links ]
Hirata H, Mori Y (1967) Mass culture of the marine rotifer fed baker's yeast. Saibai Gyogyo. 5: 36-40. [ Links ]
Hoff FH, Snell TW (1999) Plankton Culture Manual. Fifth Edition. Edited by: J. Nelson. Florida Aqua Farms, Inc. Dade City, Florida. [ Links ]
Hoff FH, Snell TW (2004) Plankton Culture Manual. 6th edition, Florida Aqua Farms, Dade City, Florida. [ Links ]
Ianora A, Poulet SA, Miralto A, Grottoli R (1996) The diatom Thalassiosira rotula affects reproductive success in the copepod Acartia clausi. Mar Biol, 125: 279-286. [ Links ]
Ito T (1960) On the culture of the mixohaline rotifer Brachionus plicatilis O. F.Muller, in sea water. Report of the Faculty Fisheries, Prefectural University of Mie. 3: 708-740. [ Links ]
Ito T (1968) Fundamental problems on the rearing of ayu fish. 36th Japan Lakes Rivers. Aquacultural Research Conference. Special edition. 1-24. [ Links ]
Jeffrey SW, Brown MR, Garland CD (1994) Microalgae for mariculture: Final report to FRDC on BacteriaFree (axenic) microalgae for improved production of larval and juvenile bivalves and microalgae for mariculture. 97 p. [ Links ]
Kleppel GS (1993) On the diets of calanoid copepods. Marine Ecology Progress Series. 99: 183-195. [ Links ]
Lacoste A, Jalabert F, Malham S, Cueff A, Gélébart F, Cordevant C, Lange M, Poulet SA (2001) A Vibrio splendidus strain is associated with summer mortality of juvenile oyster Cassostrea giggas in the bay of Morlaix(North Brittany, France). Diseases Aquatic Organisms. 46: 139-145. [ Links ]
López Elías JA, Voltolina D (1993) Cultivos semicontínuos de cuatro especies de microalgas con un medio no convencional. Ciencias Marinas. 19: 169-180. [ Links ]
Lubzens E, Tandler A, Minkoff G (1989) Rotifers as food in Aquaculture. Hydrobiologia. 186/187: 387-400. [ Links ]
Lubzens E, Zmora O, Barr Y (2001) Biotechnology and aquaculture of rotifers. Hydrobiologia. 446/447: 337-353. [ Links ]
Luis Villaseñor IE (2003) Cultivos de larvas mysis de Litopenaeus vannamei con el rotífero Brachionus plicatilis alimentadas con dos especies de diatomeas. Tesis de Licenciatura. Facultad de Ciencias del Mar. Universidad Autónoma de Sinaloa. [ Links ]
Martínez Brown JM (2001). Cultivo de Nannochloropsis sp. con tres productos de naturaleza zeolítica, para la alimentación del rotífero Brachionus plicatilis Müller. Tesis de Licenciatura. Facultad de Ciencias del Mar, Universidad Autónoma de Sinaloa. [ Links ]
McNair JN, Boraas ME, Seale DB (1998) Size-structure dynamics of the rotifer chemostat: a simple physiologically structured model. Hydrobiologia. 387: 469-476. [ Links ]
Morten A, Jo A, Olsen Y (2006) An individual-based population model for rotifer (Brachionus plicatilis) cultures. Hydrobiologia. 560: 93-108. [ Links ]
Nhu CV (2004) A comparison of yield and quality of the rotifer (Brachionus plicatilis-L strain) fed different diets under aquaculture conditions, Vietnam. Asian Fisheries Science. 17 357:363 [ Links ]
Okauchi M, Tozuda M (2003) Trophic value of the unicellular diatom Phaeodactylum tricornutum for larvae of Kuruma Prawn, Penaues japonicas. Symposium on aquaculture and pathobiology of crustaceans and other species in conjunctions with the 32nd UJNR Aquaculture panel meeting. 18 pp. [ Links ]
Piña Valdez P (2004) Balance energético de los estadios larvarios de camarón blanco (Litopenaeus vannamei, Boone) con la dieta tradicional y con otra no tradicional. Tesis de Doctorado. Posgrado Interinstitucional en Ciencias Pecuarias. Universidad Autónoma de Nayarit. [ Links ]
Poulet SA, Ianora A, Miralto A, Meijer L (1994) Do diatoms arrest embryonic development in copepods? Marine Ecology Progress Series. 111: 79-86. [ Links ]
Rocha JM, Gracia JE, Henriques MH (2003) Growth aspects of the marine microalgae Nannochloropsis gaditana. Biomolecular engineering. 20 (4-6) 237-242. [ Links ]
Serra M (1987) Variabilidad morfológica, isoenzimatica y demográfica en poblaciones de Brachionus plicatilis. Diferenciación genótica y plasticidad fenotípica. Tesis doctoral. Universidad de Valencia. [ Links ]
Sokal R, Rholf J (2000) Biometry. Third edition. Freeman Inc. 887 pp. [ Links ]
Stanley-Samuelson DW (1987) Physiological roles of prosta-glandins and other eicosanoids in invertebrates. Biological Bulletin. 173: 92-109. [ Links ]
Whyte JNC (1987) Biochemical composition and energy content of six species of phytoplankton used in mariculture of bivalves. Aquaculture. 60 pp.
Widdows J, Fieth P, Worrall CM (1979) Relationships between seston, available food and feeding activity in the common mussel Mytilus edulis. Marine Biology. 50: 195-207. [ Links ]
Winberg GG (1960) Rate metabolism and food requirements of fish. Fisheries Research Board of Canada. 194: 1-254 p. [ Links ]
Zar JH (1999) Biostatistical Analysis. 4th ed. Prentice Hall, Inc. 660 pp. [ Links ]














