Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Universidad y ciencia
Print version ISSN 0186-2979
Universidad y ciencia vol.27 n.2 Villahermosa Aug. 2011
Artículos
Control poscosecha de Geotrichum citri-aurantii en el limón mexicano (Citrus aurantifolia [Christm.] Swingle) mediante levaduras marinas y epífitas
Postharvest control of Geotrichum citri-aurantii on Mexican lemon (Citrus aurantifolia [Christm.] Swingle) with marine and epiphytic yeasts
LG Hernández–Montiel1*, J Holguín–Peña1, MG López–Aburto1, E Troyo–Diéguez1
1 Centro de Investigaciones Biológicas del Noroeste. Mar Bermejo 195, Col. Playa Palo de Santa Rita. La Paz, Baja California Sur, 23090. (LGHM) (JHP) (MGLP) (ETD) *Correo electrónico: lhernandez@cibnor.mx
Artículo recibido: 04 de diciembre de 2009,
Aceptado: 17 de agosto de 2011
RESUMEN
Se evaluó el potencial antagónico de cuatro cepas de levaduras Debaryomyces hansenii, dos cepas de origen marino (DhhBCS05 y DhhBCS06) y dos epífitas (LL1 y LL2), contra Geotrichum citri-aurantii en frutos de limón mexicano. De acuerdo a la identificación y a las pruebas de patogenicidad, se determinó que G. citri-aurantii es el agente causal de la enfermedad de la pudrición ácida. Las cepas epífitas LL1 y LL2 redujeron significativamente la incidencia de la enfermedad y el área de lesión en los frutos inoculados con el patógeno. Todas las levaduras D. hansenii colonizaron las heridas de limón. Los resultados indican que las levaduras epífitas de D. hansenii son eficientes para el control de G. citri-aurantii sobre frutos de limón mexicano.
Palabras clave: Control biológico, hongo fitopatógeno, Debaryomyces hansenii.
ABSTRACT
The antagonistic potential of yeast Debaryomyces hansenii (two strains from marine source DhhBCS05, DhhBCS06 and two epiphytic LL1, LL2) against Geotrichum citri-aurantii on Mexican lemon fruits was evaluated. According to the identification and pathogenicity test, G. citri-aurantii was found to be the causal agent of sour rot disease. LL1 and LL2 epiphytic strains significantly reduced the disease incidence and the area of lesion on inoculated fruits with pathogenic fungi. All yeasts D. hansenii colonized lemon wounds. Results suggest that epiphytic yeasts D. hansenii were highly effective for controlling G. citri-aurantii on Mexican lemon fruits.
Key words: Biological control, phytopathogenic fungi, Debaryomyces hansenii.
INTRODUCCIÓN
América Latina es considerada como la principal región productora de cítricos con una aportación del 32% del total de la producción mundial. En el caso particular del limón mexicano (Citrus aurantifolia [Christm.] Swingle), México es el principal país productor en el mundo, exportando principalmente a los Estados Unidos un promedio anual de 30 mil toneladas de fruta, con un valor aproximado de 11.3 millones de dólares (ASERCA 2006). A pesar de la derrama económica que se obtiene con este cítrico, existen problemas en la conservación de la fruta en poscosecha, debido a las pudriciones causadas principalmente por hongos (Sharma et al. 2009; Hao et al. 2010). Una de las enfermedades comunes de los cítricos es la denominada pudrición ácida causada por el hongo Geotrichum citri-aurantii (Ferraris) R. Cif. & F. Cif. (Sinónimo Geotrichum candidum Link). Las infecciones por este patógeno se originan principalmente a través de las heridas en la superficie de los frutos durante la recolección o posteriormente en el manejo poscosecha (Liu et al. 2010; Mercier & Smilanick 2005). El tratamiento tradicional de control es a base de fungicidas sintéticos, sin embargo, se ha documentado ampliamente sobre la aparición de cepas resistentes a varios ingredientes activos, principalmente al tiabendazol e imazalil (Liu et al. 2009; Eckert & Eaks 1989), por lo que la búsqueda de alternativas ha llevado a experimentar con el uso de agentes desinfectantes (Cerioni et al. 2009; Smilanick et al. 2002), aceites orgánicos (Yahyazadeh et al. 2009) y microorganismos como agentes de control biológico (Abraham et al. 2010). Por otra parte, la demanda del consumidor por adquirir alimentos libres de residuos tóxicos ha llevado a la restricción en el uso de una gran diversidad de agroquímicos. Además, en materia de fitosanidad e inocuidad alimentaria se han establecido lineamientos generales para la búsqueda de alternativas de control que incluyan ser inocuas y ecológicamente sustentables. En los últimos años, el control biológico de enfermedades poscosecha ha contemplado el uso de microorganismos antagónicos, destacando diversos tipos de levaduras, las cuales tienen la capacidad de colonizar y sobrevivir en la superficie de las frutas por largos periodos de tiempo (Lahlali et al. 2011). Dentro de sus mecanismos antagónicos destacan: la producción de toxinas killer, competencia de espacio y nutrientes, lisis enzimática e inducción de resistencia (Chi et al. 2010; Droby et al. 2002). La actividad de estos mecanismos está relacionada con el tipo y origen del antagonista, patógeno, hospedero y condiciones ambientales (Tian et al. 2002; Spotts et al. 1998). Diversos estudios con la levadura Debaryomyces hansenii han demostrado que es un antagonista eficaz contra patógenos de cítricos como Penicillium italicum y P. digitatum (Taqarort et al. 2008; Chalutz & Wilson 1990). Sin embargo, a la fecha no se ha explorado el potencial de esta levadura antagonista contra G. citri-aurantii. En esta investigación, se estudia el potencial de cepas marinas y epífitas de D. hansenii para disminuir la pudrición ácida ocasionada por G. citri-aurantii sobre frutos de limón mexicano.
MATERIALES Y MÉTODOS
Aislamiento e identificación del hongo
El patógeno fue obtenido de frutos de limón mexicano con síntomas de pudrición ácida provenientes de huertas localizadas en Tecomán, Estado de Colima con un grado de madurez fisiológica o punto sazón mínimo determinado mediante la norma mexicana NMX-FF-012-1982. Para el aislamiento, se realizó un raspado superficial sobre los limones, depositando las muestras en placas con medio Agar de Papa-Dextrosa (PDA, Difco) adicionado con 100 ppm de cloranfenicol y 50 ppm de ampicilina, incubándolas a 25 oC durante 72 h. Las colonias fueron trasferidas a nuevas placas con PDA hasta su purificación. Se realizaron los postulados de Koch para verificar la patogenicidad del hongo, el cual, fue identificado a nivel de género en base a sus características morfológicas con las claves taxonómicas propuestas por De-Hoog et al. (1986) y Gente et al. (2006). La determinación de la especie se llevó a cabo por la técnica molecular de la reacción en cadena de la polimerasa (PCR), utilizando los iniciadores ITS1 e ITS4 de la región ITS1-5.8s-ITS2 del DNA ribosomal (rDNA) (White et al. 1990). La amplificación se realizó en un termociclador (System 9700 GeneAmp) utilizando el protocolo descrito por Ochoa et al. (2007). El producto obtenido fue secuenciado por la compañía MACROGEN (Seúl, Korea) y analizado en base a las secuencias de hongos depositadas en el banco de datos del NCBI (http://www.ncbi.nlm.nih.gov).
Levaduras antagónicas
Se utilizaron cuatro cepas de la levadura D. hansenii catalogadas como: DhhBCS05, DhhBCS06 (aisladas de ambiente marino), LL1 y LL2 (epífitas de limón mexicano). Como tratamiento control se utilizó una levadura de Saccharomyces cerevisiae. Todos los microorganismos pertenecen a la colección de levaduras (Cepario No. Reg. CLT20) del Centro de Investigaciones Biológicas del Noroeste (CIBNOR).
Preparación de inóculo
El hongo se cultivó en medio líquido de papa-dextrosa y se incubó por 8 d a 25 oC y 80 rpm. Posteriormente, se cosecharon las artrosporas suspendiéndolas en agua destilada estéril conteniendo 0.01% (p/v) de Tween 80. Se utilizó un hematocitómetro para ajustar la concentración a 104 artrosporas mL-1. Por su parte, las levaduras se crecieron en medio líquido (YPD) conteniendo: extracto de levadura 1%, peptona 2% y dextrosa 2%. Se incubaron por 24 h a 25 oC y 80 rpm. Con un hematocitómetro la concentración de cada levadura se ajusto a 106 células mL-1.
Inoculación experimental
Los frutos de limón mexicano se desinfectaron con 2 mg L-1 de dióxido de cloro por 2 min. Para la infección experimental, se utilizó un sacabocados estéril para realizarle a los frutos dos heridas equidistantes de 3 mm de diámetro por 2 mm de profundidad. Los frutos se sumergieron en cada solución de levadura durante 5 min y se dejaron secar a temperatura ambiente. Trascurrido el tiempo, se inoculó cada herida con 20 μl de la solución con G. citri-aurantii. Los frutos se almacenaron durante 21 días a 20 ± 1 oC y 85 ± 5% de humedad relativa (HR). Se calculó la incidencia de la enfermedad mediante la fórmula: iT = (Fi[100])/T, donde: Fi = número de frutos infectados; T = total de frutos inoculados a los 7, 14 y 21 d después de la inoculación (DDI) y, al final del experimento, se midió el diámetro de lesión (cm) ocasionado por el hongo sobre las heridas de los limones. Se utilizaron doce frutos por tratamiento. Todo el experimento se realizó por duplicado.
Colonización en heridas de limón
Con un bisturí estéril se cortó 1 cm2 de la superficie del limón abarcando la zona de la herida, depositándolo en tubos falcón conteniendo 10 ml de buffer de fosfatos y 0.06% (v/v) de Tween 20. Las muestras se agitaron durante 20 min a 200 rpm (agitador rotativo Tecnal TE-421). Posteriormente, se realizaron diluciones (1:10, 1:100, 1:1000) utilizando una solución salina al 0.85%. Se sembró 1 mL de cada dilución, para el caso de las levaduras, en medio YPD adicionado con agar microbiológico 2%, 100 ppm de cloranfenicol, 50 ppm de ampicilina y 2 ppm de fluconazol. En el caso del hongo, se utilizó PDA adicionado con 100 ppm de cloranfenicol y 50 ppm de ampicilina. El cloranfenicol y la ampicilina fueron incluidos para inhibir el crecimiento bacteriano y el fluconazol se utilizó para inhibir el crecimiento de hongos filamentosos (Bendow & Sugar 1999). Las placas se incubaron durante 48 h a 25 oC. La cuantificación de la población de levadura y el hongo se realizó a los 7, 14 y 21 DDI de los frutos, expresándola en unidades formadoras de colonias (ufc cm-2). Se realizaron tres repeticiones por tratamiento. Todo el experimento se realizó por duplicado.
Observaciones al microscopio electrónico de barrido
Para la observación de la colonización sobre los limones de G. citri-aurantii y las levaduras D. hansenii, se tomaron muestras de las heridas de los frutos para ser fijadas por inmersión con 2.5% de glutaraldehído en buffer de fosfatos a pH 7 durante 24 h. Posteriormente fueron procesadas de acuerdo a la metodología descrita por Usall et al. (2001) y observadas al microscopio electrónico de barrido (Hitachi S-3000N).
Análisis estadístico
Los datos fueron procesados en un análisis de varianza (ANOVA) de una vía. Se utilizó el paquete estadístico STADISTICA (Versión 6.0, StatSoft, Tulsa, OK). Para la separación de medias se realizó la prueba de Fisher de diferencia mínima significativa (LSD) con un nivel de significancia del 5% (p < 0.05).
RESULTADOS
Identificación del hongo patógeno
De acuerdo a las características morfológicas observadas de micelio septado e hialino, crecimiento prolífico y presencia de artrosporas, se identificó al hongo como Geotrichum spp. (Gente et al. 2006; De-Hoog et al. 1986). El análisis del fragmento amplificado de 374 pb por PCR obtuvo una similitud del 99% con la secuencia de la especie G. citri-aurantii (Número de acceso AF411060). De acuerdo a los Postulados de Koch se determinó al hongo como el agente causal de la pudrición ácida del limón mexicano. Los síntomas observados sobre los frutos fueron pudrición blanda con cambios iniciales en la coloración del flavedo de verde a café claro y lesiones con olor fermentado.
Incidencia de la enfermedad y tamaño de lesión en frutos de limón inoculados con levaduras
No se observó pudrición ácida a los 7 DDI de los limones con G. citri-aurantii y las levaduras epífitas de D. hansenii LL1 y LL2, en comparación con las levaduras marinas (DhhBCS05 y DhhBCS06) donde se presentaron pudriciones sobre los frutos de limón. A los 14 DDI y 21 DDI, las levaduras epífitas mantuvieron niveles bajos de incidencia de la enfermedad en comparación con las levaduras marinas (Tabla 1). Los frutos inoculados con Saccha-romyces cerevisiae al final del experimento (21 DDI) presentaron el mismo porcentaje de incidencia que el tratamiento con G. citri-aurantii.

El diámetro de lesión al final del experimento fue estadísticamente (p < 0.05) diferente entre los tratamientos de G. citri-aurantii y levaduras. Los frutos con las D. hansenii DhhBCS06, LL1 y LL2, presentaron lesiones menores (0.77, 0.65 y 0.63 cm, respectivamente) comparados con el tratamiento solo con hongo patógeno (2.83 cm). Los limones inoculados con S. cerevisiae presentaron un tamaño de lesión (2.82 cm) similar a la causada por el hongo (Figura 1).

Colonización de heridas
Todas las levaduras D. hansenii presentaron una dinámica poblacional más alta que G. citri-aurantii en los frutos de limón, tendencia que se cuantificó durante todo el experimento en los tres períodos evaluados (Figura 2). La población de todas las D. hansenii se mantuvo a través del tiempo (7 DDI) con valores superiores a 2x108 ufc cm-2, alcanzando la máxima concentración de 3.7 x108 ufc cm-2 a los 21 DDI con las levaduras DhhBCS05 y LL1. La población de S. cerevisiae sobre los frutos fue menor que las demás levaduras, manteniéndose también por debajo de la dinámica del hongo. La eficiencia en la colonización por D. hansenii se puede observar en la micrografía electrónica de la Figura 3, donde se visualiza un ejemplo de la proliferación de la levadura LL1 en comparación con G. citri-aurantii sobre frutos de limón.

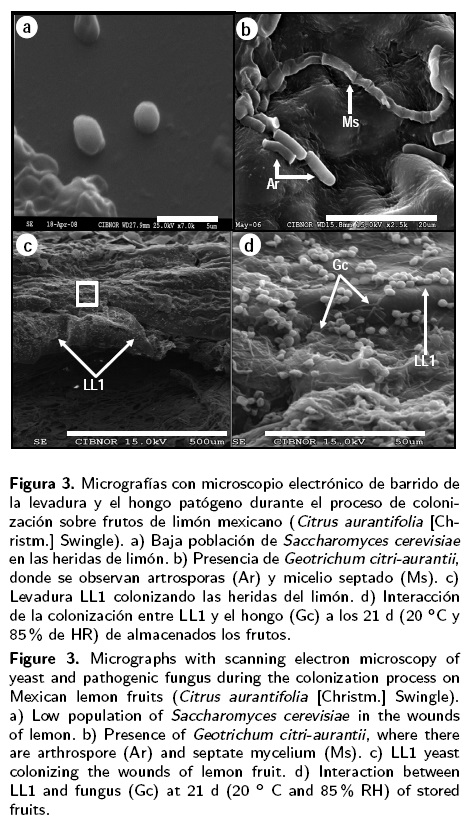
DISCUSIÓN
Geotrichum citri-aurantii es un patógeno referido como uno de los principales hongos que ocasionan pérdidas económicas en poscosecha de cítricos, especialmente en limón (cv. Eureka), mandarina y naranja (cv. Valencia y Navel) (Smilanick et al. 2008; Mercier & Smilanick 2005; Tournas & Katsoudas 2005). La pruebas de patogenicidad con G. citri-aurantii muestran que este hongo es el agente causal de la pudrición ácida del limón mexicano en Tecomán, Estado de Colima. De acuerdo a los resultados de este estudio, la aplicación de levaduras epífitas de Debaryomyces hansenii es una alternativa para el control de G. citri-aurantii. Las levaduras de este género han mostrado ser una alternativa viable para el control biológico de hongos en poscosecha en cultivos como la toronja y limón (Hernández-Montiel et al. 2010; Droby et al. 1989). En limón mexicano, existió una rápida colonización de las levaduras epífitas sobre las heridas, las cuales limitaron al hongo en su población, debido principalmente a la competencia por espacio y nutrientes. Este mecanismo es una ventaja que las levaduras presentan en comparación con los hongos que tienen una tasa de crecimiento lenta (Zhao et al. 2008). La eficiencia de las distintas cepas de D. hansenii en la disminución de la enfermedad, puede estar relacionada con la capacidad adaptativa de cada levadura hacia el hospedero, principalmente, en su habilidad para asimilar los carbohidratos presentes en las heridas del limón (Fazio et al. 2008; Plaza et al. 2004). Este mecanismo de competencia por nutrientes es uno de los más importantes ejercidos por levaduras hacia el antagonismo de hongos (Zhang et al. 2010; Bencheqroun et al. 2007). Aunque los resultados encontrados con S. cerevisiae, sugieren que no cualquier levadura tiene la capacidad de inhibir a otro organismo aún en la competencia por espacio y/o nutrientes. A pesar que en este estudio no se evaluó la capacidad de las levaduras para producir toxinas killer y enzimas hidrolíticas, estos compuestos extracelulares tienen un papel importante en el antagonismo de hongos causantes de enfermedades en poscosecha (Hernández-Montiel et al. 2009; Santos et al. 2009; Ganiger et al. 2008). Las diferencias en la colonización de los frutos entre las D. hansenii y S. cerevisiae comúnmente se encuentran relacionadas a la capacidad de adaptación y asimilación de diversos carbohidratos presentes en las heridas (Plaza et al. 2004). Estos compuestos, permiten a las levaduras establecerse y adaptarse al sustrato del hospedero, colonizando de manera eficiente las heridas (Smilanick et al. 2008; Tournas & Katsoudas 2005). Al respecto, Macarisin et al. (2010) y Nunes et al. (2001) mencionan que existen otros mecanismos que influyen en estos procesos que van desde la disponibilidad de espacio y nutrientes hasta la restricción de sitios de infección. La aplicación de la levadura D. hansenii, como agente de control biológico, puede ser una alternativa para sustituir o disminuir el uso de agroquímicos y otros desinfectantes sintéticos utilizados para el control poscosecha de G. citri-aurantii, agente causal de la pudrición ácida en frutos de limón mexicano. Además, que esta levadura no representa un riesgo para la salud humana ni para el medio ambiente, al ser un componente natural del agroecosistema terrestre y marino (Ochoa & Vázquez-Juárez 2004).
LITERATURA CITADA
Abraham AO, Laing MD, Bower JP (2010) Isolation and in vivo screening of yeast and Bacillus antagonists for the control of Penicillium digitatum of citrus fruit. Biological Control 53: 32-38. [ Links ]
ASERCA (2006) La producción de cítricos en México y su competitividad en el mercado internacional. ASERCA-Claridades Agropecuarias 159: 36-51. [ Links ]
Bencheqroun SK, Bajji M, Massart S, Labhilili M, El-Jaafari S, Jijakli MH (2007) In vitro and in situ study of postharvest apple blue mold biocontrol by Aureobasidium pullulans: evidence for the involvement of competition for nutrients. Postharvest Biology and Technology 46: 128-135. [ Links ]
Benbow JM, Sugar D (1999) Fruit surface colonization and biological control of postharvest diseases of pear by preharvest yeast applications. Plant Disease 83: 839-844. [ Links ]
Cerioni L, Rapisarda VA, Hilal M, Prado FE, Rodríguez-Montelongo L (2009) Synergistic antifungal activity of sodium hypochlorite, hydrogen peroxide and cupric sulfate against Penicillium digitatum. Journal of Food Protection 72: 1660-1665. [ Links ]
Chalutz E, Wilson CL (1990) Postharvest biocontrol of green and blue mold and sour rot of citrus fruit by Debaryomyces hansenii. Plant Disease 74: 134-137. [ Links ]
Chi ZM, Liu G, Zhao S, Li J, Peng Y (2010) Marine yeasts as biocontrol agents and producers of bio-products. Applied Microbiology and Biotechnology 86: 1227-1241. [ Links ]
De-Hoog GS, Smith MT, Guého E (1986) A revision of the genus Geotrichum and its teleomorphs. Studies in Mycology 29: 1-131. [ Links ]
Droby S, Chalutz E, Wilson CL, Wisniewski ME (1989) Characterization of the biocontrol activity of Debar-yomyces hansenii in the control of Penicillium digitatum on grapefruit. Canadian Journal of Microbiology 35: 794-800. [ Links ]
Droby S, Vinokur V, Weiss B, Cohen L, Daus A, Goldschmidt EE, Porat R (2002) Induction of resistance to Penicillium digitatum in grapefruit by the yeast biocontrol agent Candida oleophila. Phytopathology 92: 393-399. [ Links ]
Eckert JW, Eaks IL (1989) Postharvest disorders and diseases of citrus fruits. pp. 179-260. In: W. Reuther, E.C. Calavan, and G.E. Carman (eds.). The Citrus Industry Vol. 5. University of California, Division of Agriculture and Natural Resources. Oakland, California, USA. 374 p. [ Links ]
Fazio MLS, Coelho AR, Hirooka EY, Pasnocca FC, Hoffmann FL (2008) Biocontrol by killer yeasts against Penicillium expansum with perspectives of application in the post-harvest fruits. Proceedings of the International Congress: Novel approaches for the control of postharvest diseases and disorders. pp. 100-107. [ Links ]
Ganiger MC, Bhat S, Chettri P, Kuruvinashetti MS (2008) Cloning and Expression of endoglucanase genes from Trichoderma species in Saccharomyces cerevisiae. Journal of Applied Sciences Research 11: 1546-1556. [ Links ]
Gente S, Sohier D, Coton E, Duhamel C, Guéguen M (2006) Identification of Geotrichum candidum at species and strain level: proposition of a standardized protocol. Journal of Industrial Microbiology and Biotechnology 33: 1019-1031. [ Links ]
Hao W, Zhong G, Hu M, Luo J, Weng Q, Rizwan-ul-Haq M (2010) Control of citrus postharvest green and blue mold and sour rot by tea saponin combined with imazalil and prochloraz. Postharvest Biology and Technology 56: 39-43. [ Links ]
Hernández-Montiel LG, Larralde-Corona CP, Vero S, López-Aburto MG, Ochoa JL, Ascencio-Valle F (2009) Caracterización de levaduras Debaryomyces hansenii para el control biológico de la podredumbre azul del limón mexicano. CyTA-Journal of Food 8: 49-56. [ Links ]
Hernández-Montiel LG, Ochoa JL, Troyo-Diéguez E, Larralde-Corona CP (2010) Biocontrol of postharvest blue mold (Penicillium italicum Wehmer) on Mexican lime by marine and citrus Debaryomyces hansenii isolates. Postharvest Biology and Technology 56: 181-187. [ Links ]
Lahlali R, Hamadi Y, El-guilli M, Jijakli MH (2011) Efficacy assessment of Pichia guilliermondii strain Z1, a new biocontrol agent, against citrus blue mould in Morocco under the influence of temperature and relative humidity. Biological Control 56: 217-224. [ Links ]
Liu X, Wang LP, Li YC, Li YC, Yu T, Zheng XD (2009) Antifungal activity of thyme oil against Geotrichum citri-aurantii in vitro and in vivo. Journal of Applied Microbiology 107: 1450-1456. [ Links ]
Liu X, Fang W, Liu L, Yu T, Lou B, Zheng X (2010) Biological control of postharvest sour rot of citrus by two antagonistic yeasts. Letters in Applied Microbiology 51: 30-35. [ Links ]
Macarisin D, Droby S, Bauchan G, Wisniewskia, M (2010) Superoxide anion and hydrogen peroxide in the yeast antagonist-fruit interaction: A new role for reactive oxygen species in postharvest biocontrol?. Postharvest Biology and Technology 58: 194-202. [ Links ]
Mercier J, Smilanick JL (2005) Control of green mold and sour rot of stored lemon by biofumigation with Muscodor albus. Biological Control 32: 401-407. [ Links ]
Norma Oficial Mexicana, NMX-FF-012-1982. Productos alimenticios no industrializados para uso humano-Fruta fresca-Determinación del contenido de jugo en frutas cítricas en base al peso. Declaratoria de vigencia publicada en el Diario Oficial de la Federación 10 de junio de 1982. [ Links ]
Nunes C, Usall J, Teixidó N, Viñas I (2001) Biological control of postharvest pear diseases using a bacterium, Pantoea agglomerans CPA-2. International Journal of Food Microbiology 70: 53-61. [ Links ]
Ochoa JL, Vázquez-Juárez (2004) Las levaduras marinas como herramientas científica y biotecnológica. Universidad y Ciencia I: 39-50. [ Links ]
Ochoa JL, Hernández-Montiel LG, Latisnere-Barragán H, León de La Luz JL, Larralde-Corona CP (2007) Aislamiento e identificación de hongos patógenos de naranja Citrus sinensis L. Osbeck cultivada en Baja California Sur, México. Ciencia y Tecnología Alimentaria 5: 352-359. [ Links ]
Plaza P, Torres R, Usall J, Lamarca N, Viñas I (2004) Evaluation of the potential of commercial post-harvest application of essential Oils to control citrus decay. Journal of Horticultural Science and Biotechnology 79: 935-940. [ Links ]
Santos A, Mauro MS, Bravo E, Marquina D (2009) PMKT2, a new killer toxin from Pichia membranifaciens, and its promising biotechnological properties for control of the spoilage yeast Brettanomyces bruxellensis. Microbiology 155: 624-634. [ Links ]
Sharma R, Singh D, Singh R (2009) Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. Biological Control 50: 205-221. [ Links ]
Smilanick JL, Aiyabei J, Mlikota-Gabler F, Doctor J, Sorenson D, Mackey B (2002) Quantification of the toxicity of aqueous chlorine to spores of Penicillium digitatum and Geotrichum citri-aurantii. Plant Disease 86: 509-514. [ Links ]
Smilanick JL, Mansour MF, Gabler FM, Sorenson D (2008) Control of citrus postharvest green mold and sour rot by potassium sorbate combined with heat and fungicides. Postharvest Biology and Technology 47: 226-238. [ Links ]
Spotts RA, Sanderson PG, Lennox CL, Sugar D, Cervantes LA (1998) Wounding, wound healing and staining of mature pear fruit. Postharvest Biology and Technology 13: 27-36. [ Links ]
Taqarort N, Echairi A, Chaussod R, Nouaim R, Boubaker H, Benaoumar AA, Boudyach E (2008) Screening and identification of epiphytic yeasts with potential for biological control of green mold of citrus fruits. World Journal of Microbiology and Biotechnology 24: 3031-3038. [ Links ]
Tian S, Fan Q, Xu Y, Liu HB (2002) Biocontrol efficacy of antagonist yeast to gray mold and blue mold on apples and pears in controlled antospheres. Plant Disease 86: 848-853. [ Links ]
Tournas VH, Katsoudas E (2005) Mould and yeast flora in fresh berries, grapes and citrus fruits. International Journal of Food Microbiology 105: 11-17. [ Links ]
Usall J, Teixido N, Torres R, Ochoa X, Viñas I (2001) Pilot test of Candida sake (CPA) applications to control postharvest blue mold on apple fruit. Postharvest Biology and Technology 21: 147-156. [ Links ]
White TJ, Bruns TD, Lee S, Taylor J (1990) Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. pp. 315-322. In: M.A. Innis, D.H. Gelfand, J.J. Sninsky and T.J. White (eds.). PCR protocols: A guide to methods and applications. Academic Press. San Diego, California, USA. 482 pp. [ Links ]
Yahyazadeh M, Zare R, Omidbaigi R, Faghih-Nasiri M, Abbasi, M (2009) Control of Penicillium decay on citrus fruit using essential oil vapours of thyme or clove inside polyethylene and nano-clay polyethylene films. Journal of Horticultural Science and Biotechnology 84: 403-409. [ Links ]
Zhang H, Ma L, Turner M, Xu H, Zheng X, Dong Y, Jiang S (2010) Salicylic acid enhances biocontrol efficacy of Rhodotorula glutinis against postharvest Rhizopus rot of strawberries and the possible mechanisms involved. Food Chemistry 122: 577-583. [ Links ]
Zhao Y, Tu K, Shao X, Jing W, Sua Z (2008) Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit. Postharvest Biology and Technology 49: 113-120. [ Links ]














