Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.27 no.1 Villahermosa abr. 2011
Artículos
Efecto del ambiente enriquecido sobre el consumo de nicotina en la rata wistar
Effect of the enriched environment on nicotine consumption in the wistar rat
A Venebra-Muñoz1, A Corona-Morales3, F García-García1,2 *
1 Instituto de Ciencias de la Salud. (AVM, FGG).
2 Facultad de Medicina. Universidad Veracruzana. (FGG)
3 Dirección General de Investigaciones. Universidad Veracruzana. Av. Luís Castelazo Ayala s/n Col. Industrial Ánimas, Xalapa 91190 Veracruz, México. (ACM). * Correo electrónico: fgarcia@uv.mx
Artículo recibido: 30 de noviembre de 2007,
Aceptado: 18 de marzo de 2011
RESUMEN
En mamíferos, condiciones enriquecidas del entorno (EE), así como el nivel educativo, la complejidad del ambiente de trabajo o la naturaleza de los pasatiempos en humanos, al parecer protegen contra la demencia y el deterioro cognoscitivo asociado con el envejecimiento. Además, se ha demostrado que ratas mantenidas en EE, se auto-administran menor cantidad de anfetaminas que las ratas criadas en condiciones aisladas. El objetivo del presente estudio fue determinar el efecto del EE sobre el consumo de nicotina en la rata. Ratas Wistar macho de 21 días de edad se dividieron en dos grupos: Grupo Control (GC), las ratas se mantuvieron en condiciones estándar de laboratorio por 81 días. Grupo enriquecido (GE), las ratas se mantuvieron en EE (8 animales en cajas de 75x60x60 cm, con una variedad de objetos como: tubos, juguetes y material para madriguera) por 81 días. El día 61 se realizó una prueba de consumo de nicotina (0.006%) por tres semanas. El método usado fue el de libre elección de bebedero. Las ratas del GE consumieron menos nicotina por día durante las tres semanas de prueba que las ratas del GC: Semana uno [GE, 0.42 ± 0.09 mg kg-1 d–1 vs. GC, 0.70 ± 0.10 mg kg-1 d–1 , t = -2.3, p < 0.05); Semana dos [GE, 0.22 ± 0.04 mg kg-1 d-1 vs. GC, 0.49 ± 0.08 mg kg-1 d–1 ; t = -3.3, p < 0.01), Semana tres [GE, 0.10 ± 0.01 mg kg-1 d–1 vs. GC, 0.43 ± 0.04 mg kg-1 d–1; t = -6.8, p < 0.01). Los resultados sugieren un posible efecto protector del ambiente enriquecido para desarrollar conductas adictivas a la nicotina.
Palabras clave: Adicción, sistema dopaminérgico, desarrollo cerebral.
ABSTRACT
In mammals, enriched environment (EE) conditions, as well as a high level of education, the complexity of the work environment or the nature of leisure activities in humans, seem to protect against age-related cognitive decline and dementia. In addition, it has been shown that rats kept in an EE self-administer a lower amount of amphetamines than those raised in isolated conditions. The purpose of this study was to determine the effect of an EE on nicotine consumption in rats. Male Wistar rats, 21 days old, were divided into two groups: Control Group (GC), the rats were kept under standard lab conditions for 81 days. Enrichment Group (GE), the rats were kept in an EE for 81 days (8 animals in 75x60x60 cm boxes, with a variety of objects such as: tubes, toys and materials for burrows). On day 61 animals were exposed to nicotine (0.006%) for three weeks. The method used was the two-bottle free-choice where the animals choose freely between water and water+nicotine. The rats of the GE consumed less nicotine per day during the three week trial than the rats of the GC: First week [GE, 0.42 ± 0.09 mg kg-1 d–1 vs. GC, 0.70 ± 0.10 mg kg-1 d–1; t = -2.3, p < 0.05), Second week [GE, 0.22 ± 0.04 mg/kg/d vs. GC, 0.49 ± 0.08 mg kg-1 d–1; t = -3.3, p < 0.01), Third week [GE, 0.10 ± 0.01 mg kg-1 d–1 vs. GC, 0.43 ± 0.04 mg kg-1 d–1, t = -6.8, p < 0.01). The results suggest a possible protective effect of the enriched environment on the development of nicotine addiction.
Key words: Addiction, dopaminergic system, brain development.
INTRODUCCIÓN
El fumar tabaco es una de las causas más comunes para desarrollar enfermedades como el cáncer de pulmón o los infartos al miocardio. De acuerdo con estadísticas de la Organización Mundial de la Salud, existen alrededor de 650 millones de fumadores en el mundo, lo cual se convierte en un problema grave de salud pública. Tan solo en el 2000, 4.2 millones de personas murieron por causas relacionadas con el tabaco y el número estimado para el 2025 es de 10 millones de muertes, correspondiendo 7 millones a personas que habitan en países en vías de desarrollo (Mackay & Eriksen 2002).
Algunos estudios han demostrado que personas con niveles educativos bajos (menos de 10 años de estudio) son más vulnerables a desarrollar el hábito de fumar y como consecuencia una adicción por la nicotina, sustancia activa del tabaco (Härtel et al. 1993; Setter et al. 1998), que personas con un nivel educativo alto. Se ha sugerido que además del bajo nivel educativo, otros factores como la pobreza, el poco tiempo libre para practicar algún deporte o incluso niveles elevados de estrés emocional pudieran ser factores que favorezcan esta conducta (Härtel et al. 1993).
Por otra parte, se ha reportado que el enriquecimiento sensorio-motor del lugar donde los animales crecen (ambiente enriquecido) produce efectos sobre la citoarquitectura y neuroquímica del sistema nervioso. Por ejemplo, roedores de 21 d recién destetados que crecen bajo un ambiente enriquecido aprenden más rápido las pruebas para evaluar aprendizaje cuando son adultos que los animales que crecieron en un ambiente estándar de laboratorio (Forgays & Forgays 1952; Kobayashi et al. 2002). Varios reportes han mostrado que el ambiente enriquecido produce aumento de la arborización dendrítica, elevación de factores neurotróficos y de la neurogénesis en ciertas regiones del cerebro (Volkamar & Greenough 1972; Kempermann et al. 1998; Pham et al. 1999; Leggio et al. 2005). De manera interesante, un ambiente enriquecido puede funcionar como un protector en contra del desarrollo de ciertas conductas adictivas. Se ha reportado que ratas expuestas por 60 d a un ambiente enriquecido disminuyen significativamente la auto-administración de anfetaminas (Bardo et al. 2001). La ingesta de morfina también disminuye en ratas que se mantienen en un ambiente social, es decir, con más compañeros, que ratas criadas de manera aislada (Hadaway et al. 1979). De igual manera, el ambiente enriquecido reduce el efecto estimulante locomotor que produce la nicotina en las ratas (Green et al. 2003), sugiriendo que quizás también el consumo de esta sustancia se vea disminuida en animales mantenidos bajo condiciones de enriquecimiento. El objetivo del presente trabajo fue determinar el efecto que la exposición a un ambiente enriquecido durante la etapa postnatal temprana de la rata tiene sobre el consumo de nicotina en la etapa adulta.
MATERIALES Y MÉTODOS
Animales
16 ratas machos de la cepa Wistar de 21 d de nacidas se emplearon para este experimento. El cuidado de los animales y los protocolos experimentales estuvieron acorde con las normas del comité ético de nuestra Universidad. Los animales estuvieron bajo un ciclo invertido de luz-oscuridad (12 h/12 h) y tuvieron acceso a agua y alimento ad libitum durante el desarrollo de todo el experimento.
Grupos experimentales
Grupo Control (GC; n = 8), los animales se colocaron en cajas de policarbonato (47x33x19 cm) en grupos de 4 ratas por un periodo de 81 d. A este entorno se le considera "condición estándar" (Will et al. 2004). Cada tercer día los animales se cambiaron de caja sin recibir ningún otro tipo de estimulación. Grupo Enriquecido (GE; n = 8), los animales se mantuvieron en cajas con dimensiones de 75x60x60 cm por los mismos 81 d. Las cajas de enriquecimiento se diseñaron con 2 niveles y una serie de objetos en el interior que el animal pudo manipular libremente: tubos de plástico, pelotas de polipropileno, tubos de PVC, juguetes de diferentes formas, tamaños y texturas, cajas con función de balancín, material para fabricar madrigueras, así como barras donde los animales desarrollan habilidades acrobáticas (Will et al. 2004). Además, se utilizaron 2 diferentes diseños de cajas con el propósito de hacer más variado el ambiente donde los animales crecieron. Cada tercer día los animales se cambiaron a una caja diferente, con una ambientación de objetos distinta para manipular.
Prueba de consumo de nicotina
A partir del día 61 del experimento a los animales se les aplicó la prueba de consumo de nicotina, por el método de libre elección de bebedero (Dadmarz & Vogel 2003). Esta prueba consistió en colocar dos bebederos en cada jaula, uno con agua y el otro con nicotina disuelta en agua (0.006%; Sigma N5260) (Dadmarz & Vogel 2003). Todos los días se midió el volumen de agua y de solución de nicotina ingerido en cada condición experimental. El agua como la solución de nicotina se prepararon todos los días. Los bebederos se cambiaron de posición diariamente en las dos condiciones, con la finalidad de descartar una preferencia por el lugar. Para evitar un posible sesgo de consumo, se observó de manera conductual que existiera un consumo homogéneo de la solución de nicotina para la población de animales en ambas condiciones experimentales,
Los animales de los dos grupos se pesaron cada tercer día hasta el día 60 y a partir del día 61 todos los días. Para cada grupo se calculó la dosis ingerida de nicotina de la siguiente manera: (0.06 mg ml–1) (Promedio de los mililitros ingeridos de la solución de nicotina) / (Promedio del peso de los animales) (Dadmarz & Vogel 2003).
Análisis estadísticos
Se compararon ambos grupos en cuanto al peso, volumen total de liquido ingerido y dosis de nicotina consumida mediante una prueba estadística t-student o ANDEVA de una vía, tomando como valor significativo una p < 0.05.
RESULTADOS
En el presente trabajo se explora el ambiente enriquecido, condición que se caracteriza por aumento de la conducta exploratoria y de la estimulación sensorial y motora, como una estrategia de analizar el aumento en la plasticidad neuronal y la preferencia en el consumo de nicotina en la edad adulta. Este enriquecimiento ambiental tuvo dos componentes: aumento de actividad social, al concentrar mayor número de animales en el GE por caja, y aumento en la interacción con el medio ambiente cambiante, en la que se observó a los sujetos del GE moviendo diversos objetos, columpiándose y construyendo madrigueras. De esta manera, primero se analiza si las condiciones diferentes de cada grupo afectaron el crecimiento corporal. Los resultados mostraron que los animales que crecieron en condiciones estándar de laboratorio y aquellos mantenidos en condiciones de ambiente enriquecido incrementaron su peso corporal en la misma proporción, no existiendo diferencias significativas entre los grupos a lo largo de todo el experimento (t = -0.029, p > 0.05, Figura 1A).
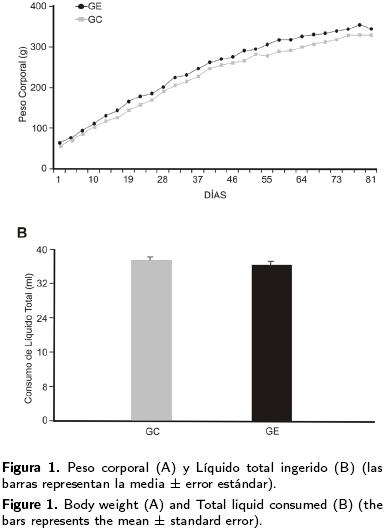
Para establecer si las condiciones ambientales del protocolo experimental modificaron el consumo de líquido, se midió a lo largo de los últimos 21 d del experimento la ingesta total de líquido (agua + solución de nicotina). El consumo de los animales del GE [36.3 ± 0.70 ml] no fue diferente al de los animales del GC [37.3 ± 0.74 ml, t = 0.98, p > 0.05, Figura 1B].
Debido a que hay evidencia que el ambiente enriquecido modifica ciertos procesos neuronales relacionados con conductas adictivas, se investigó la dosis de nicotina consumida en cada grupo experimental en las tres últimas semanas del experimento. Se encontró que los animales del GE consumieron menos nicotina desde la primera semana [GE, 0.42 ± 0.09 mg kg-1 d–1vs. GC, 0.70 ± 0.10 mg kg-1 d–1; t = -2.3, p < 0.05). La diferencia se acentuó en la segunda semana [GE, 0.22 ± 0.04 mg kg-1 d–1vs. GC, 0.49 ± 0.08 mg kg-1 d–1; t = -3.3, p < 0.01) y la mayor diferencia se observó en la tercera semana [GE, 0.10 ± 0.01 mg kg-1 d–1 vs. GC, 0.43 ± 0.04 mg kg-1 d–1; t = -9.0, p < 0.01; Figura 2). El consumo de nicotina fue constante en los animales del GC ya que no existieron diferencias intra-grupales a lo largo de las tres semanas (ANDEVA F = 3.1, p > 0.05). Sin embargo, en los animales del GE el consumo fue menor cada semana (ANDEVA F = 15.2, p < 0.01; Figura 2).

DISCUSIÓN
Los resultados de este estudio muestran que los animales que crecieron bajo condiciones de enriquecimiento consumen menos nicotina que los animales que crecieron en condiciones estándar de laboratorio, lo cual sugiere un papel protector del ambiente enriquecido en el desarrollo de la adicción a la nicotina. Estos resultados son similares a los reportados para otras sustancias que producen adicción como la morfina, las anfetaminas y la cocaína (Hadaway et al. 1979; Bardo et al. 2001; Solinas et al. 2009). Sin embargo, en estos estudios los animales que consumieron más morfina o anfetamina fueron criados en condiciones que se denominan de empobrecimiento (1 solo animal en una caja con dimensiones menores a las condiciones de enriquecimiento). Por lo tanto, el estudio muestra que las condiciones estándar también favorecen el consumo de sustancias que producen adicción, sugiriendo con ello que la interacción entre un mayor número de individuos no es un factor determinante para impedir el desarrollo de una conducta adictiva.
Actualmente se sabe que cuando los animales crecen en ambientes carentes de enriquecimiento, la densidad de fibras dopaminérgicas que inervan la corteza prefrontal y el estriado disminuyen (Winterfeld et al. 1998; Neddens et al. 2001; Lehmann et al. 2002). Como consecuencia, la actividad dopaminérgica en estos animales disminuye también (Jones et al. 1992). Esta reducción de la actividad dopaminérgica de una parte del sistema de reforzamiento pudiera ser la causa por la cual los animales en condiciones estándar consuman más nicotina. Se sabe que la nicotina estimula la liberación de dopamina en el núcleo acumbens (NA) de la rata, en concentraciones similares a las que produce el humo del cigarro (Rowell et al. 1987).
En contraste, los animales que crecieron en condiciones de enriquecimiento consumieron menos nicotina, varios estudios han mostrado que condiciones enriquecidas del entorno en la primera etapa de la vida favorecen procesos de plasticidad cerebral incluida la maduración del sistema dopaminérgico mesolímbico de reforzamiento. Más aun, se ha demostrado que el consumo de glucosa del NA se incrementa en animales que son expuestos a condiciones de enriquecimiento (González-Lima et al. 1994). Por lo tanto, se puede sugerir que los cambios en la plasticidad cerebral favorecidos por el enriquecimiento ambiental podrían ser los responsables de que los animales que crecieron en condiciones de enriquecimiento consuman menos nicotina cuando son adultos.
Por otra parte, los resultados de este estudio mostraron que el volumen total de líquido ingerido por los animales que crecieron en condiciones de enriquecimiento no mostró diferencias significativas con respecto al GC. Aquí se tomó como ingesta de líquido total los mililitros que el animal ingirió tanto de agua como de solución de nicotina. El que no exista diferencia significativa en este parámetro indica que el consumo de solución de nicotina fue independiente de la posibilidad de presencia de sed y del peso corporal del animal, ya que este último parámetro tampoco mostró diferencias significativas entre el GC y el GE, además de que varios estudios han demostrado que la palatabilidad de la nicotina no es un factor que impacte de manera significativa en la elección de la misma (Glick et al. 1996; De la García & Liu 2002; Wilnpouth & Apear 2002; Dadmarz & Vogel 2003).
En conclusión, los resultados muestran que el enriquecimiento ambiental funciona como un protector ante la posibilidad de desarrollar adicción a la nicotina. Sin embargo, aun falta investigar los mecanismos cerebrales que participan.
AGRADECIMIENTOS
Los autores de este trabajo agradecen las facilidades otorgadas por el Bioterio de la Facultad de Medicina a cargo de la Biol. Mercedes Acosta y al apoyo del CONACYT 212045-AVM, 61344-ACM, PROMEP PTC-118-FGG, así como al Dr. Juan Santiago García por revisar el trabajo.
LITERATURA CITADA
Bardo MT, Klebaur J, Valone J, Deaton C (2001) Environmental enrichment decreases intravenous self-administration of amphetamine in female and male rats. Psycopharmacology 155: 278-284. [ Links ]
Dadmarz M, Vogel W (2003) Individual self-administration of nicotine by rats. Pharmacology, biochemistry, and behavior 76: 425-432. [ Links ]
De la García R, Liu X (2002) Wistar Kyoto rats exhibit reduced nicotine self-administration behavior. Implication for a animal model of depression. Drug and Alcohol Dependence 6: 49. [ Links ]
Forgays D, Forgays JW (1952) The nature of the effect of free-environmental experience in the rat. Journal of Comparative and Physiological Psychology 45: 322-328. [ Links ]
Glick S, Visker K, Maisonneuve I (1996) An oral self-administration model of nicotine preference in rats: effects of mecamylamine. Psychopharmacology 128: 426-431. [ Links ]
Gonzalez-Lima F, Ferchmin PA, Eterovic VA, Gonzalez-Lima EM (1994) Metabolic activation of the brain of young rats after exposure to environmental complexity. Developmental Psychobiology 27: 343-351. [ Links ]
Green T, Cain M, Thompson M, Bardo M (2003) Environmental enrichment decreases nicotine-induced hyperactivity in rats. Psychoparmacology 170: 235-241. [ Links ]
Hadaway P, Alexander B, Coambs R, Beyerstein B (1979) The effect of housing and gender on preference for morphine-sucrose solutions in rats. Psycopharmacology 66: 87-91. [ Links ]
Härtel U, Stieber J, Keil U (1993) The effect of education and professional position on changes in ciga-rette smoking and alcohol consumption: results of the MONIKA Augsberg cohort study. Sozial- und Präventivmedizin 38: 133-141. [ Links ]
Jones GH, Hernandez TD, Kendall DA, Marsden CA, Robbins TW (1992) Dopaminergic and serotonergic function following isolation rearing in rats: study of behavioural responses and postmortem and in vivo neurochemistry. Pharmacology, biochemistry, and behavior 43: 17-35. [ Links ]
Kempermann G., Kuhn H., Gage F (1998) Experience-induced neurogenesis in the senescent dentate gyrus. The Journal of Neuroscience. 18: 3206-3212. [ Links ]
Kobayashi S, Ohashi Y, Ando S (2002) Effects of enriched environments with different durations and starting times on learning capacity during aging in rats assessed by a refined procedure of the Hebb-Williams maze task. Journal of Neuroscience Research 70: 340-346. [ Links ]
Leggio MG, Mandolesi L, Federico F, Spirito F, Ricci B, Gelfo F, Petrosini L (2005) Environmental enrichment promotes improved spatial abilities and enhanced dentritic growth in the rat. Behavioural Brain Research 163: 78-90. [ Links ]
Lehmann K, Teuchert-Noodt G, Dawirs RR (2002) Postnatal rearing conditions influence ontogeny of adult dopamine transporter (DAT) immunoreactivity of the striatum in gerbils. Journal of Neural Transmission 109: 1129-1137. [ Links ]
Mackay J, Eriksen M (2002) The tobacco atlas. UK: World health organization. [ Links ]
Neddens J, Brandenburg K, Teuchert-Noodt G, Dawirs RR (2001). Differential environment alters ontogeny of dopamine innervation of the orbital prefrontal cortex in gerbils. Journal of Neuroscience Research 63: 209-213. [ Links ]
Pham T, Ickes D, Albeck D, Derstro M, Granholm A, Mohammed A (1999) Changes in brain nerve growth factor levels and nerve growth factor receptors in rats exposed to environmental enrichment for one year. Neuroscience 94: 279-286. [ Links ]
Rowell PP, Carr LA, Garner AC (1987) Stimulation of [3H]dopamine release by nicotine in rat nucleus accumbens. Journal of Neurochemistry 49: 1449-1454. [ Links ]
Setter C, Peter R, Siegrist J, Hort W (1998) Impact of school and vocational education on smoking behaviour: results from a large-scale study on adolescents and young adults in Germany. Sozial- und Präventivme-dizin 43: 133-40. [ Links ]
Solinas M, Thiriet N, El Rawas R, Lardeux V, Jaber M (2009) Environmental enrichment during early stages of life reduces the behavioral, neurochemical, and molecular effects of cocaine. Neuropsychopharmacology 34: 1102-1111. [ Links ]
Volkamar FR, Greenough WT (1972) Rearing complexity affects braching of dendrites in the visual cortex of the rat. Science 176: 1445-1447. [ Links ]
Will B, Galani R, Kelche Ch, Rosenzweig M (2004) Recovery from brain injury in animals: relative efficacy of environmental enrichment, physical exercise of formal training (1990-2002). Progress in Neurobiology 72: 167-82. [ Links ]
Wilnpouth C, Apear LP (2002) Oral nicotine self-administration in rats during adolescece. Drug and Alcohol Dependence 6: 195. [ Links ]
Winterfeld KT, Teuchert-Noodt G, Dawirs RR (1998) Social environment alters both ontogeny of dopamine innervation of the medial prefrontal cortex and maturation of working memory in gerbils (Meriones unguiculatus). Journal of Neuroscience Research 52: 201-209 [ Links ]














