Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Universidad y ciencia
versão impressa ISSN 0186-2979
Universidad y ciencia vol.27 no.1 Villahermosa Abr. 2011
Artículos
Salinidad inducida con NaCl y aplicación de fósforo sobre las propiedades bioquímicas de frijolillo (Rhynchosia minima L (DC))
NaCl induced salinity and supplementary phosphorus on the biochemical properties of wild bean (Rhynchosia minima L (DC))
A Madueño-Molina1 * , JD García-Paredes1, J Martínez-Hernández1, R Bugarín- Montoya1, JI Bojórquez-Serrano1
1 Universidad Autónoma de Nayarit. Cd. de la Cultura Amado Nervo. Boulevard Tepic-Xalisco S/N. CP. 63190. Tepic, Nay; México. Tel. (311) 211-8800 ext. 8912. (AMM)(JDGP)(JMH)(RBM)(JIBS). * Correo electrónico: albertom@nayar.uan.mx
Artículo recibido: 06 de noviembre de 2007,
Aceptado: 11 de marzo de 2011
RESUMEN
Este estudio se realizó con el propósito de evaluar dos dosis de fósforo sobre frijolillo Rhynchosia minima (L) DC., en condiciones de salinidad inducida y al mismo tiempo identificar los componentes de ajuste osmótico como respuesta a las condiciones de salinidad. El trabajo se desarrolló bajo condiciones de invernadero. Se usaron macetas de 5 L, las cuales se llenaron de jal (piedra pómez de origen volcánico) como sustrato. Se utilizó un arreglo factorial A x B en un diseño completamente al azar con cuatro repeticiones. El factor A se formó con cuatro niveles de NaCl (0, 25, 50 y 100 mM) y el factor B con dos concentraciones de fósforo (4 y 8 meq L–1). Las variables evaluadas fueron: azúcares solubles totales, aminoácidos libres totales, prolina libre, pigmentos fotosintéticos (clorofila-a y clorofila-b) y carotenos. El ajuste osmótico celular en frijolillo se asoció con la acumulación de azúcares solubles, aminoácidos libres y prolina libre, ya que se encontraron proporciones mayores al control cuando la concentración de NaCl fue de 100 mM. La aplicación de fósforo ocasionó mejor respuesta al ajuste osmótico celular de frijolillo. El contenido de los pigmentos fotosintéticos se favoreció con los niveles medios de NaCl (25 y 50 mM), y disminuyó a la concentración de 100 mM. El contenido de carotenos aumentó gradualmente con el gradiente salino. Los tratamientos evaluados no afectaron el contenido de proteínas.
Palabras clave: Salinidad, fósforo, compuestos orgánicos, frijolillo.
ABSTRACT
The purpose of the study was to evaluate two doses of phosphorus on the wild bean Rhynchosia minima (L) DC under conditions of induced salinity, and at the same time to identify the components of osmotic adjustment as a response to the salinity conditions. The study took place under greenhouse conditions, using 5 L flower pots filled with pumice material as substrate. An A x B factorial arrangement was used in a completely random design, with four replications. Factor A consisted of four levels of NaCl (0, 25, 50 and 100 mM) and factor B of two concentrations of phosphorus (4 and 8 meq L–1). The variables evaluated were total soluble sugars, total free amino acids, free proline, photosynthetic pigments (chlorophyll-a and chlorophyll-b) and carotenes. The cellular osmotic adjustment in the wild bean was associated with the accumulation of soluble sugars, free amino acids and free proline, as proportions greater than the control were found when the NaCl concentration was 100 mM. The addition of phosphorus resulted in a better response to the cellular osmotic adjustment of the wild bean. The amount of photosynthetic pigments was favoured at the medium levels of NaCl (25 and 50 mM), and decreased at the concentration of 100 mM. The content of carotenes increased gradually with the saline gradient. The evaluated treatments did not affect the protein content.
Key words: Salinity, phosphorus, organic compounds, wild bean.
INTRODUCCIÓN
La salinida es un factor ambiental que puede estar presente en el agua y en los suelos. Además de afectar el crecimiento y contenido mineral de las plantas, la salinidad tiene efecto sobre el comportamiento de los estomas y la fotosíntesis, así como en el contenido de clorofila en las plantas (Ashraf & Bhatti 2000). Bajo condiciones de estrés por salinidad, una deficiencia de fósforo puede influir en los procesos metabólicos, principalmente en el metabolismo de nitrógeno, lo que ocasiona un incremento en aminoácidos libres, especialmente de proteínas (Al-Karaki et al. 1996; Kabir et al. 2004). También bajo condiciones salinas, la solución del suelo tiene un potencial osmótico muy negativo, las plantas afectadas por estrés de salinidad mantienen un potencial osmótico intracelular más negativo con el propósito de evitar que el agua de las células se mueva hacia el suelo y cause lo que se denomina "sequía osmótica". En casi todas las plantas el ajuste osmótico incluye la síntesis y acumulación de solutos orgánicos, lo cual reduce el potencial osmótico de las células hasta un nivel de alta turgencia para mantener el desarrollo. Los compuestos orgánicos de bajo peso molecular sintetizados en el citoplasma de las células, en respuesta a un potencial hídrico del agua más negativo en la solución del suelo, son: azúcares solubles, ácidos orgánicos, aminoácidos y sus derivados metilados (Ashraf 1994).
El frijolillo (Rhynchosia minina (L) DC.) es una leguminosa silvestre distribuida en la llanura costera de Nayarit, que forma parte de la cuenca del Río Lerma-Santiago, región en donde se localiza la mayor diversidad biológica de esta especie, desde el nivel del mar hasta una altitud de 1 350 m (McVaugh 1987). Esta especie tiene potencial como planta forrajera ya que crece en suelos afectados por la salinidad donde no prosperan los cultivos susceptibles a esta condición. Además, dado que se desarrolla durante el período más seco del año, cuando hay poca disponibilidad de alimento para los rumiantes, es utilizado como forraje verde. Sin embargo, a pesar de su potencial forrajero esta especie no ha recibido atención en los aspectos de caracterización agronómica y valoración nutricional.
Este estudio se realizó con el objetivo de evaluar el efecto de dos concentraciones de fósforo sobre frijolillo en condiciones de salinidad inducida y al mismo tiempo identificar los componentes de ajuste osmótico como respuesta a las condiciones de salinidad.
MATERIALES Y MÉTODOS
El estudio se realizó en condiciones de invernadero utilizando al frijolillo como planta indicadora. Se usaron macetas de 5 L, las cuales se llenaron de jal (piedra pómez de origen volcánico) como sustrato, previamente lavado y cribado a partículas con tamaño de 0.4 mm. Se utilizó la solución nutritiva propuesta por Hewitt & Smith (1975), la cual fue modificada para tener dos soluciones madres de fósforo (P) con 4 y 8 meq L–1 , mismas que se combinaron con 0, 25, 50 y 100 mM de cloruro de sodio (NaCl). El pH de la solución nutritiva se ajustó con ácido sulfúrico concentrado (0.5 mL por cada 5 L de solución) a un valor de 5.8 para favorecer la absorción de nutrimentos (Schachtman et al. 1998).
El experimento se estableció con un arreglo factorial A x B, en un diseño completamente al azar con cuatro repeticiones. El factor A fueron los cuatro niveles de NaCl y el factor B los dos niveles de fósforo. A cada uno de los tratamientos se le determinó la conductividad eléctrica. A las variables evaluadas se les realizó análisis de varianza y comparación de medias mediante la prueba de Tukey (5 %),utilizando el paquete estadístico SAS.
Las macetas fueron regadas con agua destilada dos veces por día. Se realizaron observaciones cada semana, durante 42 d, tiempo en que las plantas iniciaron su etapa reproductiva, la cual se identificó por la emisión de las primeras flores. En esta etapa se cosecharon las plantas para estimar su composición química. Las variables incluidas para su evaluación fueron:
Contenido de elementos esenciales
Se realizaron análisis químicos para determinar el contenido de P, K, Ca, Mg y Na en los tejidos de hojas y correlacionar estos valores con los metabolitos. Para la extracción de los minerales se utilizó el método de acenización húmeda: el fósforo se determinó por colorimetría; el potasio y sodio por fotometría de flama; y el contenido de calcio y magnesio por volumetría, de acuerdo a los métodos convencionales.
Seis semanas después de la emergencia de la plántula se realizaron los muestreos para la cuantificación de los metabolitos. Los azúcares solubles totales fueron evaluados mediante la técnica propuesta por Dubois et al. (1956) y modificada por Buysse & Merckx (1993); para los aminoácidos libres totales se utilizó el procedimiento propuesto por Pin & Takahasiii (1966); en la determinación de prolina libre se siguió la técnica propuesta por Magné & Larher (1992); los pigmentos fotosintéticos y carotenos fueron analizados de acuerdo al procedimiento usado por Lichtenthaler (1987).
RESULTADOS
La conductividad eléctrica en cada tratamiento fue de 1.8, 4.6, 7.2, 12.4, 2.0, 4.8, 7.4, y 12.6 mS cm–1 respectivamente, iniciando con la combinación del nivel bajo para cada factor.
El análisis estadístico indicó diferencias significativas entre niveles de fósforo, concentración de NaCl y su interacción con el contenido de azúcares solubles, aminoácidos totales y prolina libre, tanto en los tejidos de las hojas como en los de las raíces, así como con el contenido de pigmentos fotosintéticos de las hojas de frijolillo. La Tabla 1 muestra la separación de medias de las diferencias en concentraciones, derivadas de los tratamientos.
Respuesta a la aplicación de fósforo y NaCl
Las concentraciones de azúcares, aminoácidos y prolina, en hojas, fueron mayores con el nivel de fósforo de 8 meq L–1. En cambio, la clorofila a, b y carotenos fueron mayores con la dosis baja de fósforo (4 meq L–1). En las hojas de plantas tratadas con 100 mM de NaCl, la concentración de azúcares, aminoácidos, prolina y carotenos se incrementó, mientras que con 25 mM de NaCl se tuvo mayor cantidad de clorofila a y b, en comparación con el testigo (Tabla 1). En la misma tabla se presentan los promedios de azúcares, aminoácidos y prolina en raíces de frijolillo. Se observa que la concentración de azúcar y aminoácidos se incrementó en la medida que se aumentó la dosis de fósforo, mientras que la cantidad de prolina no tuvo efecto al mismo elemento. Las concentraciones de estos compuestos orgánicos aumentaron en función directa al grado de salinidad.
Efectos producidos por la interacción del fósforo con NaCl
En la Figura 1 se aprecia la respuesta de las variables con respecto a la interacción entre el fósforo y el NaCl.
Azúcares
La concentración de azúcares solubles en los tejidos de las hojas presentó una respuesta directamente proporcional al aumento de la salinidad, con mayor acumulación debido a la dosis de 8 Meq L–1 de fósforo (Figura 1a). Los valores estuvieron en el rango entre 1 446 a 3 653 μg g–1 con base a peso fresco, lo que representa una diferencia de 253%.
Aminoácidos
La acumulación de aminoácidos como respuesta a la salinidad y a la aplicación de fósforo fue mayor, pero el efecto que ocasionaron las dosis de fósforo fue similar (Figura 1b). La diferencia entre el menor y el mayor valor (836 vs 1 996 μg g–1 con base a peso fresco) fue de 238%.
Prolina libre
La concentración de prolina libre en los tejidos de las hojas osciló entre 57 a 1 659 μg g–1 de peso fresco, lo que significa un incremento de 2 910 %. La respuesta observada para la acumulación de prolina en hojas fue exponencial, con 8 meq L–1, a través del gradiente salino (Figura 1c). Es de resaltarse el incremento obtenido entre los valores de 50 a 100 mM de NaCl.
Pigmentos fotosintéticos
Las concentraciones de clorofila a y b aumentaron donde el fósforo se aplicó en 4 ó 8 meg L–1 junto con 25 mM de NaCl, con relación al testigo y disminuyeron gradualmente con las interacciones del fósforo (4 ó 8 meq L–1 ) con 50 y 100 mM de NaCl (Figura 1d y 1e). No obstante, las cantidades mayores de clorofila a y b se obtuvieron con la dosis baja de fósforo (4 meq L–1 ).
Carotenos
La concentración de carotenos se incrementó al pasar de 0 a 25 mM de NaCl y disminuyó después de este valor de salinidad. La respuesta, en cantidad de carotenos, a la aplicación de fósforo fue similar con las dos dosis (Figura 1f).
Contenido de azúcares, aminoácidos y prolina en raíces
La concentración de azúcares en raíces se presenta en la Figura 2a, donde se nota que el contenido de azúcares se incrementó gradualmente conforme se aumentó el NaCl. La respuesta tuvo la misma tendencia con respecto a la observada en hojas. No obstante, el efecto fue mayor en las plantas tratadas con la dosis de fósforo de 8 meq L–1 y cualquiera de las dosis de NaCl, en comparación con la respuesta observada en las plantas cultivadas con fósforo con 4 meq L–1 y las dosis de NaCl.
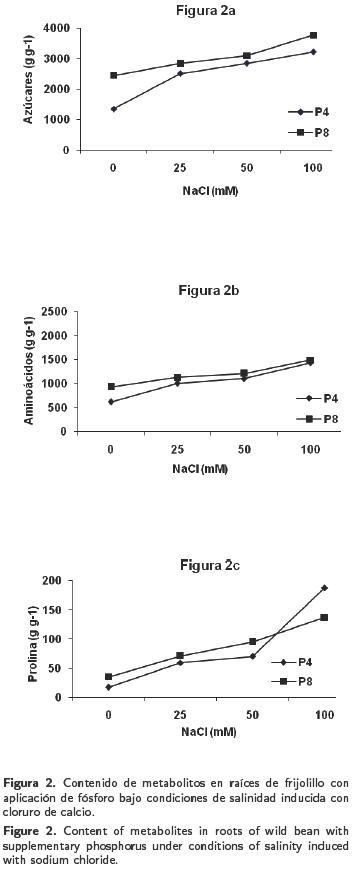
En las plantas que recibieron las dosis de 4 meq L–1 y 25 mM de NaCl, respectivamente, el contenido de aminoácidos solubles en raíces varío de 614 a 1 438 μg g–1 lo que ocasionó una diferencia de 234%; sin embargo, los incrementos fueron mayores cuando el fósforo se aplicó en 8 meq L–1 y cualquiera de las dosis de NaCl (Figura 2b).
La cantidad de prolina en raíces osciló entre el rango de 17 y 188 μg g–1 cuando los tratamientos incluyeron fósforo en 4 meq L–1 y 0 ó 100 mM de NaCl, lo que representó un incremento de 1 106%; sin embargo, estos valores son bajos comparados con los observados en las hojas. La respuesta observada para la acumulación de prolina en la raíz fue lineal (Figura 2c).
Coeficientes de correlación
La correlación obtenida entre la cantidad de NaCl y la concentración de compuestos orgánicos fue positiva y significativa para azúcares, aminoácidos, prolina y carotenos, lo cuál confirma la respuesta observada gráficamente. Para la clorofila a y b, la correlación fue negativa y no significativa para la primera, y significativa para la segunda (Tabla 2). También se observaron correlaciones significativas entre los elementos minerales analizados y los compuestos orgánicos (Tabla 3). El P y Na se asociaron positivamente con la acumulación de azúcares, aminoácidos, prolina y carotenos. El K y el Ca se asociaron negativamente con estos mismos compuestos y positivamente con clorofila a y b.


DISCUSIÓN
En un gradiente salino, el agua fluye de un potencial osmótico alto (baja concentración de sales) hacia un potencial bajo (alta concentración de sales). En consecuencia, cuando la solución del suelo tiene un potencial osmótico menor que el de las células de las plantas, se limita la extracción de agua del suelo y ocurre la sequía osmótica. Es conocida la relación directa entre la concentración de sales y la conductividad eléctrica. Conforme aumenta la concentración de sales la presión osmótica se va haciendo más negativa.
La acumulación de compuestos orgánicos permite inferir que el frijolillo es una especie con capacidad para realizar un ajuste osmótico en sus células, como respuesta a un potencial hídrico muy negativo del medio externo provocado por la alta concentración de sales en la solución del suelo.
Lo anterior tiene relación con lo descubierto por Ashraf (1994) y Volkmar et al. (1998) quienes refieren que, en condiciones salinas, el bajo potencial osmótico de la solución del suelo obliga a que las plantas expuestas a ese medio mantengan también un bajo potencial osmótico de sus células, de lo contrario pueden experimentar una desecación osmótica, debido a que el agua se movería de la célula hacia el suelo, lo cual eventualmente le puede provocar la muerte. Asimismo, con lo indicado por Flowers et al. (1977), quienes observaron que el ajuste osmótico, bajo condiciones de estrés por salinidad, puede ocurrir por el consumo de iones desde la solución del suelo o por la síntesis interna de solutos orgánicos, aunque según Ashraf (1994) la contribución del ajuste osmótico para la adaptación osmótica varía considerablemente entre diferentes plantas y entre diferentes compartimentos celulares de la misma planta.
En frijolillo, la acumulación de azúcares y aminoácidos varió poco entre hojas y raíces, sin embargo la prolina se acumuló más en las hojas, favoreciendo el ajuste osmótico, mismo que según Wyn-Jones (1981) en todos los tipos de plantas involucra la síntesis y acumulación de solutos orgánicos, reduciendo el potencial osmótico celular a un nivel que permite un alto potencial de turgencia para conservar la tasa de crecimiento, aunque no todos los solutos orgánicos tienen un efecto positivo en la capacidad de adaptación, como sucede en algunos tejidos en estrés, donde se sintetizan ciertas aminas eventualmente tóxicas.
Los compuestos orgánicos de bajo peso molecular que generalmente se sintetizan en respuesta a un bajo potencial hídrico de la solución del suelo son azúcares, ácidos orgánicos, aminoácidos y sus derivados metilados. De estos, los azúcares y los ácidos orgánicos son considerados como osmolitos orgánicos principales en las glicófitas (Ashraf 1994). De acuerdo con Cram (1976), los azúcares contribuyen hasta con el 50 % del potencial osmótico total en glicófitas desarrolladas en un ambiente salino, lo cual concuerda con lo obtenido en este trabajo, donde en las hojas el azúcar respecto a los aminoácidos fue de 62 %, 59 % y 50 % cuando la concentración de NaCl en la solución fue de 25, 50 y 100 mM de NaCl, mientras que en la raíz esta relación fue de 70%, 70% y 66% para el mismo gradiente.
La prolina se acumuló exponencialmente en tejidos de hojas, siendo superior al control en aproximadamente 5, 7 y 21 veces, con las concentraciones: 25, 50 y 100 mM de NaCl respectivamente, mientras que en tejidos de raíz este incremento fue de 3, 4 y 11 en el mismo gradiente salino. La acumulación de prolina ha mostrado una tendencia exponencial en salinidad. Al respecto, Rhodes & Handa (1989) encontraron en plantas de tabaco con estrés por salinidad, que la prolina se acumuló 80 veces más con respecto al control.
El papel de la prolina como osmoregulador, ha sido cuestionado, sin embargo, diversos autores han encontrado que se acumula en respuesta a un severo estrés de salinidad y de sequía (Greenway & Munns 1980; Wyn-Jones 1981; Rains 1981, Iyer & Caplan, 1998).
De acuerdo con Rains (1981) y Wyn-Jones (1981), la prolina puede regular la acumulación de nitrógeno esencial y es osmóticamente muy activa. Ashraf (1994) señaló que también es compatible con otros componentes citoplásmicos y puede ser fácilmente convertida a glutamato, lo cual es muy importante, porque el glutamato es el precursor en la síntesis de otros aminoácidos esenciales, de tal forma que la prolina puede actuar como reserva de nitrógeno y como osmoregulador.
Iyer & Caplan (1998) señalaron que durante el estrés por salinidad o sequía, las plantas incrementan su nivel de prolina libre cuando se presenta o existe demanda de proteínas, sin embargo, se ha sugerido que este incremento en los niveles de prolina libre es un síntoma que resulta del desbalance en otras rutas metabólicas (Perez-Alfocea & Larher 1995). A pesar de lo anterior, se ha acumulado suficiente evidencia que señala, que los altos niveles de prolina son benéficos para las plantas estresadas. El contenido de prolina encontrado en raíces fue bajo en comparación con el de hojas, lo que permite suponer que esta especie realiza la función osmo-reguladora principalmente en las células de las hojas.
Los resultados encontrados en este estudio permiten inferir que el ajuste osmótico celular en frijolillo se asoció a la acumulación de azúcares solubles, aminoácidos libres y prolina libre, ya que se encontraron proporciones mayores al control cuando la concentración de NaCl fue de 100 mM. Ahmad & Jhon (2005) reportaron incrementos en el contenido de prolina y azúcares en plantas de chícharo sujetas a tratamientos de 50, 100, 150 y 200 mM de NaCl. El incremento en dosis de fósforo en las soluciones salinas resultó en una mejor respuesta al ajuste osmótico celular de frijolillo. El contenido de clorofila a y b, fue mayor cuando la concentración de NaCl fue de 25 y 50 mM, y menor con 100 mM, lo que sugiere que la capacidad fotosintética foliar fue favorecida en esta especie con una salinidad moderada. Este comportamiento manifestó que la actividad fotosintética de esta especie se estimula con la presencia de NaCl en cantidades bajas (25 mM), y se inhibe cuando la concentración es más elevada, lo que se puede atribuir al ingreso de fósforo a las células y a una concentración de sodio a niveles no tóxicos. Estos resultados concuerdan con lo encontrado por Kaya et al. (2001) quienes reportaron que el contenido de clorofila, en hojas de espinaca, se redujo considerablemente con 60 mM de salinidad.
Los contenidos de clorofila a y b fueron mayores cuando la concentración de NaCl fue de 25 y 50 mM y menor con 100 mM, lo que sugiere que la capacidad potencial para fotosintetizar fue favorecida en esta especie con una salinidad moderada, lo cual puede ser atribuido al ingreso de fósforo a las células y a una concentración de sodio a niveles no tóxicos.
El contenido de carotenos se incrementó gradualmente en el gradiente salino, por lo que al formar parte de la envoltura de los cloroplastos y de los tilacoides, éstos pueden proporcionar protección directa contra sustancias oxidantes o bien impulsar la síntesis de ABA y de esta forma inducir la abscisión de las hojas donde la concentración de sodio haya alcanzado niveles de toxicidad.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) de México, por el apoyo mediante la beca otorgada (Registro No. 55116) y el financiamiento del proyecto CONACYT 0707-B.
LITERATURA CITADA
Ahmad P, Jhon R (2005) Effect of salt stress on growth and biochemical parameters of Pisum sativum L. Archives of Agronomy and Soil Science 51(6): 665-672. [ Links ]
Ashraf MY (1994) Breeding for salinity tolerance in plants. Critical Reviews in Plant Sciences 13: 17-42. [ Links ]
Ashraf MY, Bhatti AS (2000) Effect of salinity on growth and chlorophyll content in rice. Pakistan Journal of Scientific and Industrial Research. 43: 130-131. [ Links ]
Al-Karaki GN, Clark RB, Sullivan CY (1996) Phosphorus nutrition and stress effects on proline accumulation in sorghum and bean. Plant Physiology 148: 745-751. [ Links ]
Buysse J, Merckx R (1993) An improved colorimetric method to quantify sugar content of plant tissue. Journal Experimental Botany. 44: 1627-1629. [ Links ]
Cram WJ (1976) Negative feedback regulation of transport in cells. The maintenance of turgor. Volume and nutrition supply. Encyclopedia of plant physiology: transport in plant. U. Lüttge, M.G. Pitman. 2nd Ed. Berlin/Heidelberg/New York. Pp 284-316. [ Links ]
Dubois M, KA Gilles, JK Hamilton, PA Roberts, F Smith (1956) Colorimetric methods for determination of sugar and related substances. Analytical Chemistry 28(3): 350-356. [ Links ]
Flowers TJ, Troke PF, Yeo AR (1977) The mechanism of salt tolerance in halophytes. Annual Review of Plant Physiology. 28: 89-121. [ Links ]
Greenway H, Munns R (1980) Mechanisms of salt tolerance in non-halophites. Annual Review of Plant Physiology. 31: 197-205. [ Links ]
Hewitt EH, Smith TA (1975) Plant mineral nutrition: effects of mineral nutrients on growth and composition. The English Universities Press, LTD London. 298 p. [ Links ]
Iyer S, Caplan A (1998) Products of proline catabolism can induce osmotically regulated genes in rice. Plant Physiology. 116: 203-211. [ Links ]
Kabir ME, Karim MA, Azad MAK (2004) Effect of potassium on salinity tolerance of mungbean (Vigna radiata L Wilczek). Journal of Biological Sciences 4(2): 103-110. [ Links ]
Kaya C, Higgs D, Kirnak H (2001) The effects of high salinity (NaCl) and supplementary phosphorus and potassium on physiology and nutrition development of spinach. Bulg. J. Plant Physiol., 27 (3-4): 47-59. [ Links ]
Lichtenthaler HK (1987) Chlorophylls and carotenoids: pigments of photosintetic biomembranes. Plant Cell Membranes. Methods in Enzimology 148: 350-382. [ Links ]
Magné C, Larher F (1992) High sugar content of extracts interferes with colorimetric determination of amino acids and free proline. Anal. Biochem. 200: 115-118. [ Links ]
McVaugh R (1987) Flora Novo-Galiciana: a descriptive account of the vascular plants of western Mexico. Leguminosae. Ann Arbor. The University of Michigan Press. USA. 786 pp. [ Links ]
Pérez-Alfocea F, Larher F (1995) Effects of phlorizin and pchloromercuribenzenesulfonic acid on sucrose and proline accumulation in detached tomato leaves submitted to NaCl and osmotic stresses. J. Plant Physiol. 145: 367:373. [ Links ]
Pin YL, Takahasiii T (1966) An improved colorimetric determination of aminoacids with the use o nihydrin. Anal. Biochem. 14: 71-77. [ Links ]
Rains DW (1981) Salt tolerance-new developments. In: Advances in food producing systems for arid and semiarids. Academic press. New York. 431 pp. [ Links ]
Rhodes D, Handa S (1989) Amino acids metabolism in relation to osmotic adjustment in plant cells. En: Environmental stress in plants. Biochemical and physiological mechanisms. J.H. Cerry, (ed) Springer-Verlag, Berlin, Germany. pp. 41-42. [ Links ]
Schachtman DP, Reid RJ, Ayling SM (1998) Phosphorus uptake by plants: from soil to cell. Plant Physiol. 116: 447-453. [ Links ]
Volkmar KM, Hu Y, Steppuhn H (1998) Physiological responses of plants to salinity: a review. Can. J. Plant Sci. 78: 19-27. [ Links ]
Wyn-Jones RG (1981) Salt tolerance. En: Physiological processes limiting plant productivity. C.B. Johnson (ed) Butterworths, London. 271 pp. [ Links ]














