Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.26 no.2 Villahermosa ago. 2010
Artículos
Efectos de rizosfera, microorganismos y fertilización en la biorremediación y fitorremediación de suelos con petróleos crudo nuevo e intemperizado
Effects of rizosphere, microorganisms and fertilization on bioremediation and phytoremediation of soils with new and weathered crude oil
E Maldonado–Chávez1, MC Rivera–Cruz1* , F Izquierdo–Reyes1, DJ Palma–López1
1Programa en Producción Agroalimentaria en el Trópico, Campus Tabasco. Colegio de Postgraduados Periférico Carlos A. Molina s/n km 3.5 CP 86570, H. Cárdenas, Tabasco. México. (EMC)(MCRC)(FIR)(DJPL) * Correo electrónico: mariari@colpos.mx
Artículo recibido: 26 de septiembre de 2008
Aceptado: 15 de junio de 2010
RESUMEN
Se evaluó el potencial de un consorcio microbiano constituido por bacterias (Pseudomonas sp y Serratia marcescens y hongos (Aspergillus sp y Trichoderma sp) y de fertilizante inorgánico incorporados al suelo en la biorremediación, y el potencial del pasto egipto (Brachiaria mutica) y de la leguminosa guaje (Leucaena leucocephala) en la fitorremediación de un suelo contaminado con petróleos nuevo (PN) recién incorporado al suelo y el intemperizado (PI) procedente de derrames crónicos de petróleo desde hace 25 años. El experimento fue factorial 4x3x2x2, estos fueron petróleo [150 mg kg–1 de hidrocarburos totales del petróleo (HTP) de origen biogénico, 50 000 y 78 000 mg kg–1 HTP de PN y 79 457 mg kg–1 HTP de PI], planta (sin planta, con planta de pasto egipto o de guaje), consorcio microbiano (sin inóculo y con inóculo, 5 mL de inóculo bacteriano con 250x106 UFC mL–1 + 40x105 UFC de hongos mL–1) y fertilizante (sin fertilizante y con fertilizante, dosis 160–50–00). Se evaluaron 48 tratamientos. Se cuantificaron al inicio (día 1) y al final (día 158) la degradación de los HTP y las poblaciones de bacterias y hongos. La medición de bacterias y hongos se realizó con el método de recuento en cajas Petri. La extracción de HTP se efectuó con diclorometano, procedimiento EPA 418.1 y la cuantificación por gravimetría según la NMX–AA–134–SCFI–2006. La interacción de rizósfera, consorcio microbiano y el fertilizante originaron efectos positivos significativos (Tukey p < 0.05), promovieron la degradación del PN y el PI. La mayor degradación a los 158 d fue 47% en el suelo con 50 000 mg kg–1 de PN y la menor en suelos con 78 000 y 79 457 mg kg–1 de PN y PI, respectivamente. La leguminosa guaje inoculada con consorcio y fertilizante tiene un amplio potencial de uso en la fitorremediación de un suelo con 50 000 mg kg–1 de HTP de PN, se promovió la degradación de HTP hasta un 81 %, 9% más respecto a la rizósfera del pasto Egipto, pero en suelo con PI el mejor fue en pasto Egipto con un 44% de degradación.
Palabras clave: Aspergillus, Brachiaria, Leucaena, Pseudomonas, Serratia, Trichoderma, consorcio microbiano, degradación, fertilizante, hidrocarburos totales del petróleo.
ABSTRACT
The bioremediation potential for a consortium including two bacteria (Pseudomonas sp and Serratia marcescens), two fungi (Aspergillus sp and Trichoderma sp) and inorganic fertiliser incorporated into the soil, and the phytoremediation potential of the Para grass (Brachiaria mutica) and the leguminous "guaje" (Leucaena leucocephala), were evaluated both in a soil polluted with fresh crude oil (PN) recently incorporated into the soil, and in a soil with 25–year old weathered crude oil (PI) from chronic oil spills. The bioassay was 4x3x2x2 factorial: with the oil [150 mg kg–1 total oil hydrocarbons (HTP) from biogenic sources, 50 000 and 78 000 mg kg–1 HTP of PN and 79 457 mg kg–1 HTP of PI], the plant (without plant, with Para grass or with guaje), the microbial consortium (without and with inoculum, 5 mL of bacterial inoculum with 250x106 CFU mL–1 + 40x105 fungal CFU mL–1) and the fertiliser (without and with fertiliser, 160–50–00 dose). Forty eight treatments were evaluated. Quantified at the start (day 1) and end (day 158) were the degradation of the HTP, and the bacteria and fungi populations. The measurement of bacteria and fungi followed the counting method in Petri dishes. HTP extraction was carried out with dichloromethane according to the EPA 418.1 method, and quantification by gravimetry followed the NMX–AA–134–SCFI–2006. The interaction among the rhizosphere, the fertiliser and the microbial consortium generated significant positive effects (Tukey p < 0.05) and promoted new oil degradation and weathering. The greatest degradation after 158 days was of 47% in the soil with 50 000 mg kg–1 of PN, and the lowest was that in soils with 78 000 and 79 457 mg kg–1 of PN and PI respectively. The leguminous guaje inoculated with the consortium and fertiliser has a great potential for use in phytoremediation of soils with 50 000 mg kg–1 of HTP and PN. The degradation of HTP was promoted up to 81%, 9% more than in the Egypt grass rhizosphere. In soils with PI, the Egypt grass was the best with a degradation of 44%.
Key words: Aspergillus, Brachiaria, Leucaena, Pseudomonas, Serratia, Trichoderma, microbial consortium, degradation, fertiliser, total oil hydrocarbons.
INTRODUCCIÓN
El consumo mundial de energía en la actualidad se basa en diferentes fuentes. Las opciones incluyen combustibles sólidos como el carbón, biomasa vegetal, petróleo, gas natural, hidroeléctrica, solar, geotérmica, eólica y nuclear. A pesar de los elevados precios del petróleo y la dependencia asociada con el suministro energético, el mayor consumo de energía son recursos no renovables como el petróleo. Cifras del Departamento de Energía del Reino Unido (Anónimo 2007) muestran que el petróleo representó cerca del 40% de la energía utilizada durante 1990 a 2006, las tendencias se mantendrán para 2010.
La industria petrolera de México tiene reservas probadas para 9.6 años a la actual velocidad de extracción (Anónimo 2007). La producción de petróleo en México disminuyó durante 1996 a 2006. La Región Sur de la paraestatal Petróleos Mexicanos, en la cual se encuentra el estado de Tabasco, aportó 630 000 barriles diarios en 1996 y disminuyó a 491 000 barriles en 2006, decreció 22 % en 10 años (PEMEX 2007). La industria petrolera en México es una fuente importante de contaminación del suelo. Las actividades de perforación, extracción, conducción y transformación del petróleo en zonas petroleras, han originado la contaminación del suelo y el agua ocasionada por derrames, fugas, filtraciones, lodos y recortes de perforación desde hace más de 40 años (Trujillo et al. 1995; Adams et al. 1999). Al respecto Fent (2004) señala que los sitios contaminados plantean peligros significativos para el medio ambiente, para los ecosistemas terrestres y acuáticos. Los suelos con una contaminación extrema comparten características críticas como son severa toxicidad aguda y/o crónica y prolongada persistencia ambiental.
Esta situación existe en la región occidental del estado de Tabasco, en donde se han reportado instalaciones petroleras de extracción y procesamiento que ocasionan frecuentes derrames, localizados en suelos inundables cultivados con praderas introducidas, nativas, algunos cultivos y vegetación natural (Trujillo et al. 1995; Zavala et al. 2002). Las cifras de la PROFEPA (Anónimo 2008) mencionan que de 1993 a 2003 sucedieron en Tabasco 1044 fugas o derrames de petróleo, que representó el 18.9 % del total nacional. Esta misma fuente reporta que en 2005 ocurrieron 62 derrames de petróleo en Tabasco, los principales contaminantes fueron hidrocarburos, combustóleo y aceites. La superficie afectada fueron 1 340.2 ha.
Los contenidos de petróleo en el suelo son variables, se han reportado concentraciones de 100 000 (Ortiz 1999) y 323 000 mg kg–1 de hidrocarburos totales del petróleo (Rivera–Cruz et al. 2002). Estas concentraciones rebasan los límites máximos permisibles de suelos contaminados especificados en la normatividad ambiental mexicana (DOF 2005). Las tecnologías de remediación más utilizadas son el lavado de suelos, la oxidación química, la separación física y los métodos biológicos como el composteo y la biolabranza. La mayor parte de los tratamientos de remediación se realizan in situ y en menor medida ex situ (Volke & Velasco 2002). Las tecnologías de biorremediación ofrecen la ventaja de usar procesos naturales que se basan en la capacidad de los microorganismos para la biodegradación del petróleo mediante procesos metabólicos o cometabólicos. Estos procesos pueden transformar los compuestos tóxicos en productos secundarios de menor toxicidad, o incluso promueven la mineralización completa de los hidrocarburos totales del petróleo a dióxido de carbono y agua (Alexander 1999; Maier et al. 2000).
La fitorremediación se sustenta en el uso de plantas superiores y de microorganismos que viven en la zona radical de las plantas, lugar donde se desarrolla una actividad microbiológica intensa entre la microflora de la rizosfera y las plantas verdes. Se asocia con enmiendas y prácticas agronómicas del suelo para eliminar, contener o disminuir la toxicidad de los contaminantes ambientales (Schnoor et al. 1995; Cunningham et al. 1996; Hutchinson et al. 2001a).
En los sistemas de fitorremediación se han utilizado diversas especies de pastos efectivos en la fitorremediación de suelos con hidrocarburos como son Festuca arundinacea (Parrish et al. 2004; Ho et al. 2007), los pastos Echinochloa polystachya (Rivera–Cruz et al. 2004), en maíz Zea mays L. (Quiñones–Aguilar et al. 2003) y en la leguminosa Galega orientalis (Lindstróm et al. 2003).
La aplicación de la biorremediación y fitorremediación está limitada entre otros factores por las características físicas y químicas del suelo, la toxicidad ocasionada por la concentración y grado de intemperismo del petróleo. Otros factores son la disponibilidad de nutrimentos, la presencia y permanencia en el tiempo de poblaciones de microorganismos degradantes de hidrocarburos (Schnoor et al. 1995; Hutchinson et al. 2001a).
Las dos principales estrategias biológicas que se utilizan para aumentar la eficacia microbiológica de la biorremediación en experimentos de campo son la bioestimulación y la bioaumentación. La primera se sustenta en la estimulación de la población autóctona, por lo común con la adición de nutrimentos limitantes (nitrógeno y fósforo), esta práctica se ha aplicado con éxito en derrames de petróleo en ambiente marino y en suelos contaminados con hidrocarburos policíclicos aromático (Riser–Roberts 1998). La bioestimulación se basa en la adición controlada de microorganismos específicos al ambiente, los microorganismos introducidos aumentan pero no substituyen a las poblaciones residentes. En algunos casos se lleva a cabo la combinación de la bioaumentación y la bioestimulación en suelos contaminados con petróleo (Bennett et al. 2001). En la bioaumentación es importante el uso de especies microbianas o consorcios de bacterias y hongos autóctonos que han logrado cambios de adaptación, enzimáticos y mecanismos cometabólicos naturales que les permiten utilizar al petróleo como fuente de carbono y energía (Cerniglia & Sutherland 2001). En el presente estudio el consorcio microbiano, la fertilización inorgánica, la rizósfera del pasto egipto Brachiaria mutica (Forsskal) Staff., y de la leguminosa guaje Leucaena leucocephala Lam fueron evaluados en sus interacciones para realizar procesos de biorremediación y fitorremediación de suelos con petróleo crudo nuevo e intemperizado.
MATERIALES Y MÉTODOS
Selección de suelo, colecta, preparación y propiedades físico–químicas
Se seleccionó dos Gleysoles, uno testigo y el otro contaminado con petróleo, utilizados en estudios anteriores (Rivera–Cruz et al. 2005). El suelo testigo contiene 150 mg kg–1 de HTP de origen biogénico, se localiza al noroeste de la Ciudad de H. Cárdenas, Tabasco, en las coordenadas 17° 59' 50"latitud Norte y 93° 24' 59"longitud Oeste. El segundo es un suelo contaminado que recibió durante los últimos 25 años derrames crónicos de petróleo, contiene 79 457 mg kg–1 de HTP, base seca, se localiza en el ejido José Narciso Rovirosa en el área aledaña sur del Complejo Procesador de Gas La Venta, en las coordenadas 18° 04' 54" latitud Norte y 94° 02' 31"longitud Oeste. Se colectó suelo del horizonte superficial (0–25 cm), se secó a la sombra a temperatura ambiente, se fragmentó y se tamizó con una malla metálica de 0.5 cm de abertura (OECD 2006). De acuerdo a los criterios que establece la Norma Oficial Mexicana NOM–021–RECNAT–2000 (DOF 2002), el suelo testigo es arcilloso, moderadamente ácido, contenido medio de materia orgánica, concentración alta de P y media de K y alta capacidad de intercambio catiónico (CIC). El suelo contaminado es arcilloso, fuertemente ácido, materia orgánica muy alta, contenido bajo de P, medio de K y alta CIC.
Petróleo y contenedores
Se utilizaron dos tipos de petróleo. Uno es el petróleo crudo recién extraído del yacimiento y almacenado en la batería cinco del campo petrolero Cinco Presidentes. El segundo petróleo es el intemperizado contenido en suelo contaminado, procede de la ruptura de oleoductos y que ha estado expuesto a las condiciones ambientales durante los últimos 25 años. Los contenedores que se utilizan son frascos de vidrio color ámbar limpios y desinfectados, con capacidad de 2 L, de 13 cm de diámetro y 17 cm de altura.
Diseño experimental y tratamientos
Se estableció un experimento de tipo factorial 4x3x2x2, con un total de 48 tratamientos, alojados en un diseño completamente al azar con tres repeticiones y un total de 144 unidades experimentales. Los factores en estudio fueron: 1) cuatro niveles de petróleo [150 mg kg–1 HTP de origen biogénico; 50 000 y 78 000 mg kg–1 HTP de petróleo crudo nuevo y 79 457 mg kg–1 HTP de petróleo crudo intemperizado], 2) tres niveles de planta [sin planta, con pasto egipto Brachiaria mutica (Forsskal) Staff. y con la leguminosa guaje Leucaena leucocephala Lam.], 3) dos niveles de fertilizante (sin fertilizante y con fertilizante). Se aplicó la dosis 160 N–50 P–00N a ambas plantas. Esta dosis según Meléndez (2000) satisface la demanda nutrimental de pastos tropicales y en cuatro meses alcanza su máximo en altura y contenidos de proteínas. 4) dos niveles de consorcio microbiano [sin consorcio y con consorcio (dos bacterias, Pseudomonas sp y Serratia marcescens y dos hongos, Aspergillus sp y Trichoderma sp)]. Estos microorganismos se aislaron durante el año 2002 de plantas que crecen en forma natural en el sitio contaminado. Las bacterias y hongos son heterótrofos y se aislaron de las rizosferas de plantas tolerantes a petróleo localizadas en el suelo con derrame crónico. Pseudomonas sp se aisló de la leguminosa zarza (Mimosa pigra), S. marcescens del espadaño (Typha sp), Aspergillus sp del pasto alemán (Echinochloa polystachya) y Trichoderma sp de la planta hojilla (Thalia sp). La biorremediación agrupó 16 tratamientos de suelo sin planta (sin rizosfera) y la fitorremediación se estudió en 16 tratamientos de suelo con planta (rizosfera) del pasto egipto y en 16 tratamientos con planta de guaje. Se evaluaron 48 tratamientos obtenidos de la combinación de cada uno de los niveles de los cuatro factores en estudio. La unidad experimental consistió de un frasco de vidrio con suelo, petróleo, planta, consorcio, fertilizante o suelo sin planta, sin petróleo, sin consorcio y sin fertilizante y sus respectivas combinaciones.
Características del consorcio microbiano y la fertilización
El consorcio microbiano se integró con las dos bacterias y los dos hongos. Estos microorganismos se evaluaron in vitro en dos estudios realizados durante 2003 (Córdova 2005; Hernández 2005) que midieron la capacidad para la degradación del petróleo en el suelo. La elaboración del inóculo se realizó por separado para cada bacteria y hongo, después se resuspendieron en medio de cultivo líquido (caldo nutritivo), se incubaron para su multiplicación a una temperatura de 28 °C en agitador mecánico a 180 rpm durante un período de 48 h para bacterias y 168 h para hongos. Se utilizó la dosis de fertilización 160–50–00, la fuente de nitrógeno fue urea (46% de N) y de fósforo el superfosfato triple de calcio (46 % de P). El fertilizante se fraccionó en dos aplicaciones para mejorar la bioestimulación, la primera al inicio del experimento (día 1) y la segunda a la mitad del mismo (día 78).
Establecimiento del experimento y almácigo de plántulas
El experimento se desarrollo en invernadero durante 158 d. Se realizaron tres actividades secuenciales para su establecimiento. 1) Mezcla suelo–petróleo. Se preparó una mezcla suelo–petróleo nuevo con 50 000 y 78 000 mg kg–1 HTP, se pesó 1 605 g de suelo seco sin contaminación y se pesaron 80.25 g y 125.2 g de petróleo crudo, después el petróleo se adicionó en el suelo y se revolvió con una varilla de vidrio hasta formar una mezcla homogénea. El suelo testigo, el suelo contaminado con petróleo nuevo y el suelo contaminado con petróleo intemperizado se introdujeron, por separado, en los contenedores. La humedad del suelo se mantuvo a 28 % durante los 158 d. 2) Almácigo y transplante. Se establecieron almácigos de ambas especies vegetales en recipientes cónicos de plástico. El transplante de las plántulas de pasto egipto y de la leguminosa guaje de 50 y 38 d después de sembradas en almácigo, se realizó 24 h posterior al riego del suelo. 3) Inoculación del consorcio microbiano y fertilización inorgánica. Se utilizó 5 mL del consorcio de bacterias y 5 mL del consorcio de hongos, cada consorcio se inoculó en el suelo aledaño al momento del transplante. Las poblaciones en la primera inoculación fueron 250x106 UFC mL–1 de inóculo de bacterias y 40x105 UFC mL–1 de inóculo de hongos. La inoculación se repitió 78 d después de establecido el experimento. Al momento del transplante se realizó la fertilización del suelo, en cada contenedor se adicionó 0.128 g de urea y 0.09 g de superfosfato triple de calcio, disueltos en forma separada en 720 ml de agua, se aplicó 10 ml por contenedor. Al día 78 la dosis de urea se incrementó a un gramo por maceta aplicada en solución de agua.
Muestreo de unidades experimentales
Se colectaron muestras de cada unidad experimental al inicio (día 1) y al final del experimento (día 158), las cuales se mantuvieron por 15 días en refrigeraron a 4 °C. A estas muestras se les determinó el contenido de los HTP ( %), de humedad ( %) y la densidad de bacterias y hongos heterótrofos que integran el consorcio microbiano (UFC g–1 suelo seco).
Extracción y cuantificación de los hidrocarburos totales del petróleo
La extracción de los hidrocarburos del petróleo (HTP) se efectuó con CCl4 al 99.5% de pureza (Merck para análisis), en equipo soxhlet, según método EPA 418.1 modificado para suelo y sedimentos (EPA 1986). La determinación cuantitativa por gravimetría adaptado del procedimiento establecido en la NMX–AA–134–SCFI–2006 (Consuegra, 2006).
Consorcio microbiano
El consorcio microbiano se determinó con el tamaño de la población de bacterias y hongos heterótrofos por cada gramo seco de suelo (UFC g–1). Se aplicó el método de cuenta viable por dilución seriada por siembra en superficie (Madigan et al. 2004), los medios de cultivos para bacterias (agar nutriente) y hongos (papa dextrosa agar con rosa de bengala al 2 % de fenol). El conteo se realizó al día 1 y 158 después de la inoculación. Al primer día fue con el objetivo de verificar el establecimiento del consorcio en suelo y con medias de poblaciones de 45x105 ± 304 y 26x104 ± 259 UFC g–1 s.s de bacterias y hongos respectivamente.
Análisis estadístico
El análisis estadístico de la varianza y la separación de medias de Tukey para la variable porcentaje de degradación de los hidrocarburos totales del petróleo (PDHTP), se realizó mediante el procedimiento GLM del paquete SAS (Statystical Analysis System, por su siglas en inglés) para Windows versión 8.2 (SAS 2001). El PDHTP se determinó con la diferencias entre el valor en por ciento del contenido de HTP al día 1 respecto al día 158 en base seca.
RESULTADOS
Efecto de los factores petróleo, planta, consorcio y fertilizante en la degradación del petróleo en suelo
El análisis de varianza del PDHTP por efecto de los factores petróleo (A), planta (P), consorcio microbiano (C) y fertilizante (F) mostró diferencias estadísticas altamente significativas (p < 0.01) (Tabla 1). El factor petróleo en suelo con 50 000 mg kg–1 HTP de petróleo crudo nuevo sucedió la mayor biodegradación con 47%. El menor PBHTP fue 23 %, se determinó en el nivel se 78 000 mg kg–1 HTP de petróleo crudo nuevo y en 79 457 mg kg–1 HTP de petróleo crudo intemperizado con 27 %, estadísticamente estos dos porcentajes son similares (p > 0.01) (Tabla 2).
El nivel del factor planta con menor porcentaje de degradación de los HTP fue 16%, se determinó en suelo sin planta, mientras que en suelo con planta la biodegradación del petróleo fue 37 % por efecto rizosférico del pasto egipto y 20 % en suelo con la leguminosa guaje, respectivamente (p < 0. 01 ) (Tabla 2). La bioaumentación en suelo contaminado mediante la inoculación del consorcio de bacterias y hongos contribuyó en el 29% de la disipación del petróleo y en suelo sin consorcio fue 20% (p < 0.01). La bioestimulación mediante la aplicación de fertilizantes químicos comerciales (N y P) indican que hubo un efecto significativo sobre la biodegradación, ya que en suelo con fertilizante se encontró 27 % en comparación con el 22% en suelo sin fertilización (p < 0.05) (Tabla 2).
Combinaciones tipo de planta, consorcio microbiano y fertilizante en la degradación de diferentes niveles de petróleos crudo nuevo e intemperizado
El análisis de varianza para PDHTP a los 158 demuestra diferencias altamente significativas en 11 interacciones de 15 , de primer, segundo y tercer orden, considerando los cuatro factores; factor petróleo con cuatro niveles, factor planta con tres niveles, factor consorcio microbiano con dos niveles y factor fertilizante con dos niveles entablecidas en esta investigación, esto permite deducir que la mayoría de los factores con sus respectivos niveles interactúan y afectan la degradación de hidrocarburos totales del petróleo en el suelo (Tabla 1 ).
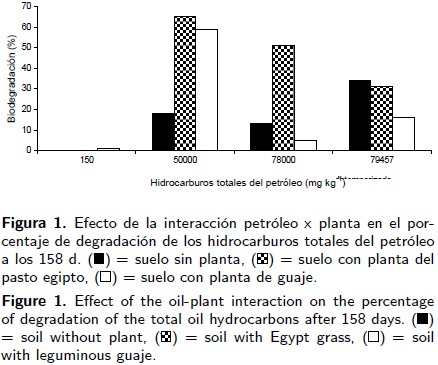
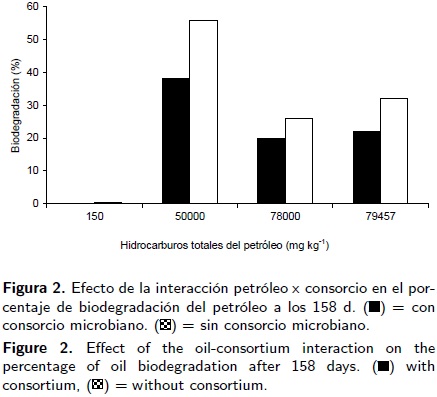
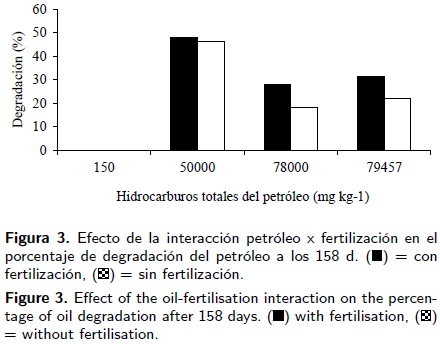
La interacción petróleo–planta (Figura 1) muestra que en suelo contaminado con 50 000 mg kg–1 de HTP petróleo crudo nuevo ocurrió la mayor biodegradación con 65 % en el suelo rizosférico del pasto egipto y 59% en el suelo rizosférico de la leguminosa guaje. La menor biodegradación (5%) se encontró en suelo rizosférico de guaje en 78 000 mg kg–1 HTP de petróleo crudo nuevo. La mayor biodegradación del petróleo crudo intemperizado con 79 457 mg kg–1 de HTP fue 34% ocurrió en suelo sin planta y fue igual en términos estadísticos que 31 % de degradación en la rizosfera del pasto egipto. En la combinación petróleo–consorcio se observó que el consorcio microbiano inoculado en suelo con 50 000 mg kg–1 HTP originó el 56 % de la biodegradación (Figura 2) en un periodo de 158 d, en cambio en suelo sin consorcio la degradación fue 38%. La disipación del petróleo no excedió 32% en suelo hasta con 78 000 de petróleo nuevo igualmente para el petróleo intemperizado. El efecto del fertilizante en la biodegradación del petróleo también fue mayor en suelo con 50 000 mg kg–1 de petróleo con 48% de degradación (Figura 3), además la tendencia fue la disminución de la degradación en suelos con mayores concentraciones de petróleos nuevo e intemperizado, bioestimulado con fertilizante o sin fertilizante.
En la relación planta–consorcio (PxC) la mayor degradación del petróleo se evaluó en suelo con pasto egipto y consorcio microbiano con 40.65 % (Tabla 3). Esta cifra fue 2.7 veces mayor al obtenido en suelo sin planta y sin consorcio. En suelo rizosférico de la leguminosa guaje con bioaumentación alcanzó un 28.12% de biodegradación, cantidad que fue 2.3 veces mayor a la obtenida en suelo sin planta y sin consorcio microbiano (p < 0.01) (Tabla 3). En la interacción planta–fertilización (PxF) el porcentaje de degradación no tuvo diferencias estadísticas significativas (p > 0.05), la mayor degradación del petróleo (40%) ocurrió en suelo con pasto egipto con fertilización, cantidad que fue 2.8 veces más grande que la obtenida en suelo sin planta y sin fertilización (Tabla 3). El porcentaje de degradación menor (14%) se evaluó en suelo no rizosférico y sin fertilización (Tabla 3).
No hubo diferencias estadísticas significativas (p > 0.01) en la combinación consorcio x fertilización (CxF) sobre el porcentaje de degradación del petróleo (Tabla 1). La Tabla 3 muestra que en suelo fertilizado y con consorcio microbiano, el PDHTP fue 31 %, que representa 1.8 veces mayor degradación que la determinada en suelo sin fertilización y sin consorcio microbiano. A su vez, en suelo sin consorcio y con fertilización la degradación fue del 22 %, mientras que en suelo con consorcio sin fertilización la degradación fue 26%.
Relaciones petróleo, planta, consorcio microbiano y fertilizante en la biorremediación y fitorremediación en diferentes niveles de petróleos crudos nuevo e intemperizado en el suelo
El análisis de la interacción petróleo–planta–consorcio (AxPxC) mostró diferencias estadísticas altamente significativas en el PBHTP a los 158 d evaluado en suelo sin planta (biorremediación) y con planta (fitorremediación) (p < 0.01) (Tabla 1). La degradación según la concentración de petróleo en los tratamientos con suelo, planta y consorcio, mostraron diferencias respecto al PDHTP en suelo sin planta y con el consorcio. En las tres concentraciones de hidrocarburos en el suelo se observó (Figura 4b) que la asociación planta (leguminosa guaje) más consorcio microbiano en 50 000 mg kg–1 HTP estimuló el mayor porcentaje de degradación (78%) y en segundo lugar el pasto egipto con consorcio favoreció el 72 % de la degradación en esta misma concentración de petróleo. El pasto egipto con consorcio microbiano promovió la mayor degradación (62%) en suelo con 78 000 mg kg–1 HTP; esta misma planta en suelo con 79 457 mg kg–1 de HTP de petróleo intemperizado pero sin consorcio degradó el 32 % del petróleo (Figura 4b). Así mismo se identificó (Figura 4a) que la degradación del petróleo fue menor en el suelo sin planta, sin embargo cuando se inoculó el consorcio microbiano en suelo con 50 000 y 78 000 mg kg–1 de HTP, esta fue de 19.5% y 15.7% respectivamente (Figura 4a).
El análisis de la interacción petróleo–planta–fertilización (AxPxF) no mostró diferencias significativas (Tabla 1) en el porcentaje de degradación de los hidrocarburos totales del petróleo (p > 0.05). Sin embargo, al determinar el efecto de la fertilización en suelo sin planta y con planta en los tres contenidos de HTP, indujo en cada uno de ellos mayor porcentaje de degradación respecto al tratamiento sin fertilización (Figura 5a,b). La mayor degradación según los contenidos de hidrocarburos en el suelo fue 66 % en suelo rizosferico del pasto egipto con 50 000 mg kg–1 de HTP y fertilizado (Figura 5b).
La fitorremediación en sistema rizosféricos del pasto egipto más fertilización tuvo el mayor porcentaje de degradación de los HTP con 65%, 58% y 35 % en la concentraciones 50 000 mg kg–1 y 78 000 mg kg–1 HTP de petróleo crudo nuevo y en 79 457 mg kg–1 HTP de petróleo crudo intemperizado (Figura 5b), respectivamente. Estas cantidades representan 4, 7.7 y 1.1 veces mayor degradación del petróleo que en suelo sin planta y con fertilización en los mismos niveles de petróleo. En la interacción planta–consorcio–fertilizante (PxCxD) hubo diferencias estadísticas altamente significativas (p < 0.01) en el porcentaje de degradación del petróleo (Tabla 1). La mayor degradación del petróleo (41 %) ocurrió en suelo con pasto egipto inoculado con el consorcio microbiano y con fertilizante, la menor disipación fue 11 %, se determinó en suelo rizosférico con la leguminosa guaje, sin inoculación y sin fertilización (Tabla 3).
De acuerdo con el análisis de varianza de la interacción petróleo–planta–consorcio–fertilizante (AxPxCxD) hubo diferencias estadísticas altamente significativas (p < 0.01) en el porcentaje de degradación de los HTP a los 158 d después de establecido el experimento (Tabla 1). En los niveles de 50 000 mg kg–1 HTP de petróleo crudo nuevo y 79 457 mg kg–1 HTP de petróleo intemperizado la biorremediación (suelo sin planta), la inoculación del consorcio microbiano y la fertilización promovió la mayor degradación del petróleo con 23% y 40%, respectivamente. Estas cifras representan incrementos de 26 % y 3 0 % respecto al suelo sin consorcio y sin fertilización (Tabla 4). La fitorremediación con pasto egipto promovió la mayor degradación. En suelo con 50 000 mg kg–1 de HTP nuevamente la adición del fertilizante y la inoculación del consorcio incrementó la descontaminación con 72 % y fue similar en suelo con consorcio pero sin fertilizante. La degradación fue un poco menor con 67 % por efecto del consorcio mas fertilizante en suelo con 78 000 mg kg–11 de petróleo nuevo(Tabla 4). Respecto a la capacidad de Leucaena leucocephala demostró mejor efecto en la descontaminación de 50 000 mg kg–1 de petróleo nuevo con 81 % de disipación por efecto conjunto del consorcio microbiano junto con el fertilizante. Destaca que 788 000 mg kg–1 (de petróleo nuevo inhibió severamente la descontaminación a pesar de la bioestimulación con fertilizante y de la bioaumentación con el inóculo microbiano, que fue hasta 40 veces menor comparado con la disminución de 50 000 mg kg–1 de petróleo nuevo. Los resultados de la degradación del petróleo intemperizado, 79 459 mg, si hubo efecto positivo de la planta de la leguminosa L. leucocephala y la adición del fertilizante y el inóculo microbiano, la mayor degradación fue 43% (Tabla 4).
DISCUSIÓN
Efecto de los factores petróleo, planta, consorcio y fertilizante en la degradación del petróleo en suelo
En el factor petróleo se observó que el PDHTP disminuyó al aumentar los contenidos de petróleo crudo nuevo en el suelo, la mayor degradación (47%) se localizó en 50 000 y la menor (23%) en 78 000 mg kg–1 HTP. Esta tendencia es probable que sea originada por la toxicidad inherente del petróleo que altera las condiciones de aeración del suelo, de modo que afecta el crecimiento de las plantas y del tamaño de las poblaciones mierobianas en rizosfera, que son los elementos más importantes en la degradación del petróleo en el suelo. El tamaño de población de bacterias y hongos localizados en suelo con 50 000 mg kg–1 HTP fueron 25x108 y 54x105 UFC g–1 suelo seco, respectivamente. Estas poblaciones pueden participar en la oxidación de moléculas de hidrocarburos a dióxido de carbono, agua y energía (Maier et al. 2000).
La presencia de la planta en suelo con petróleo promovió la degradación de los HTP en el suelo. Resultados de Anderson et al. (1993) demostraron que las plantas de trigo, caña de azúcar, trébol, arroz, maíz, chícharo, pastos, algodón, tabaco, lino y soya pueden ser utilizados en la fitorremediación de suelos contaminados por compuestos orgánicos como el petróleo y sus derivados. Datos de García (2005) destacan que la exposición de la planta de arroz Oriza sativa L. durante 120 d originó la degradación de 53 y 33 % de 60 000 mg kg–1 y 90 000 mg kg–1 HTP de petróleo crudo nuevo, respectivamente.
La mayor degradación de los HTP por efecto de la bioaumentación (inóculo microbiano) puede estar relacionado con las poblaciones grandes de bacterias y hongos (108 y 105 UFC g–1 suelo seco) contados el día 158 (datos no publicados), así como también a poblaciones de bacterias y hongos autóctonos aislados de suelo contaminado con 79 457 mg kg–1 de HTP de petróleo intemperizado. Estos microorganismos autóctonos demostraron capacidad de adaptación in vitro en estudios de biodegradación (Córdova 2005; Hernández 2005) previos al presente estudio. Otros estudios han identificado mayor degradación de las sustancias contaminantes en suelo mediante la inoculación de microorganismos nativos aislados del mismo suelo en tratamiento (MacNaugton et al. 1999).
El efecto positivo de la bioestimulación en la biodegradación del petróleo es atribuible a la presencia de N y P soluble. Resultados de Lin et al. (1999) identificaron que la incorporación en el suelo de macronutrimentos limitativos en forma soluble incrementó la velocidad de crecimiento de las poblaciones microbianas y la biodegradación del petróleo crudo en el suelo.
Combinaciones tipo de planta, consorcio microbiano y fertilizante en la degradación de diferentes niveles de petróleos crudo nuevo e intemperizado
La mayor biodegradación de los HTP por la presencia del pasto egipto y del consorcio microbiano se relaciona con el potencial que tienen los pastos en la degradación del petróleo en suelos contaminados debido al incremento de la actividad microbiana en la rizosfera de las plantas (Siciliano et al. 2003). En la relación petróleo–consorcio se observó que la inoculación del consorcio microbiano bacterias–hongos en el suelo contaminado favoreció la biodegradación del petróleo en comparación con el suelo sin inoculación microbiana.
Los resultados de la combinación planta–consorcio muestran que la bioaumentación favoreció la biodegradación del petróleo, tanto en suelo rizosférico (con pasto egipto o el guaje) como en suelo no rizosférico (sin planta), comparado con la biodegradación en suelo rizosférico y no rizosférico sin inoculación del consorcio microbiano. Según Anderson et al. (1993) se ha encontrado que el efecto general de la interacción planta–microorganismos causa incremento en la biomasa microbiana en la rizosfera, este efecto positivo puede estar relacionado con el aumento de la tasa metabólica de la degradación.
La bioestimulación con fertilizantes nitrogenados y fosfatados favorecen la biodegradación del petróleo. Datos de Atlas (1997) evidenciaron que la fitorremediación con fertilizante incrementó la biodegradación de los HTP pero no mostraron diferencias entre tratamientos. Resultados similares fueron encontrados por Hutchinson et al. (2001b) en condiciones de invernadero con los pastos bermuda Cynodon dactylon y Festuca arundinacea, suelo sin planta y fertilizantes inorgánicos (N y P) en suelo contaminado con 48 800 mg kg–1 HTP. Los resultados que obtuvieron después de seis meses fue la disipación de 49% del petróleo pero no hubo diferencias significativas entre tratamientos.
En la relación consorcio–fertilizante se identificó efecto positivo en la degradación del petróleo pero no fue significativo. Con estos resultados se infiere que la inoculación del consorcio microbiano favoreció la biodegradación del petróleo, el cual se incrementó con la aplicación del fertilizante al suelo.
Relaciones petróleo, planta, consorcio microbiano y fertilizante en la biorremediación y fitorremediación en diferentes niveles de petróleos crudos nuevo e intemperizado en el suelo
En la interacción petróleo–planta–consorcio los resultados obtenidos en la degradación de petróleo en la rizosfera del pasto egipto (B. mutica) coincide las tendencias encontradas en la degradación del petróleo en la rizosfera del pasto alemán (Echinochloa polystachya) según resultados de Rivera–Cruz et al. (2004). Éstos autores reportan que en la interacción de la rizosfera del pasto alemán con inóculo de bacterias y hongos promovieron mayor capacidad de la degradación 50 000 mg kg–1 HTP, fue 62% y 48% de 100,000 mg kg–1 HTP. Estos resultados muestran la importancia de la asociación planta con el consorcio microbiano en el proceso de descontaminación de suelos contaminados con petróleo. Hutchinson et al. (2001a) mencionan que la fitorremediación aumenta la tasa de transpiración, mejora el flujo de agua en el perfil del suelo y por lo tanto favorece la aireación dentro del suelo. Debido a que las raíces penetran a través del suelo y rompen los agregados del suelo contaminado, ésto favorece la exposición de una superficie mayor para la degradación microbiana.
En las interacciones petróleo–planta–fertilización y petróleo–consorcio–fertilización los resultados obtenidos indican efectos positivos en la aplicación y asociación de estos factores y sus niveles, que en forma conjunta promovieron la degradación del petróleo, sin embargo no hubo diferencias en el PDHTP (p ± 0.05). Esto puede estar relacionado con la dosis y frecuencia de aplicación de los fertilizantes. Al respecto Hutchinson et al. (2001a) mencionan que la fitorremediación con la planta Festuca arundinacea con aplicación de riego y fertilización diaria tuvo efecto significativo en la biodegradación, que alcanzó el 35 % HTP de un suelo contaminado con 35,000 mg kg–1 HTP de petróleo intemperizado; no obstante, encontraron efecto significativo en la biodegradación por la planta, cuando la fertilización se aplicó cada semana.
Los resultados obtenidos en la interacción planta–consorcio–fertilización y petróleo–planta–consorcio–fertilizante permiten inferir que en suelo con 50 000 mg kg–1 HTP, la aplicación conjunta del consorcio microbiano y la fertilización estimularon la degradación del petróleo. La fitorremediación con pasto egipto o la planta de la leguminosa guaje, con inóculo y con fertilización originó hasta 81 % de la disipación del petróleo, 9% mayor respecto al pasto egipto; en cambio la biorremediación sólo promovió el 23 % de la disipación del petróleo. Según Hutchinson et al. (2001a) la degradación de los compuestos orgánicos del petróleo es mayor en presencia de las raíces de las plantas porque el metabolismo y cometabolismo de los contaminantes se mejora en la zona de la rizosfera. La rizosfera de las plantas constituye una zona de gran actividad microbiológica con una compleja interacción metabólica entre la microflora de la rizosfera y las plantas verdes (Hinsinger 1998). Las plantas pueden liberar exudados al ambiente del suelo, que favorecen un mayor crecimiento microbiano (Schnoor et al. 1995) y por lo mismo una mayor degradación de las sustancias orgánicas tóxicas.
En suelo con 79 457 mg kg–1 HTP de petróleo intemperizado los resultados obtenidos en la degradación del petróleo fueron 40 % por efecto de la biorremediación y un máximo de 44% por la fitorremediación con pasto egipto. Hutchinson et al. (2001a) obtuvieron resultados similares en la fitorremediación en suelo contaminado con lodos con más de 35 000 mg kg–1 HTP de petróleo intemperizado. Estos autores observaron después de siete meses mayor disipación de los contaminantes en suelo con planta con respecto al suelo sin planta. La reducción media de los HTP fue 47% en suelo con planta y 30 % en suelo sin planta. En otro estudio (Hutchinson et al. 2001a) de fitorremediación con lodos contaminados con 48 800 mg kg–1 HTP de petróleo intemperizado se identificó que después de 12 meses la biodegradación en suelo con planta fue mayor que la determinada en suelo sin planta. Estos resultados pueden estar relacionados con la preparación y manejo del suelo intemperizado (secado, tamizado y rehumedecimiento), que favoreció la exposición de nuevas áreas en los lodos que se saturaron de aire, lo cual estimuló la mayor biodegradación (Hutchinson et al. 2001a).
La fitorremediación en el sistema rizosférico del pasto egipto o con la leguminosa guaje, la inoculación del consorcio de bacterias–hongos y la fertilización inorgánica tuvieron sinergia positiva y significativa que promovió mayor biodegradación del petróleo. Asimismo hubo respuesta positiva en los tamaños de las poblaciones de bacterias y hongos en suelo contaminado, con diferentes concentraciones de petróleo crudo nuevo e intemperizado, respecto al sistema de biorremediación en suelo sin planta, sin inóculo y sin fertilización. La bioaumentación mediante el inóculo del consorcio de bacterias–hongos y la bioestimulación con fertilizantes nitrogenados y fosfatados, incrementaron la biodegradación del petróleo en la fitorremediación y biorremediación en suelo contaminado con 50 000 y 78 000 mg kg–1 HTP de petróleo crudo nuevo y en 79 457 mg kg–1 HTP de petróleo crudo intemperizado.
En la concentración de 50 000 mg kg–1 HTP de petróleo crudo nuevo se encontraron los mejores tratamientos en la degradación de los hidrocarburos totales del petróleo con 81% y 75% en suelo rizosférico con la leguminosa de guaje inoculado con el consorcio de bacterias con fertilización y sin fertilización, respectivamente. En suelo rizosférico del pasto egipto la mayor degradación del petróleo fue 72 %, sucedió en los tratamientos con inóculo del consorcio microbiano más fertilizante y el segundo con inóculo microbiano sin fertilización. En suelo no rizosférico la mayor degradación del petróleo fue 40 %, en el tratamiento con inóculo del consorcio microbiano y con fertilizante.
El sistema rizosférico del pasto egipto con inóculo microbiano y con fertilización favoreció la degradación de los hidrocarburos totales del petróleo en suelo con 78 000 mg kg–1 HTP de petróleo crudo nuevo respecto al sistema rizosférico con la leguminosa guaje o suelo no rizosférico. El pasto egipto tiene un amplio potencial de uso en la fitorremediación de Gleysoles contaminados con petróleos crudos nuevo e intemperizado en Tabasco. Este pasto es una especie vegetal más tolerante a los efectos fitotóxicos de suelo con petróleo que la leguminosa guaje. El pasto egipto tiene un sistema radical fibroso y extenso que estimuló el crecimiento de las poblaciones del consorcio de bacterias–hongos, favoreció la biodegradación de los hidrocarburos totales del petróleo en suelo contaminado con 50 000 mg kg–1 y 78 000 mg kg–1 HTP de petróleo crudo nuevo y en suelo con 79 457 mg kg–1 HTP de petróleo crudo intemperizado.
LITERATURA CITADA
Adams SRH, Domínguez RVI, García HL (1999) Potencial de la biorremediación de suelo y agua impactados por petróleo en el trópico mexicano. Terra 17: 159–174. [ Links ]
Alexander M (1999) Biodegradation and Bioremediation. 2nd ed Academic Press San Diego CA, USA. 453 pp. [ Links ]
Anderson TA, Guthrie EA, Walton BT (1993) Bioremediation in the Rhizosphere. Plant roots and associated microbes clean contaminated soil. Environ. Sci. Technol. 27: 2630–2636. [ Links ]
Atlas RM (1997) Bioestimulación para mejorar la biorrecuperación microbiana. In: Levin M, Gealt MA (eds). Biotratamiento de residuos tóxicos y peligrosos. Selección, estimación, modificación de microorganismos y aplicaciones. Tejero IM, Amieva VJ (trads) McGraw–Hill/Interamericana de España. Madrid, España. 338 pp. [ Links ]
Bennett JW, Connick WJJr, Daigle D, Wunch K (2001) Formulation for in situ bioremediation. In: Gadd GM (ed) Fungi in Bioremediation. British Mycological Society. Cambrige University Press. Cambridge, U.K. 481 pp. [ Links ]
Cerniglia CE, Sutherland BJ (2001): Bioremediation of polycyclic aromatic hydrocarbons by ligninolytic and no–ligninolytic fungi. En: Gadd GM (ed) Fungi in bioremediation. British Mycological Society. Cambrige University Press. Cambridge, U.K. 481 pp. [ Links ]
Córdova BG (2005) Estudio de adaptación y selección de bacterias en la biorremediación de suelos contaminados con hidrocarburos derivados del petróleo crudo. Tesis Licenciatura en Biología. Facultad de Ciencias Biológicas y Agropecuarias Zona Orizaba–Córdoba. Universidad Veracruzana. Córdova, Veracruz. 90 pp. [ Links ]
Consuegra GRC (2006) NMX–AA–134–SCFI–2006. Suelo – hidrocarburos fracción pesada por extracción y gravimétrico – método de prueba. Dirección de Normalización. SEMARNAT–México. 27 pp. [ Links ]
Cunningham SD, Anderson TA, Schwab PA, Hsu FC (1996) Phytoremediation of soils contaminated with organic pollutants. Adv. Agron. 56: 55–114. [ Links ]
DOF (2002) NOM–021–RECNAT–2000 Especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios de muestreo y análisis. Diario Oficial de la Federación. Martes 31 diciembre del 2002. 75 pp. [ Links ]
DOF (2005) NOM–138–SEMARNAT/SS–2003. Límites máximos permisibles de hidrocarburos en suelos y las especificaciones para su caracterización y remediación. Diario Oficial de la Federación. Miércoles 29 de marzo del 2005. 43 pp. [ Links ]
EPA (1986) Method 418.1 mod. Petroleum Hydrocarbon, Total Recoverable. Environmental Protection Agency. Spectrophotometric Infrared. 8 pp. [ Links ]
Fent K (2004) Ecotoxicological effects at contaminated sites. Toxicology 205: 223–240. [ Links ]
García RDE (2005) Estudio de la toxicidad de los petróleos nuevo e intemperizado en el cultivo del arroz Oryza sativa L. Tesis Ingeniería Ambiental. Universidad Juárez Autónoma del Tabasco. División Académica de Ciencias Biológicas. Villahermosa, Tabasco. México. 87 pp. [ Links ]
Hernández NLC (2005) Estudio de adaptación y selección de hongos en la biorremediación de suelos contaminados con hidrocarburos derivados del petróleo crudo. Tesis Licenciatura en Biología. Facultad de Ciencias Biológicas y Agropecuarias Zona Orizaba–Córdoba. Universidad Veracruzana. Córdova, Veracruz. 112 pp. [ Links ]
Hinsinger P (1998) How do plant root acquire mineral nutrient? Chemical processes involved in the rhizosphere. Adv. Agron. 64: 225–265. [ Links ]
Ho CH, Aplegate B, Banks MK (2007) Impact of microbial/ interactions on the transformations of polycyclic aromatic hydrocarbons in rhizosphere of Festuca arundinacea. Int. J. Phytoremed. 9: 107–114. [ Links ]
Hutchinson SL, Schwab AP, Banks MK (2001a) Phytoremediation of aged petroleum sludge. Effect of irrigation techniques and scheduling. J. Environ. Qual. 30: 1516–1522. [ Links ]
Hutchinson SL, Banks MK, Schwab AP (2001b) Phytoremediation of aged petroleum sludge. Effect of inorganic fertilizer. J. Environ. Qual. 30: 395–403. [ Links ]
Lin Q, Mendelson IA, Henry CB, Roberts PO, Walsh MM, Overton EB, Portier RJ (1998) Effects of biore–mediation agents on oil degradation in mineral and sandy marsh sediments. Environ. Tech. 20: 825–837. [ Links ]
Lindströn K, Minna MJ, Hintsa H, Kaksonen A, Mokelke L, Mäkeläinen K, Pitkäjärvi J, Suominen L (2003) Potential of Galega–Rhizobium galegae System for Bioremediation of Oil–contaminated soil. Food Technol. Biotechnol. 41: 11–16. [ Links ]
MacNaughton SJ, Stephen JR, Venosa AD, Davis GA, Chang YL, White DC (1999) Microbial population changes during bioremediation of an experimental oil spill. Appl. Environ. Microbiol. 65: 3566–3574. [ Links ]
Madigan MT, Martinko JM Parker J (2004) Broca. Biología de los microorganismos. 10a. ed. Pearson Educación, S. A. Madrid, España. 1096 pp. [ Links ]
Maier RM, Pepper IL, Gerba CP (2000) Environmental Microbiology. Academic Press. San Diego CA. USA. 585 pp. [ Links ]
Meléndez NF (2000) Siembra y manejo de pastos para la zona de la Chontalpa. INIFAP. ISPROTAB. Villahermosa, Tabasco.17 pp. [ Links ]
Ortiz CA (1999) Biodegradación del petróleo crudo (Maya) en una matriz sólida, en reactores de tipo columna. Tesis Maestría en Ciencias en Biotecnología. Universidad Autónoma del Estado de Morelos. Centro de Investigaciones en Biotecnología (CEIB/UAEM), Cuernavaca, Morelos. 76 pp. [ Links ]
OECD (2006) OECD Guidelines for the Testing of Chemicals. Organisation for Economic Co–operation and Development. Terrestrial Plant Test: Seedling Emergence and Seedling Growth Test. 208. Paris, France. 21 pp. [ Links ]
Parrish ZD, Banks MK, Schwab AP (2004) Effectiveness of phytoremediation as a secondary treatment for polycyclic aromatic hydrocarbons (PAHs) in composted soil. Int. J. Phytoremed. 6: 119–137. [ Links ]
PEMEX (2007) Anuario estadístico de Tabasco 2007. 68 pp. [ Links ]
Quiñones–Aguilar EE, Ferrera–Cerrato R, Gavi–Reyes F, Fernández–Linares L, Rodríguez–Vázquez R, Alarcón A (2003) Emergencia y crecimiento de maíz en un suelo contaminado con petróleo crudo. Agrociencia 37: 585–594. [ Links ]
Riser–Roberts E (1998) Remediation of petroleum contaminated soils. Biological, physical, and chemical processes. Lewis Publisher, Boca Ratón, FL, USA. 542 pp. [ Links ]
Rivera–Cruz MC, Ferrera–Cerrato R, Volke–Haller V, Fernández–Linares L, Rodríguez–Vázquez R (2002) Poblaciones microbianas en perfiles de suelos afectados por hidrocarburos del petróleo en el Estado de Tabasco, México. Agrociencia 36:149–159. [ Links ]
Rivera–Cruz MC, Ferrera–Cerrato R, Sánchez–García P, Volke–Haller V, Fernández–Linares L, Rodríguez–Vázquez R (2004) Descontaminación de suelos con petróleo crudo mediante microorganismos autóctonos y pasto alemán Echinochloa polystachya (H.B.K.) Hitchc. Agrociencia 38:1–12. [ Links ]
Rivera–Cruz MC, Trujillo–Narcia A, Miranda de la CMA, Maldonado CE (2005) Evaluación toxicológica de suelos contaminados con petróleos nuevo e intemperizado mediante ensayos con leguminosas. Interciencia 30: 326–331. [ Links ]
SAS (2001) SAS User's guide: Basic.Versión 8.2. Cary. N.C. [ Links ]
Schnoor JL, Licht LA, McCutcheon SC, Wolfe NL, Carreira LH (1995) Phytoremediation of organic and nutrient contaminants. Environ. Sci. Tech. 29: 318–323. [ Links ]
Siciliano SD, Germida JJ, Banks K, Greer CW (2003) Changes in microbial community composition and function during a polyaromatic hydrocarbon phytoremediation field trial. Appl. Environ. Microbiol. 69: 483–489. [ Links ]
Trujillo NA, Zavala CJ Lagunes ELC (1995) Contaminación de suelos por metales pesados e hidrocarburos aromáticos en Tabasco. In: Memoria Octava Reunión Científica–Tecnológica Forestal y Agropecuaria. INIFAP Tabasco. Villahermosa, Tab. pp. 45–52. [ Links ]
Volke ST, Velasco TJA (2002) Tecnologías de remediación para suelos contaminados. Instituto Nacional de Ecología (INE–SEMARNAT). México, D.F. 64 pp. [ Links ]
Zavala CJ, Gavi RF, Adams SHR, Ferrera–Cerrato R, Palma–López DJ (2002) Hidrocarburos del petróleo y tecnologías de biorremediación para suelos de Tabasco. In: Palma–López DJ, Triano SA (comps) Plan de uso sustentable de los suelos de Tabasco, Vol. II Ed. Colegio de Postgraduados–Isprotab. Villahermosa, Tab., Méx. 179 pp. [ Links ]














