Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.25 no.2 Villahermosa ago. 2009
Artículos
Caracterización y estabilidad de antocianinas de higo, variedad Mission
Characterisation and stability of Mission variety fig anthocyanins
M Aguilera–Ortíz *1, MG Alanis–Guzmán2, CL García–Díaz2, CM Hernández–Brenes3
1 Facultad de Ciencias Químicas. Universidad Juárez del Estado de Durango Av. Artículo 123 s/n. 35010. Gómez Palacio, Durango, México. *Correo electrónico:maguilerao@hotmail.com
2 Facultad de Ciencias Biológicas. Universidad Autónoma de Nuevo León.
3 Departamento de Tecnología de Alimentos. ITESM–Campus Monterrey.
Artículo recibido: 31 de marzo de 2009
Aceptado: 3 de agosto de 2009
RESUMEN
Las antocianinas del higo azul–morado (Ficus carica) variedad Mission fueron extraídas del tejido epidérmico liofilizado usando metanol acidificado, hidrolizadas con HCl y purificadas usando un cartucho C–18 Sep Pak®. El contenido de antocianinas monoméricas, determinado por el método de diferencial de pH, fue 162 mg (100 g de tejido epidermal (base cianidina–glucósido))–1. Por medio de HPLC se separó e identificó la cianidina como única antocianina presente en el higo. Se demostró que la mayor estabilidad de antocianinas extraídas de higo Mission se presenta a un pH de 3.0, a 4 °C y en oscuridad, conservándose durante 14 días.
Palabras clave: Higo, antocianinas, estabilidad.
ABSTRACT
Mission variety Bluish–black fig (Ficus carica) anthocyanins were extracted from freeze dried fig skin with acidified methanol, hydrolysed with HCl and purified using a C–18 Sep–Pak® cartridge. The monomeric anthocyanin content, determined by the pH–differential method, was 162 mg (100 g of skin tissue (cianidin–glucoside basis))–1. Cyanidin was separated and identified by HPLC as the only anthocyanin present in the bluish–black fig. It was confirmed that the greatest stability of anthocyanins extracted from Mission figs was that at a pH of 3.0, at 4 °C and in darkness, and it remained during 14 days.
Key words: Fig, anthocyanins, stability.
INTRODUCCIÓN
Las antocianinas constituyen una gran familia de polifenoles en plantas y son responsables de los colores para muchas frutas y flores observadas en la naturaleza (Oh et al. 2008). Se encuentran típicamente en frutas tales como arándanos, fresas y uvas. Investigaciones recientes se han enfocado a los beneficios en la salud de estos pigmentos, especialmente a su actividad antioxidante (Camire 2002). La acumulación de datos muestra que las antocianinas y los extractos de plantas ricos en antocianinas pueden proveer diversos beneficios a la salud, incluyendo protección de DNA (Ramírez–Tartosa et al. 2001; Lazze et al. 2003), actividad anti–inflamatoria (Rossi et al. 2003), actividad anticancerígena (Hou et al. 2003; Hou et al. 2004), actividad antioxidante (Wang & Jiao 2000; Matsumoto et al.2002; Oh et al. 2006a), actividad antidiabética (Jankowski et al.2000; Tsuda et al. 2003) y prevención de enfermedades cardiovasculares y neurodegenerativas (Joseph et al. 1999; Youdim et al.2000). Actualmente, el estudio del contenido y estabilidad de este tipo de compuestos es de gran importancia, ya que las antocianinas son relativamente inestables y presentan reacciones degradativas en el proceso y almacenamiento de las mismas. Los higos (Ficus carica L.) son una fuente rica de estas antocianinas. Robinson & Robinson (1932) reportaron la presencia de cianidin 3–monoglucósido en frutos de Ficus carica L. Sin embargo, es incierto cuál de las variedades de estas especies fue examinada. Puech et al. (1976) concluyen que los datos obtenidos aportan evidencia, sobre la presencia de antocianinas específicas en higos Mission, una de las cuatro variedades comerciales importantes en California, Estados Unidos, caracterizadas por medio de cromatografía en papel y densitometría. Solomon et al. (2006) estudiaron el contenido de antocianinas en seis variedades de higos cultivados en Israel, por medio de Cromatografía Líquida de Fase Reversa (RP–LC) confirmaron la presencia de diferentes concentraciones de antocianinas en todas las variedades. Además, la hidrólisis reveló que la cianidina es el principal aglicón. Un método práctico para cuantificar y determinar sus índices de degradación es el método diferencial de pH que se fundamenta en las transformaciones estructurales del cromóforo de la antocianina como una función del pH, el cual puede ser medido usando espectroscopía óptica a través de un procedimiento fácil y rápido para la cuantificación de antocianinas monoméricas (Giusti & Wrolstad 2000). La técnica por RP–LC se reconoce como la mejor para análisis de antocianinas debido a que comparada con otros métodos ofrece tiempos de análisis más cortos, mejor selectividad, alta versatilidad y mejor sensitividad (Eder 1996). El higo es un fruto delicioso perteneciente a la familia Moracea, siendo la higuera uno de los primeros árboles frutales cultivados. Hoy en día, el higo es un cultivo importante en el mundo entero para consumo fresco y seco. Los higos secos contienen una de las más altas concentraciones de polifenoles entre varias frutas tales como albaricoques, arándanos, dátiles, pasas, ciruelas pasas y bebidas consumidas comúnmente. Además, los higos y las ciruelas secas tienen la mejor puntuación nutricional entre las frutas secas (Vinson et al. 2005; Vinson 1999).
Los objetivos de este estudio fueron identificar y cuantificar la concentración de las antocianinas presentes en el tejido epidérmico en higo azul–morado variedad Mission, cultivado en Ciudad Lerdo Durango, México y evaluar su estabilidad bajo diferentes condiciones de almacenamiento.
MATERIALES Y MÉTODOS
Material de estudio
Los higos azul–morado (Ficus carica L.) variedad Mission, cultivados por la Sociedad en Solidaridad Social "Higos del Nazas" (Ejido Álvaro Obregón, Municipio de Lerdo Durango, México) fueron adquiridos directamente de la planta procesadora de higo de dicha asociación. El tejido epidérmico fue separado manualmente, congelado y liofilizado en un liofilizador LABCONCO FreeZone 6 L (modelo 7753510) por 34 h, a una temperatura del colector de –44 °C y con un sistema de vacío de 596 x 10–3 Mbar (inicial) y 250 x 10–3 Mbar (final). Las muestras liofilizadas conteniendo 3% de humedad fueron envasadas a vacío y almacenadas en refrigeración previo a su análisis.
Obtención de Extractos. Las muestras liofilizadas fueron homogeneizadas con un molino de cuchillas. La extracción fue hecha siguiendo el procedimiento descrito por Kalt & McDonald (2002) utilizando 0.8 g de tejido epidérmico de higo azul–morado liofilizado los cuales fueron mezclados con 10 ml de metanol:agua:ácido fórmico (70:28:2) con un pH 3.45, durante 10 min en una licuadora Osterizer®. La mezcla obtenida se filtró a vacío, los filtrados se dejaron reposar por 1 h en la oscuridad.
Cuantificación de antocianinas por espectrofotometría. Para conocer el contenido de antocianinas monoméricas fue utilizado el métododiferencial de pH (Giusti & Wrolstad 2000). Un Espectrofotómetro HACH DR/4000V fue usado para las mediciones espectrales a 520 y 700 nm. El contenido de pigmento fue calculado como cianidina 3–glucósido, usando un coeficiente de extinción de 26 900 L cm–1 mg–1 y un peso molecular de 449.2 g L–1.
Análisis de antocianinas por HPLC. Purificación de antocianinas. Los extractos obtenidos de las muestras liofilizadas, fueron pasados a través de un cartucho de 13 mm de longitud C–18 Sep–Pak® (Waters, división Millipore, MA), previamente activado con metanol seguido por HCl acuoso 0.01 % (Wrolstad et al. 1990). Las antocianinas y otros compuestos fenólicos fueron adsorbidos en el cartucho; azúcares, ácidos y otros compuestos solubles en agua fueron removidos con tres volúmenes de HCl acuoso 0.01 % y las antocianinas se recuperaron subsecuentemente con metanol conteniendo HCl 0.01% (v/v). El extracto metanólico purificado fue concentrado usando una corriente de nitrógeno a baño maría (40 °C) y los pigmentos fueron ajustados a un volumen conocido con metanol conteniendo HCl 0.01 %.
Hidrólisis ácida de antocianinas para la identificación. Para la hidrólisis se usaron 1.5 ml de HCl 6 M más 2 ml de metanol conteniendo ácido fórmico 25 % (v/v) y fueron adicionados a 0.5 ml de extracto metanólico purificado y concentrados en un vial con taparosca, pasado por nitrógeno y cerrado. El pigmento fue hidrolizado por 60 min a 100 °C. El hidrolizado fue purificado usando un cartucho C–18 Sep–Pak®R .
Identificación y cuantificación por HPLC. Para el análisis de las muestras, sin hidrolizar e hidrolizadas, se usó un sistema HPLC (Waters 2996) equipado con un detector de arreglo de fotodiodo, muestreador automático (Waters 717 plus) y un sistema de bomba binaria (Waters 1525). La separación fue conducida usando una columna Simetry C18 (4.6 x 250 mm, Waters Corp.) con un tamaño de partícula de 5 μm. Los solventes usados fueron agua (fase A) y acetonitrilo (fase B). Las antocianinas fueron separadas usando un gradiente lineal de 0 a 30 % de fase B en 30 min. Se utilizó un volumen de inyección de 50 μL con 1 ml min–1 de velocidad de flujo, mostrado en la Tabla 1. Se registró la información espectral sobre el rango de longitud de onda de 210 a 650 nm. Los solventes y muestras fueron filtrados a través de filtros de polipropileno 0.45 μm y filtros de membrana de 0.45–μm politetrafluoroetileno (PTFE, Gelman), respectivamente. La identificación de antocianinas se basó en el tiempo de retención de la mezcla de seis estándares externos (delfinidina, cianidina, petunidina, pelargonidina, peonidina, malvidina) de la marca Sigma. Para determinar la concentración de las antocianinas en cada caso, se comparó el área del pico de la muestra con el área del pico del estándar externo, reportando en mg (100 g de muestra)–1.

Estabilidad del pigmento. Primer experimento. La estabilidad del pigmento fue probada en extractos (con un rango de pH 3.3 –3.5 inicial) aleatoriamente asignados a las siguientes condiciones y niveles: almacenamiento en la oscuridad, pH 3, 6, 8, ajustado con HCl y NaOH estandarizado a 0.1 N; temperatura 4, 25, 40 y 60 °C. Los tubos muestra (8 ml) fueron colocados verticalmente en una gradilla, dentro de la cámara de exposición. El cambio de color total (ΔE) fue evaluado por medio de un colorímetro Minolta CR–300, con la metodología triestímulo L, a y b, mediante diferencia aritmética de la luminosidad y los parámetros a* y b* al inicio y al final del almacenamiento (14 días). Se calculó  El experimento fue realizado por triplicado. El diseño experimental fue bifactorial, con 3 niveles para pH y 4 para temperatura. Los datos fueron analizados usando el paquete estadístico STATISTICA 6.0, a través de ANOVA y la prueba de rangos múltiples de Duncan.
El experimento fue realizado por triplicado. El diseño experimental fue bifactorial, con 3 niveles para pH y 4 para temperatura. Los datos fueron analizados usando el paquete estadístico STATISTICA 6.0, a través de ANOVA y la prueba de rangos múltiples de Duncan.
Segundo experimento. Se evaluó la estabilidad del pigmento a 4 °C y pH 3, 6 y 8, debido a que a estos valores de pH no se presentó diferencia estadística en el experimento anterior y a 4 °C se conservó mejor el color. Mediante la cuantificación espectrofotométrica de las antocianinas por el método de diferencial de pH (Giusti & Wrolstad 2000) se evaluó la estabilidad del pigmento, bajo las condiciones de almacenamiento mencionadas.
RESULTADOS
Contenido de antocianinas monoméricas por espectrofotometría. El rendimiento promedio del tejido epidérmico fue 182 g (kg de higo)–1.El contenido de antocianina monomérica del higo fue 162 mg (100 g de tejido epidérmico como cianidina–3–glucósido (Cy–3–glu))–1. Un total de 2.95 g de antocianina fue extraída y purificada del tejido epidérmico de 10 kg de higo azul–morado.
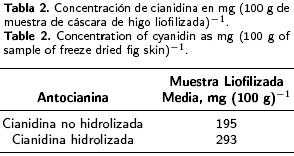
Estudio por HPLC de extractos de higo. Los extractos de higo fueron analizados por HPLC, obteniendo los resultados que se muestran en la Figura 1. Una antocianina representa el 100 % del área total del pico. Los datos obtenidos del HPLC demuestran la presencia de la antocianina cianidina en el tejido epidérmico del higo, de acuerdo al análisis de cromatogramas obtenidos de la mezcla de estándares de antocianinas. La concentración de la cianidina en las muestras liofilizadas, estimada como la concentración del pigmento en el tejido epidérmico de higo se observa en la Tabla 2. La liofilización es considerada la mejor manera para secar pigmentos de plantas sensibles (Masters 1985; Desorby et al. 1997; Francis 1999).
Hidrólisis ácida de las antocianinas de higo. La hidrólisis ácida de las antocianinas de higo arrojó solamente una antocianidina.
Estabilidad del pigmento. Primer experimento. Al evaluar la estabilidad de los pigmentos extraídos, a través de la medición de cambios de color en los extractos, se observó que hubo diferencia significativa debidas al pH y a la temperatura (ANOVA F = 103.2; p =0.000), como lo muestra la prueba de rangos múltiples de Duncan para la estabilidad del pigmento mediante el cambio de color total (Tabla 3).

Segundo experimento. El contenido de antocianina monomérica en los extractos metanólicos de los tejidos epidérmicos fue medido durante los 14 días a las diferentes condiciones de almacenamiento (Tabla 4). Las mediciones revelaron que un aumento en el valor del pH durante el almacenamiento contribuyó grandemente al descenso significativo en el porcentaje de antocianina residual original para las condiciones II y III durante el almacenamiento. Esta reducción en el contenido de antocianina pudo ser debido a su degradación por los diferentes valores de pH durante la etapa de almacenamiento. También se puede observar que a un pH más ácido, bajo las mismas condiciones de almacenamiento, el 98.54% del pigmento fue retenido.

DISCUSIÓN
Giusti & Wrolstad (1996) reportan 9 g de antocianina extraída y purificada del tejido epidérmico de 30 kg de rábano rojo, lo que equivale a 3 g de antocianina de 10 kg de rábano, por lo que la concentración de antocianinas presentes en el higo es similar a la reportada por estos autores. Algunas propiedades estructurales importantes pueden ser obtenidas de los datos espectrales, incluyendo la presencia de acilación por ácidos orgánicos aromáticos hidroxilados (Hong & Wrolstad 1990). La concentración de antocianinas determinadas con este método fue 20 % superior a la determinada por el método de espectrofotometría. El tiempo de retención y el espectro del pigmento hidrolizado es parecido a aquel de la cianidina de maíz, confirmado previa identificación de las antocianinas de higo como derivados de la cianidina (Solomon et al. 2006). Las condiciones de almacenamiento en oscuridad, pH 3, 6, 8 y a una temperatura de 4, 25, 40 y 60 °C mostraron estabilidad del pigmento significativamente diferente (p < 0.05). Los resultados obtenidos muestran que las antocianinas se mantienen estables a diferente pH debido a que estadísticamente no presentan diferencia significativa (p = 0.667). Con respecto a la temperatura, las antocianinas se presentan inestables, ya que a mayor temperatura (60 °C) existe una mayor degradación de color, mientras que a menor temperatura (4 °C) permanecen con menor pérdida de color. Lo anterior coincide con Palamadis & Markakis (1975) donde reportan que en la oscuridad, a 38 °C, después de 135 días, solamente el 23 % de la cantidad original del pigmento extraído con agua caliente permaneció en una bebida, mientras que a 3.5 °C, bajo las mismas condiciones de almacenamiento, el 92% del pigmento fue retenido. En medios acuosos las antocianinas sufren transformaciones estructurales que son dependientes del pH. Ha sido encontrado que cuatro formas de antocianinas existen en equilibrio: el catión rojo flavilium, la base azul quinonoidal, la pseudobase incolora carbinol y el chalcon incoloro. En medios fuertemente ácidos (valores de pH debajo de 2) las antocianinas existen predominantemente en su forma roja coloreada como cationes flavilium. A valores de pH débilmente ácidos, neutros y básicos el carbinol y las formas de base quinonoidal dominan al catión lavilium, así que el color destiñe y cambia de rojo a azul (Brouillard 1982). De acuerdo con Gross (1987) las antocianinas en forma general son más estables en medios ácidos y en ausencia de oxígeno bajo refrigeración y en obscuridad, lo anterior esta relacionado con el ligero descenso del contenido de antocianinas monoméricas presentado en la condición I. En presencia de oxígeno, la máxima estabilidad térmica de la antocianidina 3–glucósido ha sido observada a pH de 1.8 a 2.0 (Daravingas & Cain 1968). En general, comportamientos estructurales que conducen a incrementar la estabilidad al pH, también conducen a incrementar la estabilidad térmica, por ejemplo, la hidroxilación de la aglicona decrece la estabilidad, mientras que la metoxilación, glucosilación y acilación tienen el efecto opuesto (Hrazdina et al. 1970; Robinson et al. 1966; Van Buren et al. 1968). Generalmente, las antocianinas son más estables bajo condiciones ácidas, pero pueden degradarse por varios mecanismos posibles para formar primero productos incoloros, después productos oscuros e insolubles. Numerosas investigaciones han mostrado que la degradación y polimerización de antocianinas son influenciadas por el oxígeno, ácido ascórbico, luz, pH y temperatura donde la degradación de la antocianina sigue una cinética de primer orden (Bakker et al. 1986). Es posible cuantificar el contenido de antocianinas monoméricas por el método diferencial de pH del tejido epidérmico del higo como un método simple de rutina en el laboratorio. El contenido de antocianinas en el higo es similar al contenido de estos pigmentos en el rábano. Los valores obtenidos de tal cuantificación son también similares a zarzamoras, moras, etc. Por medio de HPLC se separó e identificó la cianidina como única antocianina presente en el tejido epidérmico del higo. Las mejores condiciones para almacenamiento del pigmento son pH 3.0, temperatura de 4 °C y en oscuridad. El almacenamiento en oscuridad, a bajas temperaturas y pH ácidos incrementó la estabilidad del pigmento.
LITERATURA CITADA
Bakker J, Preston NW, Timberlake CF (1986) The determination of anthocyaninsin agin red wines: comparison of HPLC and spectral methods. Am. J. Enol. Vitic. 37(2): 121–126. [ Links ]
Brouillard R (1982) Anthocyanins as food colors. En: Markakis P (ed.) Academic Press, New York. [ Links ]
Camire EM, Chaovanalikit A, Dougherty PM, Briggs J (2002) Blueberry and Grape Anthocyanins as Breakfast Cereal Colorants. J. Food Sci., 67(1): 438–441. [ Links ]
Daravingas G, Cain RF (1968) Thermal degradation of black raspberry anthocyanin pigments in model systems. J. Food Sci., 33: 138. [ Links ]
Desobry SA, Netto FM, Labuza TP (1997) Comparison of spray–drying, drum–drying and freeze–drying for B–carotene encapsulation and preservation. J. Food Sci. 62: 1158–1162. [ Links ]
Eder R (1996) Pigments. En: Nollet LM (ed) Handbook of Food Analysis, Volume I Marcel Dekker, Inc. New York, p. 970. [ Links ]
Francis FJ (1999) FD & C Colorants: Anthocyanins and Betalains. Pages 33–42, 55–66. In Colorants; Francis FJ (ed.), Eagan Press, St. Paul, Minn. [ Links ]
Giusti MM, Wrolstad ER (1996) Characterization of red radish anthocyanins. J. Food Sci., 61(2): 322–326. [ Links ]
Giusti MM, Wrolstad ER (2000) Characterización and measurement of anthocyanins by UV–Visible spectroscopy. John Wiley & Sons, Inc. Unit F1.2. [ Links ]
Gross J (1987) Pigments in fruits. Academic Press, London. [ Links ]
Hong V, Wrolstad RE (1990) Use of HPLC separation/photodiode array detection for characterization of anthocyanins. J. Agric. Food Chem. 38: 708–715. [ Links ]
Hou FX, Wang S, Hu YY (2003) Effects of noise on antioxidant enzymes of cochlea in guinea pigs. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. 21(2): 121–3. [ Links ]
Hou DX, Kai K, Li JJ, Lin S, Terahara N, Wakamatsu M, Fuji M, Youg MR, Colburn N (2004) Anthocianidins inhibit activator protein 1 activity and cell transformation: structure activity relationship and molecular mechanisms. Carcinogenesis 25: 29–36. [ Links ]
Hrazdina G, Borzell AJ, Robinson WB (1970) Anthocyanins and betalains. En: Natural Food Colorants (GA Hendry and JD Houghton, eds.), Blackie and Son Ltd., Glasgow, p. 196. [ Links ]
Jankowski A, Janlowska B, Niwdworok J (2000) The effect of anthocyanin dye from grapes on experimental diabetes. Folia Med Cracov 41: 5–15. [ Links ]
Joseph J, Shuktt–Hale B, Denisova NA, Bielinsk D, Martin A, McEwen JJ, Bickford PC (1999) Reversals of age–related declines in neuronal signal transduction, cognitive, and motor behavioral deficits with blueberry, spinach, or strawbwrry dietary supplementation. J Neurosci 19: 8114–8121. [ Links ]
Kalt W, MacDonald J (2002) Agriculture and Agri–Food Canada, Kentville, Nova Scotia, Canada. [ Links ]
Lazze M, Pizzala R, Savio M, Stivala L, Prosperi E, Bianchi L (2003) Anthocyanins Project against DNA damage induced by tert–butyl–hidroperoxide in rat smooth muscle and hematoma cells. Mutat Res 535: 103–115. [ Links ]
Masters K (1985) Spray Drying Handbook. 4 th ed., George Godwin, London, England. [ Links ]
Matsumoto HY, Nakamura Y, Hirayama M, Yoshiki Y, Okubo K (2002) Antioxidant activity of Black currant anthocyanin aglycons and their glycosides measured by chemiluminescence in a neutral pH region and in human plasma. J. Agric. Food Chem., 50(18): 5034–5037. [ Links ]
Oh J, Kim SJ, Imm J (2006) Antioxidative effect of crude anthocyanins in water–in–oil microemulsion system. Food Sci Biotech 15: 283–8. [ Links ]
Oh YS, Lee JH, Yoon SH, Oh CH, Choi DS, Choe E, Jung MY (2008) Characterization and quantification of anthocyanins in grape juices obtained from the grapes cultivated in Korea by HPLC/DAD, HPLC/MS, and HPLC/MS/MS. J. Food Sci., 73(5): C378–89. [ Links ]
Palamadis N, Markakis P (1975) Stability of Grape Anthocyanin in a Carbonated Beverage. J. Food Sci., 40: 1047. [ Links ]
Puech AA, Rebeiz AC, Catlin BP, Crane CJ (1975) Characterization of anthocyanins in fig (Ficus carica L.) fruits. J. Food Sci., 40: 775–779. [ Links ]
Ramirez–Tortosa C, Andersen O, Gardener P, Morrice PC, Wood SG, Duthie SJ, Collins AR, Duthie GC (2001) Anthocyanin–rich extract decreases indices of lipid peroxidation and DNA damage in vitamin E–depleted rats. Free Radic Biol Med 31: 1033–7 [ Links ]
Robinson GM, Robinson R (1932) A survey of anthocyanins. 2. Biochem. J. 26: 1647. [ Links ]
Robinson WD, Weiers LD, Bertino JJ, Mattick LR (1966) Anthocyanins and betalains. En: Natural Food Colorants (GA Hendry and JD Houghton, eds.), Blackie and Son Ltd., Glasgow, p. 192. [ Links ]
Rossi A, Serraino I, Dugo P, Di Paola R, Mondell L, Gerovese T, Morabito D, Dugo G, Sautebin L, Caputi AP, Cuzzcrea S (2003) Protective effects of anthocyanins from blackberry in a rat model of acute lung inflammation. Free Radic Res 37: 891–900. [ Links ]
Solomon A, Golubowicz S, Yablowicz Z, Grossman S, Bergman M, Gottlieb EH, Altman A, Kerem Z, Flaishman A (2006) Antioxidant activities and anthocyanin content of fresh fruits of common fig (Fig carica L.). J. Agric. Food Chem 54(20): 7717–7723. [ Links ]
Tsuda T, Horio F, Uchida K, Aoki H, Osawa T (2003) Dietary cyaniding 3–O–beta–D–glucoside–rich purple corn color prevents obesity and ameliorates hyperglycemia in mice. J Nutr 133: 2125–30. [ Links ]
Van Buren JP, Bertino JJ, Robinson WB (1968) Anthocyanins and betalains. En: Natural Food Colorants, Blackie and Son Ltd., Glasgow, p. 192, 199. [ Links ]
Vinson JA, Zubik L, Bose P, Samman N, Proch J (2005) Dried fruits: excellent in vitro and in vivo antioxidants. J. Am. Coll. Nutr. 24 (1): 44–50. [ Links ]
Vinson JA (1999) The finctional food properties of figs. Cereal Foods World. 4: 82–87. [ Links ]
Wang S, Jiao H (2000) Scavening capacity of berry crops on superoxide radicals, hydrogen peroxide, hydroxyl radicals, and singlet oxygen. J. Agric Food Chem 48: 5677–84. [ Links ]
Wrolstad RE, Skrede G, Lea P, Enerven G (1990) Anthocyanins and betalains. En: Natural Food Colorants, Blackie and Son Ltd., Glasgow, p. 202. [ Links ]
Youdim MB, Gassen M, Gross A, Mandel S, Grunblatt E (2000) Iron chelating, antioxidant and cytoprotective properties of dopamine recptor agonist, apomorphine. J. Neural Transm Suppl. 58: 83–96. [ Links ]














