Introducción
A pesar de que la evidencia actual sugiere que los factores genéticos tan sólo contribuyen con alrededor de 10% del riesgo de las enfermedades crónicas, hasta la fecha se desconoce la mayor parte de las exposiciones ambientales humanas que podrían iniciar procesos de enfermedad a futuro.1 Por lo tanto, para lograr una mejor compresión de la causa y la evolución de las enfermedades crónicas, debe llevarse a cabo una evaluación más profunda de los factores no genéticos y del “medio ambiente”. Tradicionalmente, la investigación en humanos sobre este tema se ha centrado en la evaluación de la repercusión de una exposición en la salud; sin embargo, con este enfoque se subestiman las posibles interrelaciones que puedan existir con otros factores ambientales.2
En este contexto, el concepto “exposoma” ha cobrado importancia en los últimos años. Éste representa la totalidad de las exposiciones ambientales a las que el ser humano está sometido desde el nacimiento y se introdujo por primera vez en el año 2005 por Christopher P. Wild, epidemiólogo molecular y director de la Agencia Internacional para la Investigación del Cáncer de Estados Unidos, buscando destacar la necesidad de llevar a cabo mediciones más completas de las exposiciones humanas que podrían iniciar procesos de enfermedad.3 Por lo tanto, el exposoma surge como una nueva estrategia o herramienta para evaluar los factores de riesgo de enfermedades generadas por el medio ambiente. El exposoma comprende no solo la exposición a productos químicos y contaminantes, sino también el estilo de vida, el nivel socioeconómico y el entorno social de un individuo.2
Explorar la repercusión de las exposiciones en las etapas más tempranas de la vida es un tema interesante y accesible para la investigación.4
Los primeros 1,000 días de la vida pueden ser un punto de partida clave para describir la dinámica del exposoma, debido a la mayor vulnerabilidad y el efecto potencial que las exposiciones ambientales pueden suponer en esta etapa y posteriormente durante toda la vida. Con el rápido desarrollo de técnicas de alto rendimiento molecular, almacenamiento de datos científicos, informática y comunicación, se están llevando a cabo múltiples estudios con el objeto de encontrar un enfoque específico relacionado con la evaluación de los efectos de las exposiciones ambientales durante este periodo crítico de la vida, que abren el paso al desarrollo de futuros proyectos de investigación para probar este enfoque a gran escala.5 En esta línea de trabajo, el proyecto The Human Early Life Exposome (HELIX) ha sido uno de los primeros intentos por describir la aplicación del concepto exposoma en los primeros años de vida de las poblaciones europeas, lo que supone un primer paso hacia la aplicación del exposoma a lo largo de todo el ciclo de vida.6
Se cree que la exposición del lactante a sustancias químicas provenientes de la sangre y la leche humana puede afectar la tolerancia inmunitaria, la colonización intestinal (microbioma), el desarrollo del intestino delgado, la disponibilidad de nutrientes y la absorción durante los periodos prenatal y posnatal. Sin embargo, la combinación de factores ambientales y el efecto de estos en la salud sigue siendo un enigma.5,7,8,9
Es por esto que hemos llevado a cabo una revisión de la bibliografía médica en torno a este tema utilizando para ello la base de datos PUBMED con los términos: exposome, early-life, gastrointestinal exposome, microbiota, gastrointestinal immunity and inflammation, xenobiotic. La selección de los trabajos fue a criterio de los autores.
Componentes del exposoma y herramientas potenciales para medirlo
El exposoma contiene tres dominios superpuestos de factores no genéticos que contribuyen al riesgo de enfermedad: externo general, externo específico e interno.10
Los factores que comprende el dominio externo general incluyen el entorno más amplio, como el nivel socioeconómico, el capital social, el nivel de educación, la ubicación de residencia, el medio rural o urbano y los factores climáticos. El uso apropiado y activo de los sistemas de información geográfica y las redes sociales podría mejorar la medición de este dominio.
Los factores que contiene el dominio externo específico incluyen los estilos de vida, las ocupaciones y la exposición a contaminantes. La monitorización individualizada utilizando la aplicación de tecnologías tales como la metabolómica y aductómica (Cuadro 1) pueden mejorar la medición de este dominio.
Cuadro 1 Glosario de términos
| Aductómica | Estudia los aductos, complejos que se forman cuando un compuesto químico se une a una molécula biológica, como ADN o proteínas. Los aductos de ADN son formas de ADN que resultan de una exposición a carcinogénicos (en el caso de los fumadores, estos serían los carcinogénicos presentes en el humo de tabaco). Un aducto de ADN, una vez formado, puede repararse. Esto significa una vuelta a la estructura original de ADN. También puede ser mal reparado, lo que resulta en una mutación. |
| Epigenética | Estudia el conjunto de elementos funcionales que regulan la expresión génica de una célula sin afectar a la composición de los genes en sí mismos ni a la secuencia de ADN. |
| Genotipo | Se refiere a la información genética que posee un organismo en particular, en forma de ADN. Es el conjunto de los genes que existen en el núcleo celular de cada individuo. |
| Metabolómica | Estudio y comparación de los metabolomas, es decir, la colección de todos los metabolitos (moléculas de bajo peso molecular) de una célula, tejido u organismo en un momento dado. |
| Microbiómica | Estudio del microbioma o genoma de la microbiota de un organismo. |
| Proteómica | Estudio de todo el conjunto de proteínas expresadas de un genoma, en particular de su estructura y función. |
| Transcriptómica | Estudio del conjunto de ARN (ARN ribosómico, ARN de transferencia, ARN mensajero, ARN interferente) que existe en una célula, tejido u órgano. |
El dominio interno incluye factores biológicos como: metabolismo, hormonas circulantes, microbiota intestinal, estrés oxidativo y la inflamación. El ambiente interno no refleja, exclusivamente, los efectos biológicos de la exposición externa, sino también las respuestas biológicas a ellos.11 Los análisis de la transcriptómica, proteómica, metabolómica y microbiómica (Cuadro 1) pueden mejorar la medición del medio interno.11,12
Aplicación del concepto exposoma en los primeros mil días de vida
En los últimos años ha tomado gran auge el periodo denominado: “Los primeros 1000 días de la vida”, lapso que comprende: 270 días desde la concepción hasta el nacimiento, 365 días del primer año de vida y 365 días del segundo año de vida. Éste representa el momento más importante en la vida de una persona, por ser una etapa crítica en el desarrollo, que permite a los niños obtener beneficios nutricionales e inmunológicos necesarios para el resto de su vida.
No obstante, este periodo es particularmente vulnerable a la exposición a múltiples factores ambientales como: contaminación del medio ambiente, humo del tabaco, ruido, pesticidas y la radiación, que pueden conducir a enfermedades graves y crónicas.13,14 Estas exposiciones ambientales, durante esta etapa, pueden modificar de forma permanente la estructura, la fisiología y el metabolismo del cuerpo.14 Estos cambios pueden favorecer la aparición de enfermedades mucho tiempo después de ser producidos, incluso a través de varias generaciones. Estas exposiciones se han asociado con retraso en el crecimiento intrauterino y con efectos neurotóxicos, inmunotóxicos y obesogénicos en los niños; sin embargo, la evidencia es limitada o inadecuada para muchas de estas asociaciones.15,16,17,18
El entendimiento de la correlación entre el exposoma, el genotipo y la epigenética de un individuo podría contribuir a una mejor comprensión de la etiopatogenia de ciertas enfermedades, como algunos trastornos del neurodesarrollo, el asma o la obesidad. 19,20,21,22,23
En este contexto, actualmente se están llevando a cabo seis estudios de cohorte en Europa relacionados con este tema. (Cuadro 2) Al igual que en el Proyecto del Genoma Humano, se concentraron estancias internacionales para coordinar un intercambio continuo de datos y evitar la dispersión de esfuerzos por los equipos que actualmente trabajan en este tema.9 Fue así como se diseñó el proyecto "The Human Early Life Exposome" (HELIX) en un intento por aplicar el concepto “exposoma” a los primeros años de vida y esclarecer su relación con marcadores ómicos y la salud infantil.5
Cuadro 2 Cohortes europeas que incluyen el estudio HELIX
| Cohorte | Años de inclusión | “n” de pacientes (Total: 32.000) |
|---|---|---|
| BiB. Nacidos en Bradford, Reino Unido (Wright et al. 2013) | 2007-2010 | 14,000 |
| EDEN. Estudio de los determinantes de desarrollo pre y postnatal, Francia (Drouillet et al. 2009) | 2003-2006 | 2,000 |
| INMA. Medio ambiente e Infancia, España (Guxens et al. 2012) | 2004-2006 | 2,500 |
| KANC. Cohorte de Kaunas, Lituania (Grazuleviciene et al. 2009) | 2007-2009 | 4,000 |
| MoBa. Cohorte de la madre y el niño noruegos, Noruega (Oslo) (Magnus et al. 2006) | 1999-2009 | 8,000 |
| Rhea. Cohorte madre- niño en Creta, Grecia (Chatzi et al. 2009) | 2007-2008 | 1,500 |
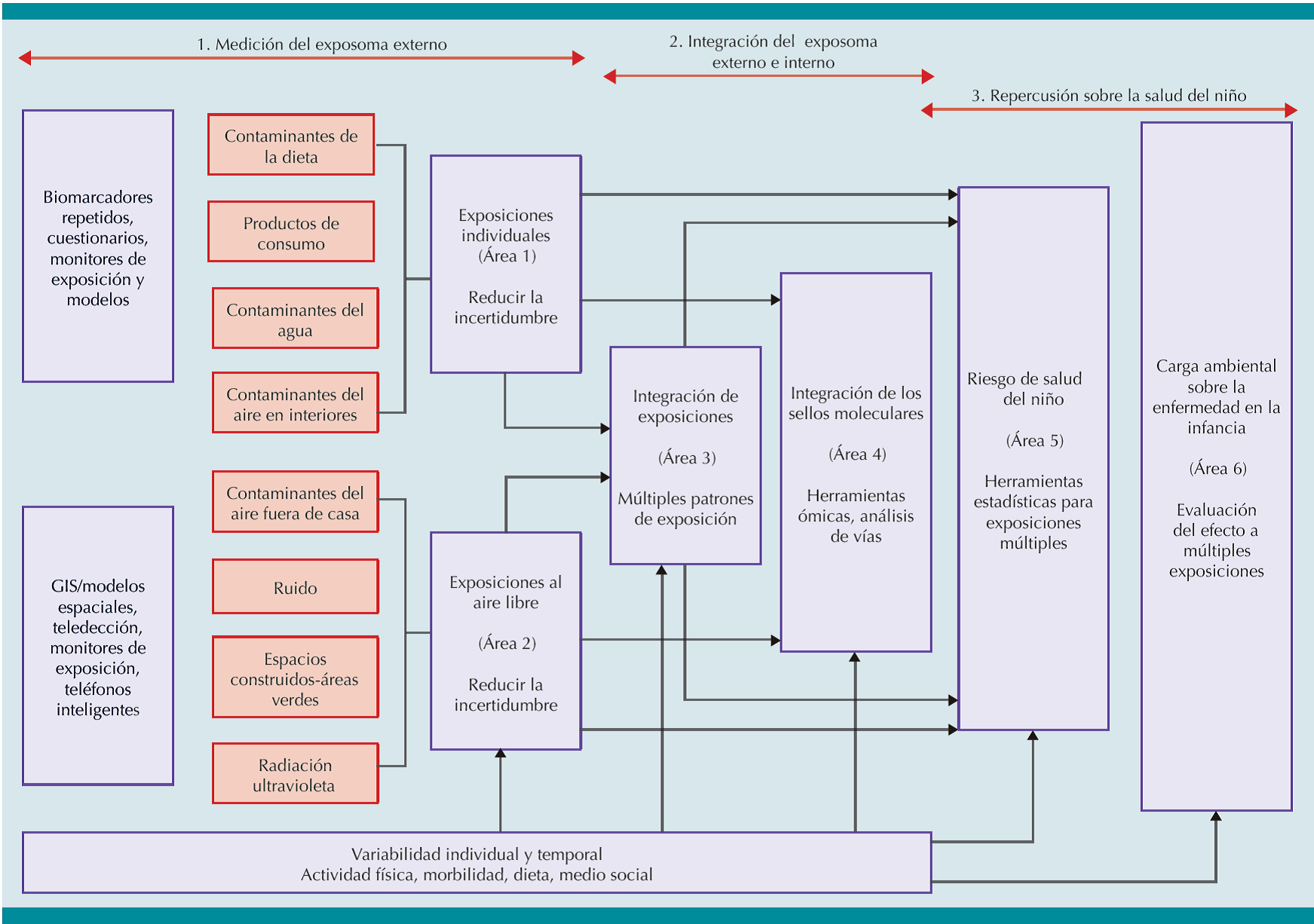
HELIX tiene como objetivo implementar nuevos métodos de evaluación para caracterizar la exposición infantil a múltiples factores ambientales y asociarlos con biomarcadores ómicos y los resultados en la salud infantil.5 HELIX estimará la exposición prenatal y posnatal a una amplia gama de exposiciones químicas y físicas. A través de tecnologías ómicas se determinarán los perfiles moleculares (metaboloma, proteoma, transcriptoma, epigenoma) asociados con las exposiciones. Por último, se utilizarán métodos estadísticos para evaluar las exposiciones múltiples con el fin de determinar estimaciones de exposición-respuesta para dilucidar la repercusión de estas en el crecimiento fetal e infantil, la obesidad, el neurodesarrollo y el funcionamiento respiratorio. (Figura 1)
Aplicación del concepto exposoma en la salud gastrointestinal
Las células humanas en el cuerpo (1013) son superadas en número por las células bacterianas que constituyen la microbiota humana (1014). La microbiota intestinal humana interactúa con el huésped tanto a nivel de la mucosa intestinal, como de forma sistémica; lo que da lugar a un amplio rango de efectos inmunológicos, fisiológicos y metabólicos.24 Desde el punto de vista del huésped, estos efectos tienen consecuencias positivas y negativas en lo que respecta a la nutrición, toxicidad, infecciones, metabolismo de xenobióticos, toxicidad de los compuestos ingeridos, mutagénesis y carcinogénesis.24 Entre los múltiples procesos endógenos llevados a cabo por la microbiota intestinal se destacan la síntesis de vitaminas: K, B12, B6, tiamina y el ácido nicotínico; la detoxificación y la fermentación de residuos no absorbibles de la dieta; la biotransformación de xenobióticos en el organismo y en el desarrollo del sistema inmunitario innato asociado con mucosas, mediante la síntesis de bacteriocinas y la regulación de la actividad de macrófagos y bacteriófagos, en respuesta a la acción de microorganismos patógenos.24,25 Así mismo, la microbiota intestinal está influida por múltiples agentes externos, como: microorganismos infecciosos, xenobióticos (medicamentos y toxinas) y cambios en los estilos dietéticos del huésped que pueden originar modificaciones importantes en la composición bacteriana de la microbiota intestinal, inflamación, carcino-génesis, síndrome metabólico y consecuencias neurológicas adversas.
Cada segmento del aparato gastrointestinal tiene características ambientales y microbiológicas típicas. La composición de la microbiota intestinal es regulada de forma diferencial en cada segmento del intestino por la tensión del oxígeno y el pH ácido del aparato gastrointestinal.24 El tubo digestivo tiene un gradiente de distribución de oxígeno, que experimenta una disminución muy significativa en los segmentos distales del intestino.24,25 Debido a esto, en los segmentos proximales se concentra mayor cantidad de bacterias aeróbicas y anaerobios facultativos como: Firmicutes (bacterias filamentosas segmentadas), Lactobacillaceae y proteobacterias (enterobacterias y Helicobacter spp).24 En contraste, en el colon predominan los anaerobios obligados fermentativos, como los de la familia Bacteroidetes, Actinobacteria (Bifidobacteriaceae), y Firmicutes (Clostridia).24 En el aparato gastrointestinal humano existen dos puntos críticos en donde predomina el pH ácido.25 El primero es el estómago, en donde se lleva a cabo la producción de ácido clorhídrico a través de las células parietales.25 El segundo se localiza en el ciego, que alberga gran número de lactobacilos y bifidobacterias, capaces de fermentar la lactosa y otros carbohidratos complejos hasta convertirlos en ácido láctico y ácidos grasos de cadena corta (acetato, propionato y butirato, fuente de energía para el organismo).25 El pH ácido puede obstruir la multiplicación de patógenos y la aparición de enfermedades gastrointestinales, y contribuir al equilibrio entre las poblaciones bacterianas dominantes y subdominantes.25 La reducción de la secreción de ácido gástrico ocurre de forma natural con la edad; es común después de una cirugía gástrica y se asocia con el surgimiento de determinadas enfermedades, como la anemia perniciosa y la hipogammaglobulinemia.26 También se ha encontrado que la microbiota de los individuos con hipoclorhidria aumenta la biotransformación de xenobióticos, particularmente debido a que en estos pacientes puede aumentar el tiempo de vaciamiento gástrico por encima de 5 horas.26 Se ha sugerido que el mayor riesgo de cáncer gástrico de los pacientes con aclorhidria se asocia con la mayor formación de compuestos N-nitroso por la microbiota gástrica.26
La colonización del organismo por parte de las bacterias se inicia incluso antes del momento de nacer; existen ciertas bacterias capaces de superar la barrera fetoplacentaria.27
La microbiota del neonato depende, en gran medida, de la forma en que se produce el nacimiento, puesto que el primer contacto con bacterias será con las procedentes de los órganos genitales y urinarios de la madre, si se trata de parto o con los microorganismos de la piel de la madre si el nacimiento es por cesárea.27
La microbiota del individuo se determina a partir de este momento y predominantemente durante el primer año de vida. Dependerá de diversos factores: consumo de leche humana o fórmula láctea, contacto con antibióticos, agentes infecciosos, vacunas, etc.28 Después del primer año de vida, la microbiota puede sufrir ciertas modificaciones secundarias a situaciones de estrés, tratamientos con antibióticos o cambios bruscos en la dieta.28 (Cuadro 3) Por lo tanto, la interacción entre el huésped y la microbiota intestinal a lo largo de la vida es dinámica y puede variar a través del tiempo. Este proceso puede ser perturbado por múltiples factores internos y externos.28 En esta línea, estudios recientes efectuados por europeos, americanos y japoneses, en el marco del proyecto MetaHIT, han determinado que la microbiota intestinal humana puede clasificarse de acuerdo con los estados de equilibrio o simbiosis, distinguiendo tres enterotipos.29 En el enterotipo 1 predominan las bacterias del género Bacteroides, en el enterotipo 2 prevalecen las del género Prevotella y el enterotipo 3 está dominado por el género Rumi-nococcus.29 Ello no quiere decir que tengamos sólo una clase de microorganismos, sino que predomina una especie sobre las otras. Esta categorización parece ser independiente del sexo, edad, nacionalidad o índice de masa corporal. La base para este agrupamiento se desconoce; sin embargo, se especula que pudiera estar relacionado con patrones dietéticos de larga evolución porque el enterotipo con predominio del género Bacteroides se ha asociado con una dieta rica en proteínas y grasa, en contraposición al enterotipo tipo 2, más asociado con el consumo de hidratos de carbono.30 La distinción de los enterotipos semeja a una “huella biológica” (como el grupo sanguíneo) que permite separar a los huéspedes en grupos con mayor o menor predisposición a padecer algunas infecciones virales, bacterianas y enfermedades crónicas; su estudio puede encaminar un asesoramiento dietético preventivo, individualizado y futuros tratamientos médicos.31,32 Cobra aún más importancia si se considera que los microorganismos causantes de enfermedades trasmisibles son los que algún día pudieron ser protectores frente a la aparición de enfermedades no trasmisibles, con un cierto componente genético, como la diabetes, hipercolesterolemia, obesidad, enfermedad de Crohn o fibrosis quística.33
Cuadro 3 Factores que afectan la microbiota intestinal
| Factores extrínsecos | Factores intrínsecos |
|---|---|
| Vía de finalización del embarazo (parto o cesárea) | Carga genética |
| Leche humana o fórmula láctea | Fisiología del huésped |
| Composición de la microbiota materna | Estrés |
| Carga microbiana del ambiente | Nutrición endógena |
| Hábitos alimenticios y tipo de dieta | |
| Consumo de agua clorada | |
| Vacunas | |
| Radioterapia | |
| Quimioterapia | |
| Medicamentos (antiinflamatorios,laxantes, antiácidos, antibióticos) |
De esta forma, toma valor el estudio del exposoma gastrointestinal, definido como la interacción entre el huésped, la microbiota intestinal y la totalidad de las exposiciones ambientales a las que el ser humano está sometido a lo largo de la vida.34,35 Los componentes más representativos de éste incluyen: fármacos, nutrientes, patógenos trasmitidos por los alimentos, toxinas biológicas y otros contaminantes sintéticos. El exposoma gastrointestinal puede alterar la composición, diversidad y actividad biológica de la microbiota intestinal. Por ejemplo, una dieta alta en grasas puede cambiar la cantidad y diversidad de la microbiota intestinal, lo que favorece la disminución de Bacteroides y el incremento de Firmicutes y Proteobacterias;36 mientras que una dieta alta en fibra aumenta la proporción de Firmicutes.37
La alteración del equilibrio entre el exposoma gastrointestinal, el microbioma y el genotipo del huésped, puede dar lugar a diversos tipos de enfermedades, como la inflamatoria intestinal. Cuando así sucede, los pacientes se tornan propensos a los cambios anormales en la composición de la microbiota intestinal (disbiosis) y, por ende, a la disminución de la biodiversidad microbiana.38,39 Como un potente factor etiológico de esta enfermedad se menciona la exposición a toxinas que inactivan los ribosomas (ribotoxinas), como los tricotecenos, la ricina y la toxina shiga, que se trasmiten por los alimentos.40 Las ribotoxinas pueden aumentar el número de bacterias aerobias y llevar a la producción de una disbiosis intestinal persistente,41,42 fenómeno que se ha implicado en la patogénesis de esta enfermedad.
Hace varias décadas se observó que una enteropatía intestinal discreta, denominada enteropatía tropical, ocurría de manera casi general en los habitantes de países en vías de desarrollo. Se asumía que esta patología intestinal, caracterizada por atrofia de vellosidades e infiltrado inflamatorio en la mucosa, en gran medida similar a la enfermedad celiaca, era un hallazgo fortuito, hasta que estudios posteriores informaron una relación inversa entre la permeabilidad intestinal y el crecimiento durante la infancia.43 No obstante, una serie de estudios recientes aportaron nuevas luces al respecto, cambió su nombre por el de disfunción entérica ambiental o enteropatía ambiental, caracterizada por un daño importante a la estructura del epitelio intestinal, a su vez originado por una alteración en la integridad de la barrera, inflamación de la mucosa y disminución en la absorción de nutrientes; que podría derivar de un probable fenómeno lesivo ambiental.
El daño al intestino parece ocurrir en una fase temprana de la lactancia (primeros 3 a 6 meses de edad) y los marcadores de la inflamación intestinal, la permeabilidad enteral y la activación del sistema inmunitario muestran una relación inversa con el crecimiento lineal.44,45 Existe la hipótesis de que la afectación de la función de la barrera intestinal permite la translocación de microbios enterales y productos microbianos, que estimulan a los receptores de reconocimiento de patrones moleculares ubicados en las células de la inmunidad innata de los ganglios linfáticos mesentéricos y del hígado, lo que determina una inflamación sistémica crónica, que puede alterar el crecimiento. Aunque la etiología de la disfunción entérica ambiental sigue sin aclararse, es probable que la exposición recurrente a microorganismos fecales modifique la composición de la microbiota, que lleva a la inflamación intestinal crónica. Así mismo, ciertas micotoxinas que se encuentran en la dieta podrían jugar un papel determinante en la aparición de la disfunción entérica ambiental o estar implicadas en otros mecanismos que conducen al retraso del crecimiento.43
Es así como se ha observado que la microbiota intestinal puede interactuar con el exposoma gastrointestinal de varias formas. Esta puede metabolizar directamente una gran variedad de xenobióticos o sus metabolitos derivados de la conjugación hepática, que llegan al lumen intestinal desde la circulación enterohepática. Recíprocamente, algunos xenobióticos pueden interferir en la actividad metabólica de la microbiota intestinal. (Figura 2) Múltiples bacterias de la microbiota intestinal producen una gran variedad de enzimas, incluido el citocromo (CYP) P450, que lleva a cabo distintos tipos de reacciones metabólicas de un gran número de alimentos y medicamentos orales.46 Entre estos están los procesos de hidrólisis, descarboxilación, desamimación, desmetilación, apertura de anillos de compuestos heterocíclicos, reducción, deshidroxilación, aromatización y deshalogenación, entre otros. Por ejemplo, bacterias como Eubacterium aerofaciens, Desulfomonas pigra y Streptomyces coelicolor, aisladas de la materia fecal humana, contienen enzimas similares al CYP.47,48 Sin embargo, la mayor parte de los procesos metabólicos efectuado por la microbiota intestinal son la desconjugación y la reducción de los metabolitos hepáticos, que finalmente producen metabolitos no polares de menor peso molecular, que se reabsorben con facilidad desde la barrera intestinal hacia la circulación, para finalmente ser eliminados por vía renal.47 Por lo tanto, este proceso puede conducir a la regeneración de ciertos xenobióticos a la estructura química original, o a la formación de nuevos metabolitos con mayor o menor toxicidad.48
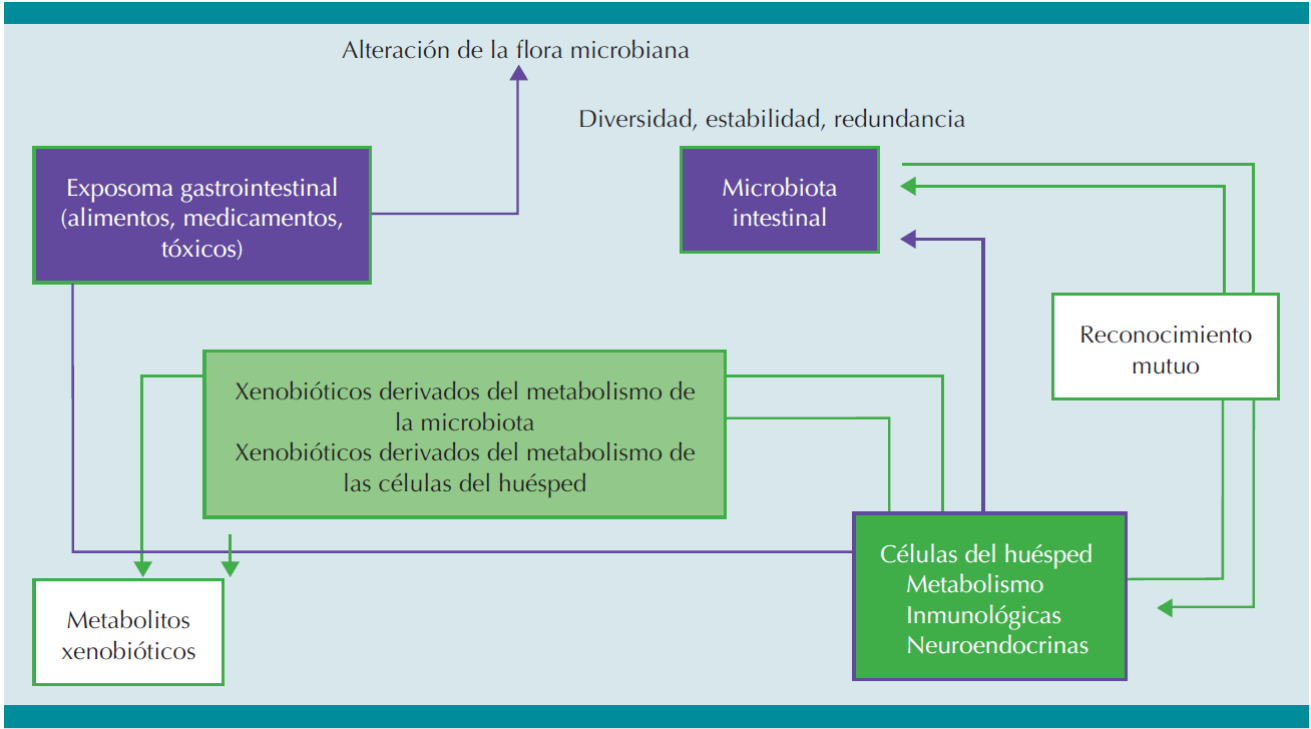
Figura 2 Vías esquemáticas del ambiente gastrointestinal. Los xenobióticos de la mucosa se convierten en metabolitos favorables o nocivos para las células del huésped y de la microbiota intestinal, que recíprocamente influyen en la biodiversidad de la microbiota intestinal y la integridad de las células del huésped. La microbiota intestinal continuamente interactúa con el huésped a través de señales inmunológicas y neuroendocrinas.
Enseguida se exponen algunas de las reacciones de biotransformación más importantes efectuadas por la microbiota intestinal en sustancias de distinta naturaleza, como: productos alimentarios, fármacos y compuestos endógenos y la repercusión de éstas en la salud gastrointestinal.
La fibra dietética es fermentada por la microbiota intestinal a componentes que promueven la salud, como los ácidos grasos de cadena corta (AGCC). Elementos solubles de la fibra dietética, como pectina, goma de mascar y mucílagos pueden ser degradados en AGCC bioactivos, que son ácidos orgánicos alifáticos saturados constituidos por 1 a 6 carbonos. Acetato (C2), propionato (C3) y butirato (C4) son los más prevalentes en el colon, y ahí están en una relación de 60:20:20 (%).49,50 La mayor parte de los ácidos grasos de cadena corta (95%) producidos en el ciego y el colon los absorbe fácilmente el epitelio intestinal.49 En particular, el colon proximal es el principal sitio destinado para la conversión de la fibra no absorbible a ácidos grasos de cadena corta por la familia Bacteroidetes.49 La fermentación de proteínas bacterianas y aminoácidos se produce en las partes más distales del colon gracias al apoyo de fermentadores proteolíticos secundarios, secretores de metabolitos potencialmente tóxicos, como: aminas, compuestos fenólicos y compuestos volátiles de sulfuro.50
Desde el punto de vista bioquímico, los ácidos grasos de cadena corta pueden inhibir parcialmente la histona deacetilasa (HDAC), que aumenta la tolerancia inmunológica y las respuestas antiinflamatoria y antineoplásica.51,52,53 Los metabolitos bacterianos identificados en los receptores acoplados a proteínas G (GPCRs) también podrían jugar un papel importante en funciones de regulación de la inflamación gastrointestinal y el síndrome metabólico, modificando la producción de leptina, la adiposidad y la secreción de insulina.54 En particular, los ácidos grasos de cadena corta inducen la secreción de péptidos, a través de la activación de los GPCRs que se encuentran en las células enteroendocrinas (CEE), modulando de esta forma algunas de las funciones, como la detección de nutrientes y el equilibrio energético.55 Además, se ha observado que la administración de prebióticos aumenta la producción de ácidos grasos de cadena corta por parte de la microbiota intestinal, lo que resulta en aumento de la secreción de péptidos intestinales a partir de las células enteroendocrinas y una modificación de la conducta alimentaria en el huésped.56 Por ejemplo, los prebióticos aumentan el número de poblaciones de Bifidobacterium y Lactobacillus, así como de diversidad de la microbiota intestinal, estimulando la diferenciación de las células enteroendocrinas y la producción de péptidos intestinales, llevando en última instancia a un aumento de la saciedad y la disminución de la ingesta energética, masa grasa, y peso corporal. Esta evidencia sugiere un papel decisivo de la microbiota intestinal y sus metabolitos, incluidos los ácidos grasos de cadena corta en la regulación de la ingesta de alimentos y el equilibrio del metabolismo energético.57,58,59,60
Ciertos flavonoides e indoles de algunos productos vegetales, como las crucíferas, son metabolizados por la microbiota intestinal, que producen metabolitos como: fenazinas, naftoquinonas y dihidroxinaftoico, que pueden activar el receptor aril hidrocarbonatado (AhR), un receptor modulador de la expresión nuclear de muchos genes que controlan la inmunidad e inflamación.61 Los derivados de triptófano de la dieta pueden ser metabolizados por la microbiota intestinal (por ejemplo, Lactobacilli) a indol-3-aldehído, un agonista del AhR. La indolamina 2,3-dioxigenasa intestinal puede catalizar la conversión de triptófano a ácido quinurénico, otro ligando del AhR.62 Esta modulación del AhR por los metabolitos de las bacterias intestinales puede ser una estrategia coevolutiva entre las bacterias comensales del intestino y el sistema inmunitario del huésped. La activación del AhR se asocia con la tolerancia inmunológica de la mucosa intestinal, mediante el establecimiento de una adecuada organización de la comunidad microbiana a través de la acción de células T reguladoras y la interleucina 22; lo que facilita la protección del huésped contra la inflamación excesiva y la infección microbiana.63 La activación crónica del AhR no siempre es benéfica porque puede favorecer la carcinogénesis.64,65 Además, los metabolitos del triptófano, como el ácido quinurénico y la niacina, también interactúan con ciertos receptores acoplados a proteínas G, como lo hacen los ácidos grasos de cadena corta.55 Además, los metabolitos bacterianos detectados por los GPCRs también están involucrados en la acción reguladora contra la inflamación gastrointestinal y el síndrome metabólico. Tomados en conjunto, los metabolitos de la microbiota vinculados con los GPCR, HDACs o AhR pueden ser objetivos prometedores para el desarrollo de nuevas intervenciones clínicas contra muchas enfermedades inflamatorias, metabólicas u oncogénicas.
En contraste con los efectos benéficos, el metabolismo de los xenobióticos efectuado por la microbiota intestinal también puede dar lugar a efectos nocivos. Por ejemplo, el metabolismo microbiano intestinal de la fosfatidilcolina (FC) proveniente de la dieta, como: colina, lecitina, trimetilamina (TMA), N-óxido, y la betaína, plantean un potente riesgo de causar enfermedades cardiovasculares.66,67 Además de la fosfatidilcolina, la L-carnitina proveniente de la dieta puede ser metabolizada en trimetilamina por la microbiota intestinal.68 La trimetilamina es convertida a N-óxido de trimetilamina (TMAO) por la flavina monooxigenasa hepática o ciertas enzimas de la microbiota intestinal. Junto con la trimetilamina, el N-óxido de trimetilamina se ha asociado con trastornos inflamatorios cardiovasculares.61,66 La administración exógena de trimetilamina o N-óxido de trimetilamina incrementa la activación de macrófagos y la lesión endotelial en los vasos sanguíneos.61,66 Algunos componentes endógenos pueden ser transformados por acción de la microbiota intestinal a metabolitos nocivos.69,70 Por ejemplo, las bacterias intestinales pueden convertir los ácidos biliares primarios en los metabolitos secundarios de los ácidos biliares, como el ácido desoxicólico y el ácido litocólico, que generan estrés oxidativo; esto favorece el daño en el ADN del enterocito y las lesiones inflamatorias en el intestino, incluyendo la formación de lesiones adenomatosas e hiperplasia de las placas de Peyer.69,70 Así mismo, se ha observado que la exposición frecuente y crónica de la mucosa a los ácidos biliares secundarios puede aumentar la inestabilidad genómica, quimiorresistencia y progresión tumoral.69,70
Conclusiones
El concepto exposoma define todas las exposiciones ambientales a las que el ser humano está sometido desde el nacimiento, surge como una nueva estrategia para evidenciar los factores de riesgo de enfermedades generadas por el medio ambiente. La determinación del riesgo en este caso tiene mayor complejidad porque se considera una multitud de exposiciones variables en el tiempo, lo que requiere mediciones basadas en diferentes tecnologías de alto costo.
Explorar la repercusión de las exposiciones en las etapas más tempranas de la vida puede ser un punto de partida clave para describir la dinámica del exposoma, debido a la mayor vulnerabilidad y al potencial impacto que las exposiciones ambientales en la primera infancia suponen en etapas posteriores de la vida. En el ámbito gastrointestinal la exposición del huésped a derivados de la dieta y otros xenobióticos puede alterar la microbiota intestinal, en términos de estabilidad, diversidad y funcionalidad. Recíprocamente, ésta participa en el metabolismo de gran número de xenobióticos.
Si bien nos falta mucho por conocer y aprender, es indudable que un mayor conocimiento de la interacción entre el huésped con el exposoma gastrointestinal y su microbioma facilitaría el mayor entendimiento del comportamiento de algunas enfermedades y permitiría el desarrollo de nuevos tratamientos médicos.











 nueva página del texto (beta)
nueva página del texto (beta)