INTRODUCCIÓN
Desde su aparición, en 1952, los esteroides tópicos representan uno de los principales pilares en el tratamiento de muchas enfermedades dermatológicas gracias a su efecto antiinflamatorio y antiproliferativo. Si se aplican de forma adecuada son seguros y eficaces; sin embargo, sin una supervisión médica correcta pueden producir graves efectos adeversos locales y sistémicos.1 Los niños, en particular los lactantes, son más propensos a manifestar estos efectos adversos, por lo que se debe vigilar estrechamente su uso en población pediátrica.
Un efecto adverso sistémico grave es el síndrome de Cushing iatrogénico que, aunque es poco frecuente, repercute de forma importante en la salud del paciente. El uso de esteroides tópicos de alta potencia también favorece la aparición de infecciones cutáneas o las empeora.
Se presenta el caso de una paciente de seis meses de edad con síndrome de Cushing iatrogénico y sarna costrosa como efectos adversos al uso de una crema con betametasona tópica, al 0.05%, combinada con clotrimazol y gentamicina.
PRESENTACIÓN DE CASO CLÍNICO
Niña de seis meses de edad, previamente sana, sin antecedentes heredofamiliares o personales patológicos de importancia. Fue llevada al servicio de Dermatología por una dermatosis de 5 meses de evolución. A su ingreso la exploración física reportó: peso de 4.910 kg (percentila < 5, Z score -2.99) y talla de 53 cm (percentila < 5, Z score -4.52), con cara de luna llena, mejillas prominentes, hipertricosis de predominio en frente, mejillas y mentón; así como giba dorsal (Figura 1).

Figura 1 Paciente de 6 meses de edad con cara de luna llena, mejillas prominentes e hipertricosis en la frente, mejillas y mentón.
Se observó dermatosis diseminada al tronco y las extremidades; en el tronco predominaba en el pecho, abdomen y genitales y en las extremidades predominaba en las palmas y las plantas; estaba constituida por múltiples pápulas eritematosas, milimétricas, pruriginosas y algunas costras hemáticas (Figura 2), así como placas queratósicas costrosas (en palmas y plantas) y paquioniquia en las uñas de las manos y pies (Figura 3).
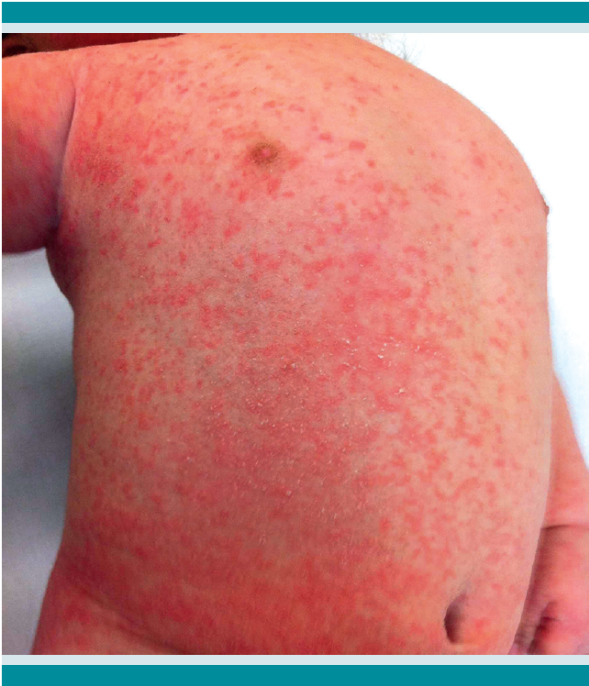
Figura 2 Múltiples pápulas eritematosas, milimétricas y algunas costras hemáticas de predominio en el tronco y las extremidades.
La madre informó que desde la tercera semana de vida se le aplicó dipropionato de betametasona al 0.05%, clotrimazol y gentamicina en crema, cada tercer día, por una supuesta dermatitis en el área del pañal, con una dosis acumulada total de esteroide de 4.28 gramos tópico en base a hidrocortisona. A los 3 meses de edad le aparecieron las lesiones costrosas descritas y la madre notó la detención del crecimiento (sin incrementos en el peso ni en la talla).
Con base en los hallazgos clínicos se diagnosticaron síndrome de Cushing iatrogénico y sarna costrosa; y tras la revisión de sus familiares se hizo el diagnóstico de escabiosis en la madre, padre y un hermano de 2 años de edad. Se suspendió el esteroide tópico y se dio tratamiento con vaselina azufrada al 5%. Los padres y el hermano fueron tratados con ivermectina vía oral (12 mg y 200 mg/kg, respectivamente) en dosis única, con la indicación de repetir el tratamiento a los 15 días.
El servicio de Endocrinología le prescribió prednisona por vía oral en dosis de reducción.
Se revaloró a la paciente al mes de tratamiento y fue evidente la desaparición de las lesiones costrosas; sin embargo, persistía la facies cushingoide (Figura 4). Durante el seguimiento se evidenció la desaparición de las manifestaciones cutáneas del síndrome de Cushing iatrogénico y recuperación del peso y la talla. Un año después de su primera consulta persistía con peso y talla por debajo de la percentila 5 (peso de 9.05 kg, Z score de 2.17, previo de -2.99 y talla de 72.6 cm Z score de -2.67, previo de -4.52).
DISCUSIÓN
Los esteroides tópicos son la primera línea de tratamiento para muchas dermatosis por su variedad de efectos antiinflamatorios, inmunosupresores antiproliferativos y vasoconstrictores.2 Su uso adecuado permite que sean seguros y eficaces; sin embargo, su uso incorrecto causa efectos adversos locales y sistémicos1,2 (Cuadro 1).
Existen diversos factores que incrementan la absorción de los medicamentos en la piel y, por lo tanto, aumentan la probabilidad de causar efectos adversos. En nuestra paciente varios de estos factores influyeron en la aparición del síndrome de Cushing iatrogénico y de la sarna costrosa:
Potencia del esteroide utilizado. Los efectos adversos se pueden presentar con cualquier esteroide tópico, incluso con los de baja potencia como la hidrocortisona al 1%;3 sin embargo, son los esteroides de mayor potencia los que se asocian más frecuentemente con efectos adversos. Se ha descrito que incluso la aplicación durante pocos días de 2 g de propionato de clobetasol al 0.05% (esteroide clase 1 o superpotente) es suficiente para suprimir el eje hipotálamo-hipófisis-suprarrenal.1 En nuestra paciente se aplicó dipropionato de betametasona al 0.05% en crema, que es un esteroide superpotente.2
Sitio de aplicación del esteroide. La absorción del medicamento es menor al 1% en zonas como las palmas o las plantas, donde la piel es más gruesa; sin embargo, en áreas de piel delgada como párpados, escroto o área del pañal la absorción puede llegar a ser del 35%.4
Aplicación sobre una piel enferma que ha perdido su función de barrera (como en dermatitis atópica o dermatitis del área del pañal).5-7 Esto incrementa la absorción del fármaco 2 a 10 veces más en comparación con la absorción en piel sana.1
Cobertura de la zona donde se aplica el esteroide.5,8 El uso de pañal en lactantes tiene efecto oclusivo.
Edad del paciente. Los lactantes tienen mayor proporción de superficie corporal cutánea en relación con su peso, lo que aumenta la absorción cutánea de cualquier medicamento tópico.2,5
Los factores mencionados permiten entender porqué los niños son más susceptibles a los efectos adversos causados por el uso de esteroides tópicos.
En un informe de la FDA (US Food and Drug Administration) se revisaron 22 casos de insuficiencia o supresión adrenal, síndrome de Cushing iatrogénico o retraso del crecimiento secundarios al uso de esteroides tópicos, en pacientes entre 6 meses y 15 años de edad. La indicación más común para el uso del esteroide tópico fue la dermatitis atópica (7 casos) y en segundo lugar la dermatitis del área del pañal (6 casos). En 11 de los 22 casos el medicamento se utilizó durante más de 3 meses, incluyendo 7 pacientes en los que se utilizó durante más de un año. El esteroide más frecuentemente utilizado fue betametasona (en 5 casos valerato de betametasona y en 3 dipropionato de betametasona) seguido del propionato de clobetasol al 0.05% (7 casos).9 Estos datos son similares a lo ocurrido con nuestra paciente en quien se aplicó dipropionato de betametasona al 0.05% durante más de 3 meses por una dermatitis del área del pañal.
El síndrome de Cushing es el resultado de la exposición prolongada e inapropiada a concentraciones excesivas de glucocorticoides circulantes, ya sean de producción endógena o exógena.10 La causa más frecuente en la edad pediátrica es la administración exógena o iatrogénica; es una entidad poco frecuente en niños, se han descrito cerca de 2-5 casos nuevos por millón de habitantes por año y de éstos sólo 10% ocurre en niños.11
La manifestación clínica más frecuente en pacientes pediátricos es el incremento de peso asociado a la detención en la talla. Otras manifestaciones son: cefalea, hipertensión arterial, hipertricosis, acné, estrías violáceas y acantosis nigricans.11 En nuestro caso hubo detención del crecimiento (peso 4.9 kg con Z score -2.99 y talla de 53 cm con Z score -4.52), hipertricosis en la cara, facies de luna llena y giba dorsal. La mayoría de estas manifestaciones son reversibles con el tratamiento adecuado del síndrome de Cushing; sin embargo, el retraso en el crecimiento puede repercutir en la talla final del paciente.
Existen diversos reportes de síndrome de Cushing iatrogénico secundario al uso de una combinación de esteroide, antimicótico y antibiótico tópicos (dipropionato de betametasona, clotrimazol y gentamicina).9 Esta combinación es comúnmente utilizada en la población pediátrica mexicana por su fácil accesibilidad, por su bajo costo y por la falta de conocimiento de los efectos adversos que pueden sobrevenir con la aplicación de esteroides tópicos y sistémicos, en especial si se utilizan en áreas de piel delgada, lastimada y bajo oclusión, como la del pañal.
Es importante reconocer este síndrome para dar un tratamiento integral. Además de suspender el esteroide tópico se debe administrar un esteroide por vía oral en dosis de reducción dado que, por la administración prolongada, hay supresión del eje hipotálamo-hipófisis-suprarrenal, la suspensión abrupta del esteroide tópico o un evento agudo debe ser tratado con hidrocorticoides porque puede desencadenarse una crisis suprarrenal aguda o un cuadro de insuficiencia suprarrenal que podría ser mortal.6
Otros efectos adversos de los esteroides tópicos se deben a su capacidad inmunodepresora, la cual favorece o empeora ciertas infecciones en la piel.1,5
La escabiosis, comúnmente conocida como sarna, es una parasitosis cutánea muy contagiosa ocasionada por el ácaro Sarcoptes scabiei, variedad hominis. Se estima que afecta aproximadamente a 300 millones de personas al año a escala mundial.12 En México la incidencia es de 55 casos por cada 100,000 habitantes.13 Clínicamente se caracteriza por pápulas eritematosas, vesículas, nódulos y túneles, así como costras hemáticas y escoriaciones debidas al intenso prurito.12 La variedad costrosa se caracteriza por placas queratósicas con grietas, fisuras y escaso prurito.13
A diferencia de la sarna clásica, donde el promedio de ácaros en un paciente infectado es de 10 a 15,12 en la variedad costrosa hay una infestación por miles a millones de ácaros, lo que la hace mucho más contagiosa que la variedad clásica.14
La sarna costrosa generalmente ocurre en pacientes inmunocomprometidos, con antecedente de aplicación de esteroides tópicos, diabéticos, infectados por el virus de inmunodeficiencia humana, con leucemia de células T, linfomas, enfermedades autoinmunitarias o malnutrición, así como pacientes física o mentalmente discapacitados.12,14,15
En condiciones normales ocurre una reacción de hipersensibilidad mediada por células a los antígenos del ácaro, responsables de las manifestaciones clínicas y de limitar la infestación. Sin embargo, cuando se altera la inmunidad celular se favorece la infestación por miles a millones de ácaros, dando lugar a un cuadro de sarna costrosa.14
De acuerdo con las Guías de los Centros para el Control y la Prevención de Enfermedades (US Centers for Disease Control and Prevention) el tratamiento de la sarna costrosa requiere el uso de escabicidas tópicos y sistémicos.16 Dado que la ivermectina por vía oral no está aprobada para pacientes menores de 2 años o menores de 15 kg12 se decidió indicar vaselina azufrada al 5%, con lo que se alivian las lesiones.
CONCLUSIONES
La aplicación incorrecta de esteroides tópicos tiene efectos adversos locales y sistémicos, especialmente en lactantes. Pueden ocasionar atrofia cutánea, empeorar infecciones cutáneas, retrasar la cicatrización de heridas e incluso suprimir el eje hipotálamo-hipófisis-suprarrenal y ocasionar un síndrome de Cushing iatrogénico. Es necesario que tanto los médicos de primer contacto, como los pediatras, conozcan estos efectos al momento de prescribir esteroides tópicos en niños, especialmente en áreas de piel delgada (como el área del pañal) donde la absorción del medicamento se incrementa. Algunas estrategias para disminuir estos efectos adversos incluyen administrar esteroides de baja potencia y durante el menor tiempo posible, así como la educación a los padres acerca de la aplicación correcta de los esteroides tópicos, sobre todo en países como México donde estos medicamentos se pueden adquirir sin prescripción médica.











 nueva página del texto (beta)
nueva página del texto (beta)





