DEFINICIONES
La discapacidad intelectual (DI) o retraso mental tiene una prevalencia del 2-3% en la población general y se define como una alteración del neurodesarrollo que inicia antes de los 18 años. Se caracteriza por limitación importante en el funcionamiento intelectual y en el comportamiento adaptativo en áreas como comunicación y uso de fuentes para la misma, autocuidado, relaciones sociales o interpersonales, autodirección, funciones académicas, salud y seguridad.1,2 La DI se determina por un coeficiente intelectual (CI) menor de 70 puntos mediante escalas como la International Classification of Diseases (ICD-10), Diagnostic and Statistical Manual of Mental Disorders (DSM-V) y la clasificación World Health Organization (WHO).3,4
En los pacientes menores de 5 años se considera como retraso global del desarrollo o retraso psicomotor (RPM) y para su definición se utilizan diferentes escalas como la de Gesell, la cual otorga un porcentaje del desarrollo mediante la evaluación de las áreas de lenguaje, motricidad, psicosocial y adaptativo.5 El promedio del CI en la población general es de 100, limítrofe entre 70 y 85 y por debajo de 70 se considera DI. Un CI de 50-70 es DI leve, moderado de 35-49, grave de 20-34 y profundo cuando es menor de 20. El 2 al 2.5% de la población tiene DI leve y sólo 0.3 a 0.5% lo presenta grave y de estos últimos del 25 al 50% son de etiología genética y suelen acompañarse de otras manifestaciones clínicas.6
Por lo general, los pacientes con RPM o DI presentan múltiples malformaciones congénitas asociadas, las cuales se definen como anomalías morfológicas que se originan antes de nacer, se presentan en un 3% de los recién nacidos, aunque esta cifra se duplica en el transcurso de la vida debido a la presencia de defectos no detectables al nacimiento y contribuyen de manera importante a pérdidas gestacionales y a la morbimortalidad pediátrica.7,8
ETIOLOGÍA
Es bien conocido que la DI es de origen multifactorial, aunque también puede haber causas solo ambientales o genéticas que lo condicionen. A nivel ambiental destacan la desnutrición durante el embarazo, exposición a agentes físicos (radiaciones), químicos (alcoholismo materno) o biológicos (TORCH).5 En la etiología genética se encuentran: a) Las alteraciones cromosómicas tanto numéricas como estructurales, en donde encontramos aneuploidías como trisomías 13, 18 y 21, síndromes de Klinefelter y Turner con sus variantes, así como translocaciones no balanceadas, deleciones, duplicaciones y rearreglos complejos; todos éstos implican un desbalance en el número de copias de regiones génicas que pueden ser identificadas por medio de Citogenética o Citogenómica; b) Las alteraciones monogénicas, de las cuales existen más de 1200 entidades con DI que están referidas en el sistema de Online Mendelian Inheritance in Man (OMIM – www.ncbi.nlm.nih.gov/sites/entrez?db=omim) y aunque se sabe que los genes relacionados con la función cerebral se encuentran distribuidos a lo largo de todo el genoma, actualmente se ha descrito que el número de genes relacionados con la discapacidad intelectual es mucho mayor en el cromosoma X que en cualquier otro cromosoma.9
En los últimos años, se han identificado varios genes como el FMR2, OPHN1, GDI1, PAK3, IL1RAPL, TM4SF2, VCX-A, y ARHGEF6, los cuales también pueden ser parte de la etiología del RPM o DI sindrómico, autismo u otros defectos del neurodesarrollo.10
El presente trabajo se enfoca en la primera parte de la etiología genética, relativo al desbalance en el genoma, ya sea por cambio en el número de cromosomas o de número de copias de regiones subcromosómicas.
ABORDAJE
Clínico
Actualmente, las causas de la DI son mejor conocidas; hasta la fecha se sabe que sólo en el 40 a 60% de los pacientes con DI se conoce la causa genética, de los cuales este porcentaje es menor cuando los pacientes presentan DI leve o moderado.11 Por esto, para conocer la causa de un cuadro clínico con DI y dismorfias se requiere realizar un abordaje integral del paciente que comprende una historia clínica completa y detallada con árbol genealógico, antecedentes familiares, antecedentes prenatales, perinatales y evolución postnatal, con una exploración física minuciosa de dismorfias mayores y menores, exploración neurológica y evaluación mental.12
Dentro de los estudios de laboratorio y gabinete que se solicitan están las pruebas de función tiroidea, TORCH (por sus iniciales en inglés de toxoplasmosis, rubeola, citomegalovirus, herpes simple y VIH), tamiz metabólico y cariotipo, así como ultrasonido (USG) transfontanelar, tomografía axial computada (TAC), o en su caso resonancia magnética (IRM) cerebrales. También es importante tomar en cuenta la utilidad de las bases de datos para diagnóstico como el Pictures Of Standard Syndromes and Undiagnosed Malformations (POSSUM) y el London Dysmorphology Database.7
El abordaje idóneo para el estudio de los pacientes con DI se ilustra en la Figura 1, la cual nos muestra las rutas adecuadas para tratar de llegar a un diagnóstico etiológico; sin embargo, es importante recalcar que esto se logra solo en el 50% de los casos con DI.9
Citogenético
El número de 46 cromosomas en la especie humana fue descubierto en 1956,13 y las aneuploidías en 1959. Cuando Lejeune y cols.14 reportaron que el síndrome de Down se debía a la trisomía de un cromosoma 21 (OMIM 190685) y que era la causa más común del retraso mental. La introducción de técnicas como la de bandas G en los 70s, facilitó la identificación de cada uno de los cromosomas, así como la detección de alteraciones cromosómicas relacionadas con algunos fenotipos,15 de manera que se integraron síndromes que cursan con DI y malformaciones y que pueden ser distinguibles clínicamente y comprobables con un cariotipo convencional, como las aneuploidías más frecuentes, las trisomías 13, 18, 21, y de cromosomas sexuales.
Otras alteraciones cromosómicas estructurales, como algunas deleciones o duplicaciones detectables al microscopio, se han podido integrar como una entidad reconocible por sus características fenotípicas. Las deleciones de los cromosomas 5p (síndrome de Cri-du-chat) o 4p (síndrome de Wolf) son detectables mediante el cariotipo con bandeo G y generalmente resuelve el diagnóstico. En pacientes sin un síndrome identificable, pero con DI y dismorfias, se han detectado alteraciones en prácticamente todos los cromosomas y generalmente desbalanceadas; las más frecuentes son las translocaciones, deleciones, duplicaciones e inversiones.
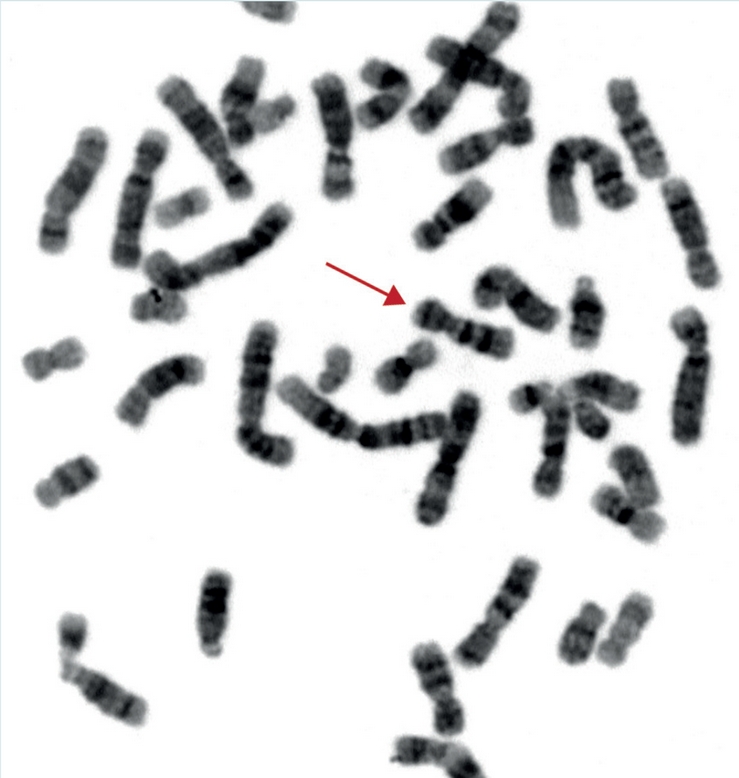
Las frecuencias reportadas de alteraciones cromosómicas detectadas al microscopio son muy variables. Xu y cols.16 reportaron una media de 16.2% (rango: 4-34.1%), Shevell y cols.17 un 3.7% (rango: 2.9-11.6%) y en la revisión más reciente de van Karnebeek y cols.18 la media fue de 9.5% (rango: 0-48.5%). De esta manera, el cariotipo convencional con bandeo G es una metodología relativamente barata y accesible, su resolución a 400-500 bandas (lo más utilizado), permite detectar alteraciones cromosómicas mayores a 5 o 10 megabases (Mb) y esto nos permite proporcionar un diagnóstico de certeza en el 10% de los pacientes con sospecha de cromosomopatía (Figura 2).19
Entre 1980 y 1990 se incrementó la resolución del estudio citogenético al utilizar la metodología de hibridación in situ con fluorescencia (FISH), la cual usa sondas de DNA marcadas con fluorocromos, para identificar la presencia, el número y localización de regiones cromosómicas pequeñas (sub-microscópicas) y así detectar microdeleciones, microduplicaciones y translocaciones crípticas (Figura 3). Para realizar el FISH se requiere tener la información o la sospecha clínica del segmento cromosómico involucrado, debido a que el estudio no es a nivel genómico, sino totalmente dirigido a una región específica del genoma. Esta metodología es muy útil para el diagnóstico de microdeleciones como la 22q11 o 1p36, ya que en estos pacientes el fenotipo puede hacer sospechar la alteración cromosómica y la resolución del FISH al ser alta puede detectar alteraciones tan pequeñas como de kilobases utilizando las sondas apropiadas. Actualmente existe una larga lista de microdeleciones o microduplicaciones que se han integrado como síndromes y son reconocibles por la experiencia clínica de los médicos tratantes (Cuadro 1).
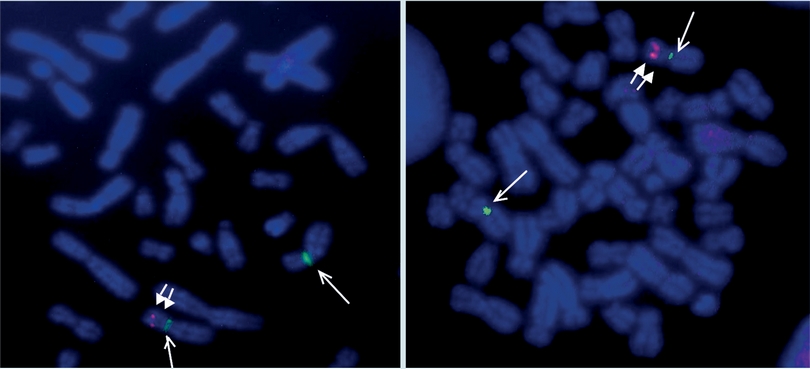
Figura 3 Análisis de FISH para la detección de una microdeleción 7p15. Análisis de una metafase con las sondas alfa satélite (una flecha delgada), para la localización del centrómero del cromosoma 7 (D7Z1) marcada con fluorocromo verde (Q-BIOgene) y sonda locus específica (dos flechas gruesas) para la detección de la región 7p15.2 en donde se localizan los genes HOXA6-HOXA13 marcada con fluorocromo rojo (SureFiSH, Agilent).
Cuadro 1 Síndromes por microdeleción y por microduplicación
| Deleción 1p36 | 1p36.33 | Síndrome de duplicación 2q31.1 | 2q31.1 |
| Síndrome de Williams | 7q11.23 | Síndrome de duplicación 2q35 | 2q35 |
| Síndrome de Langer-Giedion | 8q24.1 | Síndrome de duplicación 3q29 | 3q29 |
| Síndrome de WAGR (Tumor de Wilms, aniridia, alteraciones de genitales, retraso mental) | 11p13 | Síndrome de triplicación WBS (Williams-Beuren Syndrome) 7q11.23 | 7q11.23 |
| Síndrome de Angelman | 15q11.2 | Síndrome de duplicación 8q22.1 | 8q22.1 |
| Síndrome de Prader Willi | 15q11.2 | Síndrome de duplicación 15q11q13 | 15q11q13 |
| Síndrome de Rubinstein-Taybi | 16p13.3 | Síndrome de Potocki-Lupski | 17p11.2 |
| Síndrome de Smith Magenis | 17p11.2 | Charcot-Marie-Tooth1A | 17p11.2p12 |
| Síndrome Miller-Dieker | 17p13.3 | Síndrome de duplicación 17q12 | 17q12 |
| Síndrome Velocardiofacial | 22q11.2 | Síndrome de duplicación 17q21.31 | 17q21.31 |
| Síndrome Phelan-Mcdermid | 22q13.33 | Síndrome de duplicación 22q11.2 | 22q11.2 |
| Síndrome de Kallmann | Xp22.31 | Síndrome de duplicación Xq25 | Xq25 |
Citogenómico
Cuando los pacientes con DI y dismorfias no tienen un fenotipo que haga sospechar de alteraciones en regiones cromosómicas específicas, se debe recurrir a metodologías que exploren el genoma completo. Por esto, se desarrolló otra metodología de mayor resolución (3-5Mb) conocida como hibridación genómica comparativa (CGH). Ésta originalmente utilizaba como sonda el genoma completo y como blanco metafases normales completas, sin embargo, la capacidad de detección de alteraciones era todavía a nivel de cromosomas,8 por lo que rápidamente se migró al desarrollo de metodologías de microarreglos de CGH (aCGH),8 los cuales tuvieron sus inicios en 1997 con Salinas-Toldo y cols.,20 así como en 1998 con Pinkel y cols.21 Los aCGH cuentan con una resolución ≤1-Mb, ya que en lugar de cromosomas metafásicos utiliza segmentos de DNA obtenidos de clonas de DNA de regiones conocidas del genoma humano u oligonucleótidos, que están fijos sobre una laminilla y cuyo sitio en el genoma humano se conoce muy bien. Por lo general, estos oligonucleótidos del genoma completo se tienen por triplicado en el microarreglo y se procesan en plataformas comerciales. Esta metodología se fundamenta también en la hibridación genómica comparativa, en la cual se utiliza como sonda el genoma completo del paciente, el DNA se fragmenta y se marca con un fluoróforo verde (Cianina 3 o Cy3) y de manera paralela se utiliza un DNA de referencia para la comparación; el genoma de referencia puede provenir de un pool de DNAs de personas normales que se fragmenta y se marca con un fluoróforo rojo (Cianina 5 o Cy5); una vez marcados, los dos DNAs en relación 1:1 se hibridan competitivamente sobre el microarreglo, de manera que si la relación Cy3:Cy5 está alterada, indica una pérdida o una ganancia del DNA del paciente.22
Los aCGH permiten el escaneo completo del genoma, lo que da lugar a la detección de variaciones en el número de copias (CNVs), las cuales forman parte de la evolución del ser humano y de la diversidad genética entre individuos, pero también se han encontrado CNVs que son causales de diversas enfermedades que incluyen DI.23 Dentro de las limitantes de esta tecnología, se encuentra la incapacidad de detectar alteraciones cromosómicas balanceadas como translocaciones o inversiones y tampoco puede detectar mosaicos bajos (<20%). La interpretación de los resultados requiere de un análisis muy preciso utilizando diversas bases de datos internacionales como Database of Genomic Variants (DGV), International Standard Cytogenomic Array consortium Databases (ISCA), Database of Chromosomal Imbalance and Phenotype in Humans using Ensemble Resources (DECIPHER) y Online Mendelian Inheritance in Man (OMIM). Este análisis requiere de la experiencia del Médico Genetista para poder asociar las características fenotípicas con las funciones de los genes que se encuentran en dosis anormales, así como para la interpretación de CNVs que involucran genes con función aún desconocida, y de manera muy importante, para identificar variantes normales (polimorfismos), no relacionados con el cuadro clínico del paciente. Este análisis constituye el paso definitivo para detectar las alteraciones genómicas causales de la enfermedad, como desbalances por microdeleciones o por microduplicaciones, posibles cromosomas derivativos, aneuploidías y rearreglos subteloméricos.24-27
En las alteraciones por microdeleción y/o microduplicación el espectro del fenotipo, definido como las características bioquímicas, fisiológicas y morfológicas observadas en un individuo, determinadas por el genotipo y el ambiente en el que se expresa, se puede atribuir al mal funcionamiento de un gen sensible a dosis, ya sea por reducción de la cantidad de proteína secundaria a la pérdida del gen o por ganancia de función como consecuencia de una duplicación de un gen o genes completos.
En los síndromes de genes contiguos, generalmente el fenotipo resulta de la inapropiada dosis génica de una región determinada; el fenotipo en ciertas ocasiones es fácilmente reconocible por las características clínicas, lo que permite tener una sospecha diagnóstica (ej. síndrome de Prader-Willi, síndrome de Williams); sin embargo, en muchas otras ocasiones esto resulta difícil, a pesar de la fuerte asociación bien conocida entre DI, malformaciones congénitas y dismorfias faciales con desbalances genómicos.
Actualmente, además de estudios en CNVs, existe el análisis de microRNAs (miRNAs) en pacientes con discapacidad intelectual o retraso mental. Los miRNAs son RNAs cortos (de 20 a 23 nucléotidos) no codificantes que regulan la expresión de ciertos genes a nivel postranscripcional. Se sabe que más del 90% de los genes humanos se regulan por miRNAs e incluso, alrededor del 70% de estos pequeños RNAs se expresan en cerebro y tienen función en el neurodesarrollo, neurotransmisión, plasticidad sináptica y crecimiento neuronal. En un estudio reciente sobre miRNAs en población con DI, se demostró un incremento significativo del involucro de éstos en los CNVs patogénicos reportados en el DECIPHER. Así mismo, los miRNAs encontrados en los CNVs de novo, tienen mayor expresión en tejidos cerebrales en comparación con los de los CNVs comunes, por lo que los autores sugieren que los miRNAs de los CNVs de novo y de los patogénicos pudieran contribuir a la etiopatogenia de la DI.28
Diversos estudios con aCGH demuestran una variabilidad en la frecuencia de detección de alteraciones cromosómicas (Cuadro 2);29,10,30-34 sin embargo, el porcentaje en el grupo de pacientes con RPM o DI asociado o no con malformaciones congénitas y con cariotipo normal continúa siendo mayor con respecto al porcentaje detectado por citogenética convencional, por lo que los aCGH o los microarreglos no comparativos se están convirtiendo en el estudio de primera elección para pacientes con DI idiopática, alteraciones del espectro autista y múltiples malformaciones congénitas.
El establecer un diagnóstico de certeza, permitirá ofrecer algún tipo de manejo y sobre todo un asesoramiento genético adecuado para toda la familia, ya que posibilita al genetista estimar un riesgo de recurrencia más certero para futuros embarazos. Para los padres, esto generalmente disminuye su ansiedad, ya que en la mayoría de los casos el evento es de novo y la pareja tendrá un riesgo de recurrencia muy bajo.











 nueva página del texto (beta)
nueva página del texto (beta)