RESUMEN CLÍNICO
Adolescente femenino de 13 años de edad, originaria de Guerrero, grupo étnico mixteco, padres analfabetos y con poco entendimiento del español. Sin otros antecedentes de importancia para el padecimiento. Inició un mes previo con la aparición de una pápula hipercrómica en párpado superior derecho que en los 10 días previos al ingreso aumentó de volumen generando proptosis. Al interrogatorio se negó dolor, lagrimeo, fiebre, o pérdida de peso. Ingresó con fiebre (39.0ºC), palidez generalizada, proptosis derecha con exposición de córnea y conjuntiva, eritema periorbitario, movimientos oculares y agudeza visual disminuidos (i.e. contaba dedos a 1 m), pupila con tendencia a midriasis, hiperreactividad a la luz, y fondo de ojo con papila hiperémica edematosa y tortuosidad peripapilar. El resto de exploración no mostró datos relevantes. Se hospitalizó para iniciar tratamiento antimicrobiano parenteral de amplio espectro (i.e. ceftriaxona y vancomicina) y abordar proptosis unilateral.
La ultrasonografía ocular reportó una lesión heterogénea que ejercía compresión y desplazamiento en sentido anterior del globo ocular derecho, y datos de inflamación de tejidos blandos (Figura 1). La tomografía computada describió la lesión como heterogénea e identificó datos de sinusitis y proptosis (Figura 2). Por resonancia magnética se reportó la misma lesión con aspecto heterogéneo de 5.5 ' 2.5 cm en sus diámetros mayores, que involucró tejidos musculares y con efecto de masa sobre estructuras orbitarias. No se observó extensión intracraneal, a cavidades paranasales ni al seno cavernoso (Figura 3). Ante una proptosis de rápida evolución y sospecha de probable rabdomiosarcoma se realizó biopsia transconjuntival de lesión intraconal y tejido peri-orbitario. Las preparaciones histológicas de la lesión intraconal y de la grasa orbitaria mostraron tejidos blandos con un proceso inflamatorio, necrótico con vasculitis de vasos de pequeño calibre con afección ocasional a vasos arteriales y venosos de mayor calibre. La vasculitis fue a expensas de linfocitos e histiocitos con trombosis aislada y algunos granulomas mal constituidos. El proceso inflamatorio estaba constituido por linfocitos, histiocitos, células plasmáticas y en una zona se mezclan con numerosos neutrófilos con cariorexis; la necrosis fue isquémica. Se realizaron diversas tinciones de histoquímica convencional e inmunohistoquímica para descartar neoplasia linfoide maligna o proceso infeccioso granulomatoso como micobacterias u hongos. La glándula lagrimal mostró afección por el proceso inflamatorio, la necrosis isquémica y la propia vasculitis. El diagnóstico fue de: granulomatosis de Wegener (Figura 4).
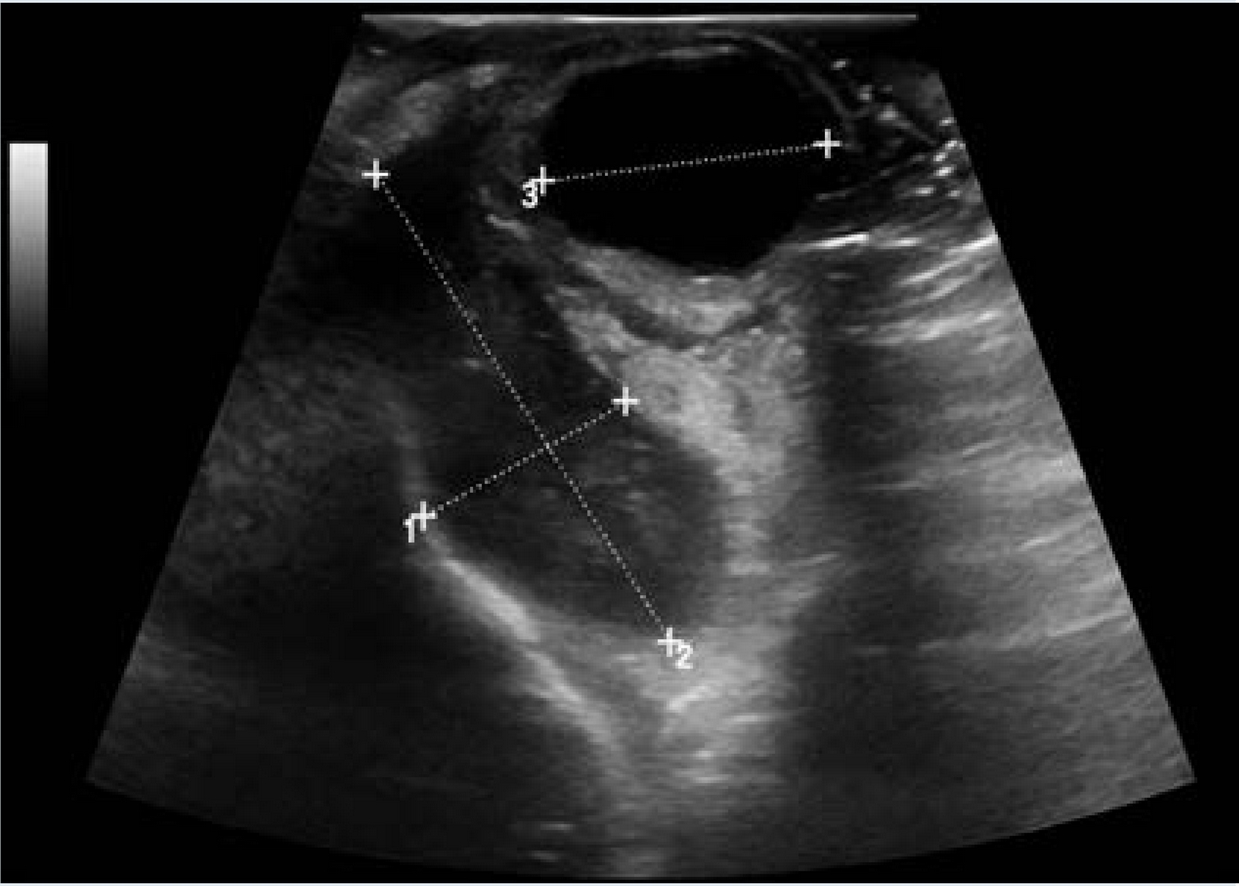
Figura 1 Ultrasonido ocular. Se observa compresión y desplazamiento en sentido anterior del globo ocular derecho, incremento del grosor del músculo recto externo con incremento de su vascularidad, con compresión y desplazamiento lateral y medial sobre la región del cono. Al rededor del músculo se observó un halo ecogénico considerado como celulitis con involucro de tejido adiposo, correlacionado con aumento de volumen del tejido celular subcutáneo del párpado inferior de aspecto heterogéneo.
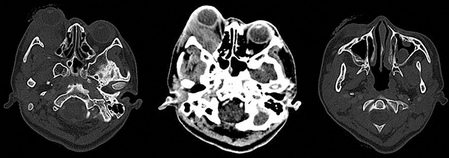
Figura 2 Tomografía axial computada. Se observa lesión lobulada de bordes mal delimitados en región superolateral de la órbita, de 53 × 23 × 38 mm en sus ejes anteroposterior, transverso y craneocaudal, respectivamente. Reforzamiento heterogéneo, en promedio de 50 UH, con componente intra- y extraconal lateral. Pobre interfase entre la lesión nervio óptico ipsilateral, así como con el músculo recto inferior. Las paredes de la órbita se encontraron respetadas, sin alteraciones en fosas temporales. Incremento de la densidad de los tejidos blandos palpebrales tanto superiores como inferiores, engrosamiento mucoso en senos maxilares y esfenoidal izquierdo con presencia de imágenes polipoideas, de hasta 50 UH. UH: unidades Hunsfield.
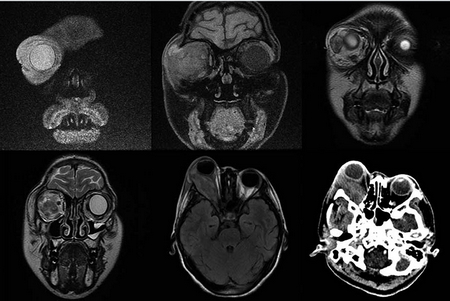
Figura 3 Resonancia magnética. Se observa una lesión intraorbitaria derecha, intra- y extraconal de aspecto heterogéneo, de 5.5 × 2.5 cm en sus diámetros mayores, que involucra al músculo recto externo, produciendo efecto de masa con proptosis y leve moldeamiento del globo ocular, desplazamiento del resto de estructuras musculares extraoculares, nervio óptico y glándula lacrimal, de aspecto hipointenso e hiperintensa en T1 y T2, con reforzamiento intenso y heterogéneo tras la administración de material de contraste con áreas que no reforzaron, sugestivas de necrosis. No se observa extensión intracraneal, ni a cavidades paranasales o a seno cavernoso.
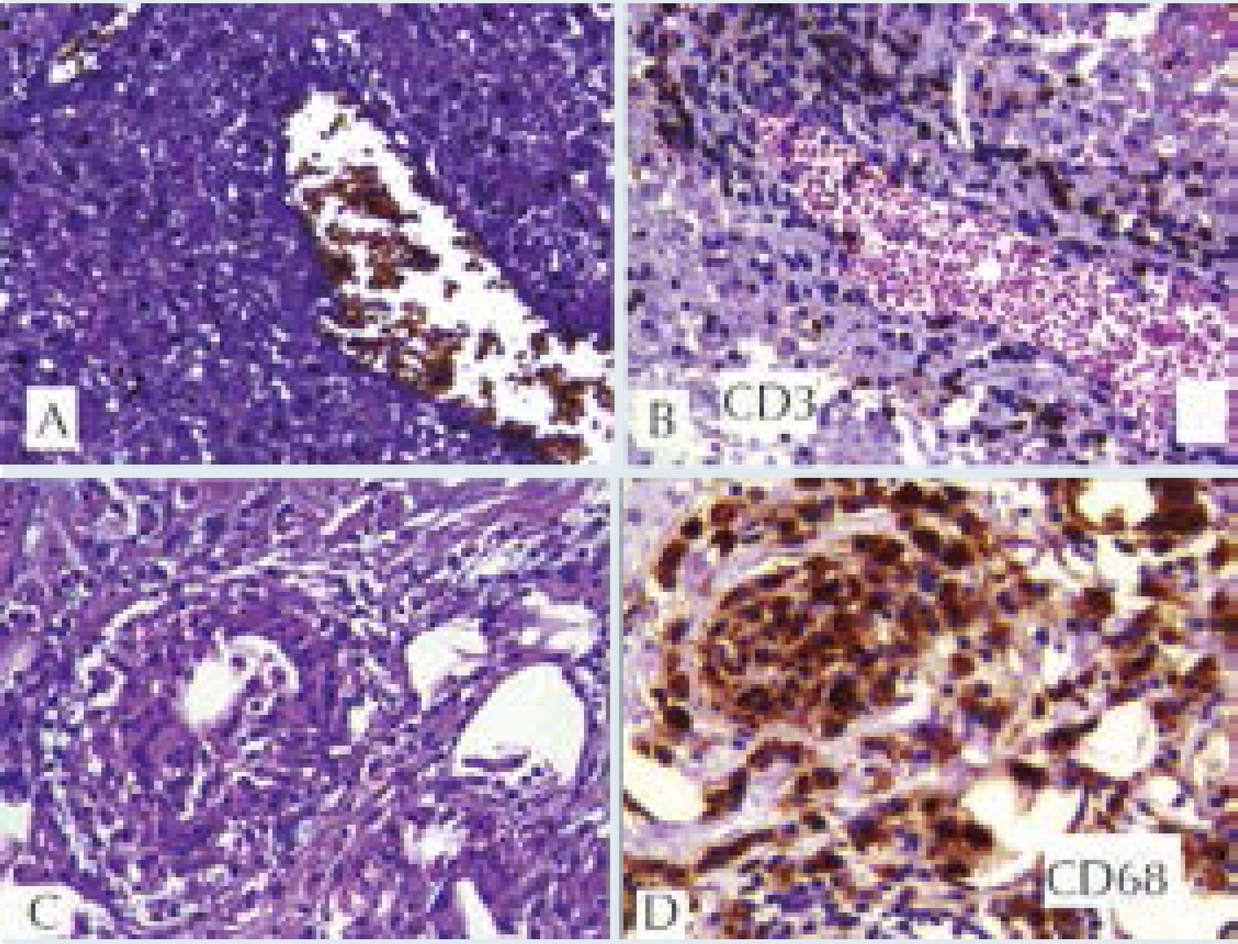
Figura 4 Biopsia de tejido periorbitario. A) Vasculitis: tinción de fibras elásticas en vaso venoso con infiltrado linfocitario en su pared. B) CD3 marcador de linfocitos T en la pared de la vena. C) Granuloma constituido por histiocitos epitelioides y una célula gigante multinucleada. D) CD68 marcador de histiocitos positivo en granuloma. A-C) Tinción de hematoxilina & eosina a 40X. D) Tinción para inmunoperoxidasa a 40X.
Ante un diagnóstico clínico e histológico compatible con granulomatosis de Wegener se realizó evaluación de daño sistémico descartando afección a cualquier otro órgano, integrando enfermedad limitada a órbita (Cuadro 1).
Cuadro 1 Estudios de extensión
| Biometría hemática | ||
| Hemoglobina | 11.6 g/dL | 10.9 - 15.7 g/dL |
| Hematocrito | 36.50% | 36.0 - 45.0% |
| CHCM | 34.3 g/dL | 32.0 - 36.0 g/dL |
| CHM | 25.8 pg | 27.5 - 33.2 fL |
| VCM | 75.3 fL | 80 - 90 fL |
| ADE | 19.00% | 12.6 - 15.2% |
| Leucocitos | 5,300/mm3 | 4,500 - 13,500/mm3 |
| Neutrófilos | 4,028/mm3 | 1,500 - 8,500/mm3 |
| Monocitos | 1,113/mm3 | 1,500 - 6,500/mm3 |
| Eosinófilos | 0/mm3 | 0 - 400/mm3 |
| Basófilos | 0/mm3 | 0 - 200/mm3 |
| Plaquetas | 106,000/mm3 | 150,000 - 350,000/mm3 |
| Reticulocitos | 2.00% | 0 - 2.0% |
| COOMBS directo | positivo 1:4 | negativo |
| ANAs | negativos | negativos |
| ANCAs | negativos | negativos |
| Perfil tiroideo | ||
| TSH | 0.88 mcU/mL | 0.4 - 4.0 mcU/mL |
| T3L | 1.3 pg/mL | 1.8 - 6.0 pg/mL |
| T3T | 53 ng/dL | 70 - 180 ng/dL |
| T4L | 1 ng/dL | 0.8 - 1.9 mg/dL |
| T4T | 5.6 mcg/dL | 4.5 - 12.5 mcg/dL |
| Serologías | ||
| HVB | negativa | negativa |
| HVC | negativa | negativa |
| VIH | negativa | negativa |
| Chagas | negativa | negativa |
| Brucella | negativa | negativa |
| VDRL | negativa | negativa |
| Cultivos (aerobios, anaerobios y hongos) | ||
| Sangre | sin desarrollo | sin desarrollo |
| LCR | sin desarrollo | sin desarrollo |
| Biopsias | sin desarrollo | sin desarrollo |
| Orina | sin desarrollo | sin desarrollo |
| Pruebas de función hepática | ||
| AST | 31 IU/L | 10 - 30 IU/L |
| ALT | 33 IU/L | 10 - 30 IU/L |
| Albúmina | 3.2 g/dL | 3.8 - 5.4 g/dL |
| FA | 132 IU/L | 105 - 420 IU/L |
| DHL | 268 IU/L | 125 - 220 IU/L |
| GGT | 22 IU/L | 14 - 25 IU/L |
| BT | 0.94 mg/dL | < 1.0 mg/dL |
| BD | 0.28 mg/dL | < 0.6 mg/dL |
| BI | 0.66 mg/dL | 0.10 - 0.60 mg/dL |
| Proteínas tot | 7.0 g/dL | 6.3 - 8.6 g/dL |
| Pruebas de función renal | ||
| BUN | 8.8 mg/dL | 7.0 - 17.0 mg/dL |
| Creatinina | 0.31 mg/dL | .060 - 1.0 mg/dL |
| Ácido úrico | 1.9 mg/dL | 3.0 - 5.8 mg/dL |
| Tiempos de coagulación | ||
| TP | 11.10 " | 10.43 - 13.63" |
| TP% | 101% | 76.04 - 124.04% |
| INR | 0.92 | 0.96 - 1.15 |
| TTP | 26.1" | 24.0 - 37.0" |
| Fibrinógeno | 254 mg/dL | 160 - 390 mg/dL |
| Otros | ||
| Triglicéridos | 146 mg/dL | 39 - 120 mg/dL |
| Colesterol | 186 mg/dL | 125 - 205 mg/dL |
| Amilasa | 60 U/L | 5 - 260 U/L |
| Lipasa | 22 UI/L | < 38 UI/L |
| CK | 72 IU/L | 2 - 143 IU/L |
| VSG | 56 mm/hr | 0 - 12 mm/hr |
| PCR | 3.26 mg/dL | 0.07 - 0.8 mg/dL |
| IgG | 821 mg/dL | 60 - 1572 mg/dL |
| IgM | 54.3 mg/dL | 52 - 242 mg/dL |
| IgA | 161 mg/dL | 45 - 236 mg/dL |
| Renina plasmática | 27 mcIU/mL | 2.8 - 39.9 mcIU/mL |
| Médula ósea | normocelular, sin infiltración neoplásica | |
| LCR | acelular | |
| TACAR pulmonar | sin lesiones ni datos patológicos | |
CHCM: concentración de hemoglobina corpuscular media; CHM: concentración media de hemoglobina; VCM: volumen corpuscular medio; ADE: ancho de distribución eritrocitaria; ANAs: anticuerpos anti-neutrófilo; ANCAs: anticuerpos anticitoplasma del neutrófilo; VIH: virus de inmunodeficiencia humana; VDRL: venereal disease related laboratory; TSH: hormona estimulante de tiroides; T3T: triyodotiroxina total; T3L: triyodotiroxina libre; T4T: tetrayodotiroxina total; T4L: tetrayodotiroxina libre; AST: aspartato amino transferasa; ALT: alanino amino transferasa; GGT: gamma glutamiltranspeptidasa; DHL: deshidrogenasa láctica; FA: fosfatasa alcalina; BT: bilirrubina total; BI: bilirrubina indirecta; BD: bilirrubina directa; TP: tiempo de protrombina; TP%: porcentaje de actividad de TP; TTP: tiempo de tromboplastina parcial; INR: índice internacional normalizado; PCR: proteína C reactiva; HVB: hepatitis B; HVC: hepatitis C; LCR: líquido cefalorraquídeo; CK: creatinincinasa total; TACAR: tomografía axial computada de alta resolución.
Ante persistencia de fiebre se modificó esquema antimicrobiano a cefepima y vancomicina) y se inició tratamiento inmunosupresor con metilprednisolona intravenosa a dosis de 30 mg/kg/día, observando pronunciada mejoría clínica con resolución de la fiebre y disminución significativa de la proptosis.
Al tener una granulomatosis de Wegener localizada a órbita que respondió favorablemente a corticoesteroide, y considerando el perfil de riesgo de efectos adversos conocidos de la ciclofosfamida, así como las condiciones socio-económicas restrictivas para asegurar apego a tratamiento con mofetil micofenolato, se decidió tratar con anticuerpo monoclonal anti CD 20 (rituximab) a 375 mg/m2/semana por 4 dosis, metotrexate 10 mg por semana (0.28 mg/kg/do) y prednisona 30 mg/día (1 mg/kg/día). Se egresó para seguimiento como paciente ambulatorio.
Diez días después de la 3er dosis de rituximab regresó por fiebre, lesiones blanquecinas y dolorosas en cavidad oral y recurrencia de proptosis acompañada de abundante secreción ocular purulenta. En la exploración se evidenció fiebre (38.5ºC), proptosis, compromiso de movimientos oculares, eritema periorbitario, quemosis, hiperemia y secreción verdosa del ojo derecho. El fondo de ojo con nervio óptico hiperémico y pliegues maculares con vasculatura tortuosa. La región de hemicara derecha con aumento de volumen, eritema, hiperemia y dolor a la palpación con compromiso de la apertura oral. En cavidad oral se observaron lesiones compatibles con candidiasis oral. El resto de la exploración no fue relevante. Se hospitalizó, disminuyó dosis de esteroide a 0.5 mg/kg/día, suspendió metotrexate e inició cobertura antimicrobiana de amplio espectro, incluyendo cobertura antifúngica. En tomografía computada de órbita, nuevamente se observó compromiso de tejidos orbitarios, así como sinusitis etmoidal, maxilar y esfenoidal y aumento de volumen con densidad heterogénea de parótida derecha (Figura 5). La resonancia magnética permitió visualizar involucro de senos paranasales, músculos, meninges y parótida derecha (Figura 6).
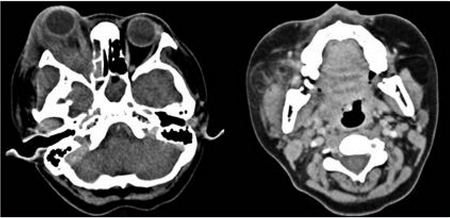
Figura 5 Tomografía axial computada. Se observa desplazamiento anterior del globo ocular, aumento de volumen y densidad de tejidos blandos de la región periorbitaria derecha con engrosamiento generalizado de los músculos intraconales de diámetro irregular y reforzamiento heterogéneo a expensas de áreas de hipodensidad en el músculo recto lateral. Además se observó ocupación generalizada de senos paranasales con predominio de las celdillas etmoidales del lado derecho y seno esfenoidal izquierdo. Los componentes óseos de los senos paranasales maxilar y celdillas etmoidales del lado derecho, así como el piso de la órbita ipsilateral, se encontraron adelgazados y con esclerosis. Se observa aumento de volumen y densidad heterogénea a nivel de glándula parótida derecha y tejido circundante.
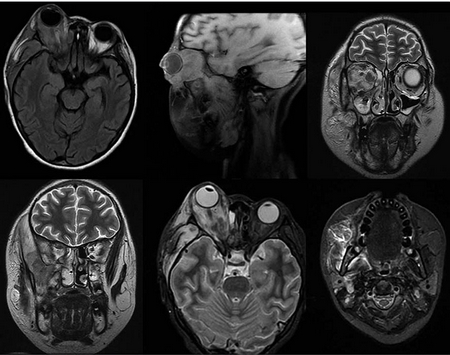
Figura 6 Resonancia magnética. Se observa franco aumento de la lesión orbitaria derecha, con ampliación hacia espacio pterigopalatino, y afección de todos los músculos, incluyendo los pterigoideos, masetero y temporal derechos. En órbita se observan lesiones nodulares, con escaso contenido necrótico y con afección intra-craneal a nivel de meninges en región temporal del lado derecho, con reforzamiento casi homogéneo de la lesión, y escaso contenido necrótico. La pared posterior del antro maxilar y la cavidad nasal con franco engrosamiento de la mucosa. Además se observa involucro de la glándula parótida derecha.
En los siguientes días evolucionó con fiebre, dolor, hiperemia e hipertermia en región de parótida derecha, y persistencia de úlceras y placas blanquecinas en cavidad oral. Dada la inmunosupresión farmacológica y el proceso infeccioso activo con poca respuesta al tratamiento antimicrobiano, se administró inmunoglobulina humana intravenosa a 1 g/kg/do y se agregó cobertura profiláctica con TMP/SMX 5 mg/kg/día. Por el compromiso de parótida derecha se realizó biopsia que se reportó sin cambios significativos. Durante el procedimiento de biopsia se reportó salida de gas, se realizó aseo quirúrgico y se envió material a cultivo, sin identificar ningún microorganismo. Posterior al procedimiento hubo mejoría clínica local significativa.
En los 6 días siguientes continuó con mala evolución con fiebre persistente e incremento de volumen de hemicara derecha, por lo que se agregó piperacilina tazobactam, otra dosis de inmunoglobulina humana intravenosa y voriconazol. La búsqueda intencionada de microorganismos aerobios, anaerobios, hongos, micobacterias y virus de material de biopsias y sangre no proporcionó información útil.
Cinco días después, persistía con fiebre y presentó deterioro neurológico súbito que requirió apoyo mecánico a la ventilación y cuidados intensivos. En el estudio tomográfico se documentó hemorragia aguda intraventricular e intraparenquimatosa (Figura 7). Ingresó a craniectomía descompresiva, drenaje de hematoma (100 mL) y toma de biopsia (Figuras 8 y 9). En las siguientes 2 semanas su evolución no mejoró persistiendo con deterioro neurológico, múltiples sangrados a nivel de sistema nervioso central (Figura 10) y gastrointestinal, así como hemorragia pulmonar masiva con nula respuesta a múltiples intervenciones (i.e.: pulsos de metilprednisolona, inmunoglobulina humana intravenosa, ciclosporina, rituximab, anfotericina B, múltiples transfusiones de hemoderivados, y plasmaféresis). Finalmente presentando falla orgánica múltiple, muerte cerebral y paro cardiorrespiratorio refractario a reanimación cardiopulmonar.
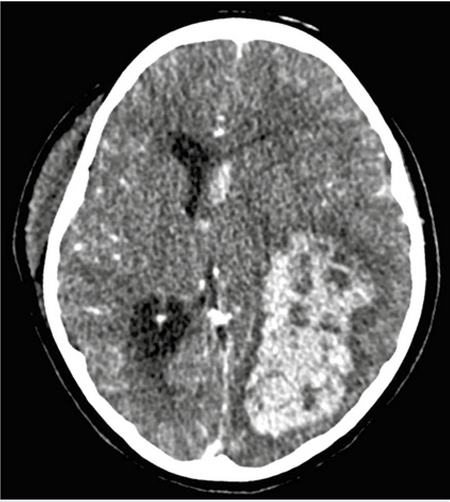
Figura 7 Tomografía axial computada. Se observa hemorragia intraparenquimatosa en región temporo-parieto-occipital izquierda, afectando ventrículo izquierdo con efecto de masa y desviación de línea media.
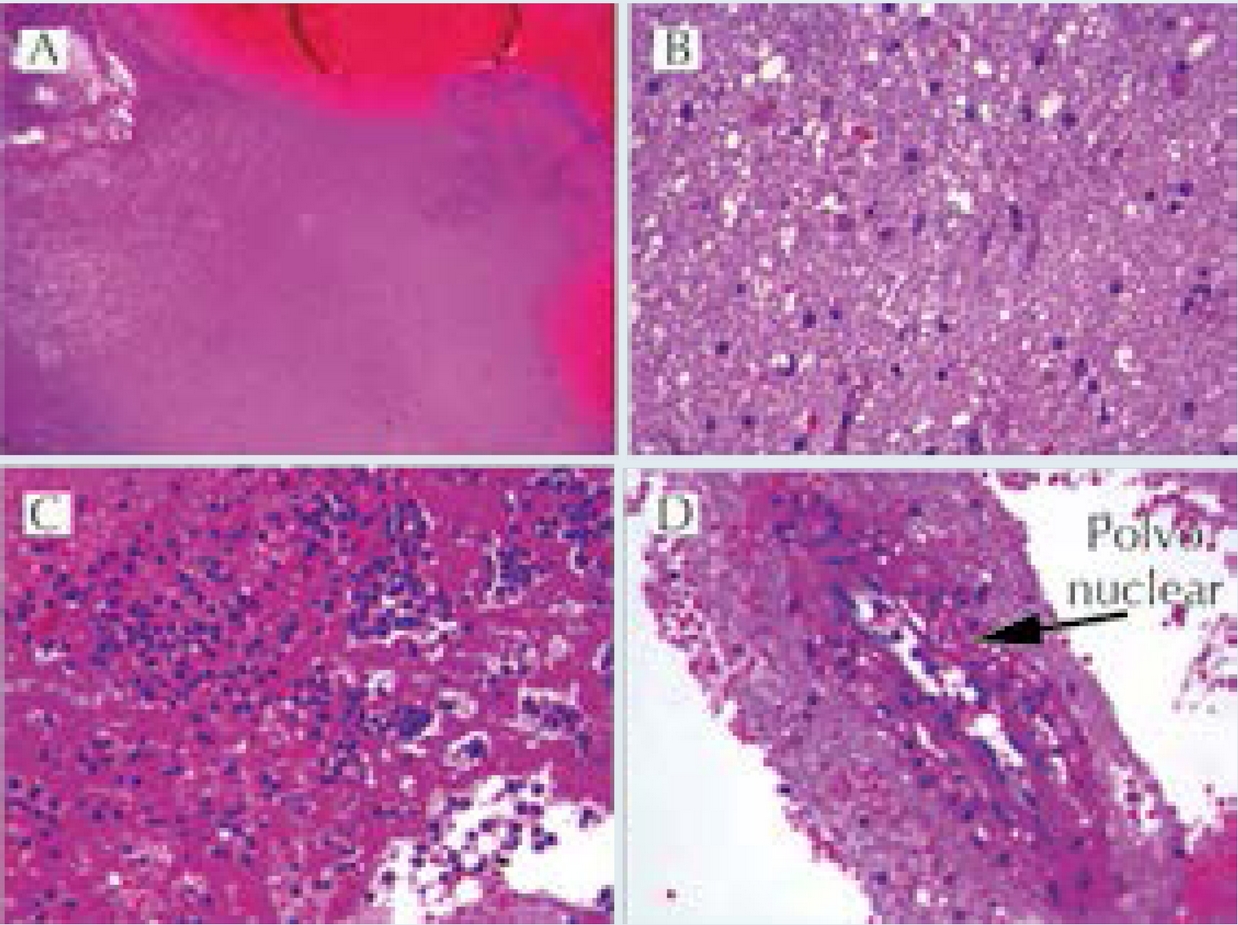
Figura 8 Biopsia de sistema nervioso central mostrando parénquima cerebral. A) Necrosis coagulativa cerebral y hemorragia. B) Gliosis reactiva con cambio microvacuolar en neurópilo. C) Exudado PMN con fibrina. D) Vasculitis focal con leucocitoclasia. Hematoxilina y eosina a 10X y 40X.
COMENTARIO CLÍNICO
La proptosis unilateral fue el síntoma principal de esta paciente y se define como el desplazamiento del globo ocular hacia delante. Aunque es poco frecuente en población pediátrica, cuando está presente requiere abordarse a la brevedad, para establecer la causa y ofrecer un tratamiento oportuno. La mayoría de las veces representa un reto diagnóstico para el clínico.1
El término enfermedad inflamatoria de la órbita, comprende todas las enfermedades inflamatorias que afectan algunas o todas las estructuras contenidas en la órbita externa y en el globo ocular.2 En términos generales ocurre en pediatría con una frecuencia de 6 a 17%, sin predilección de sexo.3 El dolor es el síntoma acompañante más común, pero dado que cualquier estructura dentro de la órbita puede verse afectada, los síntomas pueden ser muy diversos. La afección de los músculos extraoculares se traduce en diplopía. El involucro de la glándula lacrimal causa edema periorbitario supralateral y cuando existe compromiso generalizado del tejido orbitario hay proptosis, quemosis, y edema periorbitario o palpebral. En casos graves puede haber síntomas visuales por compresión del nervio óptico, e inclusive pérdida permanente de la visión.2 Todos estos síntomas estuvieron presentes en el caso en discusión, reflejando un involucro de todas las estructuras orbitarias y periorbitarias.
La historia clínica y exploración física deben permitir identificar la causa desencadenante y si se trata de una enfermedad rápidamente progresiva con riesgo de pérdida de visión o muerte.2 El interrogatorio del caso en discusión requirió de un traductor mixteco, que no fue fácil de conseguir, no se tuvo disponible todo el tiempo, y que finalmente dificultó la comunicación constante entre la paciente y su familia con los médicos tratantes. El curso clínico evidente fue el de una enfermedad inicialmente localizada a órbita pero que finalmente progresó y terminó con la vida de la paciente. Los procesos infecciosos acompañaron a la evolución, y dificultaron el tratamiento de la paciente.
En aquellos pacientes con enfermedad inflamatoria de la órbita con curso clínico atípico y pobre respuesta a tratamiento debe sospecharse una enfermedad maligna.3 Dentro de las neoplasias más frecuentes e importantes de descartar son: retinoblastoma, rabdomiosarcoma, y neuroblastoma. La biopsia juega un rol indispensable para confirmar o descartar estos diagnósticos.
El evento de proptosis, abordado desde el punto de vista oncológico, involucra varias entidades malignas, donde el cuadro clínico para el diagnóstico diferencial está dado de forma importante por el interrogatorio y la imagen de resonancia magnética.
Si bien el retinoblastoma es la neoplasia intraocular más frecuente en población pediátrica, el 90% de los casos son diagnosticados en pacientes menores de 3 años de edad. La edad de presentación, los hallazgos clínicos, de imagen e histopatológicos descartaron esta entidad. El retinoblastoma suele presentarse inicialmente como leucocoria; aunque otros signos como disminución de la visión, estrabismo, ojo rojo, dolor, incremento de la presión ocular, inflamación periocular, celulitis, pseudohipopión y proptosis en etapas avanzadas de la enfermedad pueden complicar su diferenciación de otras neoplasias. Los estudios de imagen pueden ayudar a confirmar el diagnóstico en los que las lesiones tipo nodulares con calcificaciones son distintivas de este tipo de tumor, y pueden observase mediante tomografía computada o ultrasonido en 95% de los casos.4
Por otro lado, la neoplasia de órbita más frecuente en pediatría es el rabdomiosarcoma. Dicha localización representa 10% de todos los rabdomiosarcomas, y tiene una edad media de presentación de 6 a 8 años. Existen dos variantes histológicas con comportamientos distintos, la alveolar es la menos común pero más agresiva, mientras que la embrionaria es más común y de mejor pronóstico, especialmente cuando ocurre en la órbita, debido al pobre drenaje linfático del ojo hacia el cuello. El curso clínico de la paciente levantó la sospecha de esta neoplasia, principalmente por el rápido crecimiento, inicialmente no doloroso y con involucro de estructuras adyacentes. Los estudios de imagen como tomografía computada y resonancia magnética de órbita ayudan para evaluar la extensión de la enfermedad, y los observados en la paciente pueden ser compatibles con esta neoplasia. Sin embargo, los hallazgos histológicos permitieron descartar esta entidad.4
Una tercer posibilidad diagnóstica igualmente descartada fue la presencia de metástasis de tumor neuroectodérmico primitivo, este es un tumor de células pequeñas redondas y azules, de gran similitud al neuroblastoma, sin embargo, esta última entidad es casi exclusiva de menores de 5 años.
El 20% de todos los casos de neuroblastoma metastásico tienen involucro a nivel de órbita y como primera manifestación puede presentarse como proptosis unilateral o bilateral con equimosis periorbitaria. A nivel de tomografía computada las metástasis son imágenes bien o mal circunscritas de mayor intensidad en comparación con el músculo y pueden tener calcificaciones pequeñas. Sin embargo, la edad de la paciente lo hace poco probable.
Otros tumores importantes a nivel ocular a tener en cuenta son los gliomas de la vía óptica, neurofibroma plexiforme, leucemia, enfermedad linfoproliferativa, histiocitosis de células de Langerhans, y lesiones vasculares.4
La enfermedad inflamatoria de la órbita puede estar asociada a condiciones sistémicas no oncológicas, principalmente enfermedades del sistema inmune y endocrinológico, en cuyo caso la presentación bilateral es más frecuente y suele acompañarse de hallazgos clínicos extra-oculares como fiebre, linfadenopatías, malestar general, nerviosismo, intolerancia al calor, pérdida de peso, cabello quebradizo, piel húmeda y caliente, taquicardia, temblor, mixedema peritibial, entre otros.3 En este contexto se sugiere realizar biometría hemática completa, velocidad de sedimentación globular, proteína C reactiva, pruebas de función tiroidea, anticuerpos anti-tiroideos, anticuerpos anti-citoplasma del neutrófilo y examen general de orina.2 La identificación y diferenciación de algunas características clínicas orienta a los diagnósticos más probables y guiar los estudios diagnósticos a solicitar (Cuadro 2).
Cuadro 2 Características clínicas de enfermedad inflamatoria orbitaria
| Orbitopatía asociada a enfermedad tiroidea | Variable, puede ser agudo | Raro inicial | Involucro bilateral, puede ser asimétrico, retracción de párpado, retracción palpebral, músculos afectados inferior y recto medial | Nerviosismo, intolerancia al calor, pérdida de peso, cabello quebradizo, piel húmeda, caliente, taquicardia, temblor, mixedema peritibial |
| Inflamación orbitaria idiopática | Típicamente aguda pero puede ser insidiosa | Sí | Unilateral, afecta cualquier músculo recto | Síntomas constitucionales leves o ausentes |
| Sarcoidosis | Aguda o subaguda | Sí | Puede ser unilateral o bilateral, afecta cualquier músculo recto | Síntomas constitucionales, síntomas respiratorios crónicos, eritema nodoso y rash, artritis o artralgias, linfadenopatía periférica o hiliar |
| Granulomatosis de Wegener | Aguda | Sí | Puede ser unilateral o bilateral, afecta cualquier musculo recto | Síntomas constitucionales, sinusitis, epistaxis, síntomas respiratorios, otitis media, artritis/artralgias |
| Síndrome de Tolosa-Hunt | Agudo | Sí | No proptosis, parálisis de nervios craneales | Síntomas constitucionales leves o ausentes |
| Enfermedad orbitaria linfoproliferativa | Variable | Variable | Unilateral | Fiebre, pérdida de peso, sudoración nocturna, linfadenopatía |
| Enfermedad metastásica a órbita | Variable | Variable | Unilateral o bilateral | Síntomas constitucionales, manifestaciones relacionadas a neoplasia primaria |
| Celulitis orbitaria | Aguda | Sí | Unilateral | Fiebre, antecedente de sinusitis o trauma reciente, leucocitosis |
Modificado de Lutt JR, et al. Orbital inflammatory disease. Semin Arthritis Rheum, 2008;37(4):207-22.
López Rodríguez y sus colaboradores reportaron la información de 145 pacientes pediátricos mexicanos con proptosis. Las enfermedades metabólicas y sistémicas explicaron 48.3% de los casos. La causa específica más frecuente en todos los grupos etarios fue la orbitopatía tiroidea con 67 casos (46%) y en segundo lugar el retinoblastoma con 26 casos (18%), sólo se reportó 1 paciente adolescente con granulomatosis de Wegener.1
La edad de presentación, afección unilateral, junto con los datos de imagen y finalmente los hallazgos histopatológicos descartaron cualquier proceso neoplásico, y dieron evidencia de un proceso inflamatorio granulomatoso y necrosante consistente con granulomatosis de Wegener.
La granulomatosis de Wegener o granulomatosis con poliangeítis fue descrita por primera vez en 1936 por Friedrich Wegener, como una vasculitis granulomatosa necrosante de senos paranasales, pulmón y riñón.5 Es una enfermedad inflamatoria autoinmune, caracterizada histopatológicamente por necrosis, formación de granulomas y vasculitis de vasos de pequeño y mediano calibre.6 De 80 a 90% de los sujetos con granulomatosis con poliangeítis tienen auto-anticuerpos contra antígenos citoplasmáticos del neutrófilo. Dichos anticuerpos tienen afinidad por la proteinasa 3 en 80% de los casos y por mieloperoxidasa en 20%. En el caso en discusión los antígenos citoplasmáticos del neutrófilo resultaron negativos en varias ocasiones, fenómeno que ha sido reportado por diversos autores hasta en 50% de los casos con afección limitada a senos paranasales y/u órbita.7
La granulomatosis con poliangeítis involucra proliferación aberrante de linfocitos Th1, Th2, macrófagos, neutrófilos, activación de complemento, generación de auto-anticuerpos y liberación de diversas citocinas proinflamatorias.7 Estos fenómenos conducen al desarrollo de inflamación granulomatosa y vasculitis necrosante que puede ser localizada o sistémica, afectando más frecuentemente senos paranasales, riñón y pulmón, pero pudiendo afectar cualquier órgano.5 El diagnóstico se establece de acuerdo a los criterios del American College of Rheumatology (Cuadro 3).7 Es importante mencionar que la serología positiva para antígenos citoplasmáticos del neutrófilo no es indispensable para establecer el diagnóstico, si se cumple con el resto de los criterios. La paciente cursó con inflamación orbitaria, nasal y oral, con hallazgos histopatológicos compatibles con vasculitis necrosante y formación de granulomas.
Cuadro 3 Criterios del American College of Rheumatology para el diagnóstico de granulomatosis con poliangeítis
| a) inflamación oral o nasal: desarrollo de úlceras orales (dolorosas o no) o descarga purulenta o hemorrágica |
| b) radiografía de tórax anormal: nódulos, infiltrados fijos o cavitaciones |
| c) sedimento urinario activo: > 5 eritrocitos por campo de alto poder o cilindros eritrocitarios |
| d) inflamación granulomatosa y/o vasculitis necrosante en biopsia: inflamación granulomatosa perivascular o en la pared de arterias o arteriolas, o vasculitis necrosante |
| e) inmunoensayo enzimático positivo para anticuerpos PR3 |
Modificado de: Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the diagnosis of Wegener's granulomatosis. Arthritis Rheum. 1990;33:1101-7.
El involucro ocular en granulomatosis con poliangeítis se presenta en 50-60% de todos los pacientes y puede ser la manifestación inicial en 8-16 % de los casos.8 Suele iniciar a nivel de senos maxilares o etmoidales y diseminarse hasta involucrar los músculos extraoculares, nervios y vasos sanguíneos contenidos en el cono muscular. También puede crecer a nivel intraconal y diseminarse a través el espacio retrobulbar.7 La mayoría de los pacientes cursan con enfermedad contigua que afecta la nariz y senos paranasales. Cuando la proptosis es pronunciada compromete el cierre palpebral y frecuentemente se complica por exposición corneal ocasionando queratopatía y ulceración corneal, lo que puede provocar pérdida permanente de la visión. La extensión de la enfermedad orbitaria puede ocasionar destrucción de estructuras óseas locales así como esclerosis y neo-osificación. En los casos más graves puede haber compresión del nervio óptico, infiltrado y ceguera.7 Por otro lado puede haber contracción orbitaria con enoftalmos, asociada a oftalmopatía restrictiva, afección de nervio óptico, dolor orbitario crónico, y poca respuesta a tratamiento inmunosupresor.7 Otras estructuras oculares pueden verse afectadas e incluyen: párpados (dacrioadenitis, dacrocistitis, ptosis, granulomas, chalazión, triquiasis, xantalasma, obstrucción nasolacrimal), conjuntivas (conjuntivitis que puede ser ulcerativa y necrótica como resultado de cambios por cicatrización de la superficie ocular), escleras (epiescleritis, escleritis) y córneas (queratitis, infiltrado corneal adyacente).7
Los hallazgos histopatológicos característicos del involucro a nivel de órbita incluyen granulomas focales, depósito de colágeno, necrosis, polvo nuclear, infiltrado de células plasmáticas. La infiltración de eosinófilos se ha propuesto como un factor predictor de progresión de la enfermedad.8
La paciente en discusión inicialmente cursó con un proceso infeccioso acompañante, el tratamiento antimicrobiano no modificó el cuadro clínico de manera significativa y hasta que se inició tratamiento inmunosupresor es que se observó mejoría clínica significativa. Los procesos infecciosos acompañan a la enfermedad frecuentemente y pueden ser fenómenos detonantes (i.e. pueden participar en la inducción de autoinmunidad, así como exacerbar o reactivar la enfermedad), consecuentes (i.e. las alteraciones anatómicas y funcionales derivadas del proceso inflamatorio comprometen la inmunidad local y favorecen procesos infecciosos) o como complicaciones del tratamiento (i.e. tratamiento inmunosupresor).9
La granulomatosis con poliangeítis involucra los riñones en 80% de los casos como glomerulonefritis. Esta afección es la más asociada con mortalidad, por lo que se debe evaluar en todos los pacientes, con la búsqueda de proteinuria y revisión del sedimento urinario en búsqueda de eritrocitos, leucocitos y cilindros, datos que estuvieron consistentemente negativos en la paciente. Los pulmones se ven afectados en aproximadamente 50% de los pacientes, ocasionando tos, hemoptisis, disnea, dolor pleurítico y en estudios de imagen infiltrados pulmonares y/o nódulos. La hemorragia alveolar e insuficiencia respiratoria pueden y suelen comprometer la vida.7 Otros factores de riesgo para mortalidad descritos corresponden a edad con un incremento en riesgo relativo (RR) de 2.18 por cada década, concentración de creatinina RR 1.35 por cada 100 mmol/L de incremento, proteinuria RR 1.57 por cada 1 g/24h, necesidad de terapia de reemplazo renal RR 9.17, y retraso en el diagnóstico >6 meses con un RR 1.20.10
El tratamiento de la granulomatosis con poliangeítis se divide en dos fases; la primera conocida como inducción a la remisión, seguida de terapia de mantenimiento. Antes de los 70's la granulomatosis con poliangeítis era una enfermedad letal durante el primer año en 80% de los casos. Actualmente las tasas de sobrevida son ~95% a 5 años y de ~80% a 10 años. La combinación de glucocorticoides con inmunosupresores como ciclofosfamida, metotrexate o azatioprina son los tratamientos más utilizados en nuestro medio como inductores de remisión. Los efectos adversos de la ciclofosfamida han llevado a desarrollar otras estrategias, que en los últimos años han sido cada vez más utilizadas con evidencia de eficacia y seguridad comparables aunque ciertamente a un costo económico sustancialmente mayor. Específicamente mofetil micofenolato y rituximab han sido dos medicamentos estudiados con resultados favorables de eficacia y un perfil de seguridad superior comparado con ciclofosfamida.7 La paciente fue tratada inicialmente en el contexto de una enfermedad limitada a un órgano, con buena respuesta inicial a corticoesteroides pero con un aspecto socioeconómico restrictivo. En su segunda hospitalización, el proceso infeccioso fue el catalítico de una evolución catastrófica, por un lado, imposibilitando un tratamiento inmunosupresor más enérgico y por otro lado generando un estímulo antigénico continúo a su vez exacerbando la enfermedad.
La afección a sistema nervioso central por granulomatosis con poliangeítis en adultos ha sido reportada en un poco más de la mitad de los pacientes.11 En niños es reportado con menor frecuencia: en dos series de pacientes pediátricos, se refirieron anormalidades neurológicas en tres de 17 pacientes y en 6 de 23.12,13 Cuatro pacientes con neuropatía periférica, tres con afección a pares craneales, dos con crisis convulsivas; en dos casos descritos posteriormente el diagnóstico clínico de vasculitis en sistema nervioso central se complementó con los hallazgos de resonancia magnética.14,15 También se han descrito casos pediátricos con cerebritis transitoria16 y lesiones de vasculitis (como en nuestro caso) en estudio postmortem.17
En los casos de una enfermedad grave y refractaria se recomienda la plasmaféresis en un intento de eliminar aquellos factores solubles causantes y perpetuadores de la cascada inflamatoria y restituir aquellos sustratos consumidos por los mismos fenómenos. Dicho procedimiento se realizó en varias ocasiones, sin lograr mejoría clínica. Éste comportamiento refractario a todo tratamiento médico se ha reportado en 5% de algunas series de granulomatosis con poliangeítis.18
Nuestra paciente curso con linfopenia persistente, ausencia de antígenos citoplasmáticos del neutrófilo y progresión de la enfermedad a pesar de tratamiento inmunosupresor enérgico, estas características invitan a un análisis desde otra perspectiva. Moins-Teisserenc y sus colaboradores describieron 5 pacientes con un cuadro clínico clasificado inicialmente como granulomatosis de Wegener de acuerdo a los criterios del American College of Rheumatology pero que cursaron con una evolución atípica, con inflamación granulomatosa y necrosante grave refractaria a tratamientos antibacterianos, antifímicos e inmunosupresores, junto con negatividad de antígenos citoplasmáticos del neutrófilo a pesar de franca progresión de la enfermedad. En dichos pacientes se estableció el diagnóstico de deficiencia de antígeno leucocitario humano clase I (HLA I) o síndrome de linfocito desnudo tipo 1.19 Esta enfermedad es una inmunodeficiencia primaria que se debe principalmente a mutaciones en los genes TAP1 ó TAP2 que traducen para unas proteínas conocidas como "transportadores de péptidos 1 y 2" y se encargan de transportar los péptidos del citosol y proteasomas hacía el retículo endoplásmico para su incorporación a las moléculas de HLA I para su ulterior presentación en la superficie. La ausencia de estas proteínas (TAP1 ó TAP2) provoca una marcada disminución de la expresión constitutiva de las moléculas de HLA I en las células, lo que las hace un blanco importante para células natural killer (NK) autólogas. Es importante recordar la traducción del término NK (i.e. asesinas naturales) y que se requiere de su constante inhibición para evitar su función en contra de células propias. Una de las principales señales inhibitorias que les permite a las células de la economía corporal convivir con dichas células es la expresión constitutiva de HLA I. Se han documentado alrededor de 26 casos de síndrome de linfocito desnudo tipo 1, con diversas presentaciones clínicas (en el Cuadro 4 se muestran 20 de los casos). A pesar de la importancia clásicamente atribuida a la molécula HLA I en la presentación de antígenos y respuesta a virus, los pacientes descritos no se han caracterizado por tener infecciones virales graves o recurrentes, por lo que la patología asociada a esta entidad parece no ser consecuencia directa del defecto sino más bien un epifenómeno. Las hipótesis explicativas sugieren que ante un detonante inicial, presumiblemente infeccioso, se lleva a cabo reclutamiento de células del sistema inmune al sitio afectado y se inicia una respuesta inflamatoria que posteriormente se perpetúa y/o amplifica por la ausencia de mecanismos de contra regulación dependientes de receptores inhibitorios (i.e. HLA I) con la participación protagónica de células NK y células T gd autorreactivas.20-24
Cuadro 4 Características de pacientes con deficiencia de HLA I (síndrome de linfocito desnudo tipo 1)
| M 9 años | Anemia inexplicable | Heterocigoto | Transcripción |
| M 6 años | Ninguno | Heterocigoto | Transcripción |
| M 2 años | Ninguno | Heterocigoto | Transcripción |
| M 49 años | Sinusitis crónica, bronquiectasias crónicas, infecciones sinopulmonares bacterianas | ND | ND |
| F 33 años | Poliposis nasal, panbronquiolitis, infecciones sinopulmonares bacterianas, PFP con obstrucción, necrobiosislipoídica cutánea localizada | Homocigoto | TAP 1 |
| M 24 años | Poliposis nasal, pansinusitis, bronquiectasias bilaterales con enfisema, lesiones granulomatosas, ectopia lentis | Homocigoto | TAP 1 |
| F ND | Sinusitis crónica, bronquitis y bronquiectasias | Homocigoto | TAP 1 |
| F ND | Sinusitis crónica, bronquitis , bronquiectasias, lesiones granulomatosas | Homocigoto | TAP 1 |
| F ND | Ausencia de enfermedad pulmonar, lesiones granulomatosas | Homocigoto | TAP 1 |
| F 20 años | Poliposis nasal, pansinusitis | Homocigoto | TAP 2 |
| M 15 años | Bronquiectasias bilaterales, otitis media crónica, infecciones sinopulmonares bacterianas, enfisema, PFP con patrón obstructivo | Homocigoto | TAP 2 |
| M 36 años | Infecciones sinopulmonares bacterianas, bronquiectasias bilaterales | Homocigoto | TAP 2 |
| F 36 años | Sinusitis, bronquitis y bronquiectasias | Homocigoto | TAP 2 |
| F ND | Lesiones granulomatosas, vasculitis | Homocigoto | TAP 2 |
| F ND | Sinusitis crónica, bronquitis, bronquiectasias, lesiones granulomatosas | Homocigoto | TAP 2 |
| M 46 años | Lesiones granulomatosas mínimas | Homocigoto | TAP 2 |
| F 30 años | Ninguno | Homocigoto | TAP 2 |
| M 15 años | Toxoplasmosis retiniana | Homocigoto | TAP 1 |
| M 14 años | Ninguno | Homocigoto | TAP 1 |
| F 56 años | Glomerulonefritis primaria crónica | Homocigoto | Tapasina |
F: femenino; M: masculino. Modificado de: Henri de la Salle, Lionel Donato & Daniel Hanau. Chapter 18: Peptide Transporter Defects in Human Leukocyte Antigen Class I Deficiency. En: Ochs Primary Immunodeficiency Diseases 2nd ed, Oxford University Press 2007 pp. 242-250.
El diagnóstico de linfocito desnudo tipo 1 se realiza relativamente fácil documentando expresión disminuida de HLA clase I en células mononucleares de sangre periférica mediante citometría de flujo. Sin embargo, identificar el tipo de defecto específico que lleva a esta expresión disminuida requiere de estudios sofisticados y sólo disponibles en algunos laboratorios de investigación (i.e. evaluar si la expresión de HLA clase I es inducible, si la molécula es correctamente sialilada y asociada con la proteína b2-microglobulina) y posteriormente secuenciación genética dirigida al gen candidato. Los estudios generales del sistema inmune pueden no ser orientadores (i.e. inmunoglobulinas séricas normales, bajas o incrementadas, respuesta a polisacáridos disminuida, respuesta a péptidos normal, subpoblaciones de linfocitos T citotóxicos CD3+CD8+, cooperadores CD3+CD4+, linfocitos B CD19+/20+, y linfocitos NK CD16+/56+ normales, linfoproliferación normal, citotoxicidad disminuida o normal etc.) Las características clínicas e histológicas pueden ser indistinguibles de granulomatosis con poliangeítis, pero la falta de respuesta a tratamiento inmunosupresor, junto con la asociación con infecciones sinopulmonares y/o bronquiectasias, puede ser clave para sospechar en esta inmunodeficiencia.20-24
El tratamiento de esta inmunodeficiencia primaria incluye medidas generales para disminuir exposición a agentes infecciosos y nocivos para el sistema respiratorio (e.g. no acudir a guarderías, tabaquismo pasivo, etc.) antibióticos profilácticos, tratamiento oportuno de procesos infecciosos, búsqueda intencionada de microorganismos asociados a procesos infecciosos (e.g. Haemophilus influenzae, Streptococcus pneumoniae y Pseudomonas aeruginosa son los más frecuentemente encontrados), inmunoglobulina humana intravenosa, rehabilitación pulmonar intensiva, búsqueda y tratamiento de complicaciones respiratorias (e.g. poliposis nasal, sinusitis, bronquiectasias, otitis media crónica, etc.) y cuidado especializado de lesiones cutáneas o de mucosas.20-24
CONCLUSIONES
Todo paciente con proptosis debe considerarse como una emergencia pediátrica. El abordaje deberá realizarse de una forma ordenada y multidisciplinaria, siempre guiada por las características clínicas identificadas en el interrogatorio y exploración física. Los estudios de laboratorio e imagen proporcionarán información indispensable para afinar la causa más probable, sin embargo el estudio histopatológico será en la mayoría de los casos la forma más rápida y certera de tener el diagnóstico, y no deberá retrasarse ni obviarse.
La granulomatosis con poliangeítis es una vasculitis grave y como este caso lo ejemplifica constituye un reto diagnóstico y terapéutico. El equilibrio para lograr inmunosupresión suficiente para inducir remisión de la enfermedad sin favorecer procesos infecciosos que a su vez puedan fungir como causantes de recaídas constituye un proceso de toma de decisiones complejo y dinámico, muy difícil de dominar. Cuando la evolución y/o respuesta a tratamiento no son lo esperado, el clínico siempre deberá replantear el caso y considerar diagnósticos diferenciales.











 nueva página del texto (beta)
nueva página del texto (beta)




