INTRODUCCIÓN
El calcio y el fósforo son los mayores constituyentes del hueso, conforma el sistema óseo de un recién nacido de término; aproximadamente 99% del calcio corporal y 80% de fósforo en forma de microcristales de apatita (Ca5 (PO4) OH).1,2 La homeostasis del calcio y el fosfato está controlada por el eje hormonal paratiroides-riñón que implica a la hormona paratiroidea (PTH) y la 1,25-dihidroxivitamina D (1,25 (OH) 2D).3
Con frecuencia, en el periodo neonatal se observan alteraciones significativas de las concentraciones séricas de calcio.4 En el prematuro influye de forma decisiva la falta de aporte mineral que acontece al final de la gestación.5 La mayor parte de la mineralización ósea fetal ocurre en el tercer trimestre del embarazo.6
La enfermedad ósea metabólica del prematuro resulta de la desmineralización de los huesos del recién nacido prematuro, es de origen multifactorial y se desarrolla luego de las primeras semanas postnatales.1 La incidencia y la gravedad son inversamente proporcionales a la edad gestacional y al peso al nacer.1,2,7 Se debe sospechar en todo prematuro menor de 1,500 gramos a partir de las cuatro semanas de edad.
Existen factores que deben ser vigilados con el fin de realizar un diagnóstico y tratamiento temprano.2,8 Entre ellos se encuentran la prematurez, relacionada con la brusca separación de la fuente fetal de minerales de las 24 a 32 semanas de gestación y su gran efecto sobre la mineralización ósea,8,9 que se manifiesta en menor reserva mineral,10,11 displasia broncopulmonar debido a un aumento del gasto energético, restricción de líquidos, tratamiento prolongado con diuréticos, uso de metilxantinas y falla respiratoria por déficit de fósforo,12-14 corticoides a dosis altas que han demostrado ser capaces de suprimir la actividad osteoblástica en humanos, la falta de estimulación mecánica que aumenta la resorción ósea y desmineralizacion,13 sepsis neonatal debido al incremento de las necesidades metabólicas e intolerancia enteral,4,15,16 nutrición parenteral prolongada que contenga elementos tóxicos para el hueso y falta de elementos esenciales para el desarrollo óseo,15 excreción exagerada de calcio por uso de furosemide o teofilina,4,13 déficit de vitamina D.17,18 La mayoría de los niños no manifiesta síntomas en etapas tempranas de la enfermedad.19
La importancia de este estudio radica en resaltar la necesidad de realizar un escrutinio bioquímico para reconocer y tratar oportunamente la enfermedad en pacientes con riesgo.
OBJETIVO
Determinar los factores de riesgo asociados a enfermedad ósea metabólica en prematuros mediante un escrutinio bioquímico, en una unidad de terapia intensiva neonatal.
MATERIALES Y MÉTODOS
Estudio transversal comparativo realizado del 1 de octubre de 2011 al 30 de octubre de 2013 en la terapia intensiva neonatal de la unidad médica de alta especialidad, Hospital de Pediatría, Instituto Mexicano del Seguro Social, en Guadalajara, México, hospital de tercer nivel que atiende a pacientes enviados de la zona noroccidente del país.
Criterios de selección
Se consideraron prematuros con enfermedad ósea metabólica los pacientes con criterios bioquímicos y se compararon con prematuros sin enfermedad ósea metabólica. Para evaluar prematurez se utilizó el método de Ballard y correspondió a edad gestacional menor de 37 semanas, peso < 1,500 gramos al nacer y edad postnatal de 21 días o más. No se incluyeron pacientes con síndrome colestásico o enfermedades metabólicas congénitas (osteogénesis imperfecta o errores innatos de cualquier tipo).
Tamaño de la muestra
Se calculó empleando la fórmula para dos proporciones considerando la presencia de enfermedad ósea metabólica según peso al nacimiento por Bozzetti V y Tagliabue P, se consideró significancia de 0.05 y un poder de 95% con valor K (Zα+Zβ)2 de 13,0 con una población mínima para validez de 53 pacientes por grupo de estudio. Muestreo no probabilístico de casos consecutivos.
Desarrollo del estudio
Se establecieron las características de todos los prematuros con peso < 1,500 gramos al nacer a través de los datos obtenidos de forma retrospectiva del expediente clínico. Se tomó muestra de sangre venosa de los pacientes al cumplir 21 días o más de vida extrauterina para procesar calcio, fósforo y fosfatasa alcalina por técnica seca, mediante el analizador VITROS 250. Se determinó en cada paciente la edad gestacional al nacer, peso al nacer en gramos, género, edad en días al momento del estudio, edad gestacional corregida al momento del estudio, presencia y severidad de displasia broncopulmonar, sepsis y número de eventos, número de días de administración de diurético de asa, metilxantina, nutrición parenteral total, sedación y corticoide sistémico. Se catalogó como duración prolongada un tiempo de administración de 14 días o más para diurético de asa, metilxantina y nutrición parenteral total, 7 días o más para sedación y 5 días o más para corticoide sistémico. Se estableció la edad postnatal en días en que se inicio la alimentación enteral trófica la cual fue exclusiva con calostro materno en todos los pacientes; posteriormente, se continuó su progreso con lactancia mixta (leche materna y fórmula láctea para prematuro). La nutrición parenteral en todos los casos inició en las primeras 72 horas de vida postnatal.
Enfermedad ósea metabólica del prematuro
Se estableció el diagnóstico de enfermedad ósea metabólica en aquellos pacientes con hipofosfatemia (< 3.5 mg/dL), hipocalcemia (< 8.5 mg/ dL) o normocalcemia (8.5-10 mg/dL) y elevación de fosfatasa alcalina sérica (> 900 UI/L). Este último valor de corte elegido debido a que este nivel precede a los hallazgos radiológicos de la enfermedad.
Análisis estadístico
Se empleó estadística descriptiva con frecuencias y porcentajes para variables cualitativas. Las variables cuantitativas se analizaron con media y desviación estándar. Estadística inferencial con Chi cuadrada para variables cualitativas y t de Student para variables cuantitativas. Significancia estadística p<0.05. Los datos fueron capturados en el paquete estadístico SPSS versión 20.0 (Chicago IL USA).
Ética
Según la Ley general de Salud se considera un estudio sin riesgo por lo que no requirió consentimiento bajo información. El estudio cumple los principios internacionales de investigación establecidos en Helsinki. El protocolo fue aprobado por el Comité de Investigación y Ética Hospitalario con folio R-2011-1302-16.
RESULTADOS
Se estudiaron 120 pacientes menores de 37 semanas de gestación, con peso al nacer menor a 1,500 gramos. Se establecieron dos subgrupos de peso, pacientes con peso al nacer ≤ 1,000 gramos y pacientes con peso al nacer entre 1,001 y 1,500 gramos. El diagnóstico de enfermedad ósea metabólica se estableció en 58 pacientes de la muestra estudiada. El 67% de los prematuros que desarrollaron la enfermedad tenían un peso al nacer < 1,000 gramos (p < 0.05). La relación de sexo fue relación 1:1 masculino:femenino. En el Cuadro 1 se describen las características clínicas y sociodemográficas de pacientes de la población estudiada con y sin enfermedad ósea metabólica del prematuro.
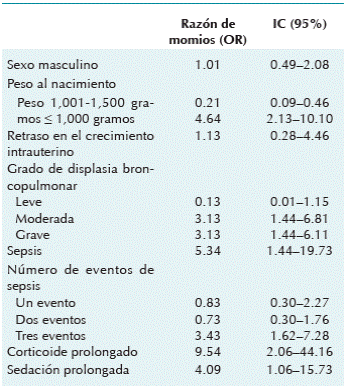
Cuadro 1 Comparación de las características sociodemográficas de los prematuros con y sin enfermedad ósea metabólica en la Terapia Intensiva Neonatal

EOMP: enfermedad ósea metabólica del prematuro; DE: desviación estándar. Comparación de medias con t de Student, comparación de proporciones con chi cuadrada.
El total de los pacientes afectados con enfermedad ósea metabólica del prematuro presentó una evolución asintomática y sin evidencia clínica de fracturas. Los marcadores bioquímicos en el grupo de peso ≤ 1,000 se compararon con los resultados de pacientes de 1,000 a 1,500 gramos con y sin afección. Los marcadores descritos incluyen calcio sérico, fósforo sérico y fosfatasa alcalina sérica (Cuadro 2).
Cuadro 2 Niveles séricos de calcio, fósforo y fosfatasa alcalina en los pacientes con enfermedad ósea metabólica del prematuro de acuerdo al grupo de peso
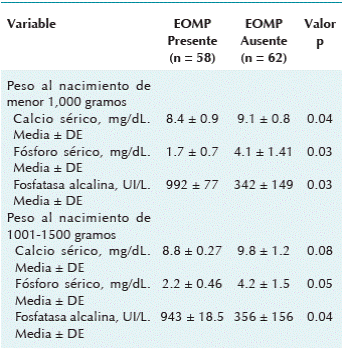
EOMP: enfermedad ósea metabólica del prematuro; mg/dL: miligramos por decilitro; UI/L: Unidades internacionales por litro; DE: desviación estándar. Comparación de medias con t de Student.
Al comparar los tratamientos médicos en los pacientes de acuerdo al grupo de estudio se encontró uso de corticoide prolongado más frecuente en prematuros con enfermedad ósea metabólica comparado con niños sin la enfermedad, resultados similares se observaron con el uso de sedación prolongada. En todos los pacientes se manejó lactancia mixta materna y fórmulas lácteas, aunque para el inicio de la lactancia trófica obligadamente fue a través de fórmula materna (Cuadro 3).
Cuadro 3 Comparación de los tratamientos médicos en los pacientes con y sin enfermedad ósea metabólica del prematuro en la Unidad de Terapia Intensiva Neonatal

EOMP: enfermedad ósea metabólica del prematuro; DE: desviación estándar; NPT: nutrición parenteral total. Comparación de medias con t de Student, comparación de proporciones con chi cuadrada.
Se determinaron los padecimientos asociados a la presencia de enfermedad ósea metabólica del prematuro, sobresaliendo por su significancia estadística la displasia broncopulmonar, sobre todo en estadios severos, sepsis neonatal, principalmente neonatos con mas de tres eventos infecciosos (Cuadro 4).
Cuadro 4 Comparación de los padecimientos de los pacientes con y sin enfermedad ósea metabólica del prematuro en la Unidad de Terapia Intensiva Neonatal

EOMP: enfermedad ósea metabólica del prematuro. Comparación de proporciones con chi cuadrada.
Para calcular la posibilidad de presentar enfermedad ósea metabólica del prematuro de acuerdo a las variables estudiadas se calculó la razón de momios (OR). Encontramos la posibilidad de presentarse en los recién nacidos con un peso ≤ 1,000 gramos de 4.64 veces, grados moderados o severos de displasia broncopulmonar 3.13 veces. De la misma manera se observó que los pacientes con tres eventos de sepsis tuvieron 3.43 veces más probabilidad de tenerla. Los niños con uso de sedación prolongada presentaron 4.0 y corticoides 9.5 veces más de probabilidad de enfermedad ósea metabólica del prematuro (Cuadro 5).
DISCUSIÓN
En nuestro estudio describimos las características principales de pacientes prematuros menores de 37 semanas de gestación y con peso menor de 1,500 gramos al nacer, de los cuales a 58 se les diagnósticó enfermedad ósea metabólica. Se estudiaron prematuros con peso adecuado para la edad gestacional y prematuros con retraso en el crecimiento intrauterino debido a que ambos grupos tienen riesgo. El desarrollo de la enfermedad en pacientes con retraso en el crecimiento intrauterino sugiere que la lesión crónica a la placenta puede limitar la transferencia de fosfato, debido a alteración de la conversión de la vitamina D en 1,25-dihidrocolecalciferol.6
El diagnóstico de enfermedad ósea metabólica del prematuro puede realizarse por medio de datos clínicos, radiológicos, bioquímicos, así como por medición de la densidad mineral ósea, análisis post mortem, análisis de la composición mineral y ultrasonografía cualitativa.20-22 Los niveles altos de fosfatasa alcalina y fosfato sérico disminuidos presentan 100% de sensibilidad y 70% de especificidad para el diagnóstico de enfermedad ósea metabólica del prematuro.23,24 Existe una falta de consenso en cuanto a detección de la enfermedad. Según Kelly A y su grupo 25 el diagnóstico de se basa casi universalmente en la elevación de la fosfatasa alcalina (58.6%) y el 52% por medio de rayos X. Esto tambien influenciado por el grado de afección respiratoria por la displasia broncopulmonar.26
Vachharajani AJ y sus colaboradores15 establecen que no existe una prueba específica para el diagnóstico de enfermedad ósea metabólica del prematuro. De acuerdo a Mitchell SM y sus colegas27 la fosfatasa alcalina, fósforo y calcio séricos se han utilizado tradicionalmente para la pesquisa ya que las radiografías estándar muestran evidencia de osteopenia sólo hasta que la densidad ósea está disminuida significativamente. Román y su equipo28 realizaron un estudio prospectivo donde compararon fosfatasa alcalina, calcemia y fosfatemia en 10 prematuros de 28 a 30 semanas de gestación con un grupo control de 10 niños de 36 a 37 semanas de gestación. En nuestro estudio utilizamos calcemia, fosfatemia y fosfatasa alcalina sérica como marcadores bioquímicos para establecer el diagnóstico oportuno antes de que la enfermedad ósea metabólica del prematuro resultara sintomática.
En nuestro país un estudio publicado en 2013 por Tapia-Rombo C y sus colaboradores29 concluyó que alrededor de la tercera semana de vida extrauterina es el momento en que se presenta la osteopenia en prematuros. Similar a los resultados de Tapia-Rombo, la edad de presentación de enfermedad ósea metabólica del prematuro resultó más temprana en nuestro estudio, a partir de la tercera a la octava semanas de vida. A diferencia de lo generalmente reportado en otros estudios internacionales, donde el momento de la aparición de la enfernedad es más tardía, entre la sexta y la doceava semanas de vida.7 Estos resultados pueden relacionarse a la falta de control de los factores predisponentes en nuestro país, a diferencia de otros más desarrollados en los que la invasión y estancia hospitalaria de los prematuros es mucho menor. Por tal motivo, en contraste a lo establecido por Abrams SA30 y su sugerencia de realizar determinación de marcadores bioquímicos en pacientes de riesgo a partir de la cuarta o qunita semanas postnatales, nosotros proponemos el escrutinio a partir de la tercera semana de vida en países con nivel de desarrollo en salud similar al nuestro.
En nuestro estudio incluimos a prematuros, con peso igual o inferior a 1,500 gramos al nacer y con edad gestacional menor de 37 semanas, debido a que los pacientes con restricción de crecimiento intrauterino también tienen riesgo de enfermedad ósea metabólica del prematuro. La frecuencia encontrada fue de 48%, siendo similar al 30% informado por otros autores como Mitchell SM y sus colaboradores.27 En nuestra población en el grupo con peso al nacer menor de 1,000 gramos encontramos un 67% con enfermedad ósea metabólica del prematuro y 30% con peso de 1,001-15,00 gramos. Lo anterior es comparable con lo publicado por Bozzetti y Tagliabue31 quienes encontraron enfermedad ósea metabólica del prematuro hasta en más de 55% de los recién nacidos ≤ 1,000 gramos y en 23% de los menores de 1,500 gramos, especialmente frecuente en los recién nacidos menores de 28 semanas de gestación. También es importante señalar que en los países desarrollados la incidencia es difícil de estimar debido a que ha disminuido considerablemente como consecuencia de la mejoría en el manejo nutricional, nutrición parenteral agresiva temprana, inicio de alimentación enteral temprana y cambios en las fórmulas nutricionales, así como por los cambios en la práctica clínica, como la disminución de parálisis para la ventilación mecánica o el aumento de la ventilación no invasiva.15 Lo anterior nos hace considerar la posibilidad de que en nuestro país la enfermedad ósea metabólica del prematuro sea subdiagnosticada debido a que suele ser asintomática y se pasa por alto con frecuencia.32
En nuestro estudio encontramos que los recién nacidos prematuros ≤ 1,000 gramos presentan una probabilidad mayor de enfermedad ósea metabólica del prematuro, este hallazgo es comparable con lo comentado por Mitchell y su grupo27 quienes realizaron una cohorte de 113 pacientes para determinar la relación entre el peso al nacimiento y los niveles máximos de actividad de fosfatasa alcalina en recién nacidos con peso extremadamente bajo al nacer concluyendo que el peso al nacer es inversamente proporcional al nivel de fosfatasa alcalina y presencia de hallazgos radiográficos de enfermedad ósea metabólica del prematuro. Vachharajani y su equipo15 de igual manera informan que el peso bajo al nacer predispone a una deficiencia mineral debido a un incremento en los requerimientos nutricionales para el crecimiento.
La condición de riesgo más frecuentemente asociada con enfermedad ósea metabólica del prematuro resultó ser la presencia de tres eventos de sepsis y, en el grupo de pacientes de 1,0011,500 gramos el uso de sedación prolongada. En cambio Vachharajani y sus colaboradores15 informaron el aspecto nutricional (deficiencia de fósforo) como la principal causa para desarrollar enfermedad ósea metabólica del prematuro, y el uso de corticoesteroides, furosemide y metilxantinas como factores predisponentes que la exacerban por movilización de calcio del hueso ocasionando disminución de la densidad ósea. Acorde con nuestros resultados solo el uso prolongado de sedación y de corticoide se relacionó directamente con enfermedad ósea metabólica del prematuro probablemente secundaria a la falta de estimulación mecánica y a la supresión de la actividad osteoblástica. Por lo que el papel de la estimulación mecánica para promover el crecimiento del hueso, contenido mineral y el desarrollo muscular no puede ser pasado por alto.33
Otro hallazgo contrastante a lo establecido por la literatura es la ausencia de relación entre la edad gestacional al nacer y el sexo con la enfermedad ósea metabólica del prematuro en nuestra población, debido a que Vachharajani y su grupo15 consideran como factores de riesgo el grado de prematurez y el sexo masculino.
Los niveles bajos de vitamina D al nacimiento son otro factor de riesgo reportado por Hitrova S y sus colegas.34 La determinación de hormona paratiroidea también es de utilidad para la monitorización de enfermedad ósea metabólica del prematuro.34, 35 Cabe señalar que en nuestro estudio tuvo la limitación que no se realizaron dichas determinaciones.
Por último, no se encontraron efectos de la estimulación trófica enteral con leche materna con respecto a los niveles de marcadores bioquímicos estudiados, probablemente debido al inició tardío de la misma (8-9 días). A diferencia de los resultados reportados en la cohorte realizada por Fewtrell MS,19 donde se reporta un efecto positivo respecto a un mayor tamaño del esqueleto y del contenido mineral óseo.
Una limitación importante de nuestro estudio es que la terapia donde se llevó a cabo es un servicio de referencia de otras unidades hospitalarias que cuentan con menos recusos para el manejo de los prematuros y que tienen suficientes factores de riesgo para desarrollar complicaciones más graves a edad temprana. Otra limitación es que el estudio es un abordaje transversal del problema, no sé realizó estudio de seguimiento por lo que el comportamiento de la enfermedad puede verse limitado.
Nuestros resultados, a pesar de las limitaciones comentadas previamente, pueden ser de gran utilidad para mejorar el pronóstico que los bebes prematuros tienen. Estos resultados alertan sobre la necesidad de un abordaje más integral en el paciente de alto riesgo no sólo en el aspecto nutricional, sino en el manejo menos invasivo que favorezca un desarrollo físico y psicomotor muy cercano a un niño de término (catch-up growth).
CONCLUSIONES
En conclusión nuestros resultados sugieren como población de riesgo para desarrollar enfermedad ósea metabólica del prematuro a pacientes prematuros con peso al nacimiento ≤ 1,000 gramos y con eventos repetidos de sepsis, así como a los prematuros de 1,001-1,500 gramos con administración de sedación mayor de 7 días y uso de corticoide mayor de 5 días. Dado que los recién nacidos prematuros menores de 1,500 gramos y hospitalizados en terapia intensiva neonatal son población de alto riesgo proponemos realizar determinación de calcio, fósforo y fosfatasa alcalina a partir de la tercera semana de vida para la detección oportuna de la enfermedad ósea metabólica del prematuro.











 nueva página del texto (beta)
nueva página del texto (beta)