INTRODUCCIÓN
Las inmunodeficiencias primarias son enfermedades hereditarias generalmente causadas por alteraciones monogénicas. Pueden afectar el sistema inmunitario en su desarrollo, su función, o en ambos.1 Se clasifican de acuerdo con la afección particular del sistema inmunológico que presentan. Desde 1970 existe un Comité de Expertos de la Unión Internacional de Sociedades de Inmunología que actualiza periódicamente esta clasificación, que en la actualidad incluye a más de 180 entidades.2 En 2007 Boyle publicó un estudio en una muestra representativa de población abierta en Estados Unidos en la que, mediante una encuesta telefónica, reportó una prevalencia estimada de 1 por cada 1,200 habitantes. 3
En los últimos años ha sido notorio el avance del conocimiento de estas enfermedades, de su expresión clínica y, más recientemente, de las alteraciones genéticas con las que se asocian.4 Esto ha permitido que el diagnóstico se pueda establecer con mayor precisión, aumentando el número de casos diagnosticados y, en algunos países, que se haga de manera temprana. Esto aún no se logra en México debido principalmente a que los médicos de primer contacto frecuentemente no están familiarizados con las manifestaciones clínicas de estas enfermedades.5 Cuando los enfermos con inmunodeficiencias primarias no se diagnostican y tratan oportunamente cursan con infecciones recurrentes o graves que pueden poner en peligro la función del o los órganos afectados y en ocasiones también la vida.6
En México, al igual que en Latinoamérica y el resto del mundo, las inmunodeficiencias primarias con defecto predominante en la producción de anticuerpos son las que se diagnostican con mayor frecuencia.5 El tratamiento de estas enfermedades consiste en la administración periódica (de por vida) de inmunoglobulina G humana (IgG) con el objeto de mantener niveles séricos de IgG similares a los de una persona sana.7-11
El hecho de que los pacientes con defectos en la producción de anticuerpos requieran recibir IgG cada tres o cuatro semanas obliga al paciente y sus familiares a desplazarse a un centro de atención médica donde pueda aplicarse el medicamento, con la consiguiente pérdida de días de escuela para los pacientes y de trabajo para los padres. Además, el retraso diagnóstico puede ocasionar daño irreversible en los órganos afectados por infecciones recurrentes. Todo lo anterior, puede afectar la calidad de vida tanto del paciente como de sus familiares.
En los últimos 10 años, se han desarrollado cuestionarios con módulos independientes que evalúan la calidad de vida en muchas enfermedades crónicas en pediatría, como el asma, la apnea obstructiva del sueño, el cáncer y la artritis idiopática juvenil, entre otras.12-19 En una revisión sistemática en la que se analizaron las características de los instrumentos utilizados para medir calidad de vida en niños se concluyó que el "Pediatric Quality of Life Inventory" (PedsQL) tiene validez y confiabilidad aceptables y que su sensibilidad al cambio es buena, ya que es uno de los mejores instrumentos disponibles.12 Su aplicación es breve (4 minutos) a partir de los 5 años de edad, incluye una versión para niños y otra para padres (para las edades entre 2 y 5 años solamente incluye versión para padres) por lo que permite evaluar ambas perspectivas, además de que existe una versión en idioma español validada para México.12
Hasta hoy no existe un instrumento específico para medir calidad de vida en enfermos con inmunodeficiencias primarias. El PedsQL es el cuestionario que ha sido más utilizado en niños con diagnóstico de inmunodeficiencias primarias.20-28 Existen algunos reportes, la gran mayoría de ellos en ensayos clínicos, en los que se ha utilizado para comparar dos o más tratamientos, pero hay muy poca información a escala mundial de la calidad de vida en las inmunodeficiencias primarias y es nula en el caso de nuestro país.
Estudios retrospectivos realizados en el Instituto Nacional de Pediatría en pacientes con inmunodeficiencias primarias reportan una mediana de la edad de inicio, de infecciones de repetición, de 12.8 meses; así como una mediana de edad al momento del diagnóstico de 5.5 años, con un promedio de retraso en el diagnóstico de 3.8 años y, por consiguiente, de retraso en el inicio del tratamiento sustitutivo con IgG intravenosa.29 El tratamiento con IgG intravenosa reduce el número de infecciones anuales, la gravedad de los cuadros clínicos presentados, así como la necesidad de hospitalizaciones; lo que se traduce en un menor uso de recursos médicos. Todo ello es consistente con los resultados de otros estudios en los que, además, se documenta una mejoría en la calidad de vida de los pacientes con inmuno-deficiencias primarias que reciben tratamiento sustitutivo con IgG intravenosa.30-37
En México existe una población creciente de pacientes con inmunodeficiencias primarias cuya supervivencia es cada vez mayor debido a los avances en el tratamiento; sin embargo, no contamos con estudios que describan la calidad de vida de estos pacientes.
OBJETIVO
Comparar la calidad de vida de los pacientes con inmunodeficiencias primarias, por defecto en la producción de anticuerpos, con la calidad de vida de niños sanos en la población pediátrica mexicana.
Como objetivo secundario se comparó la percepción de la calidad de vida de los pacientes con inmunodeficiencias primarias mayores de 6 años con la de sus familiares, también se evaluó la relación entre la calidad de vida y las siguientes variables: edad al momento del diagnóstico, retraso en el diagnóstico, concentraciones séricas promedio "preinfusión" de IgG en el último año y bronquiectasias.
MÉTODOS
Diseño y ubicación del estudio
Realizamos un estudio transversal analítico para comparar la calidad de vida de pacientes con inmunodeficiencias primarias por defecto en la producción de anticuerpos versus individuos sanos. Aplicamos el instrumento en pacientes con diagnóstico de inmunodeficiencia primaria atendidos en el Servicio de Inmunología del Instituto Nacional de Pediatría en la Ciudad de México y en la Unidad Médica de Alta Especialidad 25 del Instituto Mexicano del Seguro Social en Monterrey, Nuevo León, así como en niños clínicamente sanos de una escuela pública de la zona sur de la Ciudad de México, seleccionada por la conveniencia para recolectar los datos. El protocolo fue aprobado por el Comité de Investigación y por el Comité de Ética del Instituto Nacional de Pediatría.
Sujetos
Se incluyeron 28 pacientes con diagnósticos de agammaglobulinemia ligada al X, agammaglobulinemia autosómica recesiva, inmunodeficiencia común variable e hipogammaglobulinemia con síndrome de hiper-IgM diagnosticados de acuerdo con los criterios de la Sociedad Europea de Inmunodeficiencias.38 Se excluyeron pacientes o padres que no supieran leer y escribir y aquellos que no tuvieran el español como lengua materna, así como aquellos pacientes que tuvieran complicaciones como neoplasias y otras enfermedades crónicas durante el período de inclusión en el estudio. Se incluyeron niños clínicamente sanos como controles, previa autorización del director de la escuela y permiso de sus tutores, de una escuela pública al sur de la Ciudad de México. Para la inclusión en el estudio se solicitó la firma de consentimiento informado a los padres de controles y pacientes, así como la de consentimiento informado a controles y a pacientes de 9 años y mayores antes de ser aplicado el cuestionario para evaluar la calidad de vida.
La calidad de vida fue medida con la versión en español del PedsQL validada en la población mexicana. A los pacientes mayores de 5 años se les aplicó el cuestionario acorde con su edad en la modalidad de autoaplicación; asimismo, se aplicó el cuestionario al padre o tutor que lo acompañaba. Para los menores de 5 años se aplicó el cuestionario (también en la modalidad de autoaplicación) a padres o tutores. Durante el llenado del cuestionario todos contaron con asistencia de personal capacitado.
La información sobre diagnóstico, edad de diagnóstico, tiempo de retraso al diagnóstico, concentraciones séricas de IgG (mg/dL) preinfusión del último año e incidencia de bronquiectasias fue obtenida del expediente clínico.
Análisis estadístico
Se utilizó estadística descriptiva para los datos demográficos de la población estudiada. La diferencia de la puntuación de PedsQL se determinó por la prueba de t de Student. La relación entre las variables demográficas y clínicas con los puntajes de calidad de vida fue analizada primero de manera individual. Posteriormente se analizaron, mediante un modelo de regresión lineal múltiple, incorporando las variables en un procedimiento automatizado de "stepwise" basado en la comparación de valores del AIC (Akaike Information criteria). Cuando no se observaron resultados significativos se realizó el análisis de poder estadístico post hoc. Todos los análisis de datos fueron realizados en el paquete estadístico comercial JMP10 de SAS Institute, Inc.
RESULTADOS
Se incluyeron 28 pacientes con deficiencia grave de anticuerpos, 19 con agammaglobulinemia ligada al X (XLA), 1 con agammaglobulinemia autosómica recesiva, 2 con hipogammaglobulinemia con síndrome de hiper-IgM y 6 con inmunodeficiencia común variable. La mediana de edad de los pacientes participantes fue de 5 años y 5 meses, el paciente menor fue de 2 años 7 meses y el mayor de 17 años 7 meses.
Se incluyeron 50 controles clínicamente sanos. La edad promedio de los controles fue de 8 años 2 meses con una desviación estándar de 1 año 7 meses; la edad mínima fue de 6 años y la máxima de 11 años.
El promedio de edad al diagnóstico fue de 6 años con 3 meses, con una desviación estándar (DE) de 3 años 6 meses. La mediana del retraso en el diagnóstico fue de 3 años 3 meses, con un rango intercuartil de 5 años 6 meses, con un valor mínimo de 1 mes y máximo de 10 años 8 meses. Con respecto a la edad en la primera infección grave la mediana fue de 1 año, con un rango intercuartil de 2 años 11 meses, con un valor mínimo de 5 meses y máximo de 10 años.
El promedio de calidad de vida para los pacientes fue de 74.1 (DE ± 13.8) y de 83.3 (DE ± 10.1) para los controles; esta diferencia de 9.2 puntos fue estadísticamente significativa (p = 0.005). El promedio del funcionamiento físico fue de 77.4 (DE ± 15.3) para los pacientes y de 85.2 (DE ± 9.9) para los controles, la diferencia fue de 7.8 puntos (p = 0.024). El promedio del funcionamiento psicosocial fue de 72.3 (DE ± 14.6) para los pacientes y de 82.2 (DE ± 11.2) para los controles, la diferencia (9.9 puntos) fue estadísticamente significativa (p = 0.004) (Cuadro 1). No se encontró correlación entre la percepción de los pacientes y la de los padres (Cuadros 2 y 3). De los 26 casos comparados se encontró que en 6, la percepción de la calidad de vida fue similar entre padres y pacientes, en 10 casos fue mejor la percepción de los pacientes comparada con la de los padres y en los 10 restantes fue peor la percepción de los pacientes que la reportada por los padres.
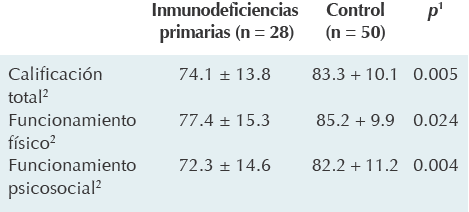
*Inventario de calidad de vida pediátrica.
1 Prueba t de Student.
2Media ± desviación estándar.
Cuadro 1 Comparación de puntajes de la escala del PedsQL* entre los niños con inmunodeficiencias primarias y controles sanos
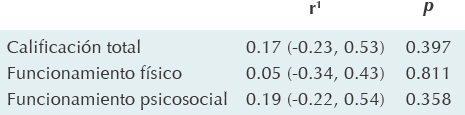
*Inventario de calidad de vida pediátrica.
n=26; dos pacientes fueron excluidos por ser menores de 5 años.
1 Coeficiente de correlación de Pearson.
Cuadro 2 Correlación entre la percepción de los pacientes y la de los padres en los puntajes de la escala del PedsQL*
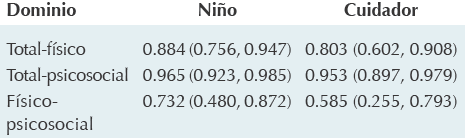
*Inventario de calidad de vida pediátrica.
Cuadro 3 Correlación entre los dominios de la escala del PedsQL* en niños con inmunodeficiencias primarias y en su cuidador
Se analizó la relación entre calidad de vida, años de retraso en el diagnóstico y presencia de complicaciones mediante un modelo lineal múltiple. Por el procedimiento de stepwise obtuvimos un modelo que consiste en las variables tiempo de retraso en el diagnóstico y presencia de complicaciones pulmonares; la interacción de estas dos fue marginalmente significativa (p = 0.054) (Figura 1). Como la interacción resultó significativa el modelo fue interpretado como dos modelos de regresión lineal simple en los que la variable de desenlace es el puntaje total de PedsQL y la variable independiente es tiempo de retraso en el diagnóstico en dos grupos de niños: uno con complicaciones pulmonares y otro sin ellas (Cuadro 4). En los niños sin complicación pulmonar no se observó asociación entre el tiempo de retraso del diagnóstico y el puntaje de PedsQL; sin embargo, en el caso de los niños con bronquiectasias hubo una asociación altamente significativa (p = 0.003) con el tiempo de retraso en el diagnóstico. De acuerdo con el modelo si un niño tiene una complicación pulmonar, cada año de retraso en el diagnóstico repercute en la disminución de 2.8 puntos porcentuales en su calidad de vida; mientras que si el niño no tiene complicación pulmonar el retraso en el diagnóstico no repercute en la puntuación del PedsQL de manera significativa (Figura 1).
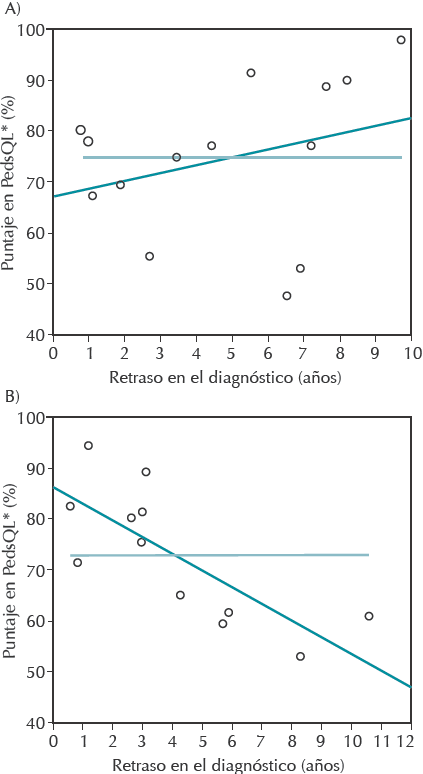
A) Niños con inmunodeficiencia primaria sin complicación pulmonar; B) Niños con inmunodeficiencia primaria y complicación pulmonar. "Inventario de calidad de vida pediátrica.
Figura 1 Efecto del retraso del diagnóstico de inmunodeficiencia primaria en niños sin y con complicación pulmonar
DISCUSIÓN
En este estudio se observó, como era de esperarse, que la calidad de vida de los pacientes con inmunodeficiencia primaria es menor que la de niños sanos de edades similares. Encontramos también que no existe correlación entre la percepción que tienen los padres y los propios pacientes con respecto a su calidad de vida. Esto puede deberse a que el instrumento, que no está diseñado específicamente para evaluar la calidad de vida en pacientes con inmunodeficiencia primaria, no evalúa objetivamente cómo la inmunodeficiencia afecta la calidad de vida de estos pacientes y, por supuesto, la diferente percepción que tienen padres y enfermos de cómo la enfermedad está afectando sus vidas.
Asimismo, se encontró diferencia entre la calidad de vida en los pacientes con complicaciones pulmonares (bronquiectasias) y los que no las tenían. Como se podría esperar, la calidad de vida fue menor en el grupo con complicaciones; aunque esto no resultó estadísticamente significativo en nuestro estudio. No obstante, cuando buscamos interacciones entre el retraso en el diagnóstico, las bronquiectasias y la calidad de vida encontramos que esta última tiende a disminuir de forma clara y estadísticamente significativa en el grupo de pacientes con complicaciones pulmonares. Existió una disminución de 2.8 puntos porcentuales de la escala utilizada por cada año que se retrasó el diagnóstico; mientras que en el grupo de pacientes sin complicaciones no hubo una tendencia clara de disminución de la calidad de vida cuando se prolongaron los años de retraso en el diagnóstico. Este fenómeno se explica debido a que los pacientes sin complicaciones, gracias al tratamiento sustitutivo con gammaglobulina intravenosa, pueden volver a tener una vida casi normal a diferencia de los pacientes con bronquiectasias en quienes el tratamiento para mantenerlos libres de síntomas, infecciones y hospitalizaciones suele ser más complicado, lo que repercute en su calidad de vida.
Este es el primer estudio que analiza la calidad de vida en pacientes con inmunodeficiencia primaria en México. Nuestros hallazgos son muy similares a los informes de los pocos estudios que existen en otros países. En un estudio similar al nuestro, en el que se midió la calidad de vida con el cuestionario PedsQL en 25 pacientes con agammaglobulinemia ligada al cromosoma X en Italia y se comparó con niños sanos y con pacientes con enfermedades reumatológicas, se reportó una calidad de vida menor en los pacientes con enfermedades reumatológicas (72.1 puntos), seguida por la de pacientes con agammaglobulinemia (75.8 puntos), en comparación con los niños sanos (86.8 puntos); hubo una asociación significativa entre la percepción de los pacientes y la de los padres.25 A diferencia de otras enfermedades crónicas como el asma o la diabetes en las inmunodeficiencias primarias, a pesar de que son afecciones crónicas y que frecuentemente ya tienen complicaciones al momento del diagnóstico, no es común encontrar informes de calidad de vida; salvo en algunos ensayos clínicos que comparan opciones de tratamiento sustitutivo. Debido a que los pacientes incluidos en el estudio ya estaban diagnosticados y en tratamiento no contamos con una medición de la calidad de vida basal; es decir, antes del inicio del tratamiento o en el momento del diagnóstico (aunado a que sólo realizamos una medición de calidad de vida para cada paciente). Todo esto se debe tomar en cuenta al analizar las correlaciones entre la calidad de vida y las diferentes variables analizadas como edad al diagnóstico, retraso en el mismo, presencia de complicaciones pulmonares y concentraciones promedio de IgG en el último año. Cuando se habla de algo tan complejo como la calidad de vida, influenciada por múltiples factores físicos, emocionales, sociales y familiares, no es fácil encontrar una correlación estadísticamente significativa con una sola variable.
CONCLUSIONES
Consideramos necesario incluir a la medición de la calidad de vida como parte de las herramientas para evaluar el estado de salud de los pacientes con inmunodeficiencia primaria, así como para el seguimiento durante su tratamiento y vigilancia; esto con el fin de incidir, con el diagnóstico y tratamiento oportunos no sólo en la reducción del número de infecciones, hospitalizaciones y complicaciones, sino también en la mejoría de la calidad de vida de nuestros pacientes, con datos objetivos para demostrarlo. Esto debería de implicar que en un futuro cercano se diseñe un instrumento específico de medición de la calidad de vida de los pacientes con inmunodeficiencias primarias.











 nueva página del texto (beta)
nueva página del texto (beta)



