INTRODUCCIÓN
El timo es un órgano complejo conformado por elemento epiteliales y linfoides; es el sitio de maduración de los linfocitos T.1 Las neoplasias epiteliales del timo incluyen timomas, carci-noides y carcinoma tímico. Los tímicos son los tumores más comunes de los mediastinales en el adulto (40%);2-4 en niños representan el 1.5% de los tumores mediastinales.3,5 La edad media de presentación es a los 13 años y predominan en los varones en proporción de 9:5. 6-8 Stachowicz y sus colaboradores describieron pacientes polacos con edades entre 4.5 y 19 años (media de 16 años).9 En el grupo italiano de tumores raros (Proyecto TREP) de nueve pacientes estudiados en 10 años la edad media fue de 12.4 años.10
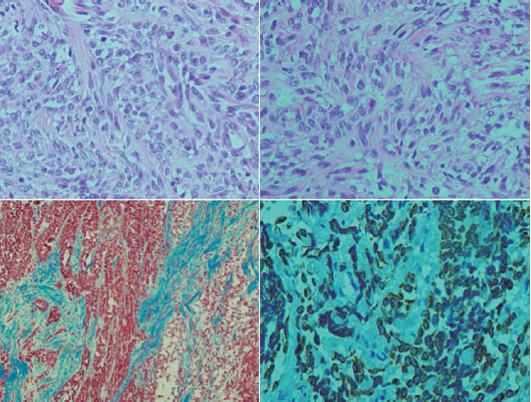
En los carcinomas tímicos las células epiteliales pierden sus características fenotípicas y funcionales, muestran anaplasia celular, con núcleos prominentes, cromatina vesicular, abundante actividad mitósica, aumento del índice núcleo-citoplasma y necrosis; infiltración extensa a los tejidos circundantes y metástasis extratorácica;11 la mayoría expresa CD5.1,12 El carcinoma tímico fue descrito por primera vez como neoplasia del epitelio tímico en 1977 por Shimosato.13
Histopatológicamente hay varios subtipos de carcinoma: de células escamosas (que se clasifica en bien diferenciado o queratinizado, moderadamente diferenciado y pobremente diferenciado; antes carcinoma semejante a linfoepitelioma) asociado con infección por virus de Epstein-Barr13 y otros subtipos como carcinoma de células claras mucoepidermoide, carcinosarcoma, anaplásico, entre otros.4,13,14 El tipo histológico más común es el de células escamosas cuya variedad poco diferenciada es la más común en la población occidental.13
Los síntomas iniciales del tumor mediastinal anterior son dolor torácico,10 tos crónica, disnea, fiebre, pérdida de peso, dificultad respiratoria y síndrome de vena cava superior3,9 y suelen presentarse de tres semanas a seis meses. Hasta 30% de los casos son asintomáticos.3,10,15
La diferencia de la miastenia grave con el timoma es que se presenta entre 15 a 59% de los casos (8% en carcinoma tímico16 ). En niños se han descrito casos relacionados con esclerodermia, lupus eritematoso, osteoartropatía hipertrófica, polimiositis, eritrodermia, síndrome de Sjögren y síndrome nefrótico.9,10,17-19
Radiológicamente puede haber derrame pleural e invasión a la pleura y al pericardio. 3 La tomografía axial computada contrastada es el estudio de elección para los tumores tímicos. Se ha utilizado la tomografía por emisión de positrones con fluorodesoxiglucosa para detectar metástasis pleurales. 20
De todos los pacientes con carcinoma tímico 46% tiene metástasis linfáticas. La diseminación hematológica a pulmón, hígado, hueso, riñón y cerebro ocurre en 43, 46, 29, 18 y 11%, res-pectivamente.7,21
La primera clasificación de los tumores tímicos fue propuesta por Bernatz de manera descriptiva, dependiendo del contenido de células linfocíti-cas. Levine y Rosai presentaron una clasificación clinicopatológica.1 En 1999 la Organización Mundial de la Salud propuso una clasificación histopatológica (Cuadro 1) designando con letras la morfología de las células epiteliales neoplási-cas y dependiendo de la relación entre células epiteliales y linfocitos, así como la atipia celular. En esta clasificación los carcinomas tímicos corresponden a B3 y C, con supervivencia a 10 años de 35 y 30%, respectivamente. 22 El tipo C tiene una prevalencia de 10 a 25%1 (Cuadro 1).
Actualmente se utiliza el sistema de estadi-ficación quirúrgico de Masaoka y su grupo (Cuadro 2).23 Hay una relación muy estrecha entre ambos sistemas de clasificación, los pacientes clasificados como tipos B2, B3 y C corresponden a los estadios III y IV de Masaoka.8,13 Otras clasificaciones son las de Müller-Hermelink y la de Suster y Morán, pero actualmente no se usan24,25 (Cuadro 2).
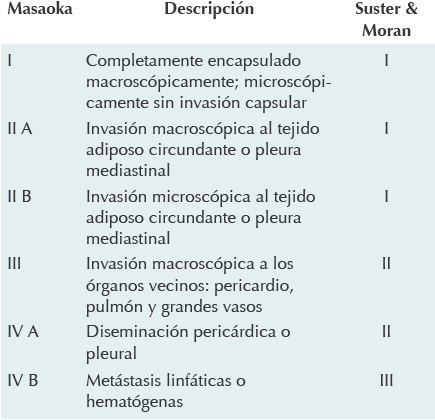
Cuadro 2 Clasificación de Masaoka et al23 de los tumores tímicos y su correlación con la clasificación de Suster y Morán11
El tratamiento del carcinoma tímico en niños se basa en la experiencia obtenida en adultos y en tratamientos heterogéneos de series de casos. El tratamiento debe ser multimodal incluyendo cirugía, quimioterapia y radioterapia. La cirugía es la piedra angular del tratamiento, aunque puede ser difícil por infiltración local del tumor y metástasis.26 La resección tumoral completa ofrece las mejores oportunidades de curación.3,25-29 Los pacientes con tumores en estadio I tratados solamente con resección completa tienen supervivencia a 5 años de 100%, con recurrencia de 1%.26,30-32 La resección subtotal es insuficiente; sólo un tercio de los pacientes a quienes se les realizó biopsia inicialmente viven 10 años.33 La resección completa es posible en 10 a 60% de los pacientes; según Stachowicz-Stencel se logró la resección total en 1 de 9 pacientes.9 En caso de recurrencia la cirugía total sigue siendo el arma principal para obtener supervivencias a largo plazo.8 El tratamiento quirúrgico utilizado es la esternotomía media34 aunque también se puede realizar toracotomía anterolateral.27,30,35
La radioterapia ayuda al control local de la enfermedad.30 Su uso en pacientes con carcinoma tímico Masaoka II es motivo de controversia ya que los tumores con infiltración transcapsular pueden tratarse solamente con cirugía. La National Comprehensive Cancer Network sugiere el uso de radioterapia tridimensional o de intensidad modulada posquirúrgica, en los pacientes con carcinoma tímico, para disminuir recaídas locales,36 aunque en algunas series no se ha visto beneficio.37 Los efectos secundarios de la radioterapia en el mediastino incluyen morbilidad cardíaca, neumonitis, fibrosis pulmonar, estenosis esofágica y segundas neoplasias.
Aunque la resección completa para tumores en estadio III ocurre entre 45 y 55% se recomienda radioterapia adyuvante. Estos pacientes tratados con altas dosis de radiación tienen supervivencia a 5 años de 30 a 50%; cuando se realiza resección total y radioterapia la supervivencia es de 60%. Si la resección es subtotal, aún con el uso de radioterapia, la supervivencia es de 30%. Onuki y sus colegas38 observaron que con dosis bajas de radioterapia prequirúrgica, más resección y radioterapia adyuvante en pacientes en estadios III, la supervivencia a 10 años es de 75%.38,39
El uso de radioterapia en carcinoma tímico depende del estadio y de la extensión de la resección quirúrgica.40 La radioterapia en pacientes con estadio IVA está bien establecida. Wright y su gripo señalaron que la radioterapia preoperatoria concomitante con quimioterapia, empleando cisplatino y etopósido, obtiene 40 a 99% de necrosis de los tumores obtenidos por cirugía.41 Nonaka y sus colaboradores mostraron que una dosis de 60 Gy mejora el pronóstico de pacientes con carcinoma tímico en estadios III y IV.42 La radioterapia disminuye la recurrencia local y prolonga las tasas de supervivencia.42-44 La dosis total de radioterapia utilizada oscila entre 40 y 70 Gy.42
La National Comprehensive Cancer Network36 propone dosis de 60 a 70 Gy para pacientes con tumores irresecables como tratamiento adyuvante, 45 a 50 Gy para tumores con márgenes negativos y 54 Gy cuando hay márgenes positivos microscópicos. Para enfermedad residual microscópica la dosis debe ser de 60 Gy en fracciones convencionales de 1.8 a 2.0 Gy diarios.42,45
Los pacientes con estadios I y los estadios II completamente resecados no se benefician con radioterapia para el control local, recurrencia o supervivencia, después de una resección quirúrgica.40
La quimioterapia neoadyuvante está indicada cuando la resección completa no es posible y se quiere reducir el tamaño tumoral y la extensión de la infiltración.39,41,46,47 Venuta y su equipo28 observaron 90% de supervivencia en pacientes que recibieron quimioterapia de inducción comparada con 71% en pacientes con escisión primaria.
Las respuestas a esquemas combinados de quimioterapia son mejores que cuando se utiliza una sola droga.48 Carlson y sus colegas describieron en 1990 el primer caso de quimioterapia exitoso en un paciente con carcinoma tímico indiferenciado metastásico utilizando el esquema PVB (cisplatino, vinblastina y bleomicina).49 Los protocolos basados en el uso de cisplatino han demostrado ser efectivos en el tratamiento,50 aunque hay muy pocos protocolos prospectivos y se han utilizados en adultos. En los años 90 del siglo pasado algunos estudios mostraban que la ifosfamida como monoterapia tenía actividad en 50% de los casos.33 El uso de antraciclinas es controvertido por el efecto tóxico incrementado cuando se utilizan junto con radioterapia mediastinal. Algunos autores han utilizado la combinación de cisplatino, doxorrubicina y me-tilprednisolona.51 El esquema ADOC (cisplatino, doxorrubicina, vincristina y ciclofosfamida) ha obtenido respuestas parciales.44,47,52 Los mejores resultados en estudios fase II se obtienen con esquema PAC (cisplatino, doxorrubicina y ciclofosfamida) y ADOC.52
El carboplatino con paclitaxel ha mostrado eficacia inclusive como primera línea de tratamiento en tumores irresecables.53-56 Iwaga y sus colaboradores establecieron supervivencia global de 22.7 meses y tasa de supervivencia a un año de 62% con este esquema en primera línea en estadios avanzados no resecables.55
Morio y Fukuda describieron respuestas parciales y resecciones completas en pacientes tratados con cisplatino y paclitaxel neoadyuvante.57-59 Lucchi y su equipo utilizaron un protocolo con cisplatino, doxorrubicina y etopósido, con cirugía y radioterapia posquirúrgica, con supervivencia a 10 años de 48 y 45% para estadios Masaoka III y IV.48 Yoh y sus colegas utilizaron quimioterapia semanal con cisplatino, vincristina, doxorrubicina y etopósido con supervivencia a 2 años de 58%.50 Recientemente se han estudiado algunas alternativas para los tumores que expresan receptores de somatostatina.59,60 Hasta 86% de los carcinomas expresan c-kit. Algunos estudios aislados evaluaron la respuesta del carcinoma tímico al imatinib sin éxito.61,62
La estadificación Masaoka y la resección tumoral completa son los factores de pronóstico más importantes en el carcinoma tímico.63 También se considera el subtipo histológico,44,64 la resección quirúrgica30 y en adultos el estado de Karnofsky.44 La supervivencia promedio en adultos es de 2.5 años.3,7,65 Con supervivencias a 5 y 10 años de 40 y 33%, respectivamente.66 El subtipo poco diferenciado tiene el peor pronóstico entre los demás subtipos histológicos65 con un promedio de supervivencia de 20 ± 18 meses.21 La mayoría de los casos pediátricos son fatales por progresión.3 El grupo polaco informó 7 defunciones de 9 pacientes, uno de ellos por toxicidad de la quimioterapia.9
Se presentan dos casos de carcinoma tímico diagnosticados y tratados en el Instituto Nacional de Pediatría (México).
CASO CLÍNICO 1
Adolescente de 15 años con historial de seis meses que inició con vómito, anorexia, fatiga, pérdida de peso (10 Kg), dolor torácico, cianosis peribucal y ungueal. Clínicamente se encontró soplo sistólico; el examen de sangre reveló hipercalcemia de 16.2 mg/dL que se trató con alendronato. Se sospechó una cardiopatía congénita. Un ecocardiograma mostro disminución de calibre de ramas pulmonares. Una tomografía axial computada de tórax y una angiorresonancia revelaron un tumor mediastinal anterior que desplazaba la silueta cardiaca; en estrecha relación con los grandes vasos infiltraba el pericardio y la pleura; los ganglios se veían aumentados de tamaño (Figura 1). Con una toracoscopia diagnóstica y la toma de biopsia se pudo diagnosticar carcinoma. Se realizó una esternotomía media y se hizo la resección parcial del tumor y peri-cardiotomía. El examen histológico del tumor confirmó el diagnóstico de carcinoma tímico (Figura 2). Se inició tratamiento con quimioterapia: CDDP (90 mg/m2); doxorrubicina (60 mg/m2); ciclofosfamida (1 500 mg/m2) y prednisona (100 mg/día durante 5 días), recibiendo tres ciclos. Después del primer ciclo el paciente cayó en choque séptico y paro cardiorrespiratorio. Se había reducido en 50% el volumen del tumor visualizado por imagen. Después del tercer ciclo se produjo bradicardia sinusal, por lo que se suspendió la quimioterapia. Recibió radioterapia con 50.4 Gy. Una tomografía de tórax no mostró evidencia de actividad tumoral. Solamente se vigiló al paciente que falleció 30 meses a causa de una neumonía por Acinetobacter iwoffii. No había evidencia clínica, radiológica ni por patología de actividad tumoral (Figura 1).
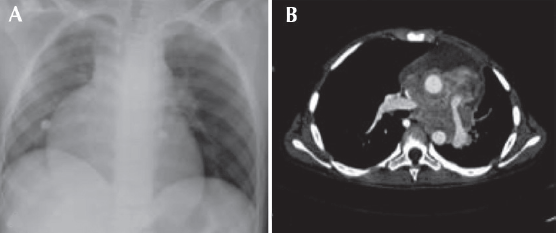
Figura 1 Estudios de imagen que muestran el tumor mediastinal. A) Radiografía de tórax: ensanchamiento mediastinal. B) Resonancia magnética de tórax: tumor mediastinal que desplaza los grandes vasos.
CASO CLÍNICO 2
Niña de 14 años de edad con historia de 3 meses de disnea progresiva y dolor torácico, fiebre y pérdida de peso de 3 kg. Fue tratada como con neumonía sin experimentar mejoría. Una tomografía de tórax mostró un tumor mediastinal anterior con calcificaciones, un derrame pleural y adenomegalias infradiafragmáticas. Se le dio tratamiento con prednisona (40 mg/kg/do) debido a los síntomas respiratorios con lo que disminuyó 30% el tamaño del tumor. Se realizó la resección parcial de 50% del tumor. Se trataba de un carcinoma linfoepitelial con invasión pleural y pulmonar. Se inició quimioterapia con CDDP (100 mg/m2 por 5 días) y 5-fluo-rouracilo (100 mg/m2 por 5 días) por 6 ciclos. Posteriormente se realizó radioterapia con 50.4 Gy en el cuello y en el mediastino con lo que hubo una respuesta favorable según mostró una tomografía. Ocho meses después apareció una metástasis pulmonar y hubo que realizar resección. Actualmente la paciente está con enfermedad pulmonar.
ANÁLISIS
Los carcinomas tímicos en niños son poco frecuentes. Presentamos dos casos diagnosticados en pacientes adolescentes en el Instituto Nacional de Pediatría en los últimos 10 años. En el primer caso el cuadro clínico correspondió a obstrucción al flujo de salida de los grandes vasos e hipocalcemia, mientras que el segundo correspondió con obstrucción de la vía aérea.
Según la clasificación de Masaoka ambos casos eran avanzados (IVA y IVB, respectivamente) y con resección incompleta inicial, por lo que estaba indicado tratamiento adyuvante. El esquema de quimioterapia utilizado en el caso 1 con CDDP/doxorrubicina/ciclofosfamida ya ha sido demostrado como útil en el tratamiento de carcinoma tímico con residual macroscópico, aunque resultó ser muy tóxico. El uso de radioterapia, indicado en pacientes con residual macroscópico se corrobora en este paciente en el que, a pesar de haber fallecido, no se encontraron datos de actividad tumoral. El esquema utilizado en el caso 2 es un esquema poco utilizado y que no ha demostrado ser efectivo en este paciente que actualmente se encuentra con progresión de la enfermedad.
El carcinoma tímico debe de ser considerado entre los diagnósticos diferenciales de los tumores mediastinales como una causa rara y potencialmente fatal. El diagnóstico temprano, que favorece la resección quirúrgica total, ayudará a disminuir la mortalidad debida a este tumor.











 nova página do texto(beta)
nova página do texto(beta)