INTRODUCCIÓN
La tuberculosis es un problema de salud pública en gran parte del mundo. La Organización Mundial de la Salud estima que anualmente ocurren nueve millones de casos y fallecen 1.5 millones de personas debido a esta enfermedad.1 En México, en el 2014, se registraron 20 137 casos de todas las formas de tuberculosis y fallecieron 2 300 personas. En el país, Sonora ocupa el cuarto lugar en incidencia (32.0/100 000) con todas las formas de tuberculosis; misma posición que tiene en tuberculosis pulmonar con una tasa de 28.6/100 000, en ambos casos duplicando el promedio nacional. En mortalidad, el estado ocupa la segunda posición en todas las formas de tuberculosis (4.7/100 000) y en tuberculosis pulmonar (3.9/100 000), más del doble de la media nacional.2
Respecto a la tuberculosis pediátrica no hay precisión acerca de su magnitud real en el mundo; no obstante que su existencia refleja transmisión activa en población adulta3 se considera que ocurre en personas menores de 15 años de edad. En México, esta categoría incluye a personas menores de 19 años de edad.
De acuerdo con la Organización Mundial de la Salud1 en el 2013 ocurrieron, en todo el mundo, unos 550 000 casos nuevos y unas 80 000 defunciones; pero otras estimaciones sugieren que hasta 11% del total de casos corresponde a niños y en regiones pobres esta proporción se incrementaría hasta 15%,4 mientras en países de alta endemia constituiría entre 30 y 40% de la carga total de tuberculosis.5 En México el Programa Nacional de Prevención y Control de la tuberculosis considera a personas menores de 19 años como casos pediátricos y estimó, en el 2014, que 8.2% (1 661) de todos los casos ocurrieron en este grupo.2
Las discrepancias en las cifras de tuberculosis pediátrica pueden obedecer a que su diagnóstico es complejo debido a la poca especificidad de sus síntomas, a la naturaleza paucibacilar en este grupo y a la dificultad que los niños tienen para expectorar, lo que puede reducir la capacidad diagnóstica de los métodos tradicionales como la baciloscopia o el cultivo. For ejemplo, se ha estimado que únicamente entre 20 y 40% de los cultivos de esputo desarrollan Mycobacterium tuberculosis.3 Nicol y sus colaboradores6 señalaron que la sensibilidad de la baciloscopia es menor a 15%, por lo que se ha recomendado evaluar técnicas de respuesta rápida para identificar al bacilo.1,7,8 Una de esas pruebas es el ensayo de liberación de interferón gamma (IGRA por sus siglas en inglés) que mide la producción de interferón gamma en respuesta a la estimulación de antígenos específicos de M. tuberculosis (ESAT-6, CFF10 y TB 7.7).9,10 Uno de los ensayos comerciales de mayor uso en el mundo es el QuantiFERON-TB Gold (QFT-G®), que ha mostrado ser útil en población adulta pero persiste la incertidumbre acerca de su valor para detectar la infección en niños, particularmente en regiones con elevadas tasas de transmisión.9-11 En México, el método ha mostrado ser válido en poblaciones confinadas,12 además de ser costo-eficaz para el diagnóstico de la tuberculosis en adultos.13 Foco se conoce acerca de su valor en niños mexicanos aunque ha mostrado su utilidad para el diagnóstico de tuberculosis latente14 y, recientemente, en migrantes que residen en Estados Unidos.15
OBJETIVO
Examinar la utilidad diagnóstica del QFT-G® en pacientes menores de 19 años de edad, con sospecha de tuberculosis, que recibieron atención médica en un hospital pediátrico del Estado de Sonora, México. La capacidad diagnóstica de la prueba se comparó con los criterios de Stegen-Toledo, un conjunto de datos clínicos y epidemiológicos de amplio uso en pediatría16 que fueron usados como estándar de referencia ante las dificultades para confirmar bacteriológicamente la enfermedad en este grupo poblacional.
MATERIALES Y MÉTODOS
Mediante un estudio transversal se evaluaron la validez y la conf labilidad del reactivo QFT-G®, en muestras de sangre venosa periférica, para identificar infección tuberculosa en pacientes de un hospital público pediátrico del Estado de Sonora (entre el 1 de enero del 2012 y el 30 de junio del 2013). El estudio recibió financiamiento del Consejo Nacional de Ciencia y Tecnología. Antes de su implementación recibió la aprobación de dos comités de ética en investigación.
El criterio para elegir a los pacientes para el estudio tomaba en cuenta si tenían hasta 18 años de edad; se contó con el consentimiento informado y signado por los familiares responsables; tenían residencia por lo menos de 6 meses antes de la entrevista en alguna localidad de Sonora; no padecían o habían padecido alguna infección viral, por ejemplo, varicela, sarampión por referencia materna o del tutor. Fueron excluidos los que tenían alguna inmunodeficiencia o enfermedades renales, hepatopatías y padecimientos hemato-oncológicos, y si recibían o habían recibido tratamiento inmunodepresor o antituberculoso durante los dos meses previos a la fecha de determinación mediante QFT-G®.
Se estudió una muestra de probabilidad en 160 sujetos (poder estadístico = 0.86) elegidos convenientemente de las áreas de hospitalización. Médicos residentes de pediatría y nutriólogas, adiestrados en los procedimientos del estudio pero ignorantes respecto a su propósito, obtuvieron información clínica y epidemiológica mediante un cuestionario estructurado, cuyos datos fueron empleados para clasificar a los sujetos con probable tuberculosis latente o activa, así como en un grupo control. La clasificación fue como se describe a continuación.
Grupo I: pacientes con probable tuberculosis activa
Pacientes con cuadro respiratorio de 2 o más semanas de evolución acompañado por una o más de las siguientes características: a) no mejorar con los tratamientos antibióticos dirigidos a los patógenos habituales; b) tener radiología con imágenes sugestivas de tuberculosis; c) antecedente de contacto 4 horas diarias o más con un paciente sospechoso o confirmado de tuberculosis; d) reacción cutánea positiva (≥ 5 mm de induración cutánea 72 horas después de la aplicación) a la intradermorreacción con derivado proteínico purificado.
Grupo II: pacientes con probable tuberculosis latente
Pacientes sin evidencia clínica, bacteriológica ni radiológica de tuberculosis que tuvieron una reacción cutánea positiva al derivado proteínico purificado (≥ 5 mm de induración cutánea a las 72 horas de su aplicación) que pudieron tener contacto con un tuberculoso.
Grupo III: pacientes sin patología respiratoria aparente
Pacientes hospitalizados, sin datos de patología respiratoria aguda o crónica y sin contacto sustancial (4 horas o más diarias) reciente con un paciente sospechoso o confirmado de tuberculosis.
Recolección de muestras sanguíneas
A los sujetos elegidos se les tomó una muestra de 3 mL de sangre venosa periférica que se depositó en tubos específicos para el ensayo de liberación de interferón gamma (QFT-G®). Los tubos fueron transportados de inmediato a 22°C (± 5 grados) a un laboratorio especializado y fueron procesados dentro de las 16 horas posteriores a la toma de la muestra. El ensayo QFT-G® fue procesado de acuerdo con las guías de uso.17 Tras una incubación de 16 a 24 horas, a 37°C, se midió el interferón-γ liberado en el plasma por los linfocitos activados mediante un ensayo de tipo ELISA. Los datos de absorción fueron convertidos a unidades internacionales por mililitro (UI/mL) utilizando una curva estándar para cada placa de ELISA, misma que fue procesada por duplicado y aceptada sólo si el coeficiente de correlación fue mayor de 0.98 y el coeficiente de variación menor de 15%. Este método tiene un límite de detección de 0.05 UI/mL. Los datos individuales sólo se aceptaron como válidos si una respuesta (al menos a un antígeno: TB7.7, ESAT-6, CFP-10) fue mayor o igual a 0.35 UI/ mL bv y la concentración de IFN-γ fue 2.5 veces mayor que la del blanco.
Aplicación del derivado proteínico purificado
La aplicación se efectuó cuando menos 72 horas antes de la toma de muestra para el QFT-G® mediante la técnica de Mantoux. Se utilizó derivado proteínico purificado RT23 (Statens Serum Institut-Batch 1530-A) en ampolletas de 1 mL equivalente a 10 dosis de 0.1 mL con dos unidades de tuberculina de derivado proteínico purificado. La medición final de la dermorreac-ción se realizó 72 horas después a la aplicación y fue efectuada por un médico distinto al que la aplicó, para reducir el sesgo de observación. La interpretación de la prueba se basó en el diámetro de la induración de acuerdo con los siguientes criterios: a) si fue menor de 5 mm se considero como negativa; b) si fue de 5 mm o más se interpretó como una reacción positiva.18
El estándar de referencia: los criterios de Stegen-Toledo
La situación clínica de los sujetos con sospecha de tuberculosis se estableció mediante el empleo de los criterios de Stegen-Toledo.16 El sistema usa una medición que establece una certeza diagnóstica cuando se tienen 7 o más puntos; si se obtienen entre 5 y 6 puntos se acepta que el diagnóstico es factible y amerita iniciarse el tratamiento; entre 3 y 4 puntos se considera que el diagnóstico es posible y amerita estudio profundo; con menos de 2 puntos la sospecha de tuberculosis se descarta. Este sistema fue el estándar de referencia empleado para evaluar el desempeño del QFT-G®. Los criterios empleados para la clasificación de los sujetos incluyeron: a) hallazgo de bacilos ácido-alcohol resistentes (7 puntos); b) granuloma específico por histología (4 puntos); c) derivado proteínico purificado mayor de 10 mm (3 puntos); d) antecedente epidemiológico (2 puntos); e) radiografía sugestiva (2 puntos); f) cuadro clínico sugestivo (2 puntos).
Análisis estadístico
Se efectuó estadística descriptiva y las diferencias entre los grupos se examinaron con prueba polinominal de χ2 (variables categóricas) y ANOVA (variables continuas). Se probaron hipótesis a dos colas y fueron considerados estadísticamente significativos valores de p < 0.05. Para estimar la validez clínica del QFT-G® se compararon los resultados de la prueba de los pacientes con el estándar seleccionado. El resultado del QFT-G® se consideró positivo cuando fue ≥ 0.35 UI/mL. La validez del método se estimó con el cálculo de la sensibilidad y la especificidad para los grupos con tuberculosis activa y latente, en tanto la confiabilidad fue examinada con el coeficiente de Kappa (K); para su interpretación se usaron los valores propuestos por Landis.19
Para examinar la relación entre una prueba positiva de QFT-G® y los predictores clínicos y sociodemográficos identificados en la etapa descriptiva se llevó a cabo una regresión logística multivariada. Se utilizó el procedimiento de eliminación en reversa para elegir las variables que ingresaron al modelo final. Se obtuvieron razones de momios ajustadas y sus respectivos intervalos de confianza a 95%. La razón de probabilidades de χ2 fue empleada para examinar la significación del modelo final. Todo el análisis estadístico se realizó con el paquete NCSS 2007®.
RESULTADOS
Reproducibilidad de la prueba diagnóstica
La reproduccibilidad del ensayo de liberación de interferón gamma fue confirmada al observar que se alcanzó una curva estándar de 8 puntos, por triplicado, con diluciones seriadas del estándar contenido en el equipo QFT-G® entre concentraciones de 0 a 8 UI/mL. El coeficiente de determinación R2 > 0.9979 demostró la precisión intraensayos. El coeficiente de variación que se obtuvo entre las repeticiones fue de 2.6%, mucho menor al aceptable para el inmu-noensayo enzimático (ELISA) donde uno < 7% es aceptable; con ello se demostró la precisión interensayos. La exactitud del método se demostró mediante ensayos múltiples con el control positivo en los que se obtuvo un coeficiente de variación < 0.05% con relación a la concentración de referencia.
Descripción de los sujetos de estudio
La muestra se constituyó con 160 sujetos, 52 de ellos clasificados en el grupo de tuberculosis activa, 36 en el de tuberculosis latente y 72 controles. La descripción de los factores sociodemográficos explorados se despliega en el Cuadro 1. La edad promedio de los sujetos fue de 6.8 ± 0.71 años sin diferencias significativas (p = 0.275) entre los grupos. En la determinación cuantitativa del QFT-G® se apreció que los valores promedio (en UI/mL) del grupo de tuberculosis activa (5.00 ± 0.72) fueron superiores a los de sujetos con tuberculosis latente y a los de los controles (p < 0.001). Con respecto a la induración producida por el derivado proteínico purificado, el grupo de tuberculosis latente mostró la mayor reactividad dérmica (14.86 ± 1.65 mm), seguido por los del grupo con tuberculosis activa y por los del grupo control (p < 0.001). En el Cuadro 2 se muestran los detalles de esta distribución.
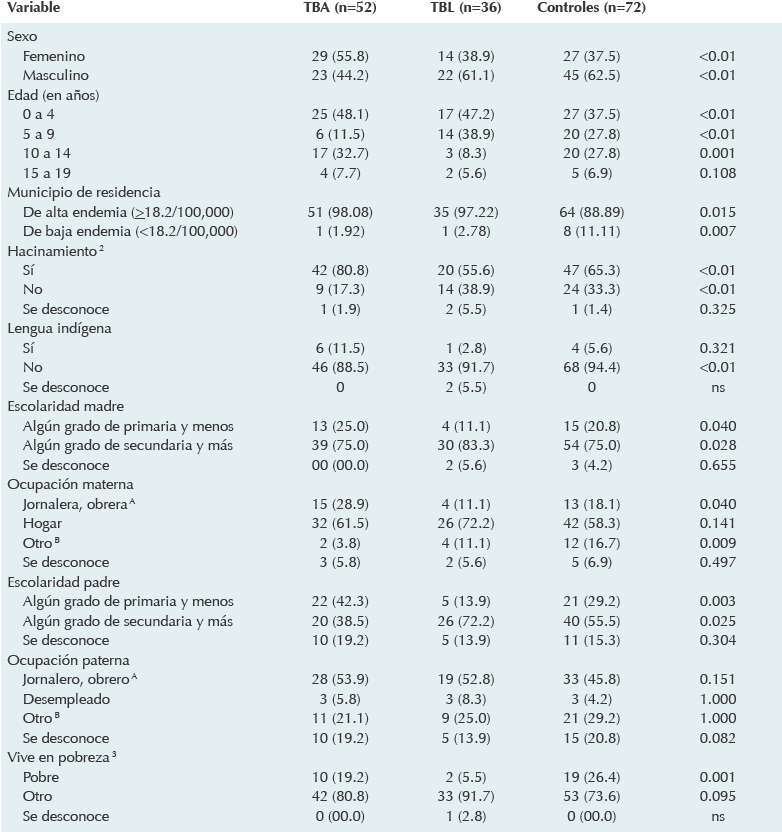
TBA: tuberculosis activa; TBL: tuberculosis latente.
1 Basado en una prueba multinomial de χ2 para igualdad de proporciones.
2Duermen 2.5 o más personas por habitación destinada a dormir (Instituto Nacional de Geografía y Estadística, 2010). 3Se consideró que vivía en pobreza si el ingreso familiar mensual estaba por debajo de la línea de bienestar del CONEVAL y alguno de sus padres, o ambos, tenía algún grado de primaria o sin educación. La línea de bienestar fue de $1,921.74 M.N. por mes [urbano] o menos de $1,202.80 M.N. [rural]. Línea de bienestar de la Comisión Nacional de Evaluación de la Política de Desarrollo Social (CONEVAL). AIncluye adicionalmente otras ocupaciones como vendedor ambulante, empleada doméstica, peones, trabajadores de reparaciones. "Incluye empleados, técnicos, oficinistas y profesionistas.
Cuadro 1 Características sociodemográficas seleccionadas de niños con sospecha de infección tuberculosa de un hospital pediátrico del estado de Sonora (2012-2013)
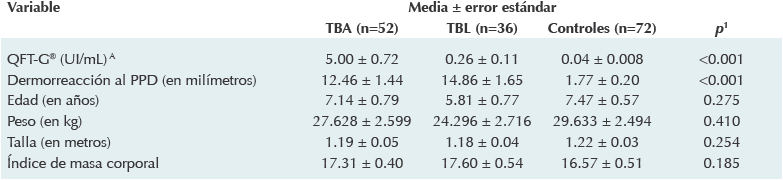
PPD: derivado proteínico purificado; QFT-G®: Quantiferon TB-Gold; TBA: tuberculosis activa; TBL: tuberculosis latente.
1 Basado en una prueba de ANOVA de una sola vía.
AExpresado en unidades internacionales por mililitro.
Cuadro 2 Características biomédicas de niños con sospecha de infección tuberculosa de un hospital pediátrico del estado de Sonora (2012-2013)
Se apreció que la tuberculosis pulmonar fue la forma clínica más frecuente de tuberculosis. De los 52 pacientes con la forma activa 41 (78.9%) tuvieron tuberculosis pulmonar; 11 (21.1%) tuvieron alguna forma extrapulmonar, principalmente ósea (5.8%) y ganglionar (5.8%). La mayor proporción (78.9%) de los sujetos con la forma activa alcanzó > 7 puntos de los criterios de Stegen-Toledo, que fue diferente de los otros grupos (p < 0.01). Además, 40 (76.9%) pacientes con tuberculosis activa tuvieron prueba positiva QFT-G® y sólo 33 (63.5%) tuvieron dermorreac-ción positiva. Esto fue diferente (p < 0.01) en el grupo con tuberculosis latente pues sólo 9 (25.0%) tuvieron QFT-G® positivo aunque 31 (86.11) fueron positivos al derivado proteínico purificado. Por otra parte, se observó que sólo 13 (25.0%) de los pacientes con tuberculosis activa tuvieron la tríada de tos de más de dos semanas de evolución, fiebre y pérdida de peso. La radiografía de tórax mostró datos sugestivos de tuberculosis en 43 (82.7%) de los pacientes con la forma activa y únicamente en dos (5.6%) de los sujetos con la forma latente (Cuadro 3).
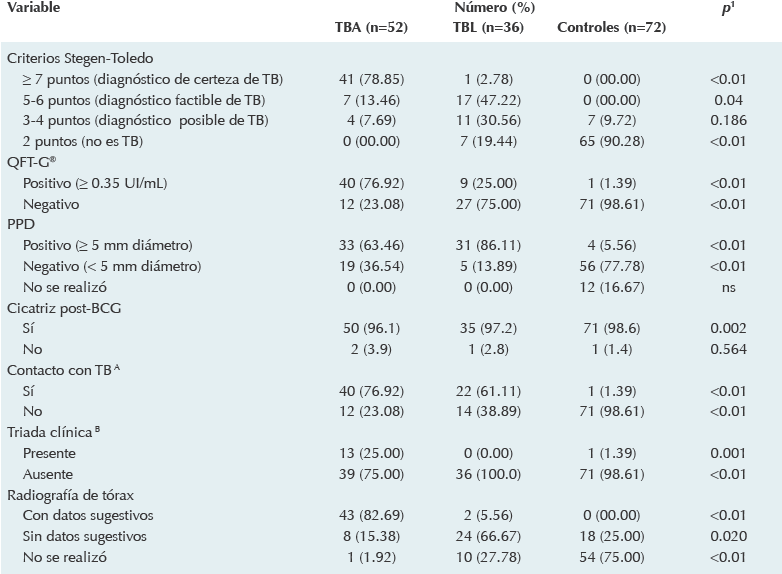
BCG: vacuna con bacilo de Calmette-Guerin; PPD: derivado proteínico purificado; QFT-G®: Quantiferon TB-Gold; TB: tuberculosis; TBA: tuberculosis activa; TBL: tuberculosis latente.
1 Basada en una prueba multinomial de χ2.
AContacto sustancial (> 4 horas diarias) con casos de TB (intradomiciliar o extradomiciliar).
BPresentaron tos de dos o más semanas de evolución, fiebre y pérdida de peso.
Cuadro 3 Características seleccionadas de niños con infección tuberculosa y un grupo control de un hospital pediátrico del estado de Sonora (2012 -2013)
Estimación de la utilidad diagnóstica del ensayo de liberación
En general, el ensayo de liberación de interferón gamma tuvo sensibilidad de 76.2% (IC 95%: 69.6, 82.8) y especificidad de 84.7% (IC 95%: 79.2, 90.3) para identificar la infección con Mycobacterium tuberculosis; fue superior al derivado proteínico purificado que tuvo sensibilidad de 26.2% (IC 95%: 17.4, 35.0) y especificidad de 56.6% (IC 95%: 48.6, 64.6). Para detectar tuberculosis activa la liberación de interferón tuvo sensibilidad de 76.9% (IC 95%: 69.5, 84.3), superior a la del derivado proteínico: 63.5% (IC 95%: 53.8, 73.1) y esa diferencia (13.4%) sí fue significativa. Esto no ocurrió con la especificidad, que fue muy semejante para ambas pruebas: 90.3 y 93.3%, respectivamente. No se apreciaron diferencias en otros indicadores, excepto en la tasa de falsos negativos, que fue superior para la dermorreacción (36.5%). No hubo diferencias significativas en los valores predictivos negativos.
En cuanto a la tuberculosis latente la sensibilidad del ensayo de liberación fue de sólo 25% (IC 95%: 16.8, 33.2) mientras la del derivado proteínico fue 86.1% (IC 95%: 79.2, 93.0); la diferencia entre éstos (61.1%) fue estadísticamente significativa. No obstante, no hubo diferencia significativa en cuanto a especificidad con valores de 98.6 y 93.3%, respectivamente. Todos los indicadores evaluados se muestran en el Cuadro 4.
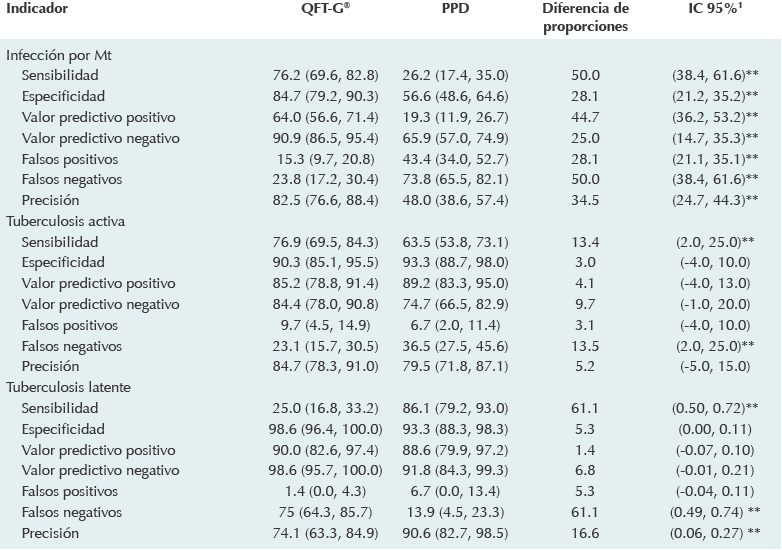
Mt: Mycobacterium tuberculosis; PPD: derivado proteínico purificado; QFT-G®: Quantiferon TB-Gold.
11ntervalo de confianza al 95% para la diferencia de dos proporciones muestrales.
**Diferencia estadísticamente significativa a 95% de confianza.
Cuadro 4 Indicadores de validez de dos métodos para el diagnóstico de tuberculosis en niños de un hospital pediátrico del estado de Sonora (2012-2013)
En lo referente a la contabilidad con el ensayo de liberación de interferón gamma se obtuvo un coeficiente Kappa (K) de 0.57 (IC 95%: 0.42, 0.73); cuando se estimó únicamente para pacientes con la forma activa de la enfermedad la K fue de 0.58 (IC 95%: 0.42, 0.73) pero fue muy pobre y no significativa para pacientes con la forma latente (K = -0.03, IC 95%: -0.19, 0.13). Para el derivado proteínico purificado el coeficiente fue muy bajo para cualquier forma de tuberculosis y en ninguna de ellas se apreció significación estadística.
Relación del ensayo de liberación con predictores sociodemográficos y clínicos
Tres variables clínicas predijeron significativamente una respuesta positiva del QFT-G® en el análisis factorial. La primera de ellas fue que el niño tuviera una radiografía posteroanterior de tórax con datos sugestivos de tuberculosis (infiltrado alveolar tipo neumonía; derrame pleural, adenopatía hiliar o miliar) cuya razón de momios cruda (RMc) fue de 6.42 (IC 95%: 2.62, 15.72); la segunda fue la triada clínica con una RMc de 6.63 (IC 95%: 1.97, 22.33) y la tercera fue la forma clínica de la tuberculosis: tanto la tuberculosis pulmonar (RMc 21.04, IC 95%: 8.06, 54.93) como la extrapulmonar (RMc 21.04, IC 95%: 4.70, 94.02) se asociaron con un QFT-G® positivo. De doce variables sociodemográficas y clínicas analizadas (edad, sexo, comorbilidades, desnutrición, cicatriz BCG, contacto con sospechoso de tuberculosis, municipio endémico, grupo étnico, ingreso familiar, ocupación y escolaridad de ambos padres, hacinamiento) sólo la última (> 2.5 personas por habitación para dormir) se relacionó con un ensayo de liberación de interferón gamma positivo (RMc 2.53, IC 95%: 1.13, 5.66).
En el análisis multivariado únicamente dos variables mantuvieron su valor para predecir un resultado positivo para el ensayo de liberación: los datos sugestivos de tuberculosis en la radiografía de tórax y la forma pulmonar de la tuberculosis. En el primer caso se observó que los sujetos con radiografía torácica sugestiva de tuberculosis tuvieron 4.4 veces (RM ajustada 4.37) más probabilidades de presentar ensayo de liberación positivo, lo que fue estadísticamente significativo. Para los sujetos con tuberculosis pulmonar se apreció que esa probabilidad fue 6.1 veces mayor (RM ajustada 6.15) en individuos con ensayo de liberación positivo, lo que también fue estadísticamente significativo. El modelo final mostró significación estadística (p < 0.01). Los resultados de la regresión logística multivariada se muestran en el Cuadro 5.
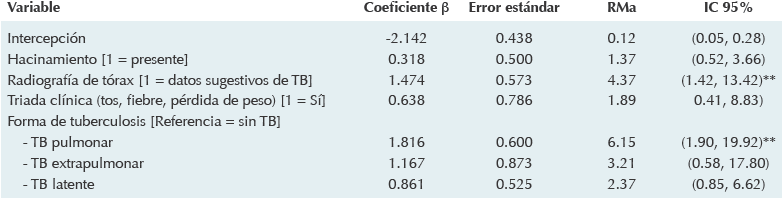
**Estadísticamente significativo; QFT-G®: Quantiferon TB-Gold; TB: tuberculosis.
IC 95%: intervalo de confianza a 95%; RMa: razón de momios ajustada por las otras variables contenidas en el modelo.
La significación general del modelo completo fue evaluada por χ2 = 55.789, p < 0.01.
Cuadro 5 Regresión logística multivariada de predictores de la respuesta a QFT-G® en niños con sospecha de infección tuberculosa de un hospital pediátrico del estado de Sonora (2012-2013)
DISCUSIÓN
Nuestro estudio muestra que el ensayo de liberación de interferón gamma es un método válido para el diagnóstico de tuberculosis pediátrica y que puede emplearse como un recurso complementario para su detección en niños y adolescentes. El método identifica correctamente a 8 de cada 10 niños con Mycobacterium tuberculosis, aunque su utilidad es casi explicada totalmente por su capacidad para identificar la forma activa de la enfermedad. Esta capacidad es consistente con la reportada por otros estudios pediátricos, que oscila entre 66 y 83%, aunque en países con economías en desarrollo esa sensibilidad fue sólo de 58%.10,11
La prueba parece tener mayor sensibilidad para detectar tuberculosis activa en países industrializados, fluctuando desde 50% hasta 100%;20,21 aunque otros reportes la ubican entre 70 y 85%, algo menor al desempeño observado en adultos.10,11 En cambio, en naciones de medianos y bajos ingresos la sensibilidad del ensayo de liberación ha sido menor y oscila entre 58 y 80%,10,11,22 un valor semejante al nuestro.
La capacidad del QFT-G® para identificar infección con M. tuberculosis no implica que pueda sustituir al derivado proteínico purificado como estrategia de cribado, por lo que una prueba positiva debe examinarse en los contextos clínico y epidemiológico específicos. Sin embargo, también es posible que un resultado negativo a la prueba pueda emplearse para descartar la enfermedad, especialmente en niños inmu-nocompetentes.23 Por ello, es recomendable ejecutar estudios longitudinales para evaluar el valor predictivo negativo de la prueba, siempre que se considere la prevalencia del escenario en donde se efectúe la investigación. En tal sentido, la especificidad de la prueba QFT-G® es un aspecto importante. En nuestro estudio la especificidad para tuberculosis activa fue 90.3%, congruente con los resultados de estudios previos que documentaron especificidad entre 91 y 95%.11,24 Así, el QFT-G® parece ser útil para detectar tuberculosis activa en regiones como la nuestra, especialmente en ausencia de confirmación bacteriológica como sucede con frecuencia en los casos pediátricos donde los datos clínicos y epidemiológicos, así como los hallazgos radiológicos, son los que apoyan el diagnóstico.
QFT-G® para el diagnóstico de la tuberculosis latente
En nuestro análisis el QFT-G® tuvo un comportamiento pobre para identificar niños con tuberculosis latente, algo ya descrito en otros trabajos.25 La sensibilidad que encontramos (25%) es inferior a la publicada (55%) por Machingaidze10 en niños de regiones con alta incidencia de tuberculosis. Kampmann y sus colaboradores26 señalaron una sensibilidad de 32% en niños vacunados o no con BCG. Este comportamiento del QFT-G® en niños es inferior al observado en adultos en quienes la sensibilidad fluctúa entre 61 y 90% para tuberculosis latente.11 Como resultado de esta sensibilidad limitada para la forma latente se ha señalado que no es mejor al derivado proteínico y que su utilidad se restringe a confirmar una historia de exposición a M. tuberculosis, que no distingue entre las formas activa y latente y puede ser obscurecida por infecciones remotas.20
Contraria a su baja sensibilidad la prueba QFT-G® mostró una excelente especificidad (98.6%), lo que es consistente con otros reportes pediátricos.11,25,27 La especificidad del método para detectar tuberculosis latente sugiere que la prueba es útil para descartar la infección en niños; aunque los resultados deben ser interpretados cautelosamente ya que, ante la ausencia de un criterio de referencia apropiado para la forma latente y la escasez de estudios longitudinales, es difícil concluir acerca de su especificidad cuando se le compara con el derivado proteínico.20 La capacidad mostrada por el QFT-G® sugiere que su incorporación a los procedimientos diagnósticos empleados para descartar tuberculosis latente en niños tendría capacidad superior al derivado proteínico pues, entre otras cosas, no se ve afectado por las tasas de vacunación con BCG.27 Nuestro hallazgo puede ser útil pues la detección y tratamiento oportunos de la forma latente de la enfermedad tiene implicaciones médicas y sanitarias sustanciales: a) puede disminuir la progresión hacia la forma activa; b) un diagnóstico preciso y el tratamiento en niños puede prevenir la reactivación adulta; c) la tuberculosis activa en niños tiene relevancia epidemiológica pues evidencia transmisión activa de M. tuberculosis en la comunidad.10
Concordancia del QFT-G® para detectar infección tuberculosa
No tenemos conocimiento de estudios previos que usaran como estándar de referencia un sistema de puntuación que, si bien tiene limitaciones metodológicas y no existe consenso acerca de su validez, constituye una herramienta útil en regiones con limitaciones para la confirmación de la M. tuberculosis. Es posible, que en situaciones similares los criterios clínicos puedan emplearse razonablemente como estándar de referencia. Si esto es aceptable, entonces el QFT-G® muestra una confiabilidad moderada cuando se le compara con los criterios de Stegen-Toledo.
Predictores de la positividad de QFT-G®
En nuestro estudio una radiografía de tórax con datos sugestivos de tuberculosis se asoció significativamente con la positividad del QFT-G®. El porcentaje de concordancia entre ambos procedimientos fue moderado (71.6%, K = 0.432); algo que fue apoyado por el análisis multivariado pues un niño con rediografía sugestiva tuvo cuatro veces más probabilidad de tener una prueba positiva de QFT-G® una vez ajustado el efecto del hacinamiento, síntomas clínicos y la forma de enfermedad. Esta asociación fue mayor en la tuberculosis pulmonar: se incrementó seis veces la probabilidad de un QFT-G® positivo.
La relación que observamos entre QFT-G® y radiografía es distinta a la de otros informes27 en donde no se encontró ninguna asociación significativa. Nuestro hallazgo indicaría, por un lado, que la detección de la infección es tardía en los niños, lo que permitiría el desarrollo de la enfermedad hasta etapas avanzadas; así cobra relevancia el valor predictivo negativo (84.4%) que muestra el QFT-G® para descartar tuberculosis activa. Por el otro, señala que la radiografía es un elemento importante del diagnóstico para detectar la forma activa de la enfermedad y que debe permanecer como una prueba de cribado de la tuberculosis en niños sintomáticos. La asociación observada debe ser tomada cautelosamente por una potencial colinearidad estadística entre la tuberculosis pulmonar y la radiografía torácica aunque, como señalamos, su hallazgo denota que la tuberculosis pulmonar no se sospecha oportunamente en la población pediátrica y que el QFT-G® puede ayudar a descartar su presencia dado su valor predictivo negativo.
Nuestro estudio tiene limitaciones: la primera es que la condición inmunitaria de los sujetos de estudio sólo fue investigada mediante el interrogatorio y la exploración médica, excepto para posible infección por VIH no se contó con controles positivos, lo que pudo dar falsos negativos en individuos con alguna inmunode-presión. Además, el antecedente de vacunación con BCG se comprobó únicamente con la identificación de la cicatriz característica, lo que pudo introducir errores de interpretación. La segunda limitación procede del criterio de referencia que empleamos pues existe un grado de subjetividad en la clasificación basada en los criterios clínicos, lo que podría sobrestimar la capacidad del QFT-G® para detectar infección tuberculosa. Además, es posible que el sesgo de selección del diseño elegido y la población que acude a atención hospitalaria tengan un efecto negativo en los resultados y que la capacidad diagnóstica del QFT-G® esté sobrestimada. Es recomendable que se efectúen estudios cuya base poblacional incluya sujetos cuya condición clínica (de tuberculosis) aún no se encuentre en fases avanzadas.
CONCLUSIONES
Nuestros hallazgos indican que el ensayo de liberación de interferón gamma (QFT-G®) es un método valioso para identificar la infección con Mycobacterium tuberculosis en niños y adolescentes atendidos en hospitales de regiones caracterizadas por exposición frecuente y con alta cobertura con BCG. La prueba parece particularmente útil para detectar la forma activa de la enfermedad (no tanto la latente) pues permite identificar a 8 de cada 10 niños con tuberculosis activa pero sólo a 3 de cada 10 con latente. Aparentemente posee alto valor predictivo negativo (> 90%) y elevada especificidad (> 90%), lo que ayudaría a descartar correctamente a 9 de cada 10 niños sin infección con M. tuberculosis. El método posee suficiente validez clínica y puede ser útil porque apoyaría razonablemente la decisión de comenzar tratamiento antituberculoso en niños con sospecha de tuberculosis, lo que contribuiría favorablemente a reducir complicaciones médicas asociadas con un tratamiento tardío, particularmente de la forma pulmonar.
Finalmente, debe considerarse que un resultado positivo del QFT-G® puede reflejar infecciones recientes más que infecciones remotas o exposición frecuente al agente, lo que ayudaría al diagnóstico de la forma activa por la naturaleza antigénica de la prueba y porque la activación de la memoria de linfocitos T que produce sólo persiste por tiempo limitado. El QFT-G® puede ser una herramienta diagnóstica útil para tuberculosis en niños y adolescentes en quienes la enfermedad es notablemente difícil de confirmar bacteriológicamente.











 nueva página del texto (beta)
nueva página del texto (beta)


