Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta pediátrica de México
versión On-line ISSN 2395-8235versión impresa ISSN 0186-2391
Acta pediatr. Méx vol.36 no.1 México ene./feb. 2015
Artículo original
Citotoxicidad de los edulcorantes Splenda® y Svetia® en formulaciones extemporáneas pediátricas*
Cytotoxicity of Splenda® and Svetia® in paediatric extemporaneous formulations
Cynthia Sámano-Salazar1, Radamés Alemón-Medina2, Juan Luis Chávez-Pacheco2, Víctor Manuel Dávila-Borja3
1 Laboratorio de Biología Celular, Universidad Autónoma Metropolitana, Unidad Cuajimalpa.
2 Laboratorio de Farmacología, Instituto Nacional de Pediatría.
3 Laboratorio de Oncología Experimental, Instituto Nacional de Pediatría.
Correspondencia:
Radamés Alemón-Medina
Laboratorio de Farmacología
Instituto Nacional de Pediatría
Insurgentes Sur 3700-C
CP 04530 México, D.F.
Tel/Fax. 52 55 10 84 09 00 Ext. 1428
ranapez@hotmail.com
Recibido: 26 de junio del 2014
Aceptado: 20 de noviembre del 2014
RESUMEN
Antecedentes: en nuestro laboratorio se ha empleado previamente sucralosa (Splenda®) para edulcorar formulaciones extemporáneas de metformina; sin embargo, hay publicaciones que sugieren una posible toxicidad del Splenda® en seres humanos.
Objetivo: determinar el efecto citotóxico de la sucralosa para producir muerte celular en células humanas, en cultivo in vitro, a la misma concentración que se ha empleado en la formulación extemporánea.
Materiales y métodos: las células se sembraron en placas de 96 pozos y se incubaron con sucralosa (Splenda®) por 60 minutos, stevia (Svetia®) o metformina. Se comparó la toxicidad celular determinada por absorbencia de formazán en lector de ELISA. Se analizaron las diferencias mediante ANOVA (p ≤ 0.05).
Resultados: no se comprobó citotoxicidad de las preparaciones endulzadas con sucralosa o stevia en comparación con la metformina sola.
Conclusión: tanto sucralosa como stevia pueden utilizarse como edulcorantes de formulaciones farmacológicas extemporáneas.
Palabras clave: sucralosa, stevia, edulcorantes, citotoxicidad, formulación extemporánea, farmacología pediátrica.
ABSTRACT
Background: In our pharmacology laboratory we have used sucralose (Splenda®) to mask the unpleasant flavour of metformin extemporaneous formulations. However, there have been reports regarding toxicity of sweeteners as Splenda® in humans.
Objetive: To determine the ability of sucralose to induce cell death in a model of in vitro cultured human cells at the same concentration used in our formula.
Methods: Cells were cultured in 96-well ELISA plates, then incubated with sucralose, stevia or metformin. Cytotoxicity was determined as the absorbance of formazan using an ELISA reader. Comparison was performed by ANOVA (p ≤ 0.05).
Results: Neither sucralose or stevia induced cell death when combined with metformin.
Conclusion: Both sucralose and stevia howed to be safe for preparation of paediatric extemporaneous formulations.
Keywords: sucralose, stevia, weeteners, cytotoxicity, extemporaneous formulation, paediatric pharmacology.
INTRODUCCIÓN
La elaboración de formulaciones magistrales o extemporáneas para ajuste de dosis individualizadas es una actividad fundamental en la farmacología pediátrica, esto debido a la carencia de presentaciones pediátricas comerciales de algunos fármacos. Con ello se facilita la administración oral de fármacos a niños y adolescentes en las dosis adecuadas.1 En condiciones idóneas, dichas formulaciones deben contener únicamente el fármaco disuelto en agua;1 sin embargo, muy a menudo tienen sabor desagradable por lo que se les adicionan edulcorantes o saborizantes artificiales. La mayoría de dichos agentes está aprobada por la farmacopea mexicana, en acuerdo con las internacionales, por tanto se asume su inocuidad para el organismo. No obstante, la elaboración de una fórmula magistral no está exenta de riesgos1 y se deben plantear estudios sobre la seguridad de los componentes empleados, tal es el caso de ciertos edulcorantes de reciente incorporación a fórmulas magistrales, como la sucralosa, para seres humanos.
En nuestro laboratorio se ha preparado una formulación magistral de metformina baja en calorías2 empleando sucralosa (Splenda®) como edulcorante. Dicha formulación ha mostrado ser estable física, química y microbiológicamente hasta por 30 días,2,3 además de cumplir con los criterios de precisión y exactitud en la cantidad de fármaco inalterado, lo que garantiza la seguridad de su uso.2 El Splenda® es un polvo a base del disacárido artificial llamado sucralosa. Según los fabricantes: "La sucralosa es una molécula extremadamente dulce y estable, altamente hidrosoluble, al igual que el azúcar y poco soluble en lípidos."
La sucralosa no produce toxicidad aguda ni crónica en organismos expuestos.4 No obstante, los informes de toxicidad en seres humanos han arrojado datos contradictorios, de tal suerte que algunos autores le han atribuido efectos citotóxicos y genotóxicos en distintas pruebas preclínicas.5 Por otro lado, aún no se han llevado a cabo estudios clínicos controlados que verifiquen la inocuidad de la sucralosa tras la exposición a largo plazo; la información en este terreno es aún muy preliminar.
El objetivo de este trabajo fue determinar la capacidad de la sucralosa para producir muerte celular en un modelo biológico de células humanas en cultivo (células MCF-7) como primer acercamiento a la determinación de la toxicidad biológica de la sucralosa, a la misma concentración que se ha empleado en las formulaciones extemporáneas elaboradas en nuestro laboratorio, a fin de descartar a priori la inocuidad in vivo del edulcorante en nuestra formulación. Asimismo, se evalúa la contribución de la metformina y se compara con la que pueda provocar el extracto de Stevia revaudiana (Svetia®), un edulcorante natural.
MATERIAL Y MÉTODOS
Elaboración de soluciones
Se elaboró la formulación de metformina 20 mg/mL disolviendo una tableta de 500 mg (Glucophage®, Roche) en 25 mL de agua potable endulzada con 10% de sucralosa (Splenda®). Para edulcorar el disolvente de la formulación se empleó agua embotellada (Bonafont®) a la que se le agregó 1 g de sucralosa por cada 10 mL; es decir, 10% masa/volumen. Asimismo se preparó agua edulcorada con stevia (Svetia®), endulzante natural elaborado con base en extractos secos de glicósidos de Stevia rebaudiana,6 también a 10%.
Cultivo celular
La determinación de la citotoxicidad en sistema eucarionte se llevó a cabo en células MCF-7 (pasaje 22) (ATCC) de cáncer de mama. El cultivo de las células se hizo en medio compuesto por F12 Ham, Dulbecco's Modified Eagle's Medium (DMEM) (1:1) enriquecido con 10% de suero fetal bovino (GIBCO-BRL), con 100 Ul/mL de antibióticos (penicilina y estreptomicina, GIBCO-BRL) e incubación a 37°C en una atmósfera compuesta por 95% de aire, 5% de CO2 y humedad relativa de casi 100%. Las células se descongelaron a 37°C y se sembraron a razón de 2 × 105 en 5 mL de medio DMEM/F12, en frascos de cultivo de 75 mL. Cuando las células alcanzaron 75% de cobertura en la superficie de crecimiento, se cosecharon empleando solución de tripsina-EDTA a 0.05% (GIBCO) durante 3 min a 37°C. Se resembraron dos veces y hasta la tercera cosecha se emplearon para el experimento.
Ensayo de citotoxicidad
Las células se sembraron en una microplaca de ELISA de 96 pozos, a razón de 2 × 104 por pozo, y se incubaron en las mismas condiciones de crecimiento (37°C y 5% CO2) por 24 horas. Las células fueron incubadas en medio de cultivo que contenía los agentes edulcorantes (Splenda® y Svetia®) por separado y la formulación extemporánea de agua potable con sucralosa + metformina y stevia + metformina, de acuerdo con el diseño de la placa (Cuadro 1). Esta disposición de los tratamientos en la placa se determinó convenientemente para facilitar la siembra de las células, la colocación de los agentes y los lavados de medio de cultivo. La lectura de la placa se realizó previa elaboración del esquema en el programa Gen 5® del lector Epoch. La exposición a tales compuestos fue de 60 minutos, considerada suficiente para producir toxicidad por compuestos mutágenos y antineoplásicos. Se retiró el medio de cultivo con los compuestos y se añadió medio nuevo. Se incubaron por 24 horas. Este tiempo de exposición sin agentes fue para evaluar al mismo tiempo viabilidad celular e inhibición de la proliferación; con este esquema, las células se exponen brevemente y luego se les da todo un ciclo de división celular. De hecho, las células del testigo negativo tienen 100% de proliferación y los tratamientos se normalizan con los datos de dicho testigo. Al concluir la exposición a los diferentes agentes, se añadieron 10 µL del reactivo WST-1, "Cell proliferation reagent", Roche®, conteniendo sales de tetrazolio y se incubaron durante 4 horas; dicho colorante es amarillo pero cambia a rojo intenso al descomponerse las sales de tetrazolio en formazán, por acción de las deshidrogenasas celulares; de este modo, a mayor absorbencia mayor actividad celular y a menor absorbencia mayor citotoxicidad. Se realizó la lectura de las absorbencias a 440 nm en un lector de placas de ELISA Epoch (Biotek®) operado por el programa informático Gen 5®.
RESULTADOS
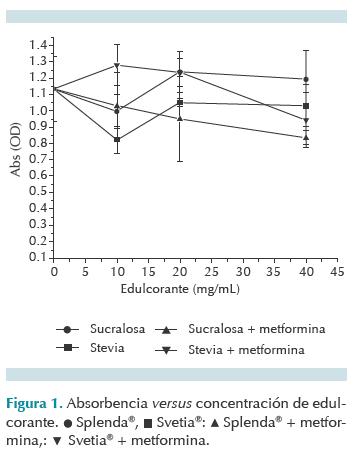
El Cuadro 2 muestra los valores promedio de densidad óptica de los tratamientos. Los datos corresponden a los valores de absorbencia del formazán, generados por la lisis de sales de tetrazolio (contenidas en el reactivo WST-1) por la actividad enzimática de células vivas, de modo que a mayor valor de absorbencia mayor cantidad de células vivas; asimismo, a menor valor de absorbencia menor cantidad de células vivas o mayor citotoxicidad.
La absorbencia del control negativo (concentración del agente igual a cero) representa citotoxicidad nula. Los datos representan la media de seis repeticiones y la desviación estándar. Las diferencias significativas entre los tratamientos se determinaron por análisis de varianza de un sentido con Microsoft Excel®. La sucralosa (Splenda®) no fue citotóxica (F = 5.6 vs. F esperada = 7.7; p = 0.07) y stevia (Svetia®) aún menos (F = 1.65 vs. F esperada = 7.7; p = 0.08); ningún edulcorante generó toxicidad en conjunto con la metformina (Figura 1).
DISCUSIÓN
Toxicidad general
En este trabajo se encontró que la sucralosa (Splenda®) no es tóxica para un sistema de células humanas (MCF-7) a la concentración probada. Dichos hallazgos concuerdan con lo descrito en la literatura especializada en otros sistemas biológicos.4,7 La sucralosa se produce por cloración de la sacarosa dando lugar a un compuesto estable de baja absorción en el tubo digestivo de los mamíferos.4,8 En algunos estudios en ratas se ha observado que la sucralosa se elimina en menos de 1% en forma de aductos de glucuronidación.9 Además, la sucralosa y sus aductos de glucurónido se eliminan sin rastro de bioacumulación en tejidos. Otros estudios en ratones también han mostrado que la sucralosa no causa toxicidad aguda a dosis más altas (10 g/kg peso corporal).9 Incluso, cabe mencionar que un buen número de estudios sobre la toxicidad a largo plazo en mamíferos indican que la sucralosa no tiene un modo específico de acción tóxica y, por lo tanto, no debería causar efectos adversos en la mayoría de los sistemas fisiológicos.10,11
Por otro lado, se ha sugerido que una disminución en la microflora gastrointestinal y un incremento en la expresión del citocromo P450 y de la glucoproteína-P12 pudieran ser consecuencias de la exposición a la sucralosa; sin embargo, el diseño del estudio y la interpretación de dichos resultados han sido cuestionados por expertos en el tema y, por tanto, no son concluyentes.
Toxicidad en el sistema endocrino
Cabe señalar que no se han realizado suficientes estudios para determinar la completa inocuidad de la sucralosa en seres humanos. Sin embargo, estudios en primates indican que las alteraciones en la regulación de la glucemia, a pesar de que la sucralosa no se metaboliza ni genera calorías, posiblemente se deban a la secreción de insulina y al aumento de glucosa en sangre, aunado a la posible estimulación sensorial de quimiorreceptores por el intenso sabor dulce que posee la sucralosa.13,14
De acuerdo con lo anterior, dado que la sucralosa no fue tóxica en células MCF-7 en cultivo, ni por sí sola ni con metformina, y dado que este edulcorante no provoca inestabilidad fisicoquímica de la metformina es posible emplearla para formulaciones extemporáneas de dicho fármaco antidiabético con la seguridad de que no va a interferir con su acción terapéutica. Sin embargo, esto no implica que el consumo prologado de sucralosa (Splenda®) sea inocuo y no cause alteraciones endocrinas en el organismo. Hacen falta más estudios clínicos al respecto; sobre todo si se va a emplear la formulación durante varios años. Por lo tanto, en la tecnología de elaboración de una formulación extemporánea de metformina, o cualquier otro fármaco antidiabético de uso pediátrico, es recomendable reducir al mínimo la cantidad de sucralosa para endulzar; además, se debe tener en mente que una formulación extemporánea idónea para administración por vía oral no debería contener nada más que el fármaco disuelto en agua.1 La recomendación podría extenderse a restringir al mínimo el consumo de alimentos y bebidas que contengan sucralosa en tanto no haya resultados concluyentes de que es inocua para el organismo.
Sucralosa versus stevia (extracto de Stevia rebaudiana)
La sucralosa no fue citotóxica (F = 5.6 vs. F esperada = 7.7; p = 0.07) y stevia lo fue aún menos (F = 1.65 vs. F esperada = 7.7; p = 0.08); ninguno de los edulcorantes provocó toxicidad ni solo ni en presencia de la metformina. Svetia® es de origen natural y su costo es menor que el de Splenda®, por lo que también puede emplearse para elaborar fórmulas extemporáneas pediátricas de metformina.
CONCLUSIONES
En las células de mamífero en cultivo el edulcorante sucralosa (Splenda®) no fue citotóxico y el stevia (Svetia®) lo fue aún menos; por lo tanto, ambos pueden utilizarse para endulzar fórmulas extemporáneas. Sin embargo, se sugiere emplear la mínima cantidad para ocasionar la menor perturbación fisiológica.
Agradecimientos
Las células MCF-7 fueron amablemente donadas por la Dra. Claudia H. González de la Rosa, de la UAM-Cuajimalpa, México.
REFERENCIAS
1. Juárez-Olguín H. Uso de fórmulas magistrales en Pediatría. Acta Pediat Mex. 2011;32(3):175-176. [ Links ]
2. Alemón-Medina R, Coria-Jiménez R, Chávez-Pacheco JL, Ramírez-Mendiola B, Rivera-Espinosa L, et al. Physicochemical and microbiological stabilities of a sweetened and caloriefree metformin extemporaneous formulation for pediatrics. Latin American Journal of Pharmacy 2012;31(9):1253-60. [ Links ]
3. Alemón-Medina R, Chávez-Pacheco JL, Ramírez-Mendiola B, Rivera-Espinosa L, García-Álvarez R. Estabilidad fisicoquímica de tres marcas genéricas de metformina en solución. Acta Pediat Mex 2014;35:104-110. [ Links ]
4. Tollefsen KE, Nizzetto L, Huggett DB. Presence, fate and effects of the intense sweetener sucralose in the aquatic environment. Science of the Total Environment 2012;438:510-516. [ Links ]
5. Schiffman SS, Rother KI. Sucralose, a synthetic organochlorine sweetener: overview of biological issues. Journal of Toxicology and Evironmental Health, Part B. 2013;16:399-451. [ Links ]
6. Morlock GE, Meyera S, Zimmermann BF, Roussel JM. High-performance thin-layer chromatography analysis of steviol glycosides in Stevia formulations and sugar-free food products, and benchmarking with (ultra) high-performance liquid chromatography. Journal of Chromatography A. 2014; doi.org/10.1016/j.chroma.2014.05.016. [ Links ]
7. Grotz VL, Munro IC. An overview of the safety of sucralose. Regul Toxicol Pharmacol 2009;55(1):1-5. doi: 10.1016/j.yrtph.2009.05.011. [ Links ]
8. AlDeeb OA, Mahgoub H, Foda NH. Sucralose. Profiles Drug Subst Excip Relat Methodol 2013;38:423-62. doi: 10.1016/B978-0-12-407691-4.00010-1. [ Links ]
9. Mace OJ, Affleck J, Patel N, Kellett GL. Sweet taste receptors in rat small intestine stimulate glucose absorption through apical GLUT2. J Physiol 200;582(Pt 1):379-92. [ Links ]
10. Ma J, Bellon M, Wishart JM, Young R, Blackshaw LA, Jones KL, Horowitz M, Rayner CK. Effect of the artificialsweetener, sucralose, on gastricemptying and incretinhormonerelease in healthysubjects.Am J Physiol Gastrointest Liver Physiol. 2009;296(4):G735-9. doi: 10.1152/ajpgi.90708.2008. Epub 2009 Feb 12. [ Links ]
11. Goldsmith LA.Acute and subchronictoxicity of sucralose. Food Chem Toxicol 2000;38(Suppl 2):S53-69. [ Links ]
12. Schiffman SS, Rother KI. Sucralose, a synthetic organochlorine sweetener: overview of biological issues. J Toxicol Environ Health B Crit Rev. 2013;16(7):399-451. doi: 10.1080/10937404.2013.842523. [ Links ]
13. Brown RJ, Walter M, Rother KI. Ingestion of dietsoda before a glucose load augments glucagon-likepeptide-1 secretion. Diabetes Care. 2009;32(12):2184-6. doi: 10.2337/dc09-1185. [ Links ]
14. Li F. Taste perception: from the tongue to the testis. Mol Hum Reprod 2013;19(6):349-60. doi: 10.1093/molehr/gat009. [ Links ]
Este artículo debe citarse como
Sámano-Salazar C, Alemón-Medina R, Chávez-Pacheco JL, Dávila-Borja VM. Citotoxicidad de los edulcorantes Splenda® y Svetia® en formulaciones extemporáneas pediátricas. Acta Pediatr Mex 2015;36:3-8.














