Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta pediátrica de México
versión On-line ISSN 2395-8235versión impresa ISSN 0186-2391
Acta pediatr. Méx vol.35 no.6 México nov./dic. 2014
Artículo original
Estabilidad fisicoquímica y microbiológica de captopril en formulación extemporánea
Physicochemical and microbiological stabilities of a captopril extemporaneous formulation
Raquel García-Álvarez1, Blanca Ramírez-Mendiola1, Rafael Coria-Jiménez2, Maribel Ortiz-Herrera2, Juan Luis Chávez-Pacheco1, Radamés Alemón-Medina1
1 Laboratorio de Farmacología,
2 Laboratorio de Bacteriología Experimental. Instituto Nacional de Pediatría, México, D.F.
Correspondencia:
QFB. Raquel García Álvarez
Laboratorio de Farmacología
Instituto Nacional de Pediatría
Insurgentes Sur 3700, Letra C
CP. 04530, México, Distrito Federal
Tel/Fax: 52 55 10 84 09 00 ext. 1428
Recibido: 25 de agosto 2014.
Aceptado: 13 de octubre 2014.
RESUMEN
Debido al número de pacientes pediátricos que necesitan tratamiento para la hipertensión arterial y a lo grave de sus secuelas, existe la necesidad de preparar una formulación extemporánea oral adecuada de captopril para su administración en población infantil.
Objetivo: desarrollar una formulación líquida de captopril, a partir del medicamento innovador y de marcas genéricas, que tenga contenido uniforme, que sea más barata y fácil de preparar y que tenga sabor agradable.
Material y métodos: se elaboraron formulaciones extemporáneas orales de captopril de marcas genéricas, en concentraciones de 1 y 5 mg/mL, con sabor y olor agradables. Se determinó su estabilidad fisicoquímica y uniformidad de contenido mediante cromatografía líquida de alto rendimiento en un equipo Waters®. El crecimiento microbiano se evaluó por unidades formadoras de colonias en medios MacConkey, AST y Sabouraud, a 72 y 96 horas de incubación a 37°C. Se determinaron estabilidad fisicoquímica y microbiológica de las diferentes formulaciones extemporáneas los días 1, 7, 14, 21 y 30. Se realizaron comparaciones de medianas por ANOVA en Microsoft Excel®.
Resultados: el captopril de dos marcas genéricas y un fármaco innovador, en las formulaciones con 1 mg/mL y 5 mg/mL, fue fisicoquímicamente estable por 30 y 21 días, respectivamente. No hubo crecimiento de bacterias u hongos patógenos comunes cuando se almacenaron a 4°C durante 30 días.
Conclusión: se pueden preparar formulaciones extemporáneas de captopril con el fármaco innovador y con algunas marcas genéricas, las cuales mantienen sus características fisicoquímicas y son microbiológicamente estables cuando se almacenan a 4°C.
Palabras clave: captopril, fármaco innovador, fármaco genérico, formulación extemporánea, hipertensión arterial, cromatografía (líquida de alto rendimiento).
ABSTRACT
Due to the large number of paediatric patients requiring treatment for hypertension (HT), to the seriousness of its consequences there is a need to prepare an extemporaneous oral captopril formulation suitable for administration to children.
Objective. To develop a liquid formulation of captopril from innovative and generic drugs with a uniform content, cheapier and easier to prepare and with good palatability.
Material and method. We have developed oral extemporaneous formulations of captopril stemming from generic brands, at concentrations of 1 and 5 mg/mL, with pleasant taste and odour. Its physicochemical stability and uniformity of content were determined by HPLC on a Waters™ analyser. Data were analysed with the Millennium software, version 32.0. Microbial growth was represented by colony forming units (CFU) in MacConkey, TSA and Sabouraud media, after 72 and 96 hours of incubation at 37°C. Physicochemical and microbiological stabilities of different extemporaneous formulations on days 1, 7, 14, 21 and 30 were determined. Comparative statistics were made by ANOVA test run in Microsoft Excel™.
Results. Two generic captopril brands and innovative in formulations containing 1mg/mL and 5mg/mL were physicochemical stable at 30 and 21 days respectively, and no growth of bacteria or fungi common pathogens occurred when stored at 4°C for 30 days.
Conclusion. Extemporaneous formulations can be prepared with captopril innovative drug and some generic brands, which maintain their physical and chemical characteristics and are microbiologically stable when stored at 4°C.
Keywords: Captopril, Innovative Drug, Generic Drug, Extemporaneous Formulation, Arterial Hypertension, Physicochemical Stability, Chromatography, High Performance Liquid, HPLC.
INTRODUCCIÓN
Durante los últimos diez años, además de realizar investigación en medicamentos pediátricos, el Laboratorio de Farmacología ha apoyado a diferentes servicios del hospital mediante la elaboración de fórmulas extemporáneas de administración oral con ajuste de dosis para niños y adolescentes.1,2
Uno de estos fármacos utilizados es el captopril, cuyo efecto antihipertensivo reside en inhibir a la enzima convertidora de la angiotensina I (ECA), tanto tisular como circulante, así como la liberación presináptica de norepinefrina y la actividad de los receptores adrenérgicos postsinápticos; disminuye la sensibilidad vascular a la actividad vasopresora con la consecuente dilatación de las arteriolas y la reducción de la resistencia vascular sistémica, la tensión arterial y la retención de agua y sodio.3-7 De esa manera mantiene disminuida la tensión arterial sistémica.
En nuestro grupo de trabajo se han preparado cápsulas con captopril de patente, con dosis individualizadas y uniformes en contenido, como apoyo al médico tratante. No obstante, debido al aumento reciente del número de pacientes pediátricos que necesitan tratamiento para hipertensión arterial8 ha surgido la inquietud de elaborar formulaciones extemporáneas de captopril a mayor escala. Es por ello que se ha preferido desarrollar una formulación líquida. La solución se prepara utilizando captopril disuelto en agua potable edulcorada y con sabor; esto último para aumentar el apego al tratamiento.
El objetivo de este trabajo es desarrollar una formulación líquida de captopril, a partir del medicamento innovador y de marcas genéricas, que tenga contenido uniforme, que sea más barata y fácil de preparar y que tenga sabor agradable. Asimismo, comprobar que el fármaco es estable fisicoquímicamente en dicha formulación, almacenado hasta por 30 días en distintas condiciones ambientales y que también sea estable microbiológicamente; es decir, que no se desarrollen los microorganismos más comunes.
Cabe mencionar que el presente trabajo es un estudio preclínico: la formulación extemporánea no será administrada a pacientes hasta que se realicen pruebas farmacocinéticas en voluntarios adultos sanos en una etapa ulterior.
MATERIAL Y MÉTODOS
Elaboración de las formulaciones extemporáneas
Las formulaciones extemporáneas de captopril se elaboraron a partir de tabletas de 25 mg del fármaco innovador Capotena® y dos marcas de genéricos comerciales: Medimart® y Genplus®. Dado que el captopril disuelto en agua tiene sabor amargo y desagradable se utilizaron dos compuestos para disimular dicho sabor: jarabe natural "La Madrileña" como edulcorante y saborizante artificial marca Deiman®, que se pueden comprar en tiendas comerciales de repostería y materias primas.
Se prepararon concentraciones a 5, 10, 20, 30 y 40% del jarabe con agua embotellada Bonafont®. En cuánto se encontró la concentración adecuada del jarabe con respecto al saborizante se probaron los sabores de naranja y grosella en concentraciones 0.1, 0.2 y 0.3% cada una. A 25 mL de agua endulzada con el jarabe y con el saborizante en las concentraciones adecuadas se le adicionaron el número de tabletas de las tres marcas comerciales del medicamento y se agitó hasta disolver las tabletas y obtener dos concentraciones utilizables en la práctica clínica: 1 y 5 mg/mL. Las mezclas se almacenaron en frascos ámbar de vidrio y se mantuvieron a 4°C, a temperatura ambiente (25oC) y a 40°C; cada una de ellas por triplicado.
Ensayo de palatabilidad
Se realizó una evaluación sensorial, de acuerdo con protocolos rutinarios,9 con diez voluntarios adultos sanos utilizando la prueba de ordenamiento, un método de respuesta subjetiva en la que se evalúa la preferencia de un producto. A los adultos voluntarios se les explicó el objetivo de preparar la formulación extemporánea de captopril, también se les preguntó si tenían interés, deseos de cooperar y disponibilidad de tiempo para seleccionar una solución extemporánea con la concentración adecuada de jarabe natural "La Madrileña" y la selección del saborizante, con la finalidad de ser aceptada por la población infantil.
Se prepararon soluciones extemporáneas de captopril (5 mg/mL ) marca Genplus, dado que esta marca disuelta en agua es la que presenta olor y sabor más desagradables que las otras dos marcas, a las cuales se les adicionó jarabe "La Madrileña" a 5, 10, 20, 30 y 40%. Para codificar las muestras se utilizaron letras en vez de números, ya que cada uno de los voluntarios decidió un orden numérico para informar su orden de preferencia; y se entregaron las muestras a cada uno de los voluntarios en orden alfabético.
A cada voluntario se le dio a probar un volumen de 0.2 mL de cada una de las soluciones aproximadamente una hora después del desayuno; y entre muestra y muestra se les dieron 100 mL de agua para neutralizar el sabor de la solución anterior; obteniéndose por orden de preferencia la concentración adecuada del jarabe.
Una vez definida la concentración adecuada de jarabe "La Madrileña" en la solución con 5 mg/ mL de captopril se procedió a probar los sabores de naranja y grosella en concentraciones de 0.1, 0.2 y 0.3. A los voluntarios se les administraron 0.2 mL de cada una de las soluciones aproximadamente una hora después de desayuno, y entre muestra y muestra se les dieron 100 mL de agua para neutralizar el sabor de la solución anterior. Se obtuvo así, por orden de preferencia, la concentración adecuada y el saborizante que enmascara mejor el sabor desagradable del captopril.
A partir del resultado de la prueba de ordenamiento se prepararon las formulaciones extemporáneas utilizando 25 mL de agua endulzada con el jarabe y saborizante en las concentraciones adecuadas, se le adicionaron el número de tabletas de las tres marcas comerciales del medicamento para obtener dos concentraciones utilizables en la práctica clínica de 1 y 5 mg/mL; se almacenaron en frascos ámbar de vidrio y se mantuvieron a 4°C, temperatura ambiente (25oC) y 40°C; cada una de ellas por triplicado.
Uniformidad de contenido
El método de uniformidad de contenido se basa en la determinación cuantitativa del contenido individual del principio activo en un cierto número de unidades de formas farmacéuticas, para determinar si la variación de los contenidos expresada en términos de desviación estándar relativa está dentro de los límites establecidos.
La Farmacopea de los Estados Unidos Mexicanos (FEUM)10 estipula que los requisitos para la uniformidad de dosis se cumplen si la cantidad de principio activo en cada una de las unidades de dosis, analizada por el método de uniformidad de contenido, se encuentran dentro del intervalo de 85% a 115% y la desviación estándar relativa no es mayor de 6%.
Esta prueba se llevó a cabo de acuerdo con el método analítico MGA 0299 descrito en la FEUM, basado en métodos internacionales. A partir de tabletas de 25 mg de captopril (para cada medicamento en estudio), se prepararon 100 mL de la formulación extemporánea de captopril de 1 y 5 mg/mL cada una, conteniendo la concentración adecuada de jarabe natural "La Madrileña" con agua embotellada y la adición de saborizante.
Para la cuantificación de los 100 mL de cada una de las soluciones extemporáneas se tomaron muestras de 1 mL de la solución, se centrifugaron a 5 000 rpm durante 10 minutos. Se separó el sobrenadante de la solución de captopril y se realizaron las diluciones necesarias con fase móvil para que se pudieran cuantificar con la curva patrón. De cada dilución se inyectaron 100 liL al sistema cromatográfico.
Reactivos
Metanol (Sigma, USA) grado cromatografía líquida de alto rendimiento y ácido o-fosfórico (H3PO4) de grado reactivo.
Captopril (grado USP) como estándar primario para la cromatografía líquida de alto rendimiento y captopril grado farmacéutico obtenido de farmacias locales mediante adquisición del medicamento innovador (Capotena®, Bristol Myers Squibb) y de dos marcas de genéricos: Medimart® y Genplus® (tabletas de 25 mg). Para la solución se empleó agua para beber embotellada de marca comercial (Bonafont®, Danone®). Como edulcorante se utilizó jarabe natural "La Madrileña", un saborizante artificial líquido sabor grosella marca Deiman® y ácido ascórbico (100 mg) en tabletas masticables (Cevalin®, Bayer®).
Equipo
El método de cromatografía líquida de alto rendimiento se llevó a cabo en un sistema cromatográfico conteniendo una bomba modelo 510, inyector modelo 717 y un detector de longitud de onda UV/Vis modelo 2487. Se utilizó una columna μBondapack® C18 (5 μm, 150 × 3.9 mm de diámetro) marca Waters. Los datos se analizaron con el software Millenium versión 32.0. Todo el equipo es Waters (Milford, MA, USA). El método fue previamente validado con los lineamientos nacionales vigentes.11 Se utilizó un potenciómetro UltraBasic, Denver Instrument.
Condiciones cromatográficas
La fase móvil está compuesta por metanol y agua (60:40) ajustado a pH 3.0 con ácido ortofosfórico, la cual se preparó diariamente para cada corrida, se filtró y se eliminó el gas. Todas las muestras se inyectaron en el equipo de cromatografía líquida de alto rendimiento con detector de longitud de onda UV (Waters®) en un volumen de 100 μL, eluidas a velocidad de flujo de 0.5 mL/min en una columna μBondapak® C18 150 × 3.9 mm y la detección se realizó a 210 nm.
Curva patrón y puntos control en solución de captopril
Se elaboró una solución inicial a 1 mg/mL del estándar de captopril disuelto en metanol. Se hicieron diluciones subsecuentes con fase móvil para obtener seis puntos de la curva patrón: 5, 10, 20, 30, 40 y 50 μg/mL, así como las soluciones de los puntos controles de calidad: 7.5, 25 y 45 μg/mL. De cada solución correspondiente a los puntos de la curva o controles, se inyectaron 100 μL al sistema cromatográfico.
Estabilidad fisicoquímica
Los frascos con las formulaciones por triplicado se almacenaron a tres temperaturas distintas: 25 ± 2oC, 4oC y 40oC durante 30 días a partir de su elaboración.
La estabilidad fisicoquímica se evaluó determinando la concentración del fármaco por cromatografía líquida de alto rendimiento a los días 1, 3, 7, 15, 21 y 30 de almacenamiento.
Para la cuantificación se tomó 1 mL de cada una de las soluciones que se centrifugaron a 5 000 rpm durante 10 minutos. Se separaron las soluciones de captopril y se realizaron las diluciones necesarias con fase móvil para poder cuantificarlas con la curva patrón. De cada dilución se inyectaron 100 μL al sistema cromatográfico.
El pH de las formulaciones extemporáneas se midió en cada uno de los días que se realizó la estabilidad fisicoquímica, en cada una de las concentraciones y condiciones de almacenamiento con un potenciómetro UltraBasic, Denver Instrument.
Se realizó prueba de ANOVA en Microsoft Excel® comparando la concentración del fármaco innovador con las dos marcas genéricas por cada día de evaluación.
Estabilidad microbiológica
Una alícuota de las soluciones obtenidas después de los pasos de centrifugación y separación (para cada marca y condición de almacenamiento), fue analizada por duplicado para cuantificar el crecimiento de bacterias mesófilas aerobias, enterobacterias y levaduras en las formulaciones de trabajo almacenadas, de acuerdo a los procedimientos recomendados por la Sociedad Americana de Microbiología.
A partir de la formulación extemporánea de captopril se tomaron muestras de 20 μL y se sembraron en una dilución 1:10, por duplicado en placas de Petri con agar-soya-tripticaseína (AST), así como con agar MacConkey y Sabouraud. Las placas se incubaron a 37oC por un período de 72 y 96 horas; en aquellas en las que hubo crecimiento de colonias de microorganismos mesófilos, enterobacterias y levaduras se contaron y se determinó el número de unidades formadoras de colonias por mL (UFC/mL).
RESULTADOS
Elaboración de la solución extemporánea
En la prueba de palatabilidad la función del voluntario consistió en ordenar las muestras, en orden ascendente de preferencia con respecto al sabor y olor de la formulación. De acuerdo con la preferencia de por lo menos 60% de los voluntarios, se decidió emplear la concentración adecuada del jarabe y del saborizante para disimular el sabor desagradable.
Se realizaron pruebas preliminares de estabilidad fisicoquímica, las cuales demostraron que las formulaciones extemporáneas preparadas sin ácido ascórbico tuvieron una estabilidad no mayor a catorce días almacenadas a 4°C, mientras que a temperatura ambiente y a 40°C mostraron estabilidad fisicoquímica por no más de tres días (datos no presentados).
La adición de ácido ascórbico a 0.4% (Cevalin®, Bayer®) incrementó considerablemente el número de días en los cuales el contenido del fármaco, independientemente de la marca, permanece inalterado bajo las condiciones de almacenamiento empleadas, llegando alcanzar de veintiuno a treinta días de estabilidad, dependiendo de la concentración de captopril.
Con la adición del ácido ascórbico a la formulación extemporánea los tiempos de retención del ácido ascórbico y del captopril son de 4.9 y 6.1 minutos, respectivamente (Figura 1).

Finalmente, se obtuvo que la adición de jarabe "La Madrileña" a 30% (v/v) y de saborizante artificial líquido sabor grosella a 0.2% (v/v) enmascararon adecuadamente el sabor y el olor desagradable del captopril en solución acuosa y que la adición de ácido ascórbico a 0.4% (Cevalin®, Bayer) incrementó la estabilidad fisicoquímica.
Uniformidad de contenido
Los datos se analizaron por cromatografía líquida de alto rendimiento y un detector de longitud de onda UV con el software Millenium versión 32.0. En el Cuadro 1 se observa que todas las formulaciones extemporáneas de captopril son uniformes en contenido; todas las marcas cumplieron con los criterios de cantidad y coeficiente de variación relativa.
Estabilidad fisicoquímica de la solución extemporánea
El Cuadro 2 muestra la estabilidad fisicoquímica de las formulaciones extemporáneas de captopril de 1 mg/mL en los días 1, 3, 7, 14, 21 y 30. Las preparaciones realizadas con el fármaco innovador y el genérico Medimart® (G1) fueron estables (concentración 90-110% del valor nominal) hasta por treinta días a 4°C, por veintiún días a temperatura ambiente y sólo por tres días a 40°C. Las preparaciones del genérico Genplus (G2) fueron igualmente estables por treinta días almacenadas a temperatura ambiente y a 4°C; sin embargo, tuvo mayor estabilidad a 40°C (siete días) que las preparaciones anteriores.
El Cuadro 3 muestra la estabilidad fisicoquímica de las formulaciones extemporáneas de captopril de las tres marcas analizadas en concentración de 5 mg/mL. Todas las formulaciones analizadas fueron estables a temperatura ambiente durante treinta días; las preparaciones del fármaco innovador y del genérico G1, preservadas a 4°C, fueron estables por veintiún días mientras la del genérico G2 lo fue hasta por treinta días. A 40°C la estabilidad del captopril en las preparaciones fue variable; el fármaco innovador se conservó por tres días; el genérico G1 se mantuvo por siete días mientras que el G2 permaneció estable hasta por catorce días.
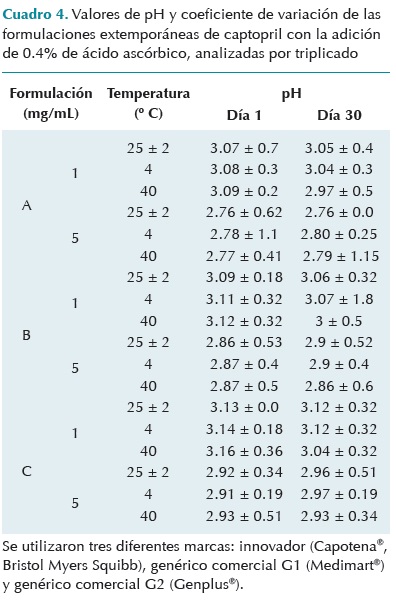
Los cambios de pH de todas las formulaciones extemporáneas preparadas y almacenadas en las diferentes condiciones de temperatura fueron mínimos, al menos durante los treinta días del estudio (Cuadro 4).
Se realizó la prueba estadística de análisis de varianza de una vía comparando las concentraciones de captopril de la marca innovador, contra las dos marcas genéricas en estudio por cada día de evaluación y no hubo ninguna diferencia estadísticamente significativa (p £ 0.018, F crítico = 18.5 y F calculado = 0.12, 3.57, 4.99).
Estabilidad microbiológica de la solución extemporánea
Los límites microbianos de los jarabes y soluciones orales, según la FEUM10 (MGA 0571), deben estar libres de microorganismos patógenos y deben contener no más de 100 UFC/mL de microorganismos mesófilos aerobios y no más de 10 UFC/mL de hongos filamentosos y levaduras.
En las formulaciones extemporáneas de las tres marcas en estudio, almacenadas a 4°C y analizadas por cuadriplicado, no hubo crecimiento en las placas de Petri con agar AST, agar MacConkey y Sabouraud durante los treinta días.
Las formulaciones extemporáneas de captopril del fármaco innovador almacenadas a temperatura ambiente y a 40°C rebasaron los límites microbianos.
En las formulaciones extemporáneas analizadas del genérico G1 a temperatura ambiente y a 40°C no se observó crecimiento en ninguno de los medios de cultivo.
En las formulaciones extemporáneas preparadas con el genérico G2 a temperatura ambiente no hubo crecimiento en ninguno de los medios de cultivo, y en una de las dos formulaciones almacenadas a 40°C se rebasaron los límites microbianos permisibles.
DISCUSIÓN
Desde hace algunos años12-18 se han elaborado soluciones extemporáneas de captopril en hospitales pediátricos en todo el mundo, utilizando el fármaco innovador (Capoten®); de ellas ya se han evaluado el tipo de componentes y aditivos que contienen, el tipo de agua que se debe utilizar para disolver el medicamento (potable, embotellada o hervida), la presencia o ausencia de agentes antioxidantes y quelantes para proteger de la oxidación e inclusive su estabilidad a diferentes condiciones de almacenamiento. De hecho, ya se ha visto que son microbiológicamente estables hasta por 30 días a 4oC, siempre y cuando se preparen con agua purificada y hervida como disolvente, sin azúcares ni endulzantes artificiales añadidos y que la presencia de ácido ascórbico, ácido cítrico y de agentes quelantes como el EDTA disódico, no modifica en lo absoluto su estabilidad.19
Sin embargo, hasta la fecha faltan estudios que comprueben la estabilidad de soluciones en las que se empleen marcas genéricas que son más económicas. Asimismo, el interés prioritario de los otros laboratorios ha sido el ajuste de dosis pediátricas, pero nadie se ha preocupado en proporcionar sabor agradable a la solución y liberarla lo más posible del mal olor y sabor que las caracteriza.
Este estudio muestra que las formulaciones extemporáneas de 1 mg/mL, de las tres marcas comerciales estudiadas, son fisicoquímicamente y microbiológicamente estables a 4°C por 30 días y que las formulaciones con 5 mg/mL son estables fisicoquímicamente por 21 días en frascos de vidrio color ámbar; así mismo, la percepción olfativa y de palatabilidad mejoró significativamente.
CONCLUSIÓN
Este estudio demuestra que es posible preparar formulaciones orales extemporáneas de captopril a partir tanto del fármaco innovador como de las presentaciones genéricas intercambiables existentes en nuestro país, con la adición de edulcorante y saborizante artificial a fin de enmascarar el sabor a mercaptano y con la adición del ácido ascórbico para incrementar la estabilidad fisicoquímica.
Estas preparaciones serán evaluadas para determinar sus parámetros farmacocinéticos en voluntarios sanos y, una vez obtenidos los valores, se iniciará un estudio clínico controlado para determinar su eficacia y seguridad en pacientes pediátricos.
REFERENCIAS
1. Juárez-Olguín H. Uso de fórmulas magistrales en pediatría. Acta Pediatr Mex 2011;32(3):175-176. [ Links ]
2. Alemón-Medina R, Chávez-Pacheco JL, Ramírez-Mendiola B, Rivera-Espinosa L, García-Álvarez R. Estabilidad fisicoquímica de tres marcas genéricas de metformina en solución. Acta Pediat Mex 2014;35:104-110. [ Links ]
3. Karimi-Maleh H, Moazampoura M, Kumar-Guptab V, Sanati AL. Electrocatalytic determination of captopril in real samples using NiO nanoparticle modified (9,10-dihydro-9,10-ethanoanthracene-11,12-dicarboximido)-4ethylbenzene-1,2-diol carbon paste electrode. Sensors and actuators B. Chemical 2014;199:47-53. [ Links ]
4. Heel RC, Brogden RN, Sperght TM, Avery GS. Captopril: a preliminary review of its pharmacological properties and therapeutic efficacy. Drugs 1980;20(6):409-52. [ Links ]
5. Brogden RN, Todd PA, Serkin EM. Captpril: An update of its pharmacodynamics and pharmacokinetic properties, and therapeutic use in hypertension and congestive heart failure. Drugs 1988;36(5):540-600. [ Links ]
6. Ohman KP, Kariberg BE, Nilsson OR, Wettre S. Captopril in primary hypertension. Effects related to the renin angiotensin aldosterone and kalikrein kinin systems. Acta Med Scand Suppl 1981;646:98-105. [ Links ]
7. Rabinad EE, Ingelmo MM, Martínez AA, Alsina J, Balcells GA. Captopril in esencial hypertension. Br J Pharmacol 1982;14(Suppl 2):103S-105S. [ Links ]
8. Pabari RM, McDermott C, Barlow J, Ramtoola Z. Stability of an alternative extemporaneous captopril fast-dispersing tablet formulation versus an extemporaneous oral liquid formulation. Clinical Therapeutics 2012;34(11):2221-2229. [ Links ]
9. Witting de Penna E. Evaluación Sensorial. Una metodología actual para tecnología de alimentos. Biblioteca Digital de la Universidad de Chile. Sistema de Servicios de información y Bibliotecas. 2001. http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/wittinge01/index.html [ Links ]
10. Farmacopea de los Estados Unidos Mexicanos. 8a Edición. México. 1994. [ Links ]
11. Norma Oficial Mexicana NOM 177- SSA1-2013. Diario Oficial de la Federación 2013. [ Links ]
12. Glass BD, Haywood A. Stability considerations in liquid dosage forms extemporaneously prepared from commercially available products. J Pharm Sci 2006;9(3):98-426.2 [ Links ]
13. Pereira CM, Tam YK. Stability of captopril in in tap water. Am J Hosp Pharm 1992;49:612-5. [ Links ]
14. Pramar Y, Das Gupta V, Bethea C. Stability of captopril in some aqueous systems. J Clin Pharm Ther 1992;17:185-9. [ Links ]
15. Nahata MC, Morosco RS, Hipple TF. Stability of captopril in three liquid dosage forms. Am J Hosp Pharm 1994;51(13):1707-8. [ Links ]
16. Allen LV Jr, Erickson MA. Stability of baclofen, captopril, diltiazeam hydrochloride, dipyridamole, and fleicainide acetate in extemporaneously compounded oral liquids. Am J Health-Syst Pharm 1996;53:2179-84. [ Links ]
17. Lye MY, Yow KL, Lim LY, Chan SY, Chan E, Ho PC. Effects of ingredients on stability of captopril in extemporaneously prepared oral liquids. Am J Health-Syst Pharm 1997;1;54(21):2483-7. [ Links ]
18. Brustugun J, Lao YE, Fagernaes C, Braenden J, Kristensen S. Long-term stability of extemporaneously prepared captopril oral liquids in glass bottles. Am J Health-Syst Pharm 2009;66:1722-1725. [ Links ]
19. Escribano García MJ, Torrado Durán S, Torrado Durán JJ. Estudio de estabilidad de soluciones acuosas de captopril en concentraciones de 1 mg/ml. Farm Hosp 2005;291:30-36. [ Links ]
Nota
Este artículo debe citarse como
García-Álvarez R, Ramírez-Mendiola B, Coria-Jiménez R, Ortiz-Herrera M, Chávez-Pacheco JL, Alemón-Medina R. Estabilidad fisicoquímica y microbiológica de captopril en formulación extemporánea. Acta Pediat Mex 2014;35:459-468.














