Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta pediátrica de México
versão On-line ISSN 2395-8235versão impressa ISSN 0186-2391
Acta pediatr. Méx vol.35 no.5 México Set./Out. 2014
Artículo original
Rotavirus en la Unidad de Cuidados Intermedios Neonatales
Rotavirus infection in Neonatal Intermediate Care Unit
Hilda G. Hernández-Orozco1, Guadalupe L. Aparicio-Santiago1, Esperanza Lucas-Reséndiz1, José Luis Castañeda-Narváez1, Carlos López-Candiani2, Virginia Díaz-Jiménez3, Aurora Rosas-Ruiz3, Ma. del Carmen Sandoval-Medina3, Patricia Arzate-Barbosa3, Wendy Domínguez-Viveros3, Patrik Eliana Sarmiento-Wilches3
1 Comité de Infecciones.
2 Jefe de Servicio de Neonatología.
3 Grupo del Comité de Infecciones. Instituto Nacional de Pediatría.
Correspondencia:
Dra. Hilda G. Hernández Orozco
Instituto Nacional de Pediatría.
Av. Insurgentes 3700C,
Col. Insurgentes Cuicuilco, México, D.F.
Tel.: 1084 0900 ext. 1511
Recibido:15 de agosto 2013
Aceptado: 2 de mayo 2014
RESUMEN
La enfermedad diarreica aguda por rotavirus es una de las principales causas de morbilidad en niños menores de 2 años; sin embargo, no es frecuente la publicación de brotes intrahospitalarios en unidades de cuidados intensivos.
Objetivo: describir un brote documentado epidemiológicamente: la trasmisión del virus entre neonatos y las medidas de control que se tomaron.
Materiales y métodos: reporte minucioso de un brote de gastroenteritis por rotavirus en una unidad de cuidados intermedios neonatales.
Resultados: se identificaron tres casos de gastroenteritis por rotavirus confirmados por detección directa de antígeno; no se identificó la fuente.
Conclusión: detectar e instituir rápidamente medidas de control en un brote permite limitar la aparición de nuevos casos y la propagación, así como la búsqueda de la fuente.
Palabras clave: brote, rotavirus, neonatos, Unidad de Cuidados Intermedios, UCIN.
ABSTRACT
Rotavirus acute gastroenteritis, continues to be one of the most common cause of morbidity in children younger than 2 years of age. However, it is not often to report outbreaks in neonatal intensive care units. The aim of this paper was to describe the epidemiological investigation of a Rotavirus outbreak, the viral transmission between infants and the control measures taken.
Materials and Methods: An outbrake study was performed in a neonatal intermediate care unit due to the presence of Rotavirus gastroenteritis cases.
Results: We identified 3 rotavirus gastroenteritis cases confirmed by direct antigen detection, the source could not be identified.
Discussion: We considered a transmission mechanism of propagated source because infected people excreted large number of viral particles and cause widespread environmental contamination.
Conclusion: Quickly case identification and implemented implementation of control measures prevent new cases and limits the spread of the outbreak.
Key words: Outbreak, Rotavirus, Infants, Intermediate Care Unit, NICU.
INTRODUCCIÓN
Se estima que la gastroenteritis viral por rotavirus es la causa de 527 000 muertes de niños al año a escala mundial.1 Se conoce que cada año causa 114 millones de episodios de gastroenteritis, 24 millones de consultas y 2.4 millones de hospitalizaciones en menores de 5 años. En Colombia, De la Hoz y sus colaboradores estimaron que anualmente se producen alrededor de 1.5 millones de episodios de diarrea por todas las causas; entre 60 000 y 90 000 hospitalizaciones y que el rotavirus podría causar hasta 40 000 hospitalizaciones y 100 000 consultas por diarrea en niños menores de 2 años.2 En México, en 2013, se reportaron 4 646 casos de gastroenteritis por rotavirus.3 Un estudio de cohorte realizado también en México encontró que la infección natural por rotavirus confiere protección, sobre todo contra infecciones severas; sin embargo, un estudio realizado en la India, que siguió a una cohorte de recién nacidos, no encontró que la infección por rotavirus confiriera protección.4,5
Los factores de riesgo para la transmisión intrahospitalaria de los virus que causan gastroenteritis han sido difíciles de determinar; esto se debe, en parte, a la amplia diseminación de partículas virales en heces (y la contaminación que esto ocasiona) así como a la baja dosis infecciosa necesaria para ocasionar brotes. El rotavirus permanece activo en las manos durante 4 horas; en superficies duras por 10 días y en húmedas por semanas. Después del inicio de los síntomas hay altos títulos de virus en heces durante 10 días.6 En los recién nacidos hay alta prevalencia de infecciones subclínicas debido a la trasferencia de anticuerpos de la madre durante las últimas semanas del embarazo o la lactancia. Así mismo, se reporta que la trasmisión del virus puede ser a través de manos o juguetes contaminados.6
Una revisión de la literatura, que se llevó a cabo para determinar los brotes intrahospitalarios de gastroenteritis de etiología viral en neonatos, mostró que de 590 brotes 11% fue de etiología viral y 69% ocurrió en Unidades de Cuidados Intensivos Neonatales, documentando como principales agentes al rotavirus (23.4%), al virus respiratorio sincitial (17.2%), al enterovirus (15.6%), al virus de la hepatitis A (11%) y al adenovirus (9.4%).7
En un estudio que reporta la seroprevalencia de rotavirus en gastroenteritis aguda predominó el genotipo 3 (G3) en 38.7%, seguido por G4 (25.8%), G1 (16.1%) y G9 (6.5%).8 Otro estudio informó que actualmente en 90% del total de aislamientos se reconocen los genotipos G1P, G2P, G3P y G4P; mientras que los genotipos como el G9, y en menor medida G5, G8, G6 y otras combinaciones, se consideran emergentes.9
En una unidad de cuidados intermedios neonatales se reportó un brote que se identificó después de la muerte de un bebé prematuro con diagnóstico de enterocolitis necrosante asociada con rotavirus; en los 4 meses posteriores se identificaron seis casos más y ocho casos de gastroenteritis hemorrágica. La infección por rotavirus se documentó en 11 de 15 lactantes sintomáticos, con sólo ocho infecciones por rotavirus en 147 bebés asintomáticos o con síntomas mínimos (p < 0.0001). En este brote se buscó rotavirus en heces entre el personal de salud y 110 enfermeras fueron negativas; sin embargo, 12 miembros del personal tenían anticuerpos IgM contra rotavirus, lo que sugirió una infección reciente.10 Los factores de riesgo identificados, asociados con la enfermedad gastrointestinal severa, fueron: peso al nacer (p < 0.001), infección por rotavirus (p < 0.0001) y edad al momento del inicio del cuadro clínico (p < 0.02).9,10
En este reporte presentamos la investigación epidemiológica de un brote por rotavirus en la unidad de cuidados intermedios de neonatología de un hospital escuela de tercer nivel.
MATERIALES Y MÉTODOS
Después de confirmar tres casos de gastroenteritis por rotavirus en la unidad de cuidados intermedios neonatales, gracias al reporte de laboratorio el día 26 de julio, se decidió realizar una investigación de brote. Dos casos iniciaron con síntomas el día 23 de julio y un tercer caso el día 25 de julio; el 26 de julio se reportaron los resultados positivos de estos casos para rotavirus. Al pensar en un probable brote se debe identificar la asociación epidemiológica considerando persona, lugar, tiempo y agente. La unidad de cuidados intermedios de neonatología tiene12 incubadoras, el manejo de cada paciente es con bata individual para cada uno, así como la indicación de efectuar higiene de manos (con agua y jabón o con soluciones alcoholadas) al entrar a la unidad, antes de atender al paciente. Se consideró como periodo de estudio del 18 de julio al 1 de agosto, con base en el periodo de incubación del agente y la premisa de considerar dos periodos de incubación previos al primer caso, y dos periodos posteriores al último caso, para considerar un estudio de brote y la terminación de éste.
Se incluyeron todos los pacientes que ingresaron en la unidad de cuidados intermedios neonatales durante el período del brote y se realizó la revisión de los expedientes clínicos documentando, en un formato de estudio, datos epidemiológicos y factores de riesgo como: peso al nacimiento, edad, antecedentes de infección por rotavirus, factores asociados con cuadros diarreicos como tipo de fórmula láctea, frecuencia de la alimentación recibida, forma de alimentación (biberón o mediante sonda nasogástrica), espacio ocupado dentro de la sala e intervenciones médicas. También se investigaron antecedentes de cuadros diarreicos en el personal médico, de enfermería y otros a cargo de la atención de los pacientes, así como entre los familiares.
Durante la investigación se reforzaron las precauciones estándar y se instalaron precauciones específicas de aislamiento por contacto a los pacientes con diarrea en la unidad de terapia intermedia; ésta es una disposición rutinaria en la institución para todo paciente que inicie cuadro enteral hasta descartar su origen infeccioso. Como medida extraordinaria se decidió movilizar a los pacientes de la unidad de terapia intensiva que presentaron cuadro diarreico a la terapia intermedia, ya que las condiciones clínicas de los pacientes en el momento del estudio lo permitían sin que implicara riesgo para ellos (cohorte de casos y contactos posibles susceptibles).
Como factor común se detectó la ingesta de fórmula para prematuro y, en uno de los casos, el cambio a fórmula de inicio, por lo que se definió como caso probable a cualquier paciente neonato que ingiriera fórmula para prematuro o fórmula de inicio y que presentara cuadro clínico con evacuaciones diarreicas, con o sin presencia de fiebre u otra sintomatología. Se definió como caso confirmado aquél que tuviera las características antes descritas y se confirmara al rotavirus como agente causal por medio de prueba, con inicio del cuadro clínico en el hospital entre el 18 de julio y el 1 de agosto del 2013. Se utilizó el Rotatest Pastorex® de laboratorio Bio-Rad, una prueba de aglutinación en látex para la detección directa del antígeno de rotavirus en heces con sensibilidad de 85.9-92.8% y especificidad de 97.7-98.9%.11,12
Se indicó toma de muestras de heces de todos los niños de la unidad de cuidados intermedios neonatales; sin embargo, no se contaba con reactivo, por lo que el plan fue almacenar y estudiar posteriormente las muestras. Por esa razón se descartó la toma de muestras en personal de salud y familiares en búsqueda de la posible fuente. Se realizó investigación de procedimientos y resultados de cultivos en banco de leches, así como de las situaciones que pudieran ser determinantes en la aparición del brote. Se analizaron los datos utilizando el programa SPSS reportando frecuencias, medidas de tendencia central de los datos epidemiológicos y factores encontrados, así como cálculo de tasas de ataque, medidas utilizadas en un estudio de brote.
RESULTADOS
Del 18 de julio al 1 de agosto del 2013 se hospitalizaron 18 neonatos en la unidad de cuidados intermedios del área. Tres casos fueron confirmados pues presentaron el cuadro clínico de gastroenteritis por rotavirus ratificado por prueba de aglutinación positiva. Durante la investigación se observó que en el período considerado se presentaron otros tres casos de diarrea aguda en la unidad de cuidados intensivos neonatales adjunta, pero se descartó rotavirus como agente causal (prueba de aglutinación negativa). De los bebés que tomaban fórmula para prematuro o de inicio en otros servicios, al igual que los casos confirmados, sólo un niño presentó evacuaciones diarreicas en el servicio de infectología sin identificarse ningún agente causal (Figura 1).
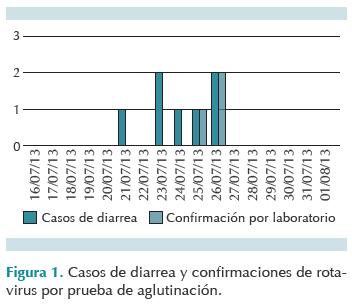
Los casos probables tenían un promedio de edad de 1 mes (rango entre 11 días y 5 meses) y una mediana de edad de 16 días; todos los casos confirmados eran menores de 1 mes y el promedio de edad fue de 18 días (rango entre 10 y 29 días); su peso promedio fue de 2 152 g, (rango: 1 780-2 866 g). Todos presentaron evacuaciones disminuidas de consistencia grumosa y color amarillo. Uno de los casos tuvo evacuaciones verdes con moco y dolor abdominal; sólo un paciente presentó febrícula (Cuadro 1).
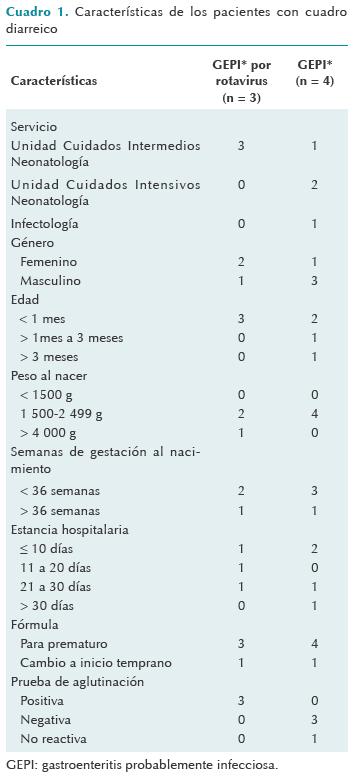
La tasa de ataque general de gastroenteritis por rotavirus en los pacientes ingresados a la unidad de cuidados intermedios neonatales fue de 16.7% (población 18 niños); 11% de género masculino y 22% del femenino. De los pacientes que presentaron cuadro diarreico la tasa de ataque de gastroenteritis por rotavirus fue de 43% (7 pacientes). La tasa de ataque para riesgo medio por peso menor a 2 500 g fue de 33%; en pacientes de menos de 36 semanas de gestación fue de 40%. Los casos diagnosticados tenían una estancia hospitalaria promedio de 14 días (rango: 5 a 27 días).
Los cultivos de control de rutina del banco de leches fueron negativos, en este servicio se realizaron 15 días antes cambios de filtros del abastecimiento de agua para la preparación de leche; después de esto se realizaron cultivos con resultados negativos. Las muestras de fórmulas enviadas con resultados negativos fueron de fórmula para prematuro y de fórmula de inicio al 13%, lo que aseguró su adecuado proceso. Dentro de los hallazgos de la investigación se encontró déficit de personal de enfermería para el cuidado de los pacientes, estudiantes de enfermería de nuevo ingreso (prácticas clínicas) y fallas de cumplimiento en la higiene de manos por parte del personal en general.
DISCUSIÓN
La enfermedad diarreica aguda es la segunda causa de muerte en menores de 5 años y se ubica como uno de los principales problemas de salud pública en el mundo. El descubrimiento del rotavirus en los años setenta mostró que la sintomatología asociada con este agente se consideraba menos grave que la causada por Salmonella, Vibrio cholerae, Shigella o Campylobacter. Sin embargo, posteriormente se estableció el alto grado de transmisibilidad del rotavirus, así como el incremento en las tasas de mortalidad por enfermedad diarreica aguda por rotavirus.10
En un estudio se reportó que de 1 501 recién nacidos ingresados en una unidad de cuidados intermedios neonatales a lo largo de 4 años, se reportaron 94 casos de infección por rotavirus con una prevalencia de 4.9 casos por 1 000 días de hospitalización; además, se encontró que de los 223 recién nacidos referidos de otros hospitales a la unidad, se pudo confirmar rotavirus en remisión en 24 casos. Esto sugiere que la infección por rotavirus en neonatos es subestimada y que realmente su frecuencia es mayor; esto es diferente a lo descrito en la literatura especializada donde se indica que la infección es más frecuente en edades de 3 a 24 meses de edad.13
El rotavirus ha sido reportado como el principal agente causal de diarrea intrahospitalaria con rangos entre 31 y 87%; sin embargo, las infecciones asociadas con otros virus como Norovirus, astrovirus y adenovirus se han incrementado casi al igual que el rotavirus. La infección por este agente asociada con la atención a la salud se presenta entre 0 y 5 años de edad, a diferencia de la gastroenteritis que se ocurre en el grupo de edad de 6 a 23 meses.14 De acuerdo con lo reportado en la literatura acerca de la alta transmisibilidad del rotavirus2,3 la presencia de este agente, en las manos del personal de salud que atiende niños con diagnóstico de gastroenteritis causado por rotavirus, es de hasta 78% y, en el personal de salud que no tiene niños a su cuidado, de sólo 20%.14
En el brote analizado se estimó que el virus pudo haber tenido una o más fuentes, dentro de las que podemos considerar: otros niños, personal o familiares colonizados o con infección asintomática. Todos los casos se consideraron de origen hospitalario por no tener antecedentes o presentar cuadro diarreico al ingreso, diagnóstico de ingreso no infeccioso y el inicio del cuadro clínico al menos 5 días después del ingreso a la unidad; considerando que el periodo de incubación de la gastroenteritis por rotavirus es de dos a tres días.1
Se ha demostrado que los rotavirus pueden seguir viables en fómites por varias semanas y son resistentes a detergentes y desinfectantes comunes. La dosis infecciosa puede ser tan baja cómo 10 partículas.4 Se ha reportado que la eliminación de rotavirus en las heces de los pacientes con enfermedades graves o inmunodeprimidos persiste de 30 hasta 57 días.15,16 La tasa de ataque de la enfermedad clínica en los niños con diarrea se puede deber a la falta de concentraciones protectoras genotipo específico de anticuerpos maternos, tal como fue mencionado en un estudio publicado por Widdowson y sus colaboradores.4
Algunos estudios muestran que el peso bajo al nacer es un factor de riesgo para la enfermedad por rotavirus. Los bebés de peso muy bajo (< 1 500 g) tienen riesgo alto (OR 2.6; IC 95%: 1.6 a 4.1); los de bajo peso al nacer (1 500-2 499 g) riesgo intermedio (OR 1.6, IC 95%: 1.3 a 2.1) y los niños con peso > 4 000 g tienen riesgo bajo (OR 0.8, IC 95%: 0.6 a 0.9).13-17 En el brote analizado de los niños que presentaron gastroenteritis por rotavirus fueron dos de riesgo intermedio y uno de riesgo bajo de acuerdo con su peso al nacer.
Un estudio muestra, en el análisis univariado a las semanas de gestación, que la edad gestacional menor a 36 semanas es un factor de riesgo para gastroenteritis por rotavirus (OR 5.2 p = 0.003),4 en ese estudio todos los casos confirmados tenían más de 30 semanas de gestación, por lo que no se consideró a la edad gestacional como un factor de riesgo.
En una revisión de los estudios de brote por rotavirus la mayoría concluyó que la fuente del brote se relacionó con la contaminación del agua; ninguno de los estudios realizó ponderaciones a través de medidas de asociación entre los probables factores que influyeron en la presentación del brote, limitándose a mencionar hacinamiento, temporada invernal, nivel socioeconómico bajo, desnutrición, ausencia de acceso a agua de redes y falta de instalaciones para eliminación de excreciones.9
En el presente brote se consideró que la probable fuente de trasmisión era un portador asintomático (paciente, personal de salud o familiar) por los problemas detectados de escasez de personal, ingreso de nuevo personal en formación e incumplimientos de las medidas de higiene de manos; sin embargo, no se comprobó esa teoría. No se efectuó detección de rotavirus en personal y familiares por falta de insumos. Epidemiológicamente se confirmó el brote ya que se cumplían los criterios de persona, lugar y tiempo, debido a que la población pertenecía al grupo de neonatos que se encontraban en un lugar específico y común (unidad de terapia intermedia) e iniciaron con los síntomas de acuerdo con el período de incubación de la enfermedad (dos días); recordemos que dos casos iniciaron el día 23 y un tercer caso el 25 de julio y que no tuvieron antecedentes previos de gastroenteritis aguda; esto confirmó la temporalidad de presentación de casos del brote.
Para la prevención de brotes de gastroenteritis por rotavirus es indispensable continuar con la política de aplicación de la vacuna contra el rotavirus, como lo estipula la Cartilla Nacional de Vacunación, ya que esta vacuna ha sido muy eficaz contra la enfermedad. Los estudios indican que la vacuna evitará cerca de 74% de todos los casos de rotavirus, alrededor de 98% de los casos graves y 96% de las hospitalizaciones aunque no previene la diarrea o los vómitos causados por otros virus.1 Se debe asegurar la vacuna contra el rotavirus en bebés prematuros y en niños de bajo peso al nacer debido ya que parecen estar en mayor riesgo de hospitalización por gastroenteritis viral y por rotavirus.16
Los casos reportados en este estudio no tuvieron el beneficio de la vacuna porque ninguno tenía la edad correspondiente a la dosis inicial.
CONCLUSIÓN
Se debe continuar con las pruebas de aglutinación en niños con sospecha de diarrea infecciosa e investigar al personal de salud y a los familiares por ser posibles portadores de rotavirus; también es importante hacer énfasis en que la detección temprana de posibles brotes permite tener una mayor probabilidad de lograr una confirmación de la fuente, así como implementar medidas oportunas de control. Lo más importante es lograr que se lleven a cabo, completamente, todas las medidas de prevención de infecciones asociadas con la atención de la salud, principalmente la higiene de manos, que es la forma de romper la cadena de trasmisión y de evitar nuevos brotes de propagación de persona a persona.
REFERENCIAS
1. CDC. Rotavirus. Disponible en: http://www.cdc.gov/rotavirus/clinical.html.
2. Cotes K, Alvis-Guzmán N, Rico A, Porras A, Cediel N. y cols. Evaluación del impacto de la vacuna contra rotavirus en Colombia usando métodos rápidos de evaluación. Evaluación del impacto de la vacuna contra rotavirus en Colombia usando métodos rápidos de evaluación. Rev Panam Salud Pública 2013;34(4):220-6. [ Links ]
3. SSA: Subsistema de Notificación Semanal de Casos Nuevos de Enfermedades, Rotavirus. Disponible en: http://www.epidemiologia.salud.gob.mx/doctos/infoepid/inf_morbilidad/2013/12Reporte%20diciembre_2013.pdf.
4. Widdowson MA, van Doornum JJ, Wim HH, van der P, de Boer AS, van de Heide R. An Outbreak of Diarrhea in a Neonatal Medium Care Unit Caused by a Novel Strain of Rotavirus: Investigation Using Both Epidemiologic and Microbiological Methods. Infect Control and Hospital Epidemiol 2002;23(11):665-670. [ Links ]
5. Banerjee I, Primrose BG, La Fevre AM, Ramani S, Iturriza-Gomara M,Gray JJ, et al. Neonatal Infection with G10P [11] Rotavirus did Not Confer Protection against subsequent Rotavirus Infection in a Community Cohort in Vellore, South India. JID 2007:195(1):625-632. [ Links ]
6. Myers MD. Grow with us natal gastroenteritis. Rotavirus transmission and prevention. 2013;19(2):1-4. [ Links ]
7. Civardi E, Tzialla C, Baldanti F, Strocchio L, Manzoni P, Stronati M. Viral outbreaks in neonatal intensive care units: what we do not know. Am J Infect Control 2013;41(10):854-856. [ Links ]
8. Meral M, Bozdayi G, Ozkan S, Dalgcic B Alp G, Ahmed K. Rotavirus prevalence in children with acute gastroenteritis and the distribution of serotypes and electropherotypes. Mikrobiyol Bul 2011;45(1):104-12. [ Links ]
9. Reyna-Figueroa J, Sánchez-Uribe E, Esteves-Jaramillo A, Hernández-Hernández C, Richardson V. Enfermedad diarréica por rotavirus en brotes epidémicos. Rev Panam Salud Pública 2012;31(2):143-47. [ Links ]
10. Rotbart HA, Nelson WL, Glode MP, et al. Neonatal rotavirus-associated necrotizing enterocolitis: case control study and prospective surveillance during an outbreak. J Pediatr 1988;112:87-93. [ Links ]
11. Pastorex TM Rotavirus Disponible en: http://www.bio-rad.com/evportal/evolutionPortal.portal?_nfpb=true&_pageLabel=search_page&searchString=52300+pastorex+rotavirus&database=faqs%2Bliteratures%2Bmsds%2Binserts&tabName=LITERATURETYPE&searchVertical=&breadcrum=&bFlag=true&clearQR=&sfResultsPerPage=0.
12. Poomima D, Velázquez FR, Gutiérrez-Escalona AL, Luddert JE. Evaluation of the second generation of a commercial latex agglutination test for the detection of rotavirus antigens in fecal samples. Journal of Clinical Virology 2013;57(1):88-90. [ Links ]
13. Castell REP, Reyes HD, GU, Ávila CFJ, López CG. Gastroenteritis por rotavirus en el recién nacido, reporte de 12 casos adquiridos en la comunidad. Enf Infect Microbiol 2012;32(3):109-13. [ Links ]
14. Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z et al. Nosocomial Rotavirus Infection in European Countries: A Review of the Epidemiology, Severity and Economic Burden of Hospital-Acquired Rotavirus Disease. Pediatric Infect Dis J 2006;25(1):S12-S21. [ Links ]
15. SSA. Manual de procesos estandarizados para la vigilancia epidemiológica. Enteritis por rotavirus. México, 2012. Disponible en: www.epidemiologia.salud.gob.mx/...manuales/25_Manual_ROTAVIRUS_vFinal_8nov12.pdf. [ Links ]
16. CISNS. Ministerio de Sanidad, Servicios Sociales e Igualdad, España. Situación epidemiológica de la gastroenteritis por rotavirus. Recomendaciones de la vacuna frente rotavirus.2006. Disponible en: www.avpap.org/gtdocencia/rotaviruscav.pdf. [ Links ]
17. Newman RD, Grupp-Phelan J, Shay DK, Davis RL. Perinatal risk factors for infant hospitalization with viral gastroenteritis. Pediatrics 1999;103(1)1-6. [ Links ]
Nota
Hilda G. Hernández-Orozco, Guadalupe Aparicio-Santiago, Esperanza Lucas-Reséndiz, José Luis Castañeda-Narváez, Carlos López-Candiani: diseño, realización y escritura de la investigación.
Virginia Díaz-Jiménez, Aurora Rosas-Ruiz, Ma. del Carmen Sandoval-Medina, Patricia Arzate-Barbosa, Wendy Domínguez, Patrik Eliana Sarmiento-Wilches: revisión del artículo y aportaciones específicas en su campo.














