Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta pediátrica de México
versión On-line ISSN 2395-8235versión impresa ISSN 0186-2391
Acta pediatr. Méx vol.35 no.2 México mar./abr. 2014
Artículo original
Estabilidad fisicoquímica de tres marcas genéricas de metformina en solución
Physicochemical stability of a metformin solution from three commercial brands
Radamés Alemón-Medina, Juan Luis Chávez-Pacheco, Blanca Ramírez-Mendiola, Liliana Rivera-Espinosa, Raquel García-Álvarez
Laboratorio de Farmacología, Instituto Nacional de Pediatría, Secretaría de Salud. Insurgentes Sur 3,700-C, Col. Insurgentes Cuicuilco, Del. Coyoacán, México D. F., CP 04530, México.
Correspondencia
Dr. en C. Radamés Alemón-Medina
Laboratorio de Farmacología, Instituto Nacional de Pediatría.
Insurgentes Sur 3,700-C, Col. Insurgentes Cuicuilco
CP. 04530 México D. F.
Tel/Fax. 52 55 10 84 09 00 Ext. 1428
ranapez@hotmail.com
Recibido: enero, 2014
Aceptado: febrero, 2014
RESUMEN
El manejo farmacológico de la resistencia a insulina y dislipidemias en niños y adolescentes es obligatorio para prevenir el síndrome metabólico (SM) y la diabetes mellitus tipo II (DM2).
Material y método: se desarrollaron formulaciones extemporáneas a partir de tabletas de 500 mg de tres marcas de metformina genérica: Medimart®, Farmacias del Ahorro® y Primer Nivel®, con sabor, color y consistencia agradables y dosis ajustada para su fácil administración. Se determinó su integridad fisicoquímica bajo distintas condiciones de almacenamiento: 25°C con luz, 25°C en oscuridad, a 4°C y a 40°C. La estabilidad del fármaco se determinó por cromatografía líquida de ultradesempeño con detección ultravioleta (UPLC-UV) y por medición del pH de la solución almacenada; la fase móvil fue amortiguador de fosfato (KH2PO4) 0.1 M, pH = 6.5, dodecil sulfato de sodio (SDS) 4.6 mM y acetonitrilo (63:7:30) a 0.8 mL/min, columna VARIAN Pursuit C8 150 × 3.9 mm templada a 40°C, con detección a 236 nm.
Resultados: todas las marcas comerciales de metformina fueron estables bajo todas las circunstancias de almacenamiento hasta por 30 días. Conservaron más de 90% de la cantidad inicial de fármaco activo, con un pH de 7.4 ± 0.3.
Conclusión: se pueden elaborar formulaciones extemporáneas de metformina tanto con el fármaco innovador como con los genéricos; se puede ahorrar dinero y tener la seguridad de que conservan sus propiedades fisicoquímicas.
Palabras clave: metformina genérica, metformina innovadora, formulación extemporánea, estabilidad fisicoquímica, UPLC-UV.
ABSTRACT
Pharmacological management of insulin resistance and dyslipidaemias in children and adolescents is required to prevent the development of metabolic syndrome (MS) and type II diabetes mellitus (DM2).
Material and method: we developed extemporaneous formulations from 500 mg-tablets from three generic brands, commercially available in Mexican drugstores: Medimart™, Farmacias del Ahorro™ and Primer Nivel™, dissolved in water sweetened with Splenda, which made them palatable and allowed customised dose adjustment. Solutions were stored at four environmental conditions: 25°C exposed to light, 25°C protected from light, 4°C and 40°C, and their physicochemical stability was assayed. The stability of the drug was determined by ultra performance liquid chromatography and ultraviolet detection (UPLC-UV) and by measuring the pH of the stock solution. The mobile phase consisted of (KH2PO4) 0.1 M, pH = 6.5, 4.6 mM sodium dodecyl sulphate (SDS) and acetonitrile (63:7:30) at 0.8 mL/min, column VARIAN Pursuit C8 150 × 3.9 mm tempered at 40°C, with detection at 236 nm.
Results: Metformin from all trademarks was stable at all storage conditions for up to 30 days, retaining more than 90% of the initial amount of active drug, with a pH of 7.4 ± 0.3.
Conclusion: Metformin extemporaneous formulations may be developed from either the innovator or generic brands, having the advantage of saving money and conserving the stability of its physicochemical properties.
Keywords: Generic metformin, Innovator metformin, Extemporaneous formulation, Physicochemical stability, UPLC-UV.
Debido al aumento de la obesidad infantil, la resistencia a insulina y las dislipidemias1 se ha sugerido que los niños y los adolescentes con obesidad están en riesgo de desarrollar diabetes mellitus tipo II (DM2) y síndrome metabólico (SM),2,3 por lo que recientemente se ha incrementado el tratamiento farmacológico con metformina en los servicios de atención en endocrinología pediátrica; para asegurar lo más posible el éxito de la terapia con ejercicio y dieta. La metformina es un fármaco antihiperglucemiante que disminuye la concentración de la glucosa sanguínea y sensibiliza a los tejidos periféricos a la acción de la insulina sin causar hipoglucemia.4,5 Asimismo, ofrece mecanismos complementarios a las sulfonilureas en el control de la DM2 y puede ser útil en el manejo de las comorbilidades asociadas con obesidad y sobrepeso6, ya que también interfiere en la oxidación de ácidos grasos libres.7 La metformina es el fármaco de elección para el tratamiento de la DM2 y sus comorbilidades; sin embargo, con excepción de Estados Unidos y Canadá (en donde se utiliza Riomet™), no existe una presentación comercial con dosis ajustadas y de fácil administración para los niños. El objetivo de este estudio fue elaborar fórmulas extemporáneas de metformina, a partir de tabletas de tres marcas genéricas, y evaluar su estabilidad fisicoquímica para determinar las mejores condiciones en las que se puede preparar, transportar y almacenar para uso pediátrico eficiente. Asimismo, mantener las propiedades de sabor agradable y sin calorías.
MATERIALES Y MÉTODOS
Reactivos
El acetonitrilo (Caledon™, Canada) fue grado HPLC, los demás reactivos empleados en la cromatografía, tales como dodecil sulfato de sodio (SDS), hidróxido de sodio (NaOH) y fosfato de potasio monobásico (KH2PO4) fueron grado reactivo. Los estándares primarios de metformina y ranitidina fueron obtenidos de MP Biomedicals. El medicamento innovador Glucophage® de Roche, así como los genéricos Medimart®, Farmacias del Ahorro® y Primer Nivel® (clorhidrato de metformina, tabletas de 500 mg) se obtuvieron de la farmacia local. La formulación extemporánea de metformina se elaboró con agua de beber embotellada de marca comercial (Bonafont® de Danone®).
Elaboración de la solución edulcorada
De cada marca de metformina genérica se registró el peso individual de 20 tabletas, de acuerdo con un método ya reportado.8 Las tabletas se trituraron en mortero con pistilo de porcelana y, por corrección lineal, se calculó la cantidad de polvo que contenía 500 mg de compuesto activo, que fue de alrededor de 94.4% (peso promedio 0.53 ± 0.015 g); esto indica una mínima cantidad de excipientes farmacéuticos. El polvo se colocó en un matraz Erlenmeyer estéril con capacidad para 250 mL. Por otro lado, se elaboró el vehículo de la fórmula con agua de beber embotellada.
El sabor amargo de la solución se enmascaró agregando Splenda® (sucralosa, Johnson & Johnson), edulcorante comercial sin calorías, en proporción de 10 g de edulcorante en 100 mL de agua (10%).
A 25 mL de agua endulzada con Splenda® se le agregó el polvo de las tabletas de cada marca (equivalente a 500 mg de metformina) de modo que cada 5 mL de dicha solución contuvieran 100 mg del principio activo. Esto corresponde a la quinta parte de la dosis inicial recomendada en adultos, la cual se podría emplear para instaurar el tratamiento en niños y adolescentes.
Curva patrón y puntos control en solución del estándar de metformina
Se elaboró una solución madre con el estándar de metformina a 1 mg/mL y a partir de ésta se hicieron diluciones subsecuentes en agua desionizada para obtener los siguientes calibradores: 20, 40, 60, 80, 100 y 200 mg/mL, así como las soluciones de concentraciones intermedias a la curva que fueron los puntos de control de calidad: 30, 70 y 150 mg/mL. De cada solución correspondiente a los calibradores o controles se tomaron 190 mL y se les agregaron 10 _L del estándar externo (ranitidina, 1 mg/mL); de esta mezcla se inyectaron 10 mL al sistema cromatográfico.
Condiciones cromatográficas
La fase móvil estuvo compuesta por amortiguador de fosfato de potasio monobásico (KH2PO4) 0.1 M, ajustado con NaOH 5 M a pH = 6.5 (252 mL) al que se agregaron SDS 4.6 mM (28 mL) y se mezcló con ACN (120 mL) para un volumen final de 400 mL (proporción KH2PO4:SDS:ACN igual a 63:7:30); esto se repitió diariamente para cada corrida. Todas las muestras se inyectaron en el equipo UPLC-UV (Acquity™, Waters) en un volumen de 10 mL, eluidas a velocidad de flujo de 0.8 mL/min en una columna VARIAN Pursuit C8 150 × 3.9 mm, acondicionada a 40°C y la detección fue a 236 nm. Los datos se analizaron empleando el programa Empower™ versión 2.0.
Preparación de la solución edulcorada
Se prepararon soluciones de metformina con tabletas de cada una de las marcas. Se prepararon tres soluciones de trabajo a concentraciones utilizables en la práctica clínica (75-375 mg/5 mL): 1.5, 3.5 y 7.5 g/100 mL. Para la preparación de cada solución se colocaron: 6 tabletas (3 000 mg de principio activo) en un matraz, 14 tabletas (7 000 mg) en otro matraz y en un tercer matraz 30 tabletas (15 000 mg). A cada matraz se le agregaron 200 mL de agua endulzada sin calorías (sucralosa 10%) para soluciones con 15, 35 y 75 mg/mL. Se agitaron manualmente a temperatura ambiente hasta disolver. Dado que la cantidad de excipientes es muy baja y la metformina es totalmente soluble en agua no fue necesario triturar las tabletas previamente.
Evaluación de la estabilidad fisicoquímica
De cada una de las tres soluciones de trabajo se tomaron muestras de 2 mL que se colocaron en tubos cónicos de 15 mL (tipo Falcon®) y se distribuyeron en cuatro sitios de almacenamiento, a saber: 25 ± 2°C expuestos a la luz y en oscuridad, 4°C en oscuridad y 40°C en oscuridad. Las soluciones se almacenaron en estas condiciones por 30 días a partir de su elaboración.
La estabilidad fisicoquímica se evaluó mediante la determinación de la concentración de fármaco por UPLC-UV a los 0, 3, 7, 15 y 30 días de almacenamiento. Para la cuantificación se tomaron 10 mL de cada solución y se diluyeron en un volumen final de 5 mL de agua desionizada (1:500) a fin de ajustar la concentración de tal modo que se pudiera cuantificar con la curva patrón. De cada dilución se tomaron 190 mL y se mezclaron con 10 mL del estándar externo (ranitidina, 1 mg/mL). De la mezcla se inyectaron 10 mL al sistema cromatográfico. Se determinó el pH de las soluciones con un potenciómetro UB-10 (Denver Instruments, USA). Visualmente se determinó el cambio de color, posibles partículas extrañas y turbidez.
RESULTADOS
Validación del método analítico para medir la cantidad de metformina
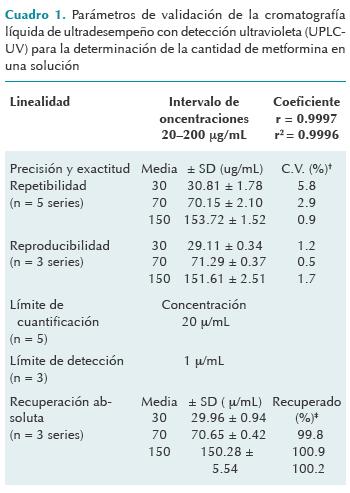
El método de cromatografía líquida de ultradesempeño con detección ultravioleta (UPLC-UV) utilizado en este trabajo se validó de acuerdo con los lineamientos nacionales vigentes descritos en la Norma Oficial Mexicana NOM-177-SSA1-2013 y bajo el esquema de buenas prácticas de laboratorio. El rango fue lineal en un intervalo de 20 a 200 µg/mL con un coeficiente de correlación r = 0.9997. El método fue repetible y reproducible ya que las concentraciones control o nominales (PC-1, PC-2 y PC-3) tuvieron un coeficiente de variación menor o igual a 15% (CV ± 15%) cuando se calcularon a partir de la curva patrón; dichos valores son los aceptables de acuerdo con la Norma Oficial Mexicana NOM-177-SSA1-20139 para concluir que las soluciones son fisicoquímicamente estables. Dichos resultados pueden verse en el cuadro 1.
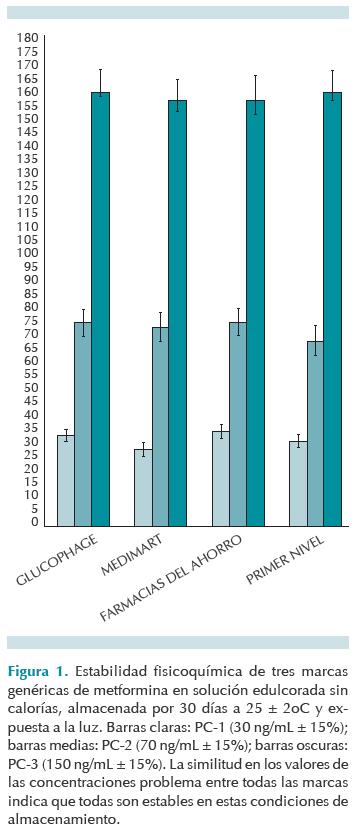
Estabilidad fisicoquímica de la solución edulcorada
En la figura 1 se muestran las tres concentraciones ensayadas: PC-1, PC-2 y PC-3 (puntos para el control de calidad) de metformina en solución de las tres marcas genéricas comparadas con la marca innovadora previamente reportada. Las tres marcas genéricas de metformina fueron estables por 30 días a las cuatro condiciones de almacenamiento probadas en este estudio (cuadro 2). Los criterios de aceptación para determinar la estabilidad fisicoquímica fue que las soluciones de los puntos de control de calidad tuvieran concentraciones de metformina en los siguientes rangos de concentración: para PC-1 30 ng/mL ± 15%; es decir, de 25.5 a 34.5. Para PC-2 de 70 ng/mL ± 15%; es decir, de 59.5 a 80.5 y, para el PC-3, de 150 ng/mL ± 15%; es decir, de 127.5 a 172.5.
DISCUSIÓN
Los costos del tratamiento de la DM2 en México y América Latina representan, aproximadamente, 14% del salario anual que percibe la mayoría de los trabajadores.
Un agravante de este problema es que la DM2 se está presentando a edades cada vez más tempranas;10 en la adolescencia e inclusive en la infancia. Ello incrementará los costos del tratamiento y reducirá los años de vida saludable y la capacidad para trabajar de la población.11 Estos aspectos refuerzan la necesidad de instaurar un tratamiento farmacológico adecuado al presentarse los primeros signos de alerta. El uso de la metformina en población pediátrica, delgada u obesa con resistencia a la insulina, promete ser parte de un plan terapéutico preventivo exitoso pues, gracias a su mecanismo de sensibilización de los tejidos a la acción de la insulina12 permite una respuesta favorable del organismo ante la hiperglucemia antes de que se instaure la diabetes mellitus. Esto, a diferencia de otros fármacos como la glibenclamida, que por su mecanismo de acción se prefiere para el manejo de la DM2 en población adulta más que para su prevención. De hecho, en adultos mexicanos con DM2 de diagnóstico reciente la glibenclamida tiene mayor éxito y menor costo que la metformina,13 lo que resalta aún más el potencial de esta última como fármaco preventivo de DM2.
Las preparaciones extemporáneas representan una alternativa terapéutica en pediatría14 por lo que es importante demostrar que son de calidad, estables, biodisponibles, eficaces y seguras.15
Una preparación oral debe ser preferentemente bien tolerada, efectiva, estable y de un sabor aceptable.16 Todas estas características, en conjunto, contribuyen al éxito de un tratamiento dado que la administración de una formulación con sabor desagradable puede ocasionar su abandono.17
Se sabe que los niños tienen preferencia por alimentos y bebidas dulces, por lo que edulcorantes como sacarina, aspartame o sucralosa se añaden en las formulaciones pediátricas. Aunque el compuesto para endulzar de mayor uso es la sacarosa se recomienda evitarlo en medicamentos diseñados para terapias a largo plazo debido a que se le asocia con problemas dentales;18 por eso se prefiere a la sucralosa en la elaboración de preparaciones pediátricas de medicamentos.18,19
En reportes previos, una solución de metformina a partir de tabletas de la marca genérica (Glucophage®), edulcorada sin calorías, es fisicoquímicamente estable hasta por 30 días.8 En este trabajo demostramos que las soluciones extemporáneas elaboradas con el mismo medicamento, pero de tres marcas genéricas diferentes, son igualmente estables en las mismas condiciones de almacenamiento y por el mismo período que el innovador. Esto repercute en ventajas para el tratamiento de los pacientes pediátricos que requieran ajuste de dosis de metformina, ya que se pueden elaborar soluciones del fármaco a partir de marcas más baratas. Esto significa ahorro para los padres o familiares responsables del menor en tratamiento que, asimismo, cuenta con más opciones para elaborar la solución sin que forzosamente tenga que ser a partir del fármaco innovador, que en algunas farmacias locales no está disponible.
Las soluciones extemporáneas líquidas de metformina elaboradas en nuestro laboratorio actualmente están en proceso de evaluación. Se efectúan ensayos de biodisponibilidad comparada y de seguridad en voluntarios sanos con el propósito de corroborar que puedan alcanzarse concentraciones plasmáticas similares a las obtenidas con las tabletas fraccionadas. Se busca comprobar que son seguras como medios de ajuste de dosis en población pediátrica en el corto plazo.
REFERENCIAS
1. Garnett SP, Baur LA, Noakes M, Steinbeck K, Woodhead HJ, Burrell S, Chisholm K, Broderick CR, Parker R, De S, Shrinivasan S, Hopley L, Hendrie G, Ambler GR, Kohn MR, Cowell CT. Researching Effective Strategies to Improve Insulin Sensitivity in Children and Teenagers - RESIST. A randomised control trial investigating the effects of two different diets on insulin sensitivity in young people with insulin resistance and/or pre-diabetes. BMC Public Health. 2010;10:575. doi: 10.1186/1471-2458-10-575 [ Links ]
2. Ventura EE, Davis JN, Alexander KE, Shaibi GQ, Lee W, Byrd-Williams CE, Toledo-Corral CM, Lane CJ, Kelly LA, Weigensberg MJ, Goran MI. Dietary intake and the metabolic syndrome in overweight latino children. J Am Diet Assoc 2008;108:1355-9. doi: 10.1016/j.jada.2008.05.006 [ Links ]
3. Kanekara A, Sharma M. Pharmacological Approaches for Management of Child and Adolescent Obesity. J Clin Med Res 2010;2:105-11. doi: 10.4021/jocmr2010.05.288w [ Links ]
4. Lalau JD, Lacroix C, Compagnon P. Role of metformin accumulation in metformin-associated lactic acidosis. Diabetes Care 1995;18:779-84. [ Links ]
5. Bailey CJ, Turner RC. Metformin. N Engl J Med 1996;334:574-9. [ Links ]
6. Hermann LS, Scherstein B, Bitzen PO. Therapeutic comparison of metformin and sulfonylurea, alone, and in various combinations. A double-blind controlled study. Diabetes Care 1994;17:1100-9. [ Links ]
7. Fulgencio JP, Kohl C, Girard J, Pégorier JP. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochem Pharmacol 2001;62:439-46. [ Links ]
8. Alemón-Medina R, Coria-Jiménez R, Ramírez-Mendiola B, Rivera-Espinosa L, García-Álvarez R, Juárez-Olguín H, Chávez-Pacheco JL. Physicochemical and microbiological stabilities of a sweetened and calorie-free metformin extemporaneous formulation for pediatrics. Lat Am J Pharm 2012;31:1253-60. [ Links ]
9. PROYECTO-NOM-177-SSA1-2013. Proyecto de Norma Oficial Mexicana-177-SSA1-2013. Diario Oficial de la Federación. 2013. [ Links ]
10. Kendall DL, Amin R, Clayton PR. Metformin in the treatment of obese children and adolescents at risk of type 2 diabetes. Pediatr Drugs 2014;16:13-20. [ Links ]
11. Reilly JJ, Kelly J. Long-term impact of overweight and obesity in childhood and adolescence on morbidity and premature mortality in adulthood: systematic review. Int J Obes 2011;35:891-8. [ Links ]
12. Glueck CJ, Fontaine RN, Wang P, et al. Metformin reduces weight, centripetal obesity, insulin, leptin and low density lipoprotein cholesterol in nondiabetic, morbidly obese subjects with BMI>30. Metabolism 2011;50:856-61. [ Links ]
13. Díaz de León-Castañeda C, Altagracia-Martínez M, Kravzov-Jinich J, Cárdenas-Elizalde MR, Moreno-Bonett C, Martínez-Núñez JM. Cost-effectiveness study of oral hypoglycemic agents in the treatment of outpatients with type 2 diabetes attending a public primary care clinic in Mexico City. Clinicoecon Outcomes Res 2012;4:57-65. doi: 10.2147/CEOR.S27826 [ Links ]
14. Juárez-Olguín H. Uso de formulas magistrales en pediatría. Acta Pediátrica de México. 2011;32:175-176. [ Links ]
15. Chávez-Pacheco JL, Rivera-Espinosa L, Alemón-Medina R, González-Zamora JF, Ramírez-Mendiola B, Flores-Pérez J, Juárez-Olguín H, Flores-Pérez C. Development and sedative effect of a new formulation of midazolam in chocolate bars. Lat Am J Pharm 2011;30:1977-84. [ Links ]
16. Nunn AJ. 2003. Making medicines that children can take. Arch Dis Child 2003;88:369-71. [ Links ]
17. Schirm E, Tobi H, De Jong-van den Berg LTW. Risk factors for unlicensed and off-label drug use in children outside the hospital. Pediatrics 2003;111:291-5. [ Links ]
18. Strickley RG, Iwata Q, Wu S, Dahl TC. Pediatric Drugs -A Review of Commercially Available. Journal of Pharmaceutical Sciences 2008;97:1731- 1774. [ Links ]
19. Young DA, Bowen WH. 1990. The influence of sucralose on bacterial metabolism. J Dent Res 1990;69:1480-4. [ Links ]
Exención de responsabilidad. Los hallazgos, opiniones y/o puntos de vista vertidos en el presente escrito son a título personal.
Financiamiento. Fondos Federales INP, Convocatoria 2013, categoría A.
Declaración de conflictos de interés. Los autores del presente trabajo declaran no tener ningún conflicto de interés; asimismo, ninguno de los autores forma parte de un comité asesor de ninguna compañía farmacéutica ni ha recibido apoyo económico de fuente comercial.














