Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de análisis de la conducta
versión impresa ISSN 0185-4534
Rev. mex. anál. conducta vol.36 no.2 México ene. 2010
Artículos de investigación empírica
Administración del 8–OH–DPAT en el núcleo ventromedial hipotalámico: caracterización de la conducta alimentaria
Administration of 8–OH–DPAT in the ventromedial hypothalamic nucleus: characterization of feeding behavior
Verónica Elsa López Alonso, Juan Manuel Mancilla Díaz, Melissa Rito Domingo, Armando Giovanni Jiménez Fujarte, Daniel Díaz Urbina
Laboratorio de Psicobiología de la Alimentación, FES Iztacala, Universidad Nacional Autónoma de México.
Correspondencia:
Juan Manuel Mancilla–Díaz,
Laboratorio de Psicobiología de la Alimentación,
UNAM FES–Iztacala. Av de los Barrios #1,
Los Reyes Iztacala, Tlalnepantla Edo. de México.
CP. 54090. Tel. + 52(55) 56231298,
ext. 410, 409 y 457. Fax: +52(55) 5390 7604.
E–mail: jmmd@servidor.unam.mx
Recibido: Abril 21, 2010
Revisado: Junio 2, 2010
Aceptado: Junio 22, 2010
Resumen
La presente investigación evaluó los efectos del agonista de los receptores 5–HT1A 8–OH–DPAT sobre la Secuencia de Saciedad Conductual (SSC) en ratas. El 8–OH–DPAT fue administrado vía central en el núcleo ventromedial hipotalámico (NVH) de ratas. Los sujetos experimentales fueron mantenidos bajo un paradigma de auto–selección dietaría consistente en proteínas, carbohidratos y grasas. El alimento y el agua estuvieron disponibles todo el tiempo. La administración intra–NVH del agonista 5–HT1A fue asociada al incremento selectivo de la ingesta de carbohidratos. El análisis de la SSC reveló que la administración del 8–OH–DPAT demoró el desarrollo natural de la SSC. Los resultados llevan a concluir que los receptores 5–HT1A del NVH participan en la modulación de la ingesta de alimento, se discute la posible participación de la interacción con otros sistemas de neurotransmisores.
Palabras clave: agonista 5–HT1A, ingesta de alimento, secuencia de saciedad conductual.
Abstract
The present study evaluated the effects of 5–HT1A receptor agonist 8–OH–DPAT on the Behavioral Satiety Sequence (BSS) in rats. The 8–OH–DPAT was administered via central in the hypothalamic ventromedial nucleus (VMN) in rats. The experimental subjects were kept under a dietary self–selection paradigm consisting of proteins, carbohydrates and fats. Food and water were available all the time. Intra–VMN administration of 5–HT1A agonist was associated with the selective increase in carbohydrate intake. The BSS analysis revealed that the administration of 8–OH–DPAT delayed the natural development of the BSS. The results lead to the conclusion that 5–HT1A receptors in the NVH involved in the modulation of food intake, is discussed the possible involvement of interactions with other neurotransmitters systems.
Keywords: 5–HT1A agonist, food intake, behavioral satiety sequence.
Introducción
Las evidencias respecto a la participación de la serotonina (5–HT) sobre el control de la ingesta de alimento y peso corporal son amplias (Blundell 1984; Leibowitz, Alexander, Cheung & Weiss, 1993; Leibowitz & Alexander, 1998). Esta amina biogénica es considerada como un mediador importante de la saciedad. En la literatura está establecido que el aumento de la actividad del sistema serotoninérgico al ser estimulado periférica o centralmente promueve la saciedad (Clifton, Barnfield & Philcox, 1989; Fletcher & Paterson, 1989; Halford & Blundell, 1996; Hewitt, Lee, Dourish & Clifton, 2002; Kitchner & Dourish, 1994; Leibowitz & Alexander, 1998; Leibowitz, Weiss & Suh, 1990; Weiss, et al., 1991). La utilización de fármacos que reducen la actividad serotoninérgica o que bloquean la disponibilidad de 5–HT (antagonistas de los receptores 5–HT o inhibidores de la liberación de 5–HT), han sido implicados en la inducción del efecto hiperfágico. Mientras que los agentes farmacológicos que facilitan la liberación de 5–HT (agonistas 5–HT, inhibidores de recaptura y fármacos que incrementan la liberación de 5–HT) causan hipofagia (Blundell 1984; Garattini, Mennini, Bendotti, Invernizzi & Samanin, 1986; Mancilla, Escartín, López & Camacho, 2006). Particularmente la estimulación de los subtipos de receptores 5–HT1B, 5–HT2A y 5–HT2C se han relacionado con la mediación de la respuesta hipofágica entretanto que el subtipo 5–HT1A se ha vinculado con la hiperfagia (Currie, Coscina & Fletcher, 1998; Jhanwar–Uniyal, Moorjani & Kahn 1994; Schreiber & De Vry, 2002; Schreiber, Selbach, Asmussen, Hesse & De Vry, 2000).
La microinyección de 5–HT en el hipotálamo medial produce cambios selectivos sobre los patrones temporales de la conducta alimentaria y selección dietaría; reduciendo selectivamente la ingestión de carbohidratos. Estos efectos se han observado en diferentes núcleos del hipotálamo medial incluyendo al núcleo ventromedial del hipotálamo (NVH) (Leibowitz & Alexander 1998; Leibowitz, et al., 1990). El NVH es una región importante para la regulación de la ingesta de alimento, secreción de hormonas y homeostasis metabólica. La destrucción del NVH y áreas adyacentes produce hiperinsulinemia, hiperfagia, metabolismo de lípidos anormal y obesidad (Stenger, Fournier & Bielajew, 1991). A través de la historia el NVH se ha venido implicado con el control de la saciedad. El trabajo pionero de Hetherington y Ranson (1942) demostró que la lesión del NVH causa sobrealimentación y una ganancia excesiva de peso. En tanto que, Kennedy (1950) fue el primero en proponer que el NVH era el centro cerebral de la saciedad. Por otra parte Mayer (1955) hipotetizó que el NVH era el lugar donde se localizaban los glucoreceptores responsables de iniciar la saciedad (teoría glucostática de la alimentación). Actualmente se tiene conocimiento de que la tasa de disparo de algunas neuronas dentro del NVH es influenciado por la disponibilidad de glucosa y afecta la actividad del sistema nervioso simpático (Lee, et al., 2007).
Adicionalmente, también se sabe de la presencia de los subtipos de receptores 5–HT1B y 5–HT2C en el NVH (Nishimura, Nishihara, Torii & Takahashi, 1996; Park, Harrold, Widdowson & Williams, 1999). Investigaciones como la de Hijiki, Inoue, Iwasaki, Ichihara y Kiriike, (2004) muestran que la infusión de m–CPP (agonista de los receptores 5–HT1B/2C) directamente en el NVH reduce la ingesta de alimento vía receptores 5–HT1B y 5–HT2C. Utilizando técnicas de binding se ha evidenciado la presencia del receptor subtipo 5–HT1A en el NVH en alta densidad (Li, Battaglia & Van de Kar, 1997; Li, Muma, Battaglia & Van de Kar, 1997). La función de este receptor con respecto a la ingesta de alimento es controversial, los reportes de investigación sugieren un efecto bifásico sobre la ingesta de alimento (De Vry & Schreiber, 2000). Algunas investigaciones han reportado el incremento de la ingesta de alimento al administrar el agonista selectivo 5–HT1A 8–OH–DPAT (Dourish, Hutson, & Curzon, 1985; Dourish, Hutson, Kennett & Curzon, 1986; Hutson, Dourish & Curzon, 1988). Empleando la metodología de auto–selección dietaría se sugiere que el efecto hiperfágico es específico sobre la ingestión de carbohidratos (Luo, Ransom & Li, 1990). También se ha reportado que el 8–OH–DPAT es capaz de bloquear el efecto hipofágico inducido por fármacos como la colecistoquinina, la fenfluramina y la fluoxetina (Currie, et al., 1998; Currie, Braver, Mirza & Sricharoon, 2004; Poeschla, Gibbs, Simansky & Smith, 1992). Contrariamente, algunas investigaciones sugieren que la administración periférica del 8–OH–DPAT reduce la ingesta de alimento (Simansky & Vaidya, 1990) y la administración central en el núcleo paraventricular hipotalámico y en el rafé medio también disminuyen la ingesta de alimento al inicio del ciclo de oscuridad (López, Mancilla, Rito, González & Escartín, 2007; Wirtshafter, 2001).
En términos generales se ha dicho que la hipofagia inducida por la administración de fármacos serotoninérgicos se debe a la aceleración del proceso de saciedad. Algunos investigadores han sugerido que los fármacos que liberan la 5–HT y los que estimulan los receptores 5–HT2C y/o 5–HT1B específicamente incrementan la saciedad en ratas (Clifton, Barnfield & Curzon, 1993; Halford, Wanninayake & Blundell, 1998; Kitchner & Dourish, 1994; Samanin & Grignashi, 1996; Simansky & Vaidya, 1990). Para determinar sí la hipofagia inducida por un fármaco se debe al desarrollo de la saciedad o a reacciones colaterales adversas como nausea, sedación, hiperactividad y/o paladeabilidad del alimento, la utilización del análisis de Secuencia de Saciedad Conductual [SSC] suele ser una buena alternativa (López, Mancilla & Escartín, 2002). Se ha observado que justo en el momento en que finaliza la ingestión de alimento se inicia el desarrollo de un patrón conductual altamente estereotipado (Gao, Harvey, Mook & Zeigler, 1998). Después de que cesa la ingesta de alimento, el animal se acicala o explora el interior de su caja–habitación y la secuencia típicamente finaliza con el animal en una postura de descanso. Halford et al. (1998) denominan a esta secuencia como SSC y la definen como la transición ordenada de comer, actividad, acicalamiento y descanso medidos durante el período de post–ingesta. De tal forma que la SSC parece estar fuertemente relacionada con el proceso de satisfacción (terminación del intervalo de alimentación) y el desarrollo de la saciedad (inhibición postingesta de alimento).
Se ha argumentado que el efecto sobre la ingesta de alimento del 8–OH–DPAT posiblemente sea dependiente de la metodología utilizada, dosis, periodos y tiempo de observación. Pero se desconocen los mecanismos de acción a través de los cuales se produce la respuesta hipofágica o hiperfagica. Por lo que es necesario continuar investigando para establecer los mecanismos involucrados para inducir uno u otro efecto. Dado lo anterior, el objetivo general de la presente investigación fue determinar el papel de la estimulación del subtipo de receptor 5–HT1A del núcleo ventromedial hipotalámico (NVH) sobre la ingesta de alimento y secuencia de saciedad conductual.
Método
Sujetos
Se utilizaron 20 ratas macho de la cepa Wistar de 200–230 g al inicio del experimento. Los animales fueron provistos por el Bioterio de la FES–Iztacala, UNAM. Todos los procedimientos del presente estudio fueron realizados de acuerdo a la Norma Oficial Mexicana (NOM–062–ZOO–1999), Especificaciones Técnicas para la Producción, Cuidado y Uso de Animales de Laboratorio.
Dietas
Hidratos de carbono (harina de maíz Maseca, maíz nixtamalizado, Molinos Azteca de Chalco S.A. de C.V., planta Teotihuacan), proteínas (proteína aislada de soya 91.5% marca Supro 500 E, distribuido por Protein Technologies International, S.A. of C.V. Checkerboard Square, St. Louis, MO), grasas (manteca vegetal Inca. Elaborado por Anderson Clayton & Co. S.A. de C.V., Tultitlán, Estado de México). El agua fue enriquecida con Vitater, un suplemento vitamínico (hecho en México por Laboratorio Maver).
Fármacos
Los fármacos utilizados fueron: 2,5–Dimetoxi–4–iodoamphetamina (DOI agonista 5–HT2A, también activa receptores 5–HT2C, 7.2 μg/0.5μl); 8–hidroxi–2–(di–n–propilamino)tetralina (8–OH–DPAT agonista selectivo 5–HT1A, 0.5 μg/0.5μl). Este fármaco fue adquirido con Sigma Chemical Co., St. Louis, MO. Todos los fármacos fueron infundidos a una velocidad de 1μl/3min en el núcleo ventromedial hipotalámico (NVH). Para asegurar una difusión completa de las sustancias el microinyector permaneció un minuto adicional dentro de la cánula guía, luego fue retirado. La administración de los fármacos se realizó con una jeringa digital para fluidos de alta precisión (Hamilton Co., Reno, NV).
Cirugía estereotáxica
Los animales fueron anestesiados con hidrato de cloral (350mg/kg). Una vez anestesiados, se fijaron a un estereotáxico y se les implantó una cánula 2 mm por arriba del NVH del lado derecho. Las coordenadas sugeridas se tomaron del Atlas Estereotáxico de Paxinos y Watson (1986). Las coordenadas fueron corregidas previamente por ensayo y error en un grupo piloto, inyectando azul de metileno a través de la cánula guía hasta teñir el NVH. Posterior a la corrección, las coordenadas fueron las siguientes: posterior a bregma –2.30 mm; lateral a la línea media 0.6 mm y de profundidad a partir de dura madre –8.0 mm. Finalmente se aplicaron 50.000 u/kg, im de penicilina benzatínica para prevenir infecciones.
Procedimiento
Se colocaron a las ratas de manera aleatoria en cajas habitación, individuales, cada una de ellas con tres comederos y mantenidas en un ciclo invertido de luz–oscuridad de 12x12 hr con libre acceso a agua y comida. Los animales se pesaron a las 8:00 hr, una hora antes de iniciar el ciclo de oscuridad (9:00 hr). Las ratas tuvieron acceso a una dieta de fuentes separadas para carbohidratos, proteínas y grasas. Cada nutrimento se cambió de lugar de acuerdo a un orden preestablecido, para evitar "preferencia de lugar". El tiempo bajo estas condiciones fue de una semana.
Después de lo anterior, los animales fueron sometidos a cirugía estereotáxica. Cuatro días posteriores a la cirugía (período de recuperación), los animales fueron asignados aleatoriamente a un grupo de diez animales cada uno (control ó 8–OH–DPAT). Las ratas fueron inyectadas dentro de NVH con salina seguida por salina (control) ó salina seguida de 8–OH–DPAT (8–OH–DPAT). A todos los animales se les administraron dos inyecciones dentro del NVH, el tiempo entre una y otra administración fue de diez minutos. Una vez iniciado el período de oscuridad se realizó un registro de duración continua de 60 min, al finalizar el registro se pesaron y rellenaron los comederos (cuidando de recolectar lo que cayera del comedero) para determinar el consumo de alimento.
Todas las sesiones se filmaron a través de una cámara de circuito cerrado para bajas intensidades de luz, para realizar el registro de duración continua. Esto se realizó desde un cuarto contiguo para no interferir la conducta de los sujetos experimentales.
Medidas conductuales
Para realizar el análisis de la secuencia de saciedad conductual (SSC), los 60 minutos de registro continuo fueron divididos en 12 segmentos de 5 minutos cada uno y se analizaron considerando las siguientes categorías conductuales: ingesta (definida como el tiempo en segundos que dedican las ratas para alimentarse), descanso (tiempo en segundos en el que las ratas permanecen inactivas con cabeza en el piso), otras conductas (tiempo en segundos que dedican para, desplazarse, husmear, levantarse sobre las patas traseras etc. dentro de la caja–habitación) y acicalarse (tiempo en segundos que pasan lavando y limpiando cualquier parte de su cuerpo).
Determinación de glucosa en suero
Al finalizar el periodo de observación (1h) los sujetos fueron decapitados. Se recolectó 1.5 ml de sangre del tronco en tubos de vidrio de 10 ml, se dejó coagular la sangre por un lapso de 15–20 min a temperatura ambiente. Cuando se observó la retracción del coagulo se centrifugó el tubo por un periodo de 10 min a 3500 r.p.m. Posteriormente se separó el suero sobrenadante empleando una micropipeta. El suero fue usado para determinar la concentración de glucosa basado en la reacción de la glucosa oxidasa / peroxidasa (GOD–POD). El kit comercial glucosa por trinder GOD–POD fue adquirido con Spinreact–Lab Center de México S.A de C.V.
Histología
El cerebro fue removido y se mantuvo 7 días en formol al 10.0 %. Posteriormente se realizaron cortes histológicos coronales de 70 μm de espesor con un vibratomo, para luego teñirlos con la técnica de Nissl y poder así verificar el sitio de implantación de la cánula.
(Análisis de resultados)
Posterior a la verificación del sitio de implantación (Figura 1), los grupos quedaron conformados de la manera siguiente: grupo Control (n=7) y grupo 8–OH–DPAT (n=8).

Los resultados se expresan en términos de la media ± Error Estándar de la Media (EEM). Cada unidad de análisis (ingestión de proteínas, carbohidratos y grasas, niveles de glucosa), se analizó empleando una Prueba t no relacionada. El criterio estadístico para significancia fue p < .05. El procesamiento estadístico se llevó a cabo con el paquete denominado SPSS (versión 13.0 para Windows).
Resultados
Ingestión
El análisis reveló que el grupo al que se le administró el 8–OH–DPAT incrementó significativamente la ingesta de carbohidratos (X̅ = 2.15, EEM = 0.30) comparado con el grupo control (X̅ = 0.98, EEM = 0.33, t (13) = –2.6; p< 0.05) (Figura 2). En la ingestión de proteínas y grasas no se encontraron efectos significativos debidos a la administración intrahipotalámica del 8–OH–DPAT.

Concentración de glucosa en suero
El análisis de la concentración de glucosa no mostró diferencias estadísticas significativas entre el grupo control y el grupo 8–OH–DPAT, una hora después de haber administrado el agonista. Sin embargo en la figura 3 se puede observar la tendencia a reducir el nivel de glucosa en el grupo al que se le administró el 8–OH–DPAT.

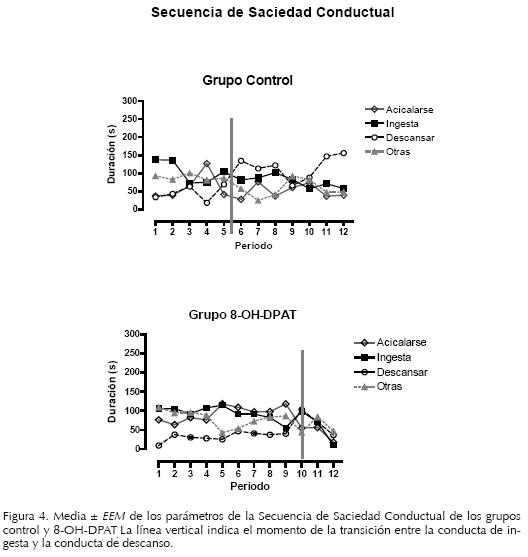
Secuencia de Saciedad Conductual
El grupo control muestra un desarrollo ordenado de la SSC, es decir conducta de ingesta (ver figura 4A), seguida de la presencia de otras conductas, acicalarse y posteriormente el descanso. La transición entre la conducta de alimentarse y el descanso para este grupo se observó entre los períodos 5 y 6. La administración del agonista 5–HT1A 8–OH–DPAT demoró el desarrollo de la SSC (ver figura 4B). En cuanto a la transición de la conducta de alimentarse y de descanso se observó un desplazamiento a la derecha (período 10), al compararse con el grupo control. El desarrollo de la conducta de descanso se retardó pero se conservó el patrón típico de la SSC.
Discusión
Estudios previos han mostrado que la actividad de la serotonina en el hipotálamo está relacionada con el control de la conducta alimentaria y el peso corporal (Leibowitz, et al., 1993; Leibowitz & Alexander, 1998). Los estudios en roedores indican que bajas dosis de 5–HT o de fármacos que incrementan la liberación de la 5–HT inhiben de forma preferencial la ingesta de carbohidratos más que la de grasas o proteínas (Wurtman & Wurtman, 1977, 1979 a, 1979b). Este fenómeno es mediado en parte por receptores 5–HT localizados en varios núcleos del hipotálamo medio. En la presente investigación, la administración del agonista 8–OH–DPAT en el NVH incrementó la ingestión de alimento, particularmente el efecto se observó sobre la ingestión de carbohidratos. Este resultado concuerda con estudios en los que se ha reportado que la administración de 8–OH–DPAT aumentó la ingesta de alimento (Dourish, et al., 1985; Dourish, et al., 1986; Hutson, et al., 1988). Los reportes también señalan que una dieta rica en carbohidratos puede facilitar el efecto hiperfágico inducido por el 8–OH–DPAT (Jhanwar–Uniyal, et al., 1994; Voigt, Nwaiser, Rex, Mayer & Fink, 2004). Posiblemente este efecto se deba a la estimulación de receptores 5–HT1A somatodendríticos y a la consecuente reducción de la actividad serotoninérgica, indicando el predominio de un sitio de acción presináptico (Hoyer, Hannon & Martin, 2002). Sin embargo el mecanismo de acción se vuelve más complejo al considerar que la activación del receptor 5–HT1A induce cambios en las concentraciones de glucosa cerebral (Grasby, Sharp, Allen & Grahame–Smith, 1992). Particularmente en la presente investigación la concentración de glucosa en sangre mostró una tendencia a reducirse al administrar el 8–OH–DPAT. Estos resultados son consistentes con los reportados en investigaciones previas en donde se señala que el agonista 8–OH–DPAT estimula la ingesta de alimento pero también reduce los niveles de glucosa en el hipotálamo, sugiriendo que los receptores 5–HT1A no solo están implicados en el control hipotalámico de la 5–HT sino también en el control hipotalámico de la glucosa (Voigt, et al., 2004). Hay evidencias de que el hipotálamo participa en el control autonómico del balance de glucosa e insulina. Específicamente el NVH ha constituido un centro de atención debido a que las neuronas localizadas en este núcleo modulan la concentración de glucosa (Song, Levin, McArdle, Bakhos & Routh, 2001; De Vries, Arseneau, Lawson & Beverly, 2003). Incluso se habla de la existencia de cuatro subtipos de neuronas sensibles a glucosa en el NVH que participan en la modulación del inicio y el término de la alimentación (Routh, 2002). Jhanwar–Uniyal, et al., (1994) sugieren que los niveles de glucosa y de insulina son un factor determinante en la hiperfagia inducida por el 8–OH–DPAT. Indicando que mientras la hiperfagia es mediada por mecanismos presinápticos, los niveles de glucosa e insulina son regulados vía receptores 5–HT1A postsinápticos. Adicionalmente, se ha demostrado que en el NVH se expresan neuronas glutamatérgicas y Gabaérgicas (Collin, et al., 2003; Commmons, Kow, Milner & Pfaff, 1999; Ziegler, Cullinan & Herman, 2002), sistemas de neurotransmisores que también han sido relacionados con el control de la conducta alimentaria (Escartín, et al., 2009; Gradison & Guidotti, 1977; Kelly & Grossman, 1979; López, et al., 2000). El nivel de GABA endógeno del NVH y la actividad de la enzima glutamato descarboxilasa (GAD) también son dependientes de los niveles de glucosa. Bajos niveles de glucosa elevan la liberación de GABA e incrementan la actividad de la GAD mientras que altos niveles de glucosa tienen efectos opuestos (Kamatchi, Veeraragavan, Chandra & Bapna, 1986). Por otro lado, también hay una fuerte expresión de aminas en el NVH tales como la noradrenalina, dopamina e histamina (Beverly, de Vries, Beverly & Arseneau, 2000; Brown, Stevens & Haas, 2001; Lee, et al., 2007). De forma particular Chaouloff y Jeanrenaud (1987) señalan que los cambios inducidos por el 8–OH–DPAT son mediados por receptores α2–adrenoreceptores. Adicionalmente Beverly et al., (2000) sugieren la interacción del sistema noradrenérgico y gabaérgico bajo condiciones de glucoprivación.
El análisis de la secuencia de saciedad conductual indica en el grupo control el desarrollo ordenado de la conducta alimentaria, es decir los sujetos comen, presentan conductas activas (locomoción, acicalarse, rascarse) y posteriormente descansan, patrón estereotipado que se ha caracterizado en investigaciones previas, y que se considera como un indicador de la saciedad (Gao et al., 1998; Halford et al., 1998; McGuirk, Muscat & Willner, 1992; Vickers, Clifton, Dourish & Tecott, 1999). En el grupo 8–OH–DPAT el orden de aparición de las conductas corresponde a la SSC típica sin embargo la presencia de estas conductas se demoró. La duración de la ingesta de alimento se prolongó a través de los periodos de observación, retardando la presentación de otras conductas como son la locomoción, el acicalarse y el descanso en relación al grupo control. Consecuentemente la transición entre la ingesta y la conducta de descanso se retardo, sugiriendo la demora del proceso de satisfacción. Por tanto el aumento de la ingesta de alimento al administrar el 8–OH–DPAT en el núcleo ventromedial hipotalámico se explica debido a la inhibición del proceso de satisfacción, es decir se prolonga el término del intervalo de alimentación.
La participación del receptor 5–HT1A sobre la ingesta de alimento es controversial. Probablemente estas controversias respondan a la utilización de las diferentes metodologías de investigación, como se ha sugerido en algunos reportes, pero también a la activación de circuitos neuronales complejos dependientes de la dosis y núcleo cerebral en el que se esté administrando el fármaco. La activación del receptor 5–HT1A es únicamente el inicio de arranque de un circuito en donde están interaccionando varios sistemas de neurotrasmisores. El efecto hiperfágico inducido por la administración del 8–OH–DPAT sugiere estar ligado a la afectación del término de la alimentación, esto es demorando el proceso de satisfacción. Estos resultados sugieren una importante participación de los receptores 5–HT1A sobre mecanismos conductuales específicos; regulando la ingesta de alimento, el proceso de satisfacción y facilitando la ingesta voluntaria de carbohidratos.
Conclusión
Los resultados de esta investigación sugieren que el efecto hiperfágico inducido por la administración del agonista 8–OH–DPAT en el NVH solo puede ser explicado en parte por la participación de los receptores 5–HT1A. Probablemente los cambios en los niveles de glucosa debidos a la estimulación de los receptores 5–HT1A sea el detonador de arranque de un circuito complejo en el que están interaccionando otros sistemas de neurotransmisores, entre los que destacan el sistema noradrenérgico y gabaérgico que por si mismos han sido relacionados con el control de la conducta alimentaria. El incremento de la ingesta de alimento al administrar el 8–OH–DPAT se debió a la inhibición del proceso de satisfacción.
Referencias
Beverly, J. L., De Vries, M. G., Beverly, M. F. & Arseneau, L. M. (2000). Norepinephrine mediates glucoprivic–induced increase in GABA in the ventromedial hypothalamus of rats. American Journal of Regulatory, Integrative and Comparative Physiology, 279, R990–R996. [ Links ]
Blundell, J. E. (1984). Serotonin and appetite. Neuropharmacology, 23(128), 1537–1551. [ Links ]
Brown, R. E., Stevens, D. R. & Hass, H. L. (2001). The physiology of brain histamine. Progress in Neurobiology, 63, 637–672. [ Links ]
Chauloff, F. & Jeanrenaud, B. (1987). 5–HT1A and alpha–2 adrenergic receptors mediate the hyperglycemic and hypoinsulinemic effects of 8–hidroxy–2–(di–n–propylamino)tetralin in the conscious rat. Journal of Pharmacology and Experimental Therapeutics, 243, 1159–1166. [ Links ]
Clifon, P. G., Barnfield, A. M. & Curzon, G. (1993). Effects of m–CPP on the ingestive behaviour of male and female rats: a microestructural analysis. Journal of Psychopharmacology, 7, 257–264. [ Links ]
Clifton, P. G., Barnfield, A. M. C. & Philcox, L. A. (1989). A behavioural profile of fluoxetine–induced anorexia. Psychopharmacology, 97, 89–95. [ Links ]
Collin, M., Bäckberg, M., Ovesjö, M–L., Fisone, G., Edwards, R. H., Fujiyama, F., et al. (2003). Plasma membrane and vesicular glutamate transporter mRNAs/proteins in hypothalamic neurons that regulate body weight. European Journal of Neuroscience, 18, 1265–1278. [ Links ]
Commons, K. G., Kow, L–M., Milner, T. A. & Pfaff, D. (1999). In the ventromedial nucleus of the rat hypothalamus, GABA–immunolabeled neurons are abundant and are innervated by both enkephalin– and GABA–immunolabeled axon terminals. Brain Research, 816, 58–67. [ Links ]
Currie, P. J., Braver, M., Mirza, A. & Sricharoon, K. (2004). Sex differences in the reversal of fluoxetine–induced anorexia following raphe injections of 8–OH–DPAT. Psychopharmacology, 172, 359–364. [ Links ]
Currie, P. J., Coscina, D. V. & Fletcher, P. J. (1998). Reversal fenfluramine and fluoxetine anorexia by 8–OH–DPAT is attenuated following raphe injections of 5,7–dyhidroxytryptamine. Brain Research, 800(1), 62–68. [ Links ]
De Vries, M. G., Arseneau, L. M., Lawson, M. E. & Beverly, J. L. (2003). Extracellular glucose in rat ventromedial hypothalamus during acute and recurrent hypoglycemia. Diabetes, 52, 2767–2773. [ Links ]
De Vry, J. & Schreiber, R. (2000). Effects of selected serotonin 5–HT1 and 5–HT2 receptor agonists on feeding behavior: possible mechanisms of action. Neuroscience and Biobehavioral Reviews, 24, 341–353. [ Links ]
Dourish, C. T., Hutson, P. H. & Curzon, G. (1985). Characteristics of feeding induced by serotonin agonist 8–hydroxy–2(di–n–propylamino)tetralin (8–OH–DPAT). Brain Research Bulletin, 15, 377–384. [ Links ]
Dourish, C. T., Hutson, P. H., Kennett, G. A. & Curzon, G. (1986). 8–OH–DPAT–Induced hyperphagia: Its neural basis and possible therapeutic relevance. En: N. Stilianos (Ed.). Serotoninergic system, feeding and body weight regulation (pp. 127–140). London: Academic Press. [ Links ]
Escartín, P. R. E., Cruz, M. A. M, Tejas, J. J. G., Cendejas, T. N. M., López, A. V. E., González, H. B., et al. (2009). Monoaminas, endocanabinoides y GABA: comprendiendo los mecanismos neuroquímicos del control de la conducta alimentaria. En A. López & K. Franco (Eds.), Comportamiento alimentario. Una perspectiva multidisciplinaria (pp. 251–277).Guadalajara, México: Editorial Universitaria. [ Links ]
Fletcher, P. J. & Paterson, A. I. (1989). A comparison of the effects of tryptamine and 5–Hydroxytrypatmine on feeding following injection into the paraventricular nucleus of the hypothalamus. Pharmacology, Biochemistry and Behavior, 32, 907–911. [ Links ]
Gao, P., Harvey, M., Mook, G. & Zeigler P. (1998). A "pre–satiety sequence" in rats drinking sucrose solutions. Physiology and Behavior, 65(2), 355–359. [ Links ]
Garattini, S., Mennini, T., Bendotti, C., Invernizzi, R. & Samanin, R. (1986). Neurochemical mechanisms of action of drugs which modify feeding via the serotoninergic system. En: N. Stilianos (Ed.). Serotoninergic system, feeding and body weight regulation (pp. 15–38). London: Academic Press. [ Links ]
Gradison, L. & Guidotti, A. (1977). Stimulation of intake muscimol and β–endorphin. Neuropharmacology, 16, 533–536. [ Links ]
Grasby, P. M., Sharp, T., Allen, T. & Grahame–Smith, D. G. (1992). The putative 5–HT1A antagonist BMY 7378 blocks 8–OH–DPAT–induced changes in local cerebral glucose utilization in the conscious rat. Neuropharmacology, 31, 547–551. [ Links ]
Haldford, J. C. G. & Blundell, J. E. (1996). The 5–HT1B receptor agonist CP–94,253 reduces food intake and preserves the behavioural satiety sequences. Physiology and Behaviour, 60(3), 933–939. [ Links ]
Haldford, J. C. G., Wanninayake, C. D. & Blundell, J. E. (1998). Behavioral satiety sequences (BSS) for the diagnosis of drug action on food intake. Pharmacology, Biochemistry and Behavior, 61(2), 159–168. [ Links ]
Hetherington, A. W. & Ranson, S. W. (1942).The relation of various hypotalamic lesions to adiposity in the rat. The Journal of Comparative Neurology, 76, 475–499. [ Links ]
Hewitt, K. N., Lee, M. D., Dourish, C. T. & Clifton, P. G. (2002). Serotonin 2C receptor agonists and the behavioural satiety sequence in mice. Pharmacology Biochemistry and Behavior, 71, 691–700. [ Links ]
Hikiji, K., Inoue, K., Iwasaki, S., Ichihara, K. & Kiriike, N. (2004). Local perfusion of mCPP into ventromedial hypothalamic nucleus, but not into lateral hypothalamic area and frontal cortex, inhibits food intake in rats. Psychopharmacology, 174, 190—196. [ Links ]
Hoyer, D., Hannon, J. & Martin, G. (2002). Molecular, pharmacological and functional diversity of 5–HT receptors. Pharmacology Biochemistry and Behavior, 71, 533–554. [ Links ]
Hutson, P. H., Dourish, C. T. & Curzon, G. (1988). Evidence that the hyperphagic response to 8–OH–DPAT is mediated by 5–HT1 receptors. European Journal of Pharmacology, 150, 361–366. [ Links ]
Jhanwar–Uniyal, M.; Moorjani, B & Kahn, A. H. (1994). Indications of pre– and post–synaptic 5–HT1A receptor interactions in feeding behavior and neuroendocrine regulation. Brain Research, 646, 247–257. [ Links ]
Kamatchi, G. L., Veeraragavan, K., Chandra, D. & Bapna, J. S. (1986). Antagonism of acute feeding response to 2–deoxyglucose and 5–thioglucose by GABA antagonists. The relative role of ventromedial and lateral hypothalamus. Pharmacology Biochemistry and Behavior, 25, 59–62. [ Links ]
Kelly, J. & Grossman, S. P. (1979). GABA and hypothalamic feeding systems. Topographic analisys of the effects of microinjections of muscimol. Physiology and Behavior, 23, 1123–1134. [ Links ]
Kennedy, G. C. (1950). The hypothalamic control of food intake in rats. Proceedings of the Royal Society of London. Series B, Biological Sciences, 137, 535–549. [ Links ]
Kitchener, S. J. & Dourish, C. T. (1994). An examination of the behavioural specificity of hypophagia induced by 5–HT1B, 5–HT1C and 5–HT2 receptor agonist using post–prandial satiety sequence in rats. Psychopharmacology, 113(3–4), 369–377. [ Links ]
Lee, J. G., Choi, I. S., Park, E. J., Cho, M. G., Lee, M. G., Choi, B. J. et al. (2007). β2–adrenoreceptor–mediated facilitation of glutamatergic transmission in rat ventromedial hypothalamic neurons. Neuroscience, 144, 1255–1265. [ Links ]
Leibowitz, S. F. & Alexander, J. T. (1998). Hypothalamic serotonin in control of eating behavior, meal size, and body weight. Biological Psychiatry, 44, 851–864. [ Links ]
Leibowitz, S. F., Alexander J. T., Cheung, W. K. & Weiss, G. F. (1993). Effects of serotonin and the serotonin blocker metergoline on meal patterns and macronutrient selection. Pharmacology Biochemistry and Behavior, 45, 185–194. [ Links ]
Leibowitz, S. F.; Weiss, G. F., Suh, J. S. (1990). Medial hypothalamic nuclei mediate serotonin's inhibitory effect on feeding behavior. Pharmacology Biochemistry and Behavior, 37, 735–742. [ Links ]
Li, Q., Battaglia, G., & Van de Kar, L. D. (1997). Autoradiographic evidence for differential G–protein coupling of 5–HT1A receptors in rat brain: lack of effect of repeated injections of fluoxetine. Brain Research, 769, 141–151. [ Links ]
Li, Q., Muma, N. A., Battaglia, G. & Van de Kar L. D. (1997). A desensitization of hypothalamic 5–HT1A receptors by repeated injections of paroxetine: reduction in the levels of Gi and Go proteins and neuroendocrine responses, but not in the density of 5–HT1A receptors. The Journal of Pharmacology and Experimental Therapeutics, 282, 1581–1590. [ Links ]
López, A. V. E., Mancilla D. J. M., Durán, D. A., Escartín, P. E. R., Cobos, Z. G. & Garfias, M. M. (2000). Efectos de la administracion central de agonistas GABAérgicos sobre la microestructura de la conducta alimenticia. Estudio experimental en ratas. Revista de Sanidad Militar, 54, 279–284. [ Links ]
López, A. V. E.,Mancilla D. J. M., & Escartín, P. E. R. (2002). Secuencia de saciedad conductual: un análisis de la conducta de alimentación. Revista Mexicana de Análisis de la Conducta, 28(2), 131–144. [ Links ]
López, A. V. E., Mancilla, D. J. M., Rito, D. M., González, B. & Escartín, P. R. E. (2007). The effects of 5–HT1A and 5–HT2C receptor agonists on behavioral satiety sequence in rats. Neuroscience Letters, 416, 285–288. [ Links ]
Luo, S., Ransom, T. & Li, E. (1990). Selective increase in carbohydrate intake by rats treated with 8–Hydroxy–2–(di–n–propilamino)–tetraline or buspirone. Life Science, 46, 1643–1648. [ Links ]
Mancilla, D. J. M, Escartín, P. R. E, López, A. V. E. & Camacho, R. E. J (2006). Psicobiología de la alimentación. En J. M. Mancilla & G. Gómez (Eds.). Trastornos alimentarios en Hispanoamérica(pp. 229–250). Manual Moderno: México. [ Links ]
Mayer, J. (1955). Regulation of energy intake and the body weight: the glucostatic theory and the lipostatic hypothesis. Annals of New York Academy of Science, 63, 15–43. [ Links ]
McGuirk, J., Muscat, R. & Willner, P. (1992). Effects of the 5–HT uptake inhibitors, femoxetine and paroxetine, and a 5–HT1A/B agonist, eltoprazine, on the behavioural satiety sequence. Pharmacology, Biochemistry and Behavior, 41, 801–805. [ Links ]
Nishimura, F., Nishihara, M., Torii, K. & Takahashi, M. (1996). Changes in responsiveness to serotonin on rat ventromedial hypothalamic neurons after food deprivation. Physiology and Behavior, 60, 7–12. [ Links ]
Park, S., Harrold, J. A., Widdowson, P. S. & Williams, G. (1999). Increased binding at 5–HT1A, 5–HT1B, and 5–HT2A receptors and 5–HT transporters in diet–induced obese rats. Brain Research, 847, 90–97. [ Links ]
Paxinos, G. & Watson, Ch. (1986). The rat brain in stereotaxic coordinates. Nueva York, NY, EE.UU.: Academic Press. [ Links ]
Poeschla, B., Gibbs, J., Simansky, K. J. & Smith, G. P. (1992). The 5–HT1A agonist 8–OH–DPAT attenuates the satiating action of Cholecystokinin.Pharmacology Biochemistry and Behavior, 42, 541–543. [ Links ]
Routh; V. H. (2002). Glucose–sensing neurons: Are they physiologically relevant? Physiology and Behavior, 76, 403–413. [ Links ]
Samanin, R. & Grignashi, S. (1996). Role 5–Hydroxytriptamine receptor subtypes in satiety and animal models of eating disorders. En: S. J. Cooper & P. G. Clifton (Eds.). Drug receptor subtypes and ingestive behaviour (pp 39–58). London: Academic Press. [ Links ]
Schreiber, R. & De Vry; J. (2002). Role of 5–HT2C receptors in the hypophagic effect of m–CPP, ORG 37684 and CP–94,253 in the rat. Progress in Neuro–Psychopharmacology and Biological Psychiatry, 26, 441–449. [ Links ]
Schreiber, R., Selbach, K., Asmussen, M., Hesse, D. & De Vry; J. (2000). Effects of serotonin1 / 2 receptor agonists on dark–phase food and water intake in rats. Pharmacology Biochemistry and Behavior, 67, 291–305. [ Links ]
Simansky, K. J. & Vaidya, A. H. (1990). Behavioural mechanisms for the anorectic action of the serotonin (5–HT) uptake inhibitor sertraline in rats: comparison with directly acting 5–HT agonist. Brain Research Bulletin, 25, 953–960. [ Links ]
Song, Z., Levin, B., McArdle, J. J., Bakhos, N. & Routh, V. H. (2001). Convergence of pre– and postsynaptic influences on glucosensing neurons in the ventromedial hypothalamic nucleus. Diabetes, 50, 2673–2681. [ Links ]
Stenger, J., Fournier, T. & Bielajew, C. (1991). The effects of chronic ventromedial hypothalamic stimulation on weight gain in rats. Physiology and Behavior, 50, 1209–1213. [ Links ]
Vickers, S. ., Clifton, P. G., Dourish C. T. & Tecott L. H. (1999). Reduced satiating effect of d–fenfluramine in serotonin 5–HT2C receptor mutant mice. Psychopharmacology, 143, 309–314. [ Links ]
Voigt, J. P., Nwaiser, B., Rex, A., Mayer, Ch. & Fink, H. (2004). Effect of 5–HT1A receptor activation on hypothalamic glucose. Pharmacological Research, 50, 359–365. [ Links ]
Weiss, G. F., Rogacki, N., Fueg, A., Buchen, D., Suh, J. S., Wong, D. T., et al. (1991). Effect of hypothalamic and peripheral fluoxetina injection on natural patterns of macronutrient intake in the rat. Psychopharmacology, 105, 467–476. [ Links ]
Wirstshafter, D. (2001). The control of ingestive behavior by the median raphe nucleus. Appetite, 36, 99–105. [ Links ]
Wurtman, J. D. & Wurtman, R. J. (1977). Fenfluramine and fluoxetine spare protein consumption while suppressing caloric intake by rats. Science, 198, 1178–1180. [ Links ]
Wurtman, J. D. & Wurtman, R. J. (1979 a). Drugs that enhance serotonergic transmission diminish elective carbohydrate consumption by rats. Life Sciences, 24, 895–904. [ Links ]
Wurtman, J. D. & Wurtman, R. J. (1979 b). Fenfluramine and other serotonergic drugs depress food intake and carbohydrate consumption while sparing protein consumption. Current Medical Research Opinion, 6 (Suppl. I), 28–33. [ Links ]
Ziegler, D. R., Cullinan, W. E. & Herman, J. P. (2002). Distribution of vesicular glutamate transporter mRNA in rat hypothalamus. The Journal of Comparative Neurology, 448, 217–229. [ Links ]
Nota
Proyecto financiado por DGAPA, PAPIIT IN309008. Contribución de los autores: López ABCDEF, Mancilla ABCDEFG, Rito ABCDEF, Jiménez BF, Díaz BF, donde: A = Diseño de Estudio, B = Recolección de Datos, C = Análisis Estadístico, D = Interpretación de Datos, E = Preparación de Manuscrito, F = Búsqueda Bibliográfica, G = Gestión de Financiamiento.














