Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de análisis de la conducta
Print version ISSN 0185-4534
Rev. mex. anál. conducta vol.35 spe México Sep. 2009
Caracterización de la conducta alimentaria inducida por Agonistas 5–HT1A, 5–HT1B, 5–HT2A y 5–HT2C
Characterization of the feeding behavior induced by agonists 5–HT1A, 5–HT1B, 5–HT2A and 5–HT2C
Verónica Elsa López–AlonsoABCDEF, Juan Manuel Mancilla–DíazABCDEFG, Melissa Rito–DomingoBF, Rodrigo Erick Escartín–PérezACDE, Armando Giovanni Jiménez–FujarteBF 1
Universidad Nacional Autónoma de México, Facultad de Estudios Superiores Iztacala, Laboratorio de Psicobiología de la Alimentación
1 Correspondencia:
Juan Manuel Mancilla–Díaz,
Laboratorio de Psicobiología de la Alimentación,
UNAM FES–Iztacala. Av. de los Barrios
#1, Los Reyes Iztacala,
Tlalnepantla Edo. de México. CP 54090.
Tel. + 52(55) 56231298, ext. 410, 409 y 457.
Fax: +52(55) 5390 7604.
Correo electrónico: jmmd@servidor.unam.mx.
Contribución de los autores:
A = diseño de estudio,
B = recolección de datos,
C = análisis estadístico,
D = interpretación de datos,
E = preparación de manuscrito,
F = búsqueda bibliográfica,
G = gestión de financiamiento.
Recibido: 23 de marzo de 2009
Revisado: 14 de mayo de 2009
Aceptado: 1° de julio de 2009
Resumen
El presente estudio examinó los efectos de los agonistas de los receptores 5–HT1A/1B/ 2A y 2C sobre la Secuencia de Saciedad Conductual (SSC) en ratas. El 8–OH–DPAT (agonista 5–HT1A), CP–93129 (agonista 5–HT1B), SB242084+DOI (antagonista 5–HT2C + agonista 5–HT2A) y Ro–60–0175 (agonista 5–HT2C), fueron inyectados en el núcleo paraventricular hipotalámico (NPH) de ratas. Las ratas fueron mantenidas bajo un paradigma de alimentación ad libitum con acceso a agua y fuentes individuales de proteínas, carbohidratos y grasas. La administración intra–NPH de cada agonista fue asociada con un decremento del consumo de carbohidratos. El análisis conductual indicó que la administración de CP–93129 y SB242084+DOI interrumpió la SSC natural al incrementar las conductas no alimentarias mientras que el 8–OHDPAT y Ro 600175 promovieron el desarrollo natural de la SSC. En conclusión, los agonistas 5–HT afectaron el control serotoninérgico de la conducta alimentaria a través de vías selectivas.
Palabras clave: agonistas 5–HT, ingesta de alimento, Secuencia de Saciedad Conductual.
Abstract
The present study examined the effects of 5–HT1A/1B/2A2C receptor agonists on behavioral satiety sequences in rats (BSS). The 8–OH–DPAT (5–HT1A receptor agonist), CP–93129 (5–HT1B receptor agonist), SB242084+DOI (5–HT2C receptor antagonist + 5–HT2A receptor agonist), and Ro–60–0175 (5–HT2C receptor agonist) were injected into the paraventricular nucleus (PVN) of rats. The animals were maintained on an ad libitum feeding paradigm with access to water and individual sources of protein, carbohydrate, and fat. Intra–PVN administration of each agonist was associated with decreased carbohydrate consumption. Behavioral analysis indicated that administration of CP–93129 and SB242084+DOI interrupted the natural BSS with an increase in non–feeding behavior whereas the 8–OH–DPAT and Ro 600175 alone promoted early development of the natural BSS. In conclusion, the 5–HT receptor agonists affected serotonergic modulation of feeding behavior in a functionally selective way.
Keywords: 5–HT agonist — food intake — behavioral satiety sequences.
El sistema serotoninérgico al ser estimulado periférica o centralmente promueve la saciedad (Halford & Blundell, 1996; Hewitt, Lee, Dourish & Clifton, 2002; Kitchner & Dourish, 1994; Leibowitz & Alexander, 1998; Leibowitz, Weiss & Suh, 1990). La estimulación de esta monoamina reduce la ingesta de alimento y el peso corporal en animales y humanos. Las primeras evidencias fueron presentadas por Wurtman y Wurtman (1977, 1979a,b), al administrar agentes que favorecen la disponibilidad de 5–HT, sus resultados sugirieron que el efecto anoréxico sobre la ingestión de carbohidratos era dependiente de mecanismos serotoninérgicos. Posteriormente se demostró que la administración central de agentes 5–HT producen el mismo fenómeno, al inicio de la fase oscura del ciclo natural de luz/oscuridad (Leibowitz, Alexander, Cheung & Weiss, 1993). Particularmente se ha establecido que los subtipos 5–HT1B 5–HT2A y 5–HT2C inducen hipofagia (Schreiber & De Vry, 2002; Shcriber, Selbach, Asmussen, Hesse & De Vry, 2000) en tanto que la estimulación del subtipo 5–HT1A produce hiperfagia (Currie, Coscina & Fletcher, 1998).
Los efectos de los agonistas 5–HT1A son sensibles a las condiciones experimentales y dosis–dependientes, pudiendo también inducir un efecto hipofágico (De Vry & Schreiber, 2000; Wirtshafter, 2001). Las evidencias indican que la estimulación de los receptores 5–HT1A induce efectos bifásicos sobre el consumo de alimento (Schreiber et al., 2000; Wirtshafter, 2001). En tanto que los fármacos con alta afinidad por los receptores 5–HT1B como el RU24969 y el CP94253 reducen la ingesta de alimento (Lee, Aloyo, Fluharty & Simansky, 1998; Lee, Kennett, Dourish & Clifton, 2002; Park, Harrold, Widdowson & Williams, 1999). Por otro lado los receptores 5–HT2A se han asociado a la reducción de la ingesta de alimento (Hewitt et al., 2002). Los efectos hipofágicos inducidos por el DOI (agonista 5–HT2A/2C) se han reportado bajo diferentes paradigmas (De Vry et al., 2000). Los resultados de un estudio en nuestro laboratorio apoyan la hipótesis de que se requiere de la estimulación de los receptores 5–HT2A/2C para la expresión total de la hipofagia inducida por la administración intrahipotalámica de 5–HT (Mancilla, Escartín & López, 2006). Con respecto a la activación de los receptores 5–HT2C se ha relacionado con el efecto hipofágico y control del peso corporal. La administración del Ro 600175 (agonista de los receptores 5–HT2C), en el NPH y en el núcleo hipotalámico ventromedial se ha reportado reduce la ingesta de alimento (Grottick, Fletcher & Higgins, 2000; Hikiji, Inoue, Iwasaki, Ichihara & Kiriike, 2004).
La investigación de la conducta alimentaria ha mostrado que después de la ingestión de alimento se presenta una secuencia característica, que muestra un patrón altamente estereotipado que se ha denominado como secuencia de saciedad conductual (SSC). Y se define como la progresión ordenada de las conductas de alimentación, acicalamiento y descanso. La transición ordenada de las conductas es un reflejo del proceso de saciedad pospandrial. La hipofagia inducida por la administración de fármacos serotoninérgicos ha sido atribuida a efectos sobre la saciedad. Sin embargo, el análisis de la SSC ha sugerido que los agonistas 5–HT, como por ejemplo el DOI, interrumpen la SSC por hiperactividad, el MK–212 produce sedación, el TFMPP y mCPP incrementan la actividad sin interrumpir el desarrollo de la SSC. La interrupción de la SSC da cuenta de que la reducción de la ingesta de alimento se debe a mecanismos diferentes a la saciedad (Halford, Wanni–nayake & Blundell, 1998).
Aunque está bien establecido que los agonistas de los receptores serotoninérgicos con alta o moderada afinidad a los subtipos 5–HT1 y/o 5–HT2 afectan la ingestión de alimento, no es claro el papel de los diferentes subtipos sobre el mecanismo conductual de la conducta alimentaria. Los efectos hipofágicos inducidos por la administración de fármacos serotoninérgicos típicamente han sido atribuidos a la saciedad, sin establecer si los fármacos preservan el desarrollo de la secuencia de saciedad normal o reducen la alimentación por mecanismos conductuales no específicos. Para caracterizar la contribución que tiene cada uno de los receptores 5–HTérgicos sobre el control de la ingestión de alimentos y su relación con los diversos mecanismos conductuales, incluyendo los efectos sobre la saciedad, es necesario realizar estudios farmacológicos con metodologías de investigación acordes a la naturaleza compleja de la conducta alimentaria. Dado lo anterior, el objetivo general de la presente investigación fue determinar el papel de la estimulación de los subtipos de receptores 5–HT1A, 5–HT1B, 5–HT2A y 5–HT2C del núcleo paraventricular hipotalámico (NPV) sobre la ingesta de alimento y secuencia de saciedad conductual.
MÉTODO
Sujetos
Se utilizaron 50 ratas macho de la cepa Wistar de 200–230 g al inicio del experimento. Los animales fueron provistos por el Bioterio de la FES –Iztacala, UNAM. Todos los procedimientos del presente estudio fueron realizados de acuerdo a la Norma Oficial Mexicana (NOM–062–ZOO–1999), Especificaciones Técnicas para la Producción, Cuidado y Uso de Animales de Laboratorio.
Dietas
Hidratos de carbono (harina de maíz Maseca, maíz nixtamalizado, Molinos Azteca de Chalco SA de CV, planta Teotihuacan), proteínas (proteína aislada de soya 91.5% marca Supro 500 E, distribuido por Protein Technologies International, SA de CV, Checkerboard Square, St. Louis, MO), grasas (manteca vegetal Inca. Elaborado por Anderson Clayton & Co. SA de CV, Tultitlán, Estado de México). El agua fue enriquecida con Vitater, un suplemento vitamínico (hecho en México por Laboratorio Maver).
Fármacos
Los fármacos utilizados fueron: 2,5–Dimetoxi–4–iodoamphetamina (DOI agonista 5–HT2A también activa receptores 5–HT2C, 7.2 Mg/0.5Ml); 8–hidroxi–2–(din–propilamino)tetralina (8–OH–DPAT agonista selectivo 5–HT1A, 0.5 Mg/0.5Ml); 5–H–Pirrolo[3,2–b]piridina–5–uno, 1,4–dihidro–3–(1,2,3,6–tetrahidro–4–piridinila] (CP–93129 agonista selectivo 5–HT1B, 7.5 Mg/0.5Ml); (S)–2–(6–cloro–5–fluoroin–dol–1–yl)–1–metiletilamina (Ro 60–0175, agonista 5–HT2C 3µg/0.5µl), 6–cloro–5 –metil–1–[2–(2metilpiridil–3–oxi)–pirida–5–il carbamoil] indolina (SB–242084 antagonista selectivo 5–HT2C, 0.50 µg/0.5µl). Estos fármacos fueron adquiridos con Sigma Chemical Co., St. Louis, MO. Todos los fármacos fueron infundidos a una velocidad de µl/3min en el núcleo paraventricular hipotalámico (NPVH). Para asegurar una difusión completa de las sustancias el microin–yector permaneció un minuto adicional dentro de la cánula guía, luego fue retirado. La administración de los fármacos se realizó con una jeringa digital para fluidos de alta precisión (Hamilton Co., Reno, NV).
Cirugía estereotáxica
Los animales fueron anestesiados con hidrato de cloral (350mg/kg). Una vez anestesiados, se Ajaron a un estereotáxico y se les implantó una cánula 2 mm por arriba del NPH del lado derecho. Las coordenadas sugeridas se tomaron del Atlas Estereotáxico de Paxinos y Watson (1986). Las coordenadas fueron corregidas previamente por ensayo y error en un grupo piloto, inyectando azul de metileno a través de la cánula guía hasta teñir el NPH. Posterior a la corrección, las coordenadas fueron las siguientes: posterior a bregma –1.30 mm; lateral a la línea media 0.4 mm y de profundidad a partir de dura madre –6.4 mm. Finalmente se aplicaron 50.000 u/kg, im de penicilina benzatínica para prevenir infecciones.
Procedimiento
Se colocaron las ratas de manera aleatoria en cajas habitación, individuales, cada una de ellas con tres comederos y mantenidas en un ciclo invertido de luz–oscuridad de 12x12 hr con libre acceso a agua y comida. Los animales se pesaron a las 8:00 hr, una hora antes de iniciar el ciclo de oscuridad (9:00 hr). Las ratas estuvieron bajo un régimen de autoselección dietaria de carbohidratos, proteínas y grasas en comederos independientes. El orden de presentación de los comederos se cambio diariamente de acuerdo a un orden preestablecido, para evitar "preferencia de lugar". Estas condiciones permanecieron durante toda la investigación.
Diez días después, bajo las condiciones anteriores los animales fueron sometidos a cirugía estereotáxica. Después de cuatro días, posterior a la cirugía (periodo de recuperación), los animales fueron asignados aleatoriamente a cinco grupos de diez animales cada uno (control, 8–OH–DPAT, CP–93129, SB242084+DOI, Ro 60–0175). Las ratas fueron inyectadas dentro de NPH con salina seguida por salina (control), salina seguida de 8–OH–DPAT (8–OH–DPAT), salina seguida por CP–93129 (CP–93129), salina seguida por Ro 60–0175 (Ro 60–0175) y un grupo en el que se utilizó el pretratamiento del antagonista SB242084 seguida de DOI (SB242084+DOI) con la finalidad de tener la sola actividad de los receptores 5–HT2A. A todos los animales se les administraron dos inyecciones dentro del NPH, el tiempo entre una y otra administración fue de diez minutos. Una vez iniciado el periodo de oscuridad se realizó un registro de duración continua de 60 min, al Analizar el registro se pesaron y rellenaron los comederos (cuidando de recolectar lo que cayera del comedero) para determinar el consumo de alimento. Todas las sesiones se filmaron a través de una cámara de circuito cerrado para bajas intensidades de luz, para realizar el registro de duración continua. Esto se realizó desde un cuarto contiguo para no interferir la conducta de los sujetos experimentales.
Medidas conductuales
Para realizar el análisis de la secuencia de saciedad conductual (SSC), los 60 minutos de registro continuo fueron divididos en 12 segmentos de 5 minutos cada uno y se analizaron considerando las siguientes categorías conductuales: ingesta (definida como el tiempo en segundos que dedican las ratas para alimentarse), descanso (tiempo en segundos en el que las ratas permanecen inactivas con cabeza en el piso) y actividad (tiempo en segundos que dedican para desplazarse, acicalarse, husmear, levantarse sobre las patas traseras, etc. dentro de la caja–habitación).
Histología
Al Analizar las observaciones, los animales fueron perfundidos intracardialmente, primero con solución isotónica de NaCl al 0.9 % y luego con formalina al 10.0 %, para la remoción del cerebro, el cual se mantuvo 7 días en formol al 10.0 %. Posteriormente se realizaron cortes histológicos coronales de 70 µm de espesor con un vibratomo, para luego teñirlos con la técnica de Nissl y poder así verificar el sitio de implantación de la cánula.
Análisis de resultados
Posterior a la verificación del sitio de implantación (figura 1), los grupos quedaron conformados de la manera siguiente: grupo control (n=9), grupo 8–OH–DPAT (n=8), grupo CP–93129 (n=8), grupo SB242084+DOI (n=7) y grupo Ro 60–0175 (n=7).

Cada unidad de análisis (ingestión de proteínas, carbohidratos y grasas), se analizó empleando un análisis de varianza de una vía (ANOVA) y la comparación por pares se hizo con la prueba de Tukey. Los parámetros de ingesta, actividad y descanso se analizaron con la prueba estadística ANOVA de dos vías con medidas repetidas (los factores fueron grupo x periodo, con medidas repetidas en periodo). Cuando la prueba de esfericidad de Mauchly rechazó la hipótesis de esfericidad, se optó por la estimación de Greenhouse–Geisser.
Para la comparación por pares se utilizó la prueba de Bonferroni para el factor periodo. Y para comparar el factor grupo se utilizó la prueba de Dunnett. El criterio estadístico para significancia fue p < .05. El procesamiento estadístico se llevó a cabo con el paquete denominado SPSS (Versión 13.0 para Windows).
RESULTADOS
Ingestión
El análisis reveló diferencias significativas [F(4,34)= 4.258, p<.05] en la ingestión de carbohidratos. La comparación por pares (Tukey) indicó que la administración de 8–OH–DPAT, CP93129, SB242084+DOI y Ro 60–0175 disminuyó) significativamente la ingestión de carbohidratos, en comparación con el grupo control (figura 2). En la ingestión de proteínas y grasas no se encontraron efectos significativos por efecto de las inyecciones intrahipotalámicas.

Duración de ingesta
Cuando la duración de la conducta ingesta fue analizada (figura 3A), se encontraron diferencias en el factor periodo [F(4.813, 19.251)= 5.47, p<.01]. La comparación por pares indicó una disminución significativa del tiempo dedicado a ingerir alimento entre los periodos 1 vs. 12 y 2 vs. 11 y 12. Este resultado es consistente con el patrón conductual, ya que se espera que en los periodos iniciales el tiempo dedicado a ingerir alimento sea mayor y vaya declinando a través del tiempo. No se encontraron diferencias significativas en el factor grupo y en la interacción. Sin embargo, en la figura 3A se puede apreciar que los grupos experimentales dedican menos tiempo para alimentarse en relación al grupo control.
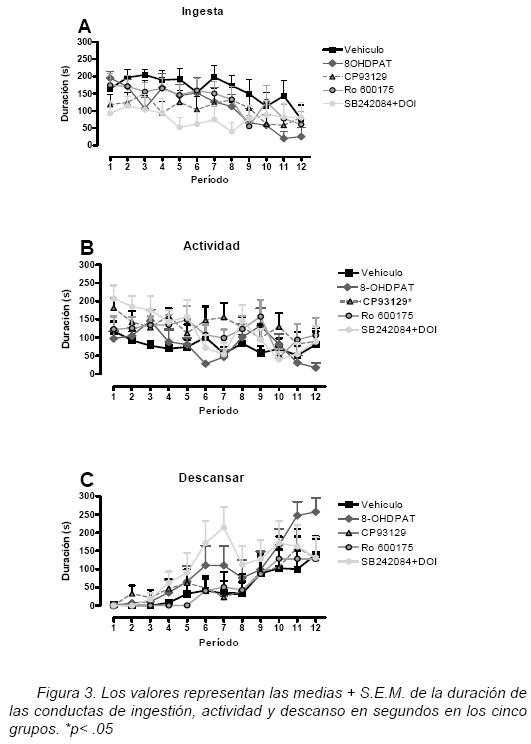
Duración de la actividad
Al analizar la duración de la conducta de actividad (figura 3B) se encontraron diferencias significativa en el factor periodo [F(6.55, 26.21)= 4.48, p<.01] y el factor grupo [F(4,34)= 2.77, p<.05], no encontrado diferencias significativas en la interacción. La comparación por pares (Bonferroni) indicó una disminución significativa del tiempo (periodo) dedicado a ingerir alimento entre los periodos 1 vs. 7 y 10–11. Aunque la actividad va disminuyendo a través del tiempo, este resultado no concuerda con el patrón conductual esperado ya que en los primeros periodos la actividad debe ser reducida debido a que es prioritaria la conducta alimentaria. En la figura 3B se puede apreciar que los grupos experimentales incrementan la actividad en comparación con el grupo control desde el inicio de la prueba. En el caso del factor grupo la comparación por pares (Dunnett) señaló un aumento significativo de la actividad entre el grupo control y el grupo CP–93129.
Duración de descansar
Al analizar la duración de la conducta de descansar (figura 3C) se encontraron diferencias significativa en el factor periodo [F(2.87, 11.49)= 15.74, p<.01]. La comparación por pares (Bonferroni) indicó un incremento del tiempo dedicado a descansar entre los periodos iniciales comparados con los últimos (periodos 1–5 vs. períodos 6,7 y 9–11). Este resultado es consiste con el patrón conductual ya que se espera que los sujetos experimentales después de alimentarse, pasen a otras actividades y posteriormente descansen. Sin embargo, aunque el incremento de la conducta de descanso a través del tiempo fue la esperada en el caso de los grupos experimentales, se observó que dedican más tiempo en comparación con el grupo control. No encontrando diferencias significativas en el factor grupo y en la interacción.
Secuencia de Saciedad Conductual
El grupo control muestra un desarrollo ordenado de la SSC, es decir conducta de ingesta (figura 4A), seguida de la presencia de otras conductas y posteriormente el descanso. La transición entre la conducta de alimentarse y el descanso para este grupo se observó entre los periodos 11 y 12.
La administración del agonista 5–HT1A 8–OHDPAT (figura 4B) produjo el desarrollo temprano de la SSC. En cuanto a la transición de la conducta de alimentarse y el descanso se observó un desplazamiento a la izquierda (entre los periodos 8 y 9), al compararse con el grupo control. La presencia de conductas activas se eleva al ser comparado con el grupo control en los periodos 3, 7 y 8.
La administración del agonista 5–HT1B CP 93129 (figura 4C) produjo el desarrollo temprano de la SSC. En cuanto a la transición de la conducta de alimentarse y el descanso se observó un desplazamiento a la izquierda (periodo 9), al compararse con el grupo control. La presencia de conductas activas es elevada desde el inicio del registro, manteniéndose por arriba de la conducta de alimentarse y el desarrollo temprano del descanso. Este patrón sugiere que el efecto anoréxico inducido por este fármaco puede deberse a la interrupción de la SSC por hiperactividad.
El grupo que recibió el agonista 5–HT2C RO600175 (figura 4D) preservó la SSC. La transición de la conducta de alimentarse y de descanso se desplazó a la izquierda (entre los periodos 8 y 9) en comparación con el grupo control, lo cual indica que el efecto anoréxico inducido por este fármaco se debe al desarrollo temprano de la SSC.
La SSC en el grupo al que se le administró el SB242084+DOI (figura 4E), no produjo el patrón típico de la SSC. La presencia de conductas activas es elevada desde el inicio del registro, seguida de la conducta de alimentarse y el desarrollo temprano del descanso. El periodo de transición de la ingesta y el descanso se localizó entre los periodos 4 y 5, en comparación al grupo control el desplazamiento fue hacia la izquierda. Este patrón sugiere que el efecto anoréxico se debe a la interrupción de la SSC por hiperactividad; la duración de la actividad es más alta que la duración de la conducta de ingesta.
En tres de los grupos experimentales se puede observar el inicio temprano de la conducta de descanso en comparación al grupo control (periodo 5), en el grupo 8–OHDPAT se presentó en el periodo 4, en el SB242084+DOI en el periodo 3 y en el CP 93129 en el periodo 2. En los 4 grupos experimentales se presentó la tendencia a incrementar la conducta de actividad incluso en los grupos CP 93129 y en el SB242084+DOI se sugiere la interrupción de la SSC por hiperactividad.
DISCUSIÓN
En la presente investigación, la administración de los agonistas 5–HT en el NPH redujo la ingestión de alimento, particularmente inhibiendo la ingestión de carbohidratos. Los estudios en roedores indican que bajas dosis de 5–HT o de fármacos que incrementan la liberación de la 5–HT inhiben de forma preferencial la ingesta de carbohidratos (Wurtman & Wurtman, 1977, 1979a,b). Este fenómeno es mediado en parte por receptores 5–HT localizados en varios núcleos del hipotálamo medio. Leibowitz et al. (1998) reportaron que la administración de 5–HT en el NPH reduce la ingestión de carbohidratos al inicio del periodo natural de alimentación.
El análisis de la SSC indica que el grupo control desarrolló una progresión ordenada de la conducta alimentaria, es decir, los sujetos comen, presentan conductas activas y posteriormente descansan, patrón estereotipado que se ha descrito en investigaciones previas, y que se considera como un indicador de la saciedad (Gao, Harvey, Mook & Zeigler, 1998; Halford et al., 1998; Mc–Guirk, Muscat & Willner, 1992; Vickers, Clifton, Dourish & Tecott, 1999). La reducción de la ingesta de alimento debida a la administración del 8–OHDPAT (agonista 5–HT1A) se acompañó por un incremento moderado de la actividad y el desarrollo temprano de las conductas de descanso. La reducción de la ingesta de alimento debida a la administración del CP 93129 se caracterizó por el incremento de la actividad y el desarrollo temprano de las conductas de descanso, sugiriendo la interrupción de la SSC. En el caso del Ro 600175 disminuyó la ingesta de alimento, preservando el patrón de desarrollo típico de la SSC. En el grupo pretratado con el 5–HT2C SB242084 + DOI se observó que no hay un desarrollo típico de la SSC.
El análisis de la SSC reveló que la administración de los agonistas 5–HT incrementó la conducta de actividad en los cuatro grupos, pero no en todos los casos este incremento ocasionó la interrupción del patrón típico de la SSC. Estos resultados son consistentes con investigaciones previas en que agonistas 5–HT como el Ro 600175, la RU24969 y el CP 94253 producen un aumento de la actividad sin interrumpir el desarrollo de la SSC (Halford & Blundell, 1996; Halford et al., 1998; Higgins & Fletcher, 2003; Kitchner et al., 1994; Lee & Simansky, 1997). La administración de agonistas 5–HT1A puede activar o inhibir la actividad locomotora dependiendo de las condiciones ambientales bajo las cuales se esté realizando la investigación; en espacios grandes y/o bajo condiciones novedosas la actividad locomotora se inhibe y en espacios pequeños y/o condiciones familiares la actividad se incrementa (Müller, Carey, Huston & De Souza, 2007). En el caso del m–CPP (agonista 5–HT2A/2C) hay reportes de que no incrementa la locomoción pero incrementa la actividad motora no ambulatoria (Abrams et al., 2005). Por otro lado Dalton, Lee, Kennett, Dourish, y Clifton (2004), señalaron que la hiperactividad inducida por el m–CPP se atribuye a la activación de los receptores 5–HT1B, 5–HT2A y 5–HT2B Estos resultados concuerdan con los obtenidos en la presente investigación, la administración de los agonistas 5–HT en el NPH indujo el incremento de la actividad, sin embargo en futuras investigaciones se sugiere considerar si el incremento de la actividad se debe al incremento de la conducta locomotora o a conductas no motoras como acicalarse, rascarse etc. Algunos investigadores sugieren que el aumento de la actividad motora no ambulatoria puede ser reflejo del incremento en el estado de ansiedad, complementariamente los reportes señalan que el sistema serotoninérgico juega un rol importante en la modulación de las respuestas conductuales y fisiológicas relacionadas con la ansiedad (Abrams et al., 2005; Fone & Topham, 2002; Lowry & Moore, 2006). Por lo tanto, el incremento de la actividad al estimular a los receptores 5–HT del NPVH en la presente investigación, posiblemente esté asociado a efectos ansiogénicos inducidos por la administración de los agonistas 5–HT. Probablemente la actividad, no sólo es mediada por el sistema serotoninérgico, sino por un circuito complejo en el que otros sistemas de neurotransmisores también se están activando o inhibiendo, al administrar los agonistas 5–HT en el NPH. La literatura sugiere la existencia de una interacción mutua entre los sistemas serotoninérgico y noradrenérgico del NPVH (Weidenfeld, Feldman, Itzik, Van de Kar & Newman, 2002). Particularmente Leibowitz y Alexander (1998) señalan que la 5–HT puede actuar antagónicamente sobre la noradrenalina a través de los receptores a2–noradrenérgicos. Tanto la administración de serotonina como noradrenalina estimulan la liberación de la hormona liberadora de corticotropina en el hipotálamo activando la vía hipotálamo–pituitaria–adrenales (Feldman, Newman & Weidenfeld, 2000; Leibowitz & Shor–Posner, 1986).
El incremento de la actividad en parte es mediado por el sistema serotoninérgico, parámetro en el cual se encontró un incremento significativo en la presente investigación. Estos resultados pueden constituir una aportación importante para explicar la etiología del patrón reportado en estudios clínicos en humanos, que han asociado el exceso de actividad y ejercicio con desórdenes alimentarios como la anorexia (Kaye, 2008; Shroff et al., 2006). El desbalance de la modulación de la 5–HT es el antecedente de los desórdenes alimentarios, estados premórbidos de ansiedad, estados obsesivos y de rasgos de perfeccionismo en adolescentes. Algunos factores que se han relacionado con el inicio de la anorexia y bulimia nervosa son, entre otros, los cambios gonadales relacionados con la edad en mujeres púberes, los cuales pueden también causar la desregulación del sistema 5–HT. Las presiones sociales, culturales y estresantes pueden también contribuir a la activación de este sistema. Los cambios en la dieta diaria pueden originar el incremento de la transmisión serotoninérgica, creando así un estado de vulnerabilidad. Por lo tanto, los datos de la presente investigación constituyen un aporte importante para el entendimiento de los mecanismos cerebrales y neuroendocrinos que participan en la etiología de la anorexia nerviosa y del patrón conductual asociado a ésta, como es el exceso de actividad y ejercicio al incrementar la actividad 5–HT.
CONCLUSIÓN
Los datos de la presente investigación son una evidencia más del control que ejerce la serotonina sobre la conducta alimentaria. La estimulación de los receptores 5–HT1A, 1B, 2A y 2C bajo ciertas condiciones experimentales inducen hipofagia. Aunque la estimulación de estos receptores indujo hipofagia, cada uno de ellos parece actuar a través de mecanismos conductuales diferentes. Los receptores 5–HT1A y 2C parecen desarrollar una SSC típica. En tanto que los receptores 5–H1B y 5–HT2A inducen hipofagia al interrumpir el desarrollo de la SSC principalmente por hiperactividad. Estos datos sugieren una importante participación de los receptores 5–HT1A 5–HT1B 5–HT2A y 5–HT2C en mecanismos conductuales específicos, regulando la ingestión voluntaria de carbohidratos. Los resultados de la presente investigación constituyen una aportación importante para entender algunos aspectos relacionados a la etiología de trastornos alimentarios como la anorexia nervosa.
Esta investigación fue realizada gracias al financiamiento del Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica de la UNAM , otorgado al Dr. Juan Manuel Mancilla Díaz.
REFERENCIAS
Abrams, J. K., Johnson, P. L., Schmidt, A. H., Mikkelsen, J. D., Shekar, A. & Lowry, A. (2005). Serotonergic systems associated with arousal and vigilance behaviors following administration of anxiogenic drugs. Neuroscience, 133, 983–997. [ Links ]
Currie, P. J., Coscina, D. V. & Fletcher, P. J. (1998). Reversal fenfluramine and fluoxetine anorexia by 8–OH–DPAT is attenuated following raphe injections of 5,7–dyhi–droxytryptamine. Brain Research, 800, 62–68. [ Links ]
Dalton, G. L., Lee, M. D., Kennett, G. A., Dourish, C. T. & Clifton, P. G. (2004). mCPP–induced hyperactivity in 5–HT2C receptor mutant mice is mediated by activation of multiple 5–HT receptor subtypes. Neuropharmacology, 46, 663–671. [ Links ]
De Vry, J. & Screiber, R. (2000). Effects of selected serotonin 5–HT1 and 5–HT2 receptor agonists on feeding behavior: possible mechanisms of action. Neuroscience and Biobehavioral Reviews, 24, 341–353. [ Links ]
Feldman, S., Newman, M. & Weidenfeld, J. (2000). Effects of adrenergic and serotonergic agonists in the amygdala on the hypothalamo–pituitary–adrenocortical axis. Brain Research Bulletin, 52, 531–536. [ Links ]
Fone, K. C. & Topham, I. A. (2002). Alteration in 5–hydroxytryptamine agonist–induced behaviour following a corticosterone implant adult rat. Pharmacology, Biochemistry and Behavior, 71, 815–823. [ Links ]
Gao, P., Harvey, M., Mook, G. & Zeigler P. (1998). A "presatiety sequence" in rats drinking sucrose solutions. Physiology and Behavior, 65, 355–359. [ Links ]
Giorgetti, M. & Tecott, L. (2004). Contributions of 5–HT2C receptors to multiple actions of central serotonin systems. European Journal of Pharmacology, 488, 1–9. [ Links ]
Grottick, A. J., Fletcher, P. J. & Higgins, G. (2000). Studies to investigate the role of 5–ht2c receptors on cocaine –and food– maintained behavior. Journal of Pharmacology and Experimental Therapeutics, 295, 1183–1191. [ Links ]
Haldford, J. C. G. & Blundell, J. E. (1996). The 5–HT1B receptor agonist CP–94,253 reduces food intake and preserves the behavioural satiety sequences. Physiology and Behaviour, 60, 933–939. [ Links ]
Haldford, J. C. G., Wanninayake, C. D. & Blundell, J. E. (1998). Behavioral satiety sequences (BSS) for the diagnosis of drug action on food intake. Pharmacology, Biochemistry and Behavior, 61, 159–168. [ Links ]
Hewitt, K. N., Lee, M. D., Dourish, C. T. & Clifton, P. G. (2002). Serotonin 2C receptor agonists and the behavioural satiety sequence in mice. Pharmacology Biochemistry and Behavior, 71, 691–700. [ Links ]
Higgins, G. A. & Fletcher, P. J. (2003). Serotonin and drug reward: focus on 5–HT2C receptors. European Journal of Pharmacology, 480, 151–162. [ Links ]
Hikiji, K., Inoue, K., Iwasaki, S., Ichihara, K. & Kiriike, N. (2004). Local perfusion of mCPP into ventromedial hypothalamic nucleus, but not into lateral hypothalamic area and frontal cortex, inhibits food intake in rats. Psychopharmacology, 174, 190–196. [ Links ]
Kaye, W. (2008). Neurobiology of anorexia and bulimia nervosa. Physiology and Behavior, 94, 121–135. [ Links ]
Kitchener, S. J. & Dourish, C. T. (1994). An examination of the behavioural specificity of hypophagia induced by 5–HT1B, 5–HT1C and 5–HT2 receptor agonist using post–prandial satiety sequence in rats. Psychopharmacology, 113, 369–377. [ Links ]
Lee, M., Aloyo, V., Fluharty, S. & Simansky, K. (1998). Infusion of the serotonin1B (5–HT1B) agonist CP–93,129 into the parabranchial nucleus potently and selectively reduce food intake in rats. Psychopharmacology, 136, 304–307. [ Links ]
Lee, M., Kennett, G., Dourish, C. & Clifton, P. (2002). 5–HT1B receptors modulate components of satiety in the rat: behavioural and pharmacological analyses of the selective serotonin1B agonists CP–94,253. Psychopharmacology, 164, 49–60. [ Links ]
Lee, M. D. & Simansky, K. J. (1997). CP–94,253: a selective serotonin1B (5–HT1B) agonist that promotes satiety. Psychopharmacology, 131, 264–270. [ Links ]
Leibowitz, S. F. & Alexander, J. T. (1998). Hypothalamic serotonin in control of eating behavior, meal size, and body weight. Biological Psychiatry, 44, 851–864. [ Links ]
Leibowitz, S. F. & Shor–Posner, G. (1986). Brain serotonin and eating behavior. En S. Nicolaidis (Ed). Serotoninergic System Feeding and Body Weight Regulation (pp. 1–14). Londres: Academic Press. [ Links ]
Leibowitz, S. F., Alexander J. T., Cheung, W. K. & Weiss, G. F. (1993). Effects of serotonin and the serotonin blocker metergoline on meal patterns and macronutrient selection. Pharmacology Biochemistry and Behavior, 45, 185–194. [ Links ]
Leibowitz, S. F., Weiss, G. F. & Suh, J. S. (1990). Medial hypothalamic nuclei mediate serotonin's inhibitory effect on feeding behavior. Pharmacology Biochemistry and Behavior, 37, 735–742. [ Links ]
Lowry, C. A. & Moore, F. L. (2006). Regulation of behavioral responses by corticotropin–releasing factor. General and comparative Endocrinology, 146, 19–27. [ Links ]
Mancilla, D. J. M, Escartín, P. R. E. & López, A. V. E. (2006) Efectos de la 5–HT en ratas pretratadas con ketanserina sobre la estructura de la conducta alimentaria. Revista Mexicana de Análisis de la Conducta, 32, 55–71. [ Links ]
McGuirk, J., Muscat, R. & Willner, P. (1992). Effects of the 5–HT uptake inhibitors, femoxetine and paroxetine, and a 5–HT1A/B agonist, eltoprazine, on the behavioural satiety sequence. Pharmacology, Biochemistry and Behavior, 41, 801–805. [ Links ]
Müller, C. P., Carey, R. J., Huston, J. P. & De Souza, M. (2007). Serotonin and psychostimulant addiction: Focus on 5–HT1A–receptors. Progress in Neurobiology, 81 , 33–178. [ Links ]
Park, S., Harrold, J. A., Widdowson, P. S. & Williams, G. (1999). Increased binding at 5–HT1A, 5–HT1B, and 5–HT2A receptors and 5–HT transporters in diet–induced obese rats. Brain Research, 847, 90–97. [ Links ]
Paxinos, G. & Watson, Ch. (1986.). The rat brain in stereotaxic coordinates. Nueva York: Academic Press. [ Links ]
Schreiber, R. & De Vry, J. (2002). Role of 5–HT2C receptors in the hypophagic effect of m–CPP, ORG 37684 and CP–94,253 in the rat. Progress in Neuro–Psychopharmacology and Biological Psychiatry, 26, 441–449. [ Links ]
Schreiber, R., Selbach, K., Asmussen, M., Hesse, D. & De Vry; J. (2000). Effects of serotonin 1/ receptor agonists on dark–phase food and water intake in rats. Pharmacology Biochemistry and Behavior, 67, 291–305. [ Links ]
Shroff, H., Reba, L., Thornton, L., Tozzi, F., Klump K., Berrettini, W., Brandt, M. & Crawford, M. (2006). Features associated with excessive exercise in women with eating disorders. International Journal of Eating Disorders, 39, 454–461. [ Links ]
Vickers, S. P., Clifton, P. G., Dourish C. T. & Tecott L. H. (1999). Reduced satiating effect of d–fenfluramine in serotonin 5–HT2C receptor mutant mice. Psychopharmacology, 143, 309–314. [ Links ]
Weidenfeld, J., Feldman, S., Itzik, A., Van de Kar, L. & Newman, M. (2002). Evidence for a mutual interaction between noradrenergic and serotonergic agonists in stimulation of ACTH and corticosterone secretion in the rat. Brain Research, 941, 113–117. [ Links ]
Wirstshafter, D. (2001). The control of ingestive behavior by the median raphe nucleus. Appetite, 36, 99–105. [ Links ]
Wurtman, J. D. & Wurtman, R. J. (1977). Fenfluramine and fluoxetine spare protein consumption while suppressing caloric intake by rats. Science, 198, 1178–1180. [ Links ]
Wurtman, J. D., & Wurtman, R. J. (1979 a). Drugs that enhance serotonergic transmission diminish elective carbohydrate consumption by rats. Life Sciences, 24, 895–904. [ Links ]
Wurtman, J. D. & Wurtman, R. J. (1979 b). Fenfluramine and other serotonergic drugs depress food intake and carbohydrate consumption while sparing protein consumption. Current Medical research opinion, 6 (suppl. I), 28–33. [ Links ]














