Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dez. 2023 Epub 08-Dez-2023
https://doi.org/10.7773/cm.y2023.3302
Artículos
Composición y biomasa fitoplanctónica bajo condiciones oligotróficas en la cuenca de Guaymas (golfo de California)
1Departamento de Ecología Marina, Centro de Investigación Científica y de Educación Superior de Ensenada, 22860 Ensenada, Baja California, Mexico.
2Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, 22860 Ensenada, Baja California, Mexico.
Con el propósito de determinar la biomasa y la composición del fitoplancton (picofitoplancton, nanodiatomeas y microdiatomeas) bajo condiciones oligotróficas, se realizó un estudio en la capa superficial de la cuenca de Guaymas, golfo de California, durante el verano tardío de 2016. El estudio contempló la medición de variables hidrográficas, químicas y biológicas en la capa superficial del área de estudio. Nuestros resultados mostraron una columna de agua cálida, fuertemente estratificada, empobrecida en nutrientes y con biomasas fitoplanctónicas reducidas (<1 mg Cla·m-3). Los cocientes promedio de N:P (0.55 ± 1.34), N:Si (0.13 ± 0.18) y Fe:N (52.70 ± 29.70) indicaron condiciones de limitación por N. La contribución de los grupos fitoplanctónicos a la biomasa fluctuó ampliamente por nivel de profundidad, y se observó el predominio del picofitoplancton (85.0 ± 2.7%) en superficie (5 m) y de las nano-microdiatomeas (91.5 ± 5.9%) en el nivel más profundo (35-40 m), adyacente a la termoclina. Las diatomeas dominaron la biomasa integrada entre la superficie y 50 m de profundidad, con una contribución promedio ~6 veces mayor que la del picofitoplancton. A pesar de que se registraron condiciones ideales para la proliferación de cianobacterias diazótrofas, la presencia de Trichodesmium spp. y Richelia intracellularis fue muy irregular y en abundancias relativamente bajas (2,220 ± 1,575 célula·L-1). Nuestros resultados son especialmente relevantes, ya que sugieren que, bajo condiciones de limitación por N, el paradigma de la alta biomasa y dominancia de células grandes en el golfo de California puede verse desafiado durante la temporada de verano.
Palabras clave: golfo de California; oligotrofía; picofitoplancton; biomasa fitoplantónica; diazótrofos
In order to determine the structure and biomass of phytoplankton (picophytoplankton, nanodiatoms, and microdiatoms) under oligotrophic conditions, a study was carried out in the surface layer of the Guaymas Basin, Gulf of California, during the late summer of 2016. This study included the measurement of hydrographic, chemical, and biological variables in the surface layer of the study area. Our results showed a warm, strongly stratified, and nutrient-depleted water column associated with reduced phytoplankton biomass (<1 mg Chla·m-3). The average ratios of N:P (0.55 ± 1.34), N:Si (0.13 ± 0.18), and Fe:N (52.70 ± 29.70) indicate N-limiting conditions. The biomass contribution of phytoplankton groups fluctuated widely by depth level, with predominance of picophytoplankton (85.0 ± 2.7%) at the surface (5 m) and nano-microdiatoms (91.5 ± 5.9%) at the deepest level (35-40 m), adjacent to the thermocline. Diatoms dominated the integrated biomass between the surface and 50-m depth, with an average contribution ~6 times greater than that of picophytoplankton. Despite the ideal conditions for the proliferation of diazotrophs, the presence of Trichodesmium spp. and Richelia intracellularis was very irregular and in relatively low abundances (2,220 ± 1,575 cell·L-1). Our results are especially relevant as they suggest that, under N-limiting conditions, the paradigm of high biomass and large cell dominance in the Gulf of California may be challenged during the summer season.
Key words: Gulf of California; oligotrophy; picophytoplankton; phytoplankton biomass; diazotrophs
Introducción
El golfo de California (GC) es un mar marginal con gran biodiversidad y alta productividad primaria, misma que se compara con las de la bahía de Bengala, norte de África, y la corriente de California (Álvarez-Borrego y Lara-Lara 1991). Sin embargo, la mayoría de los estudios sobre la composición, la diversidad y la productividad del fitoplancton en el GC se han realizado en la zona costera, rica en nutrientes por las surgencias y la mezcla por mareas (e.g., Maciel-Baltazar y Hernández-Becerril 2013). En contraste, a pesar de que las regiones profundas y alejadas de la costa en este mar presentan condiciones menos productivas, los estudios en estas zonas son relativamente escasos. Como un ejemplo de esto último destaca la cuenca de Guaymas (CG), región donde se presentan altas temperaturas superficiales durante el verano, las cuales producen una fuerte estratificación vertical, la cual impide o disminuye de manera importante el flujo de nutrientes desde aguas subsuperficiales (Segovia-Zavala et al. 2010, White et al. 2013). Esto último produce condiciones oligotróficas, las cuales podrían limitar o promover cambios en la composición, la diversidad y la productividad del fitoplancton. Debido a lo anterior, resulta de suma importancia identificar los mecanismos y los factores que intervienen en el proceso de fertilización de esta zona. En este sentido, estudios anteriores han reportado el destacado papel que tienen los florecimientos de cianobacterias diazótrofas en la región de la CG, pues como importantes fijadoras de nitrógeno (N), soportan de manera significativa la producción primaria en esta cuenca (White et al. 2007, 2013). Bajo este contexto, el objetivo del presente estudio es evaluar la composición taxonómica del fitoplancton para identificar los factores que determinan su comportamiento bajo condiciones oligotróficas de la capa de agua superficial en la región central del GC.
Materiales y métodos
Área de estudio
El GC se localiza entre los 23° y 32° N y los 108° y 115° W. Presenta una orientación de NW a SE, mide aproximadamente 1,100 km de largo y 150 km de ancho y se comunica en la parte sur con el océano Pacífico. La capa superficial del GC presenta una circulación termohalina que depende de los procesos físicos estacionales; por otro lado, algunas propiedades químicas (oxígeno disuelto, pH y nutrientes) se encuentran influenciadas por aguas subsuperficiales asociadas a la capa del mínimo de oxígeno, misma que se extiende desde el NE del Pacífico tropical hasta la región central del GC (Delgadillo-Hinojosa et al. 2006). En general, en el GC se distinguen 2 temporadas durante el ciclo estacional: la temporada fría y la temporada cálida. La temporada fría se extiende de diciembre a mayo y se caracteriza por mostrar bajas temperaturas superficiales y una capa de mezcla profunda, especialmente en febrero, como resultado del forzamiento de los vientos predominantes y la convección térmica (Robles y Marinone 1987). En contraste, en la temporada cálida, entre junio y octubre, hay un incremento de la temperatura superficial y estratificación de la columna de agua (Valdez-Holguín et al. 1999). Durante este periodo, el aporte de nutrientes desde aguas profundas es limitado y la capa superficial por encima de la nutriclina se encuentra notablemente empobrecida en nitratos (White et al. 2007, Torres-Delgado et al. 2013).
Recolecta de muestras
Del 3 al 5 de septiembre de 2016, a bordo del buque oceanográfico Alpha Helix, se realizó el crucero EXFINIFE en la región central del GC. Durante estos 3 días se realizaron 4 muestreos en un punto localizado sobre la CG (27°12ʹ N, 111°18ʹ W) (Fig. 1a): 3 de septiembre, D1; 4 de septiembre, D2; y 5 de septiembre, D3-1 y D3-2. Los muestreos fueron realizados durante el verano tardío en condiciones de mareas muertas. Estas condiciones favorecen la presencia de grupos fitoplanctónicos propios de condiciones oligotróficas (White et al. 2007, Segovia-Zavala et al. 2010).

Figure 1 Location of the sampling station ( ). Satellite image of chlorophyll a (Modis-Aqua, 8-day composite: 28 August to 4 September 2016) (a) and spatiotemporal distribution of temperature (b), salinity (c), sigma-t (d), and fluorescence (e). For the elaboration of the cross sections for temperature, density, salinity, and fluorescence, a linear interpolation scheme was used in the Ocean Data View program.
). Satellite image of chlorophyll a (Modis-Aqua, 8-day composite: 28 August to 4 September 2016) (a) and spatiotemporal distribution of temperature (b), salinity (c), sigma-t (d), and fluorescence (e). For the elaboration of the cross sections for temperature, density, salinity, and fluorescence, a linear interpolation scheme was used in the Ocean Data View program.
Mediante un CTD (SeaBird Electronics, modelo SBE 9-11 plus) equipado con sensores de conductividad, temperatura, oxígeno disuelto y fluorescencia, a lo largo de las horas luz, se realizaron un total de 5 lances en D1, 6 lances en D2 y 4 lances en D3-1 y D3-2. El punto de muestreo tiene una profundidad aproximada de 2,000 m; sin embargo, para el análisis de clorofila a (Cla), fitoplancton, hierro disuelto (Fed), nitratos más nitritos (NO3 + NO2), fosfatos (PO4) y silicatos (SiO4), se recolectaron muestras de agua a 3 diferentes profundidades, iguales o menores que 50 m (5 m, 25-35 m y 37-50 m), mediante botellas Niskin de 5 L (General Oceanics) acopladas a una roseta. Las profundidades de muestreo se eligieron de acuerdo con el potencial de la actividad fotosintética correspondiente a la superficie (5 m), ~50% de la irradiancia superficial (I0) y el máximo de fluorescencia (7-9% de I0). Para el análisis de Cla, se filtró 1 L de agua de mar a través de filtros de fibra de vidrio (GF/F, 25 mm). Una vez realizada la filtración, los filtros se colocaron en cápsulas de HistoPrep, las cuales se almacenaron en nitrógeno líquido hasta su análisis en el laboratorio. La recolecta de agua para el análisis de Fed se realizó bajo condiciones de ultra limpieza (Bruland et al. 2001, Delgadillo-Hinojosa et al. 2006, Segovia-Zavala et al. 2010). Las muestras de agua para la estimación de la abundancia y la identificación del fitoplancton se preservaron en una solución ácida de Lugol al 1% de concentración final y se almacenaron en oscuridad a 4 °C. El agua para el análisis de nutrientes se mantuvo en frascos de plástico oscuros de 20 mL a -20 °C hasta su análisis en el laboratorio.
Análisis de variables
Hierro disuelto y nutrientes inorgánicos
El Fed fue preconcentrado utilizando el método de extracción orgánica con el quelante 1-pirrodil ditiocarbamato de amonio/dietilamonio dietilditiocarbamato (APDC/DDDC) (Bruland et al. 2001, Segovia-Zavala et al. 2010), y se agregó un paso de retroextracción (Félix-Bermúdez et al. 2020). La concentración de Fed fue determinada por absorción atómica en horno de grafito utilizando un espectrofotómetro Agilent 280Z AA equipado con corrección de fondo Zeeman. Los análisis de los nutrientes inorgánicos (NO3 + NO2, PO4 y SiO4) en la fracción disuelta se efectuaron mediante técnicas colorimétricas (Gordon et al. 1993) utilizando un autoanalizador de flujo segmentado continuo AA3 Skalar SANPlus (Seal Analytical, Reino Unido).
Clorofila a in situ y clorofila satelital
Previo al análisis, los filtros destinados para la determinación de Cla se descongelaron, se colocaron inmediatamente en 10 mL de acetona al 90% durante 24 h y se mantuvieron en la oscuridad a 4 °C. La concentración de Cla se determinó utilizando un espectrofotómetro UV-Visible Cary 50 Agilent Technologies y la ecuación de Jeffrey y Humphrey (1975). Por otro lado, la imagen de clorofila satelital (Clsat) se obtuvo a través del sensor MODIS-Aqua en composición de 8 días (28 de agosto a 4 de septiembre de 2016), nivel 3 y resolución espacial de 4 × 4 km. El procesamiento de la imagen se realizó mediante el programa SeaDAS 7.3.2 (https://oceancolor.gsfc.nasa.gov, accedida el 03 de abril de 2021).
Nano-microfitoplancton y cianobacterias diazótrofas
El análisis del fitoplancton se llevó a cabo mediante conteos y medición de células de acuerdo con Hasle (1978). La técnica consiste en concentrar 100 mL de agua de mar en una cámara de sedimentación por un periodo de 48 h. En su mayoría, el fitoplancton se clasificó al nivel taxonómico más alto mediante las técnicas utilizadas por Gómez (2013). Las diatomeas y las cianobacterias diazotróficas se midieron con un micrómetro adaptado a un microscopio Zeiss Axio Vert.A1. Posteriormente, las mediciones de diatomeas se transformaron a biovolumen (µm3) utilizando las formas estereométricas sugeridas por Strathmann (1967) y Edler (1979). La biomasa de diatomeas se determinó por fracciones de tamaño: nanodiatomeas (5-20 µm) y microdiatomeas (>20 µm). La abundancia de Trichodesmium spp. y Richelia sp. se determinó en células por litro. El cálculo de biomasa de diatomeas y picofitoplacton se realizó mediante la siguiente ecuación:
donde B p es la biomasa de la población de células (μg C·L-1), C p es la abundancia de organismos (célula·L-1), V p es el biovolumen celular (μm3 célula·L-1) y F p es el factor de conversión de biovolumen a carbono utilizando la ecuación pg C·célula-1 = 0.443 × (µm3)0.863 (Verity et al. 1992).
Picofitoplancton
Para el análisis del picofitoplancton, las muestras de agua de mar se fijaron en formaldehído neutralizado con borato de sodio a una concentración final del 1% y se almacenaron a -4 °C bajo condiciones de oscuridad (este fijador puede provocar subestimación del conteo). Posteriormente, en el laboratorio se filtraron con membrana de policarbonato de 0.2 μm y se montaron en portaobjetos con aceite de inmersión de baja fluorescencia para el conteo por epifluorescencia (MacIsaac y Stockner 1993). Las células con morfología circular y ovoide y autofluorescencia roja-naranja se contabilizaron a una magnificación de 1200× con luz de excitación de longitud de onda del azul (450-490 nm).
Resultados
Condiciones hidrográficas
A lo largo de los 3 días de muestreo, la columna de agua pasó de una estratificación fuerte a una mezcla parcial. En los primeros 2 días de muestreo (D1 y D2), la isopicna de los 22 kg·m-3 se mantuvo a una profundidad aproximada de 30 m (Fig. 1d). Esto se debió a que los valores promedio de salinidad (35.41 ± 0.06) y temperatura (30.69 ± 0.11 °C) en la capa por encima de los 30 m (llamada capa superficial de aquí en adelante) fueron mayores que los de salinidad (35.23 ± 0.10) y temperatura (24.82 ± 2.91 °C) registrados por debajo de los 30 m (llamada capa profunda de aquí en adelante). Sin embargo, como resultado de una disminución de salinidad y temperatura promedio en la capa superficial (35.34 ± 0.05 y 28.30 ± 1.60 °C), durante el tercer día de muestreo (D3-1 y D3-2), la isopicna de 22 kg·m-3 presentó un levantamiento abrupto, lo que indica un cambio de estabilidad a relativa inestabilidad en la columna de agua (Fig. 1d).
Variables biogeoquímicas
Variables químicas
Los nutrientes inorgánicos presentaron un comportamiento similar durante los 3 días de muestreo, con concentraciones bajas en la capa superficial y altas en la capa profunda (Fig. 2a-c). Los promedios encontrados para NO3 + NO2, PO4 y SiO4 fueron, respectivamente, 0.02 ± 0.00, 0.58 ± 0.17 y 3.49 ± 1.12 µM en la capa superficial y 2.29 ± 2.08, 0.95 ± 0.22 y 8.16 ± 3.44 µM en la capa profunda (Tabla 1). En el primer día de muestreo (D1), la distribución vertical del Fed presentó concentraciones promedio menores en la capa superficial y mayores en la capa profunda (2.50 ± 0.00 nM y 4.60 ± 2.40 nM, respectivamente; Fig. 2d). En contraste, los promedios para los muestreos del segundo (D2) y del tercer (D3) día presentaron valores muy similares para la capa superficial y la capa profunda (1.19 ± 0.46 y 1.29 ± 0.22 nM, respectivamente; Tabla 1).

Figure 2 Vertical distribution of nitrates plus nitrites (NO3 + NO2) (a), phosphates (PO4) (b), silicates (SiO4) (c), and dissolved iron (Fed) (d) in the samples from the Guaymas Basin during the late summer of 2016.
Table 1 Physicochemical and biological variables measured during the EXFINIFE cruise carried out in the Guaymas Basin from 3 to 5 September 2016. Depth (Z, m); temperature (T, °C); salinity (S); chlorophyll a (Chla, mg·m-3); diatoms (Diato., cell·L-1); dinoflagellates (Dino., cell·L-1); Trichodesmium spp. (Trich., cell·L-1); Richelia sp. (Rich., cell·L-1); picophytoplankton (Pico., cell × 106·L-1); nano-microdiatom biomass (BND-BMD, µg C·L-1); picophytoplankton biomass (BPico., µg C·L-1); irradiance (I0, %); nitrates plus nitrites (NO3 + NO2), phosphates (PO4), and silicates (SiO4) (detection limit of 0.02, 0.02, and 0.04 µM, respectively); and dissolved iron (Fed, 0.04 nM detection limit).
| Survey | Z | T | S | Chla | Diato. | Dino. | Trich. | Rich. | Pico. | BND-BMD | BPico. | I0 | NO3 + NO2 | SiO4 | PO4 | Fed |
| D1 | 5 | 30.61 | 35.37 | 0.33 | 1,717 | 8,623 | 1,043 | 28.8 | 1.39-3.42 | 32.70 | 100 | 0.02 | 3.08 | 0.51 | 2.47 | |
| 35 | 28.94 | 35.25 | 0.32 | 1,770 | 5,379 | 3,128 | 33.8 | 0.54-89.30 | 37.40 | 15 | 0.02 | 3.67 | 0.80 | 2.86 | ||
| 50 | 22.20 | 35.09 | 0.39 | 10,872 | 5,050 | 5,214 | 18.3 | 42.90-122.60 | 20.70 | 5 | 3.80 | 9.24 | 6.31 | |||
| D2 | 5 | 30.77 | 35.46 | 0.48 | 677 | 6,088 | 2,085 | 23.3 | 0.12-5.25 | 26.41 | 100 | 0.02 | 2.24 | 0.38 | 1.63 | |
| 35 | 24.57 | 35.22 | 0.78 | 31,285 | 11,411 | 1,564 | 49.7 | 71.73-1,590.00 | 56.30 | 15 | 0.06 | 6.03 | 0.84 | 1.53 | ||
| 45 | 23.59 | 35.35 | 0.80 | 17,747 | 11,091 | 417 | 21.6 | 20.41-422.30 | 24.50 | 5 | 3.24 | 9.14 | 1.24 | |||
| D3-1 | 5 | 29.08 | 35.36 | 0.33 | 1,408 | 4,629 | 2,086 | 28.1 | 1.00-4.96 | 31.90 | 100 | 0.02 | 3.75 | 0.65 | 0.71 | |
| 25 | 26.45 | 35.29 | 0.61 | 4,218 | 6,190 | 134.0 | 3.70-105.19 | 151.90 | 20 | 0.02 | 4.89 | 0.77 | 1.24 | |||
| 40 | 24.45 | 35.29 | 0.94 | 8,861 | 4,421 | 89.7 | 14.94-1,828.00 | 101.70 | 10 | 4.31 | 12.70 | 1.20 | 1.10 | |||
| D3-2 | 5 | 29.23 | 35.38 | 0.19 | 989 | 5,261 | 31.1 | 0.59-5.01 | 35.30 | 100 | ||||||
| 33 | 25.59 | 35.34 | 0.74 | 5,269 | 4,612 | 147.0 | 6.18-230.24 | 166.60 | 20 | |||||||
| 37 | 25.06 | 35.35 | 1.02 | 8,729 | 4,878 | 64.9 | 11.07-293.90 | 72.40 | 10 |
Composición taxonómica del fitoplancton (>5 µm).
La riqueza de diatomeas (>5 µm) estuvo constituida por un total de 42 taxones, de los cuales 7 pertenecieron a Chaetoceros, 6 a Rhizosolenia, 3 a Coscinodiscus, 2 a Guinardia, 2 a Actinoptychus y 2 a Bacteriastrum (Tabla 2). Asimismo, se identificaron 20 géneros, cada uno con una morfoespecie. Los dinoflagelados (no incluidos en la Tabla 2) mostraron 26 taxones, distribuidos en 7 especies de Tripos (Tripos fusus, Tripos furca, Tripos azoricus, Tripos macroceros, Tripos candelabrus, Tripos lineatum y 1 Tripos sp.), 3 de Gymnodinium (Gymnodinium catenatum y 2 Gymnodinium spp.), 2 de Gyrodinium (Gyrodinium spirale y 1 Gyrodinium sp.), 3 de Oxytoxum (Oxytoxum laticeps, Oxytoxum sceptrum y Oxytoxum scolopax), 2 de Prorocentrum (Prorocentrum gracile y Prorocentrum micans), 2 de Protoperidinium (Protoperidinium corniculum y Protoperidinium acutum), Scrippsiella trochoidea, Podolampas palmipes, Gonyaulax polygramma, Ornithocercus magnificus, Amphisolenia bidentata, Brachidinium capitatum y Peridinium sp.
Table 2 List of marine phytoplankton diatoms (Bacillariophyta) identified during the EXFINIFE cruise carried out in the Guaymas Basin from 3 to 5 September 2016. The symbols indicate the size (<20 µm, >20 µm) of the taxon determined from the volume of the sphere.
| Survey/depth | ||||||||||||
| D1 | D1 | D1 | D2 | D2 | D2 | D3-1 | D3-1 | D3-1 | D3-2 | D3-2 | D3-2 | |
| Nano-microdiatoms | 5 m | 35 m | 50 m | 5 m | 35 m | 45 m | 5 m | 25 m | 40 m | 5 m | 33 m | 37 m |
| Cylindrotheca closterium (Ehrenberg) | < | < | < | < | < | < | < | < | < | < | < | < |
| Nitzschia longissima (Kützing) | < | < | < | |||||||||
| Pseudo-nitzschia seriata (Cleve) | < | < | < | < | < | < | < | < | ||||
| Rhizosolenia longissima (Grunow) | > | > | > | > | > | > | < | < | > | > | > | < |
| Rhizosolenia clevei (Ostenfeld) | > | > | > | > | > | > | > | |||||
| Rhizosolenia bergonii (Peragallo) | > | > | > | > | > | |||||||
| Rhizosolenia imbricata (Brightwell) | > | > | > | |||||||||
| Rhizosolenia acuminata (Peragallo) | > | |||||||||||
| Rhizosolenia setigera (Brightw) | < | > | > | < | < | < | > | |||||
| Pseudosolenia calcar-avis (Schultze) | > | > | ||||||||||
| Proboscia alata (Brightwell) | > | > | > | > | > | |||||||
| Coscinodiscus radiatus (Ehrenberg) | > | > | > | > | > | > | > | > | > | |||
| Coscinodiscus gigas (Ehrenberg) | > | > | > | > | > | > | > | |||||
| Coscinodiscus curvatulus (Grunow) | > | > | > | > | < | < | < | < | ||||
| Leptocylindrus danicus (Cleve) | < | < | < | < | < | < | < | < | ||||
| Chaetoceros affinis (Gran) | < | < | ||||||||||
| Chaetoceros messanensis (Castracane) | < | < | < | < | < | < | < | < | < | < | ||
| Chaetoceros lorenzianus (Grunow) | > | > | > | |||||||||
| Chaetoceros radicans (Schütt) | < | < | < | < | < | < | < | < | < | |||
| Chaetoceros pseudoaurivilli (Ikari) | > | |||||||||||
| Chaetoceros peruvianus (Brightwell) | > | > | ||||||||||
| Chaetoceros curvisetus (Cleve) | < | < | < | |||||||||
| Guinardia delicatula (Cleve) | > | > | > | |||||||||
| Guinardia striata (Stolterfoth) | > | > | > | > | > | > | > | > | ||||
| Actinoptychus splendens (Shadbolt) | > | > | > | |||||||||
| Actinoptychus senarius (Ehrenberg) | > | > | > | > | ||||||||
| Bacteriastrum elegans (Pavillard) | > | |||||||||||
| Bacteriastrum delicatulum (Cleve) | < | < | ||||||||||
Dentro de las cianobacterias diazótrofas en tricomas, se detectaron 2 especies de Trichodesmium (Trichodesmium erythraeum Ehrenberg ex Gomont, 1892 y Trichodesmium sp.) y una simbiótica (Richelia intracellularis J. Schmidt, 1901) asociada a diatomeas del género Rhizosolenia. Dentro del grupo de los silicoflagelados, se identificaron a Distephanus speculum, Dictyocha fibula, así como una morfoespecie no identificada del grupo de los cocolitofóridos. Otros individuos fitoplanctónicos abundantes, con células no identificadas <13 µm, fueron agrupados por su morfología dentro de la categoría de fitoflageladas.
Biomasa y abundancia del fitoplancton
En la Figura 3 se muestran los perfiles verticales de la concentración de Cla y de la biomasa cuantificada a partir de 2 grupos de fitoplancton (diatomeas más picofitoplancton autótrofo). Aunque se observó una considerable variabilidad temporal de Cla y de biomasa fitoplanctónica, ambas variables estuvieron estrechamente correlacionadas (r de Spearman = 0.75, n = 12, P < 0.05). Con excepción del perfil de Cla para el muestreo D1, donde se presentó escasa variabilidad vertical, los máximos valores de Cla y biomasa se observaron en la subsuperficie (Fig. 3a-b). En general, la biomasa superficial promedio, caracterizada por las contribuciones de picofitoplancton autótrofo, nanodiatomeas y microdiatomeas (~85.0%, 2.0% y 13.0%, respectivamente), fue ~20 veces menor que la de la capa profunda (10.0%, 8.0% y 82.0%, respectivamente). Particularmente, los máximos de biomasa en D2 (1,718 µg C·L-1) y D3-1 (1,944 µg C·L-1) fueron 4 veces mayores que los registrados en D3-2 (403 µg C·L-1).

Figure 3 Vertical profiles of chlorophyll a concentration and biomass of phytoplankton groups (diatoms plus autotrophic picophytoplankton) in samples collected during the 3 days of sampling (D1, D2, D3-1, and D3-2) in the Guaymas Basin during the late summer of 2016.
El fitoplancton (>5 µm) presentó mayores abundancias en D2 respecto a los otros muestreos, con un máximo de 60 × 103 célula·L-1 a 35 m (Fig. 4). Por su parte, el picofitoplancton (<2 µm) presentó máximos subsuperficiales, aunque de menor magnitud en D1 y D2 en comparación con D3-1 y D3-2 (134 y 147 × 106 célula·L-1, respectivamente) (Fig. 4). En cuanto a la contribución de los grupos fitoplanctónicos a la abundancia de la fracción >5 µm, las fitoflageladas indeterminadas y los dinoflagelados fueron predominantes en las muestras superficiales (promedio: 44.0% y 39.0%, respectivamente), a diferencia de las diatomeas que predominaron en las del estrato más profundo (43.0%). En el estrato intermedio, la contribución promedio fue similar entre los 3 grupos (30.0-32.0%). Los registros de las cianobacterias diazótrofas en tricomas fueron, en general, muy irregulares, y se registraron abundancias relativamente bajas (entre indetectables y 5.21 × 103 célula·L-1), con observaciones de Trichodesmium spp., principalmente, en D1 y D2 a 5 m. En contraste, Richelia intracellularis no se detectó en D1, pero se encontró en D2 a 35 y 45 m y en D3-1 a 5 m (Tabla 1). Estos diazótrofos y otros grupos fitoplanctónicos (cocolitofóridos más silicoflagelados) contribuyeron, respectivamente, hasta el 22.0% (e.g., en D1 a 35 m) y el 1.2% (e.g., en D2 a 35 m) de la abundancia de la fracción >5 μm (Fig. 4).
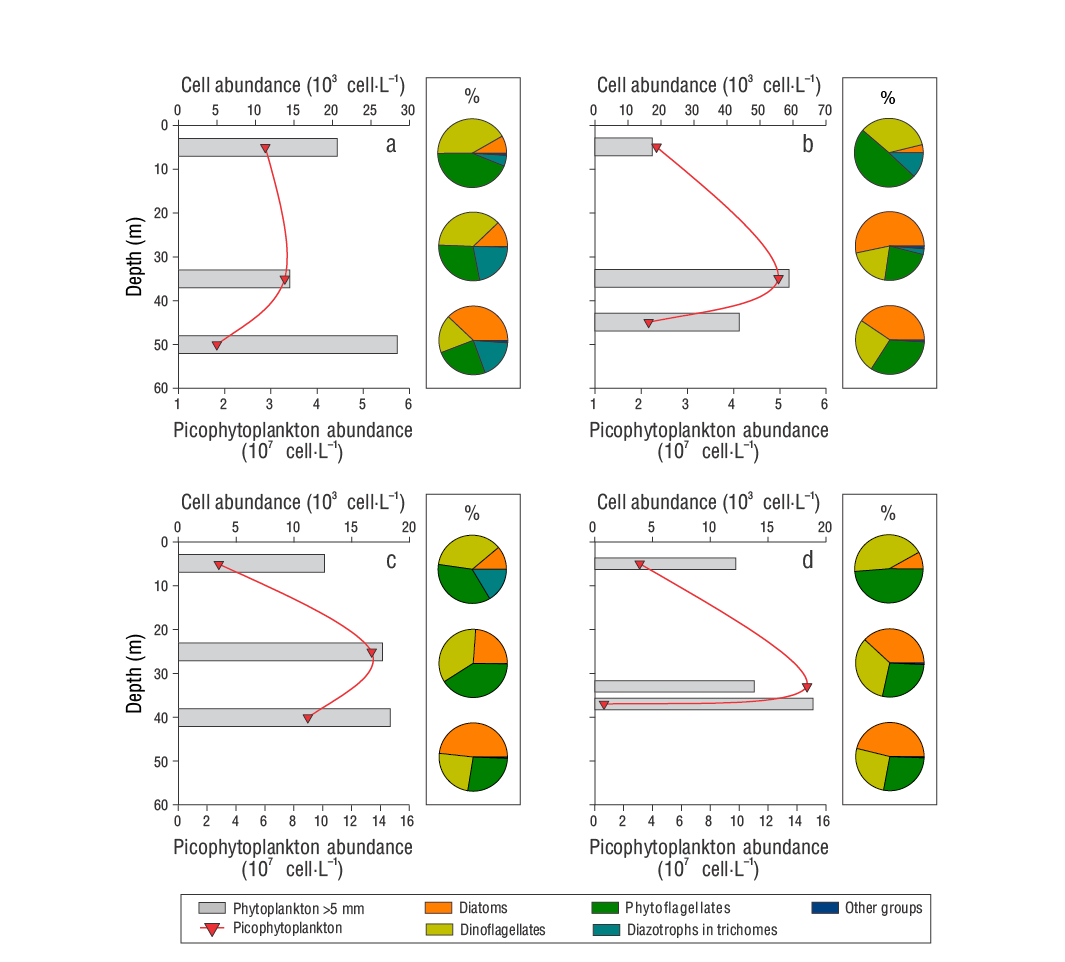
Figure 4 Vertical profiles of the total abundance of phytoplankton >5 μm and diagrams of the relative contribution of the main phytoplankton groups (%) to the abundance of samples collected in the Guaymas Basin during the late summer of 2016: September 3, D1 (a); September 4, D2 (b); and September 5, D3-1 (c) and D3-2 (d).
Discusión
Hidrografía
El área de estudio presentó una estabilidad vertical bien definida en D1 y D2 (Fig. 1b, c). Sin embargo, en D3-1 y D3-2 se observó una disminución de temperatura y salinidad en la capa superficial. Este cambio de una estabilidad vertical a una mezcla parcial pudo ser debido a que durante los muestreos D3-1 y D3-2, la región experimentó un incremento en la velocidad del viento y la altura del oleaje debido a la influencia del huracán Newton (https://www.nhc.noaa.gov/archive/2016/ep15/ep152016.publica.005.shtml?, accedida en octubre de 2016), lo que, además de limitar la continuidad del estudio, disminuyó en 10 m la zona eufótica (de 70 a 60 m) y en un 50% la profundidad de la capa de mezcla (de 30 a 15 m).
Variabilidad espacial y temporal de los nutrientes
A pesar del debilitamiento parcial de la estratificación vertical en D3-1 y D3-2, la condición de oligotrofía se mantuvo durante todo el estudio. Los cocientes promedio de N:P (0.55 ± 1.34), N:Si (0.13 ± 0.18) y Fe:N (52.70 ± 29.70) indicaron que el nutriente limitante durante este estudio fue el N. El principal abastecimiento de N a la capa superficial en la región central del GC proviene desde las capas más profundas y es modulado por procesos de convección, advección y difusión diapicnal y/o turbulenta (Lavín et al. 1995, Torres-Delgado et al. 2013). Sin embargo, las aguas de estas capas más profundas suelen presentar deficiencias en el contenido de N (N:P < 16) disponible para productores primarios no diazótrofos (Dutkiewicz et al. 2012, Torres-Delgado et al. 2013). Esto es debido a que las masas de agua a las que pertenecen experimentaron procesos de desnitrificación en la zona del mínimo de oxígeno del Pacífico nororiental tropical (Delgadillo-Hinojosa et al. 2006), lo cual reduce el contenido de N utilizable por productores primarios no diazótrofos (Dutkiewicz et al. 2012).
Estructura del fitoplancton
La composición fitoplanctónica fue representativa de zonas de transición, con especies de condiciones tanto costeras como oceánicas, y se caracterizó por una contribución importante de diatomeas, dinoflagelados y fitoflageladas. Comparable con nuestros resultados, Hernández-Becerril (1987) reportó una riqueza de 60 especies y 3 morfotipos no identificados en la región central del GC durante junio de 1982, con una contribución de diatomeas y dinoflagelados del 48.0% y 33.0%, respectivamente, en relación con el total de taxones de fitoplancton >5μm.
La alta contribución de algunas especies de dinoflagelados (e.g., Tripos fusus, Tripos furca, Tripos macroceros, Tripos candelabrus, Prorocentrum gracile, Prorocentrum micans, Oxytoxum sceptrum y Oxytoxum scolopax) al fitoplancton >5 μm en la capa superficial se caracterizó por la presencia de especies con alta motilidad, capaces de regular su posición en la columna de agua y de crecimiento más lento para conservar biomasa y administrar recursos en condiciones oligotróficas y de alta irradiancia (Reynolds 1991). En profundidades intermedias se detectó un importante componente de nanodiatomeas céntricas (e.g., Chaetoceros messanensis, Chaetoceros radicans, Chaetoceros curvisetus, Leptocylindrus danicus) y dinoflagelados (e.g., S. trochoidea, Oxytoxum laticeps), caracterizados por una elevada relación superficie-volumen. Esto último les confiere una rápida asimilación de nutrientes, así como altas tasas de crecimiento en entornos con bajos niveles de perturbación (Reynolds et al. 2002). Bajo las condiciones oligomesotróficas de la termoclina, coexisten diatomeas con similares estrategias a las de las diatomeas del nivel intermedio, y poblaciones de diatomeas de mayor tamaño y morfología (e.g., Rhizosolenia clevei, Rhizosolenia bergonii, Rhizosolenia imbricata, Coscinodiscus gigas, Coscinodiscus radiatus y Actinoptychus senarius), con alta captación y altos requerimientos de nutrientes (Reynolds 1991).
Biomasa del fitoplancton
Los resultados indican que las diatomeas tendieron a acumularse en los niveles más profundos y presentaron una distribución vertical similar a la de la fluorescencia (Figs. 1e, 4). Esta acumulación de diatomeas se produce debido a que en las aguas más profundas se encuentran las mayores concentraciones de nutrientes, principalmente de NO3 + NO2, y a que las diatomeas cuentan con adaptaciones ecofisiológicas de fotoaclimatación dadas por el aumento de Cla por célula con la profundidad (Latasa et al. 2017). En contraste, otros grupos relativamente abundantes en la capa superficial, constituidos por algunas especies de dinoflagelados y ecotipos de picofitoplancton, se caracterizan por una mayor afinidad a condiciones oligotróficas (e.g., aquellos con capacidad heterotrófica o mixotrófica) y de adaptación a altas irradiancias (e.g., bajos cocientes de clorofila b 2/a 2 y variaciones en su contenido de ficoeritrina) (Ong y Glazer 1991, Moore y Chisholm 1999) (Fig. 4).
La resolución temporal de los perfiles de fluorescencia, como indicador de la biomasa fitoplanctónica, confirma la dinámica del fitoplancton en relación con la fotoadaptación a la intensidad de luz en combinación con la disponibilidad de nutrientes inorgánicos (Fig. 1e). Esta distribución muestra una capa predominantemente oligotrófica en los primeros metros, así como un máximo subsuperficial entre ~40 y 55 m que tiende, ligeramente, a profundizarse e incrementarse en magnitud durante los lances de la tarde. (Figs. 1e, 4c). Esto último se ve reflejado en las correlaciones significativas (P < 0.05) que la Cla tiene con la profundidad y la temperatura (ρ = 0.58 y ρ = -0.61, respectivamente; n = 12). El máximo subsuperficial de Cla es una característica común en ambientes estratificados verticalmente y, en general, coincide con la parte menos profunda de la nutriclina y con condiciones óptimas de irradiancia (Cullen 2015). Esto indica que las bajas concentraciones de Cla detectadas en los niveles superficiales en este trabajo pueden ser consecuencia de la irradiancia excesiva (>1,500 µE·m-2·s-1) y las bajas concentraciones de NO3 + NO2, lo cual puede limitar el crecimiento fitoplanctónico. Por otro lado, en aguas intermedias-profundas, la abundancia de nutrientes y la aclimatación del fitoplancton a la irradiación y su calidad espectral estimulan el crecimiento de células de microfitoplancton y, por tanto, aumentan la concentración de pigmentos fotosintéticos y biomasa (Klausmeier y Litchman 2001). Esto último se ve reflejado en las correlaciones significativas (P < 0.05) de Cla con la concentración de NO3 + NO2 (ρ = 0.68, n = 9) y la profundidad (r = 0.58, n = 12). En síntesis, las bajas concentraciones de NO3 + NO2 y el exceso de irradiancia en la superficie no favorecen la proliferación de diatomeas, lo cual está de acuerdo tanto con la correlación significativa entre estas últimas y la Cla (P < 0.05, ρ = 0.68, n = 12) como con la alta contribución de la Cla a la biomasa de las nano-microdiatomeas. Esta observación, es consistente con los valores de Clsat del MODIS-Aqua a la primera profundidad óptica (~20 m, Fig. 1a), los cuales fueron muy similares a la concentración de Cla del muestreo D1 a 5 y 35 m (Tabla 1, Fig. 3a).
Por otro lado, las bajas concentraciones de Cla detectadas en superficie coinciden con el incremento relativo de biomasa del picofitoplancton en un 85.0% en relación con las diatomeas. Este predominio puede ser explicado por la elevada relación superficie-volumen que caracteriza a células muy pequeñas y, en consecuencia, por su eficiencia para la absorción de nutrientes respecto a las fracciones más grandes (Chisholm 1992, Raven et al. 2005). Esta contribución a la biomasa es similar al 75.0% aportado por el picofitoplancton (Synechococcus y Prochlorococcus) que reportaron Miranda-Alvarez et al. (2020) para las aguas superficiales de la región noreste del Pacífico tropical. De la misma manera, la relación entre los intervalos de Cla y los valores de la contribución relativa a la biomasa autotrófica de las fracciones por tamaño observada aquí es muy similar a la reportada para la región sur de la corriente de California (Taylor y Landry 2018).
Lo anteriormente descrito indica que el aporte de nutrientes, el cual depende del grado de estabilidad de la columna de agua (Karl y Lukas 1996, Falkowski 1997), y el grado de fotoadaptación a la intensidad de luz controlaron la presencia y la abundancia de ciertos grupos de fitoplancton en las aguas superficiales del GC.
Variabilidad espaciotemporal de cianobacterias diazótrofas
La presencia de cianobacterias diazótrofas en este trabajo fue muy irregular y en abundancias relativamente bajas (2,220 ± 1,575 célula·L-1). Esto último es comparable a las cuantificaciones indirectas a partir de tricomas de Richelia intracelularis (<40-1,700 tricoma·L-1, con el supuesto de un intervalo de 3-5 células vegetativas en simbiosis por tricoma) y de genes nifH de Trichodesmium spp. (0-624 copias de ADNc·L-1) realizadas previamente en la CG en verano por White et al. (2007, 2013). Trichodesmium spp. fue encontrada en todas las profundidades en D1 y a 5 m en D2, pero estuvo ausente en D3-1 y D3-2 (Tabla 1). En contraste, Richelia intracelularis no se detectó en D1, pero se encontró a 35 y 45 m en D2 y a 5 m en D3-1 (Tabla 1). Esto sugiere que, a pesar de las condiciones favorables de estratificación vertical, alta temperatura y bajas concentraciones de N inorgánico, la proliferación de estos organismos pudo estar limitada por factores no evaluados en este estudio (e.g., concentración de micronutrientes, pastoreo, competencia, etc.).
Agradecimientos
Este estudio se realizó gracias al financiamiento del Consejo Nacional de Ciencia y Tecnología (México, código CB-2011-01-166897). Agradecemos a la tripulación del B/O Alpha Helix, así como al personal técnico y colaboradores por su apoyo en la toma de muestras y el análisis de laboratorio.
REFERENCIAS
Álvarez-Borrego S, Lara-Lara JR. 1991. The physical environment and primary productivity of the Gulf of California. In: Dauphin JP, Simoneit BRT (eds.), The Gulf and Penninsular Province of the Californias. AAPG Memoir 47. McLean (VA): GSW. p. 555-567. https://doi.org/10.1306/M47542C26 [ Links ]
Bruland KW, Rue EL, Smith GJ. 2001. Iron and macronutrients in California coastal upwelling regimes: implications for diatoms blooms. Limnol Oceanogr. 46(7):1661-1674. https://doi.org/10.4319/lo.2001.46.7.1661 [ Links ]
Chisholm SW. 1992. Phytoplankton size. In: Falkowski PG, Woodhead AD (eds.), Primary Productivity and Biogeochemical Cycles in the Sea. New York (NY): Plenum Press. p. 213-237. https://doi.org/10.1007/978-1-4899-0762-2_12 [ Links ]
Cullen JJ. 2015. Subsurface chlorophyll maximum layers: enduring enigma or mystery solved? Annu Rev Mar Sci. 7:207-239. https://doi.org/10.1146/annurev-marine-010213-135111 [ Links ]
Delgadillo-Hinojosa F, Segovia-Zavala JA, Huerta-Diaz MA, Atilano-Silva H. 2006. Influence of geochemical and physical processes on the vertical distribution of manganese in the Gulf of California waters. Deep Sea Res Part I. 53(8):1301-1319.https://doi.org/10.1016/j.dsr.2006.06.002 [ Links ]
Dutkiewicz S, Ward BA, Monteiro F, Follows MJ. 2012. Interconnection of nitrogen fixers and iron in the Pacific Ocean: Theory and numerical simulations. Global Biogeochem Cycles. 26(1):GB1012. https://doi.org/10.1029/2011GB004039 [ Links ]
Edler L. 1979. Recommendations for marine biological studies in the Baltic Sea: Phytoplankton and chlorophyll. Baltic Mar Biol. 5:1-38. [ Links ]
Falkowski PG. 1997. Evolution of the nitrogen cycle and its influence on biological sequestration of CO2 in the oceans. Nature. 387:272-275. https://doi.org/10.1038/387272a0 [ Links ]
Félix-Bermúdez A, Delgadillo-Hinojosa F, Torres-Delgado EV, Muñoz-Barbosa A. 2020. Does sea surface temperature affect solubility of iron in mineral dust? The Gulf of California as a case study. J Geophys Res Oceans. 125(9):e2019JC015999. https://doi.org/10.1029/2019JC015999 [ Links ]
Gómez F. 2013. Reinstatement of the dinoflagellate genus Tripos to replace Neoceratium, marine species of Ceratium (Dinophyceae, Alveolata). CICIMAR Oceánides. 28(1):1-22. https://doi.org/10.37543/oceanides.v28i1.119 [ Links ]
Gordon LI, Jennings JC Jr, Ross AA, Krest JM. 1993. A Suggested protocol for continuous flow automated analysis of seawater nutrients (phosphate, nitrate, nitrite and silicic acid) in the WOCE Hydrographic Program and the Joint Global Ocean Fluxes Study. WOCE Hydrographic Program Office, Methods Manual WHPO: Oregon State University College of Oceanography. p. 91-100. [ Links ]
Hasle GR. 1978. Using the inverted microscope. In: Sournia A (ed.), Phytoplankton Manual. Paris (France): UNESCO. p. 191-196. [ Links ]
Hernández-Becerril DU. 1987. Vertical distribution of phytoplankton in the central and northern part of the Gulf of California (June 1982). Mar Ecol. 8(3):237-251. https://doi.org/10.1111/j.1439-0485.1987.tb00186.x [ Links ]
Jeffrey SW, Humphrey GF. 1975. New spectrophotometric equations for determination chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem Physiol Pflanz. 167(2):191-194. https://doi.org/10.1016/S0015-3796(17)30778-3 [ Links ]
Karl DM, Lukas R. 1996. The Hawaii Ocean Time-series (HOT) program: Background, rationale and field implementation. Deep-Sea Res., Part A. 43(2-3):129-156. https://doi.org/10.1016/0967-0645(96)00005-7 [ Links ]
Klausmeier CA, Litchman E. 2001. Algal games: The vertical distribution of phytoplankton in poorly mixed water columns. Limnol Oceanogr . 46(8):1998-2007. https://doi.org/10.4319/lo.2001.46.8.1998 [ Links ]
Latasa M, Cabello AM, Morán XAG, Massana R, Scharek R. 2017. Distribution of phytoplankton groups within the deep chlorophyll maximum. Limnol Oceanogr . 62(2):665-685. https://doi.org/10.1002/lno.10452 [ Links ]
Lavín MF, Gaxiola-Castro G, Robles JM, Richter K. 1995. Winter water masses and nutrients in the northern Gulf of California. J Geophys Res. 100(C5):8587-8605. http://dx.doi.org/10.1029/95JC00138 [ Links ]
Maciel-Baltazar E, Hernández-Becerril DU. 2013. Especies de dinoflagelados atecados (Dinophyta) de la costa de Chiapas, sur del Pacífico mexicano = Species of athecate dinoflagellates (Dinophyta) from coasts of Chiapas, southern Mexican Pacific. Rev Biol Mar Oceanogr. 48(2):245-259. http://dx.doi.org/10.4067/S0718-19572013000200005 [ Links ]
MacIsaac EA, Stockner JG. 1993. Enumeration of phototrophic picoplankton by autofluorescence microscopy. In: Kemp PF, Sherr BF, Sherr EB, Cole JJ (eds.), Handbook of Methods in Aquatic Microbial Ecology, 1st ed. Boca Raton (FL): CRC Press. p. 187-198. https://doi.org/10.1201/9780203752746 [ Links ]
Miranda-Alvarez C, González-Silvera A, Santamaría-del-Angel E, López-Calderón J, Godínez VM, Sánchez-Velasco L, Hernández-Walls R. 2020. Phytoplankton pigments and community structure in the northeastern tropical Pacific using HPLC-CHEMTAX analysis. J Oceanogr. 76:91-108. https://doi.org/10.1007/s10872-019-00528-3 [ Links ]
Moore LR, Chisholm SW. 1999. Photophysiology of the marine cyanobacterium Prochlorococcus: ecotypic differences among cultured isolates. Limnol Oceanogr . 44(3):628-638. https://doi.org/10.4319/lo.1999.44.3.0628 [ Links ]
Ong LJ, Glazer AN. 1991. Phycoerythrins of marine unicellular cyanobacteria. I. Bilin types and locations and energy transfer pathways in Synechococcus spp. phycoerythrins. J Biol Chem. 266(15):9515-9527. https://doi.org/10.1016/S0021-9258(18)92851-6 [ Links ]
Raven JA, Finkel ZV, Irwin AJ. 2005. Picophytoplankton: bottom-up and top down controls on ecology and evolution. Vie et Milieu. 55(3-4):209-215. [ Links ]
Robles JM, Marinone SG. 1987. Seasonal and interannual thermohaline variability in the Guaymas Basin of the Gulf of California. Cont Shelf Res. 7(7):715-733. https://doi.org/10.1016/0278-4343(87)90013-6 [ Links ]
Reynolds CS. 1991. Functional morphology and adaptative strategies of freshwater phytoplankton. In: Sandgren C (ed.), Growth and Reproductive Strategies of Freshwater Phytoplankton. Cambridge (MA): Cambridge University Press. p. 388-426. [ Links ]
Reynolds CS, Huszar V, Kruk C, Naselli-Flores L, Melo S. 2002. Towards a functional classification of the freshwater phytoplankton. J Plankton Res. 24(5):417428. https://doi.org/10.1093/plankt/24.5.417 [ Links ]
Segovia-Zavala JA, Lares ML, Delgadillo-Hinojosa F, Tovar-Sánchez A, Sañudo-Wilhelmy SA. 2010. Dissolved iron distributions in the central region of the Gulf of California, México. Deep-Sea Res Part I. 57(1):53-64. https://doi.org/10.1016/j.dsr.2009.10.007 [ Links ]
Strathmann RR. 1967. Estimating the organic carbon content of phytoplankton from cell volumen or plasma. Limnol Oceanogr . 12(3):411-418. https://doi.org/10.4319/lo.1967.12.3.0411 [ Links ]
Taylor AG, Landry MR. 2018. Phytoplankton biomass and size structure across trophic gradients in the southern California Current and adjacent ocean ecosystems. Mar Ecol Prog Ser. 592:1-17. https://doi.org/10.3354/meps12526 [ Links ]
Torres-Delgado EV, Delgadillo-Hinojosa F, Camacho-Ibar VF, Huerta-Díaz MA, Segovia-Zavala JA, Hernández-Ayón JM, Galindo-Bect S. 2013. Wintertime enrichment of inorganic nutrients in the Ballenas Channel, Gulf of California = Enriquecimiento invernal de nutrientes inorgánicos en el canal de Ballenas, golfo de California. Cienc Mar. 39(2):165-182. http://dx.doi.org/10.7773/cm.v39i2.2236 [ Links ]
Valdez-Holguín JE, Álvarez-Borrego S, Trees CC. 1999. Seasonal and spatial characterization of the Gulf of California phytoplankton photosynthetic parameters = Caracterización estacional y espacial de los parámetros fotosintéticos del fitoplacton del golfo de California. Cienc Mar . 25(4):445-467. https://doi.org/10.7773/cm.v25i4.732 [ Links ]
Verity PG, Robertson CY, Tronzo CR, Andrews MG, Nelson JR, Sieracki ME. 1992. Relationships between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton. Limnol Oceanogr . 37(7):1434-1446. https://doi.org/10.4319/lo.1992.37.7.1434 [ Links ]
White AE, Prahl FG, Letelier RM, Popp BN. 2007. Summer surface waters in the Gulf of California: Prime habitat for biological N2 fixation. Global Biogeochem Cy. 21(2):GB2017. https://doi.org/10.1029/2006GB002779 [ Links ]
White AE, Foster RA, Benitez-Nelson CR, Masqué P, Verdeny E, Popp BN, Arthur KE, Prahl FG. 2013. Nitrogen fixation in the Gulf of California and the Eastern Tropical North Pacific. Prog Oceanogr. 109:1-17. http://dx.doi.org/10.1016/j.pocean.2012.09.002 [ Links ]
Recibido: 13 de Agosto de 2021; Aprobado: 17 de Mayo de 2022; Publicado: 17 de Marzo de 2023











 texto em
texto em 



