Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dez. 2023 Epub 08-Dez-2023
https://doi.org/10.7773/cm.y2023.3316
Artículos
Primera aproximación del periodo de crecimiento y desove de Symphodus ocellatus (Linnaeus, 1758) (Pisces: Labridae) en el sureste del mar Negro
1Department of Fishing Technology, Faculty of Fisheries, Recep Tayyip Erdogan University, Rize, 53100, Turkey. E-mail: hatice.bal@erdogan.edu.tr
El objetivo de este estudio fue proveer una primera aproximación del crecimiento, la reproducción y las relaciones entre la longitud y el peso deSymphodus ocellatusen el sureste del mar Negro, Turquía. Se recolectaron un total de 320 especímenes (273 machos, 47 hembras) entre junio de 2015 y mayo de 2016, y se estimaron sus parámetros biológicos para cada sexo y sexos combinados. Las longitudes totales variaron de 6.90 a 13.70 cm y los parámetros (a,b) en las relaciones de potencia longitud-peso fuerona= 0.065 yb= 2.38 para machos ya= 0.102 yb= 2.20 para hembras. La edad se estimó exitosamente con procedimientos comúnmente aceptados para otolitos. Los parámetros de crecimiento de von Bertalanffy de la estimación de la edad de los otolitos fueronL ∞ = 12.66 cm,k= 0.764,t 0 = -1.151 (clases de edad entre 0 y 3 años) para machos yL ∞ = 14.15 cm,k= 0.764,t 0 = -0.188 (clases de edad de 1 a 3 años) para hembras. El índice gonadosomático mensual reflejó un periodo de desove entre abril y julio, con un pico de desove en mayo-junio. El presente estudio proporciona la primera estimación del crecimiento y la reproducción deS. ocellatusen el sureste del mar Negro de Turquía y compara los resultados con aquellos de otras áreas.
Palabras clave: factor de condición; estimación de edad; relación peso-longitud; periodo de desove; Symphodus ocellatus
The aim of this study was to provide a first approximation of the growth, reproduction, and length-weight relationships ofSymphodus ocellatusin the southeastern Black Sea, Turkey. A total of 320 specimens (273 males, 47 females) were collected between June 2015 and May 2016, and their biological parameters were estimated for each sex and both sexes combined. Total length ranged from 6.90 to 13.70 cm and the parameters (a,b) in the power length-weight relationships werea= 0.065 andb= 2.38 for males anda= 0.102 andb= 2.20 for females. Age was successfully estimated by commonly accepted procedures for otolith analysis. The von Bertalanffy growth parameters from the otolith age estimation wereL ∞= 12.66 cm,k= 0.764, andt 0 = -1.151 (0-3 years) for males, andL ∞= 14.15 cm,k= 0.764, andt 0 = -0.188 (1-3 years) for females. The monthly gonadosomatic index values reflected a spawning period between April and July, with a spawning peak in May-June. The present study provides the first estimate of the growth and reproduction ofS. ocellatusin the southeastern Black Sea of Turkey and compares the results with those from other areas.
Key words: condition factor; age estimation; length-weight relationship; spawning period; Symphodus ocellatus
Introducción
El tordo ocelado,Symphodus ocellatus(Linnaeus 1758), es una especie residente común en el mar Negro, el mar Adriático, el mar Mediterráneo y el mar de Azov (Hureau 1986), donde habita fondos rocosos y mantos de pastos marinos (Lejeune 1985, Hureau 1986, Harmelin 1987). AunqueS. ocellatusse puede encontrar entre 1 y 30 m de profundidad, estos peces generalmente permanecen en el bentos durante toda su vida, donde se alimentan de moluscos, gasterópodos, crustáceos y foraminíferos (Bell y Harmelin-Vivien 1983, Lejeune 1985). Cuando se alejan del bentos,S. ocellatusse puede encontrar en la columna de agua alimentándose de plancton (e.g., copépodos) cuando este es abundante (Bell y Harmelin-Vivien 1983, Lejeune 1985).Symphodus ocellatuspresenta longitudes de 8 a 12 cm y vive de 3 a 5 años (Lejeune 1985, Hureau 1986, Harmelin 1987). La amplia distribución y alta densidad deS. ocellatusen los mares antes mencionados ha resultado en que esta especie ictiológica se emplee comúnmente para estimar impactos ecológicos (e.g., perturbaciones antropogénicas o naturales).
En otoño, los juveniles deS. ocellatusse convierten en cuantiosas presas para otras especies dada su gran abundancia (24-85 juveniles por 100 m2; P. Francour, com. pers.; Levi et al. 2005). La reproducción deS. ocellatusocurre entre mayo y julio en el noroeste del mar Mediterráneo (Quignard y Pras 1986), con machos que exhiben 3 fenotipos distintos con diferentes características de comportamiento (i.e., machos paternales, machos tipo satélite y machos furtivos; Warner y Lejeune 1985, Taborsky et al. 1987). Los machos construyen nidos de algas en depresiones rocosas, que se convierten en sitios de desove para las hembras (Alonzo et al. 2000). Los embriones dentro de los huevos fertilizados se desarrollan durante 3-4 días antes de eclosionar y entrar al plancton como larvas (Alonzo et al. 2000).
Varios estudios han investigado los comportamientos reproductivos deS. ocellatus(Warner y Lejeune 1985, Taborsky et al. 1987, Bentivegna y Benedetto 1989, Budaev y Zworykin 1998, Alonzo et al. 2000, Alonzo y Warner 2000, Stiver y Alonzo 2013, Sinopoli et al. 2014, Stiver et al. 2014). Por otro lado, Mouillot et al. (1999) evaluaron la distribución de esta especie, mientras que Škeljo y Ferri (2012) evaluaron la morfología de sus otolitos, y Peskov y Manilo (2018), las relaciones de tamaño-edad y la plasticidad sexual en el mar Negro. Sin embargo, parte de la información sobre la edad y el crecimiento proviene de estudios realizados hace más de un cuarto de siglo (Pauly 1978, Quignard y Pras 1986).
La gestión pesquera es importante para garantizar una pesca sostenible y debe adaptarse para cumplir con los requisitos de las diferentes áreas de pesca (Uzer et al. 2019). Se deben estudiar algunos parámetros de la población, como la edad y el crecimiento de los peces, para mejorar nuestra comprensión de la biología pesquera y las estrategias de gestión actuales, que son fundamentales para preservar las poblaciones en el futuro. Se utilizan varios métodos para determinar la edad de los peces (Treble et al. 2008). Los incrementos de crecimiento en los otolitos se utilizan ampliamente y pueden proporcionar información sobre el crecimiento anual (Campana y Thorrold 2001). La información biológica deS. ocellatus, una especie no comercial, es muy limitada, a pesar de su importancia ecológica en la región. Por lo tanto, el objetivo de este estudio fue describir las características biológicas fundamentales deS. ocellatus, incluida la edad, el crecimiento, la proporción de sexos, la condición de los peces, el periodo de desove y las relaciones entre la longitud y el peso en el sureste del mar Negro.
Materiales y métodos
Muestreo
Este estudio se realizó a lo largo de la costa de Rize en el sureste del mar Negro, Turquía (Fig. 1). Todos los especímenes deS. ocellatusse recolectaron de los descartes de la flota comercial, que se obtuvieron con trasmallos (malla de 36 y 40 mm) a profundidades de 10 a 40 m desde junio de 2015 hasta mayo de 2016. El número de especímenes por sexo y por sexos combinados por mes se presenta en la Tabla 1. Las muestras se transportaron a un laboratorio de la Facultad de Pesca de la Universidad Recep Tayyip Erdogan, Rize (Turquía), donde se midieron inmediatamente (longitud total, LT) con una precisión de 0.10 cm y se pesaron a los 0.10 g más cercanos. El sexo se determinó por medio de un examen macroscópico de las gónadas.
Tabla 1. Número de especímenes deSymphodus ocellatuspor sexo y sexos combinados recolectados por mes en el sureste del mar Negro.
| Sex/Month | February | March | April | May | June | July | August | September | October | December |
| Female | 6 | 0 | 10 | 1 | 1 | 8 | 6 | 0 | 15 | 0 |
| Male | 10 | 14 | 5 | 29 | 54 | 85 | 39 | 29 | 0 | 8 |
| All | 16 | 14 | 15 | 30 | 55 | 93 | 45 | 29 | 15 | 8 |
Proporción sexual
Las distribuciones de la frecuencia de longitudes por mes para hembras y machos se calcularon utilizando intervalos de clase de 0.50 cm y la LT. Se utilizó la prueba de chi cuadrada para calcular la proporción de sexos. Las desviaciones de 1.00:1.00 se probaron mediante el análisis de chi cuadrada (Dagnelie 1975).
Relaciones longitud-peso, factor de condición e índice gonadosomático
La relación longitud-peso (RLP) se determinó con la ecuaciónW=aL b (Ricker 1975), dondeWes el peso total (g),aes el intercepto,bes la pendiente yLes la LT (cm). La variación debde 3 se evaluó con una pruebatde una muestra. El grado de asociación entre variables se determinó conr 2(King 1995).
El factor de condición es la relación entre el peso corporal y la longitud, que refleja la interacción entre las variables bióticas y abióticas con respecto al estado fisiológico de los peces (Le Cren 1951). El factor de condición (K) se calculó con la ecuaciónK=W/aL b (Le Cren 1951), dondeWes el peso total observado (g) yaL b es el peso estimado obtenido de la RLP (Le Cren 1951). Se evaluaron la edad y el sexo estacionales para determinar cómo estos afectan la condición de los peces utilizando un modelo lineal general. Los datos se analizaron estadísticamente con SPSS (versión 15) para Windows.
La temporada de desove en los peces se puede estimar a partir de las etapas de madurez gonadal o el índice gonadosomático (IGS), el cual es un buen indicador de la actividad reproductiva (Rizzo y Bazzoli 2020). Se registró el sexo y se midió el peso húmedo de las gónadas con una precisión de 0.01 g. Mensualmente, los valores del IGS se calcularon tanto para hembras como para machos con la ecuación de Avşar (2005): IGS =Wgonad/W× 100, dondeWgonades el peso de las gónadas (g) yWes el peso total del pez (g).
Edad y crecimiento
Para determinar la edad, se extrajeron, limpiaron y almacenaron los otolitos de 320 peces en tubos Eppendorf que contenían etanol al 70% durante 3 a 4 semanas. La edad se estimó contando el número de bandas opacas (claras = crecimiento rápido) y bandas hialinas (oscuras = crecimiento lento) en los otolitos sagitales bajo luz reflejada (Panfili et al. 2002).
Las estimaciones de edad fueron realizadas por un solo lector que interpretó y contó las bandas de crecimiento hialino (annuli; Landa et al. 2014; Fig. 2) siguiendo el esquema general de interpretación de márgenes de otolitos acordado para varias especies (Vitale et al. 2019). Se tomó como fecha de nacimiento el 1 de enero. El esquema de estimación de la edad por trimestre se muestra en la Tabla 2. En el esquema se consideraron varios factores, como el tipo de borde (hialino y opaco), la resolución de la edad, la fecha de captura, el día de nacimiento teórico y el número deannuli(ICES 2017). Dada la fecha de nacimiento mencionada anteriormente, si se observaba una banda hialina en el borde del otolito durante la primera mitad del año, se contabilizaba como unannulus. Por el contrario, si se observaba una banda hialina en el borde del otolito durante la segunda mitad del año, no se contaba como un annulus (ICES 2012).
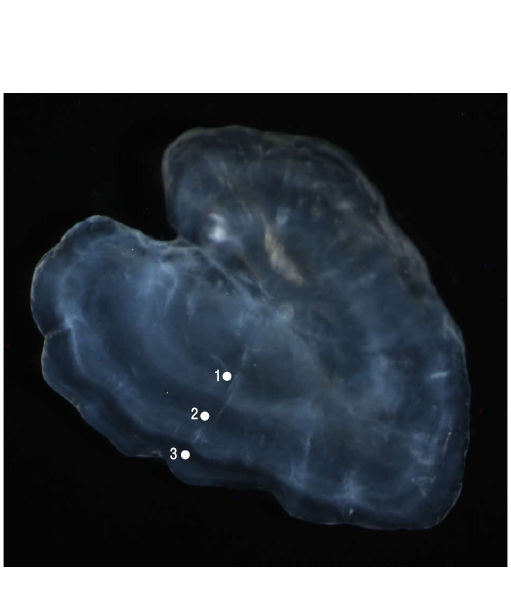
Figura 2. Otolito sagital de un individuo deSymphodus ocellatuscapturado en julio de 2015. Se observa un borde opaco y la edad estimada es de 3 años.
Tabla 2. Esquema de estimación de edad paraSymphodus ocellatuscon un día de nacimiento teórico del 1 de enero.
| Date of capture | Otolith edge | Age |
| First and second quarters | Translucent | N |
| Opaque | N+ 1 | |
| Third and fourth quarters | Translucent | N- 1 |
| Opaque | N |
Se tomaron imágenes de los otolitos utilizando una cámara digital Nikon SMZ1000 conectada a un microscopio estereoscópico Nikon SMZ1000 (aumento de ×0.8 a ×8.0; Nikon, Tokio, Japón) (Fig. 2). Se utilizó la prueba de 2 muestras de Kolmogorov-Smirnov para comparar la frecuencia de longitudes para cada edad entre sexos.
Análisis de los incrementos marginales de otolitos
Se realizaron 2 análisis de los incrementos marginales de otolitos. La naturaleza del margen (opaco o hialino) se identificó en 182 otolitos. Se evaluó la proporción de individuos con bordes hialinos y opacos por mes para determinar si se presentaba un patrón de formación anual y por edad para evaluar posibles diferencias ontogenéticas en el tiempo de formación de bordes opacos (Holden y Raitt 1974). Posteriormente, se utilizó el incremento marginal absoluto (IMA), que se estimó utilizando la distancia entre el final del último anillo hialino y el borde, y la distancia entre los 2 últimos anillos hialinos (Di, i-1) para estimar el incremento marginal relativo (IMR: IMA/Di, i-1, Panfili et al. 2002, Navarro et al. 2021). Solo se seleccionaron los otolitos completos y se midieron (μm) con un microscopio. Cada mes, se seleccionaron de 5 a 27 otolitos, lo que resultó en un total de 108 otolitos representativos de todo el intervalo de longitudes.
La función de crecimiento de von Bertalanffy se determinó con la siguiente fórmula:
dondet 0 es la edad teórica a la longitud 0,kes el coeficiente de crecimiento corporal,L ∞ es la longitud total máxima media asintótica yLtes la longitud total esperada a la edad detaños (von Bertalanffy 1938). El índice de rendimiento de crecimiento de Munro,Ø= log(k) + 2log(L ∞ ), se calculó para comparar los resultados de crecimiento obtenidos con los hallazgos de otros estudios (Pauly y Munro 1984). Los parámetros se determinaron por separado para machos, hembras y sexos combinados (R Foundation for Statistical Computing 2021-11-01) con los paquetes ‘FSA’ (Ogle et al. 2021), ‘FSAsim’ (Ogle 2020) y ‘nlstools’ (Baty et al. 2015).
Resultados
Composición por sexo y proporción de sexos
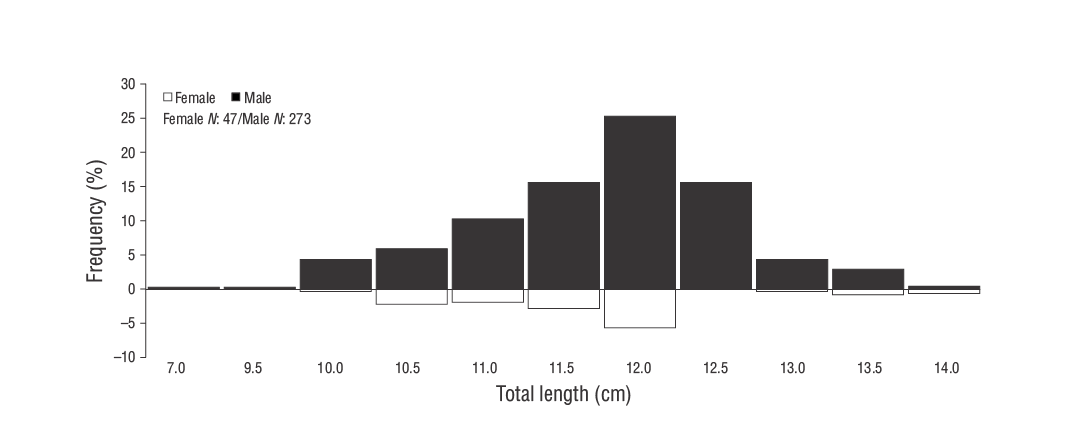
Durante el estudio se recolectaron un total de 320 individuos deS. ocellatus, de los cuales la mayoría eran machos (machos: 273, 85.31%; hembras: 47, 14.68%). Se obtuvo una proporción de sexos (femenino:masculino) de 1.00:5.80 que fue significativamente diferente de la proporción de 1.00:1.00 (P< 0.05). Los machos presentaron valores de LT yWentre 6.90 y 13.70 cm y 6.77 a 33.69 g, respectivamente, mientras que las hembras presentaron valores de LT yWentre 10.00 y 13.70 cm y entre 15.23 y 33.46 g, respectivamente. La Figura 3 muestra la distribución de la frecuencia de la LT por sexo delS. ocellatusdel sureste del mar Negro. Se observó una variación mensual en la proporción de sexos a lo largo del periodo de estudio, con una proporción mucho mayor de machos que de hembras de mayo a septiembre (Tabla 1).
Relaciones longitud-peso, factor de condición e índice gonadosomático
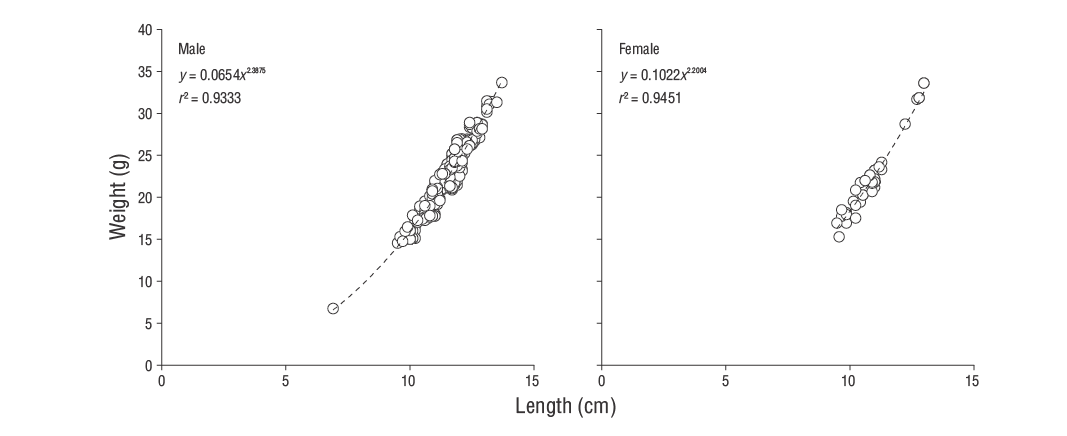
Tanto los machos como las hembras deS. ocellatusexhibieron alometría negativa (b< 3; pruebat:P< 0.050; Fig. 4). La RLP mostró un buen ajuste (r 2= 0.93,P< 0.001), y los parámetros de regresión se presentan en la Tabla 3.Kse calculó para todos los sexos y grupos de edad (Tabla 3). No se encontró un efecto significativo de la edad y el sexo sobreKsegún el análisis del modelo lineal general (P> 0.050), aunque la temporada sí tuvo un efecto significativo (P< 0.050). Los valores más altos deKse observaron en primavera y verano, después de lo cual cayeron bruscamente en otoño y alcanzaron los valores más bajos en invierno (Fig. 5a).
Tabla 3. Parámetros de crecimiento de Von Bertalanffy (L ∞ = longitud asintótica,k= coeficiente de crecimiento corporal yt 0 = edad teórica), índice de rendimiento de crecimiento (Ø), parámetros de relación longitud-peso (a= intersección yb= pendiente de la relación) y número deSymphodus ocellatus(n) analizados en el sureste del mar Negro (r 2= coeficiente de determinación de cada función).
| Sex | n | L ∞ | k | t 0 | r 2 | Ø | a | b | r 2 |
| Female | 47 | 14.150 | 0.764 | -0.188 | 0.990 | 2.068 | 0.102 | 2.200 | 0.940 |
| Male | 273 | 12.660 | 0.764 | -1.151 | 0.950 | 1.975 | 0.065 | 2.388 | 0.930 |
| Combined sexes | 320 | 12.630 | 0.791 | -1.080 | 0.950 | 2.000 | 0.070 | 2.362 | 0.930 |
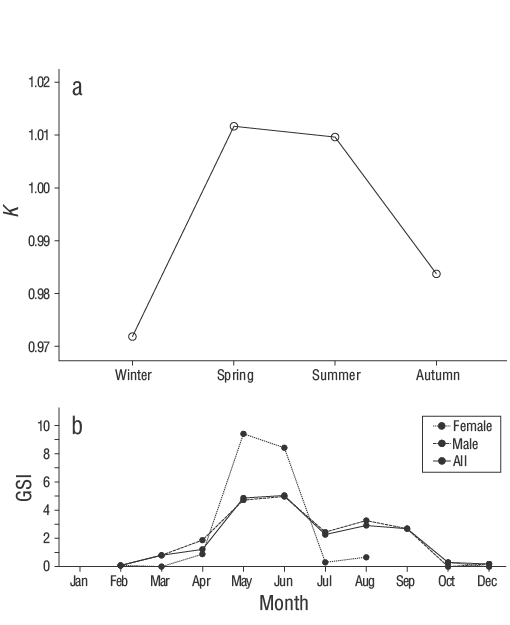
Figura 5. (a) Valores del factor de condición estacional (K) de sexos combinados y (b) valores del índice gonadosomático mensual (GSI) por sexo y sexos combinados deSymphodus ocellatusen el sureste del mar Negro.
El periodo reproductivo de los machos ocurre de mayo a septiembre, con un pico de mayo a junio. El periodo completo de desove de las hembras aún no se conoce debido al bajo número de hembras en este estudio; sin embargo, las hembras también mostraron un claro pico de desove de mayo a junio. La única conclusión que se puede sacar con la información limitada disponible para las hembras es que el periodo máximo reproductivo para toda la población parece ocurrir de mayo a junio (Fig. 5b).
Edad y crecimiento
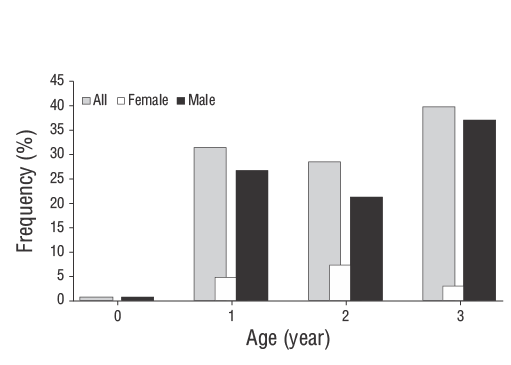
El análisis de la composición por edades reveló que la edad de la mayoría de los individuos era 1-3 años (85% machos). Solo 2 especímenes presentaron una edad de 0. La Figura 6 muestra la distribución de la composición por edades por sexo. Se determinó que la longitud mínima a la edad 0 era 6.90 cm, mientras que la longitud máxima a la edad 3 era 13.70 cm (Tabla 4). De acuerdo con los resultados de la prueba de Kolmogorov-Smirnov, la diferencia de la LT entre sexos a la edad de 1 año no fue significativa (P> 0.050) cuando se compararon las distribuciones de las longitudes para cada edad. Se encontró una diferencia significativa en la LT entre sexos en peces de 2 (Z= 1.402,P< 0.050) y 3 (Z= 1.560,P< 0.050) años de edad. Las claves de edad-longitud de machos y hembras se presentan en la Tabla 5. Los valores medios de la LT a las edades 2 y 3 fueron más altos en las hembras que en los machos.
Tabla 4. Datos biométricos básicos por sexo deSymphodus ocellatusen el sureste del mar Negro.
| Total length (cm) | Total weight (g) | Condition factor | ||||||||
| Age group | Sex | N | Mean ± SD | Range | Mean ± SD | Range | Mean ± SD | Range | ||
| 0 | Male | 2 | 8.20 ± 0.65 | 6.90-9.50 | 10.66 ± 2.93 | 6.77-14.56 | 1.85 ± 0.08 | 1.65-2.06 | ||
| 1 | Female | 15 | 10.56 ± 0.22 | 10.00-11.10 | 18.35 ± 1.03 | 15.23-20.78 | 1.53 ± 0.02 | 1.38-1.68 | ||
| Male | 85 | 10.64 ± 0.09 | 9.60-11.40 | 18.59 ± 0.44 | 14.77-22.97 | 1.48 ± 0.01 | 1.26-1.69 | |||
| 2 | Female | 23 | 11.50 ± 0.17 | 11.00-11.60 | 21.94 ± 0.78 | 20.60-23.11 | 1.43 ± 0.02 | 1.34-1.62 | ||
| Male | 68 | 11.53 ± 0.10 | 11.00-11.80 | 22.41 ± 0.49 | 17.79-25.20 | 1.42 ± 0.01 | 1.25-1.58 | |||
| 3 | Female | 9 | 12.92 ± 0.29 | 11.80-13.70 | 29.03 ± 1.26 | 23.20-33.46 | 1.33 ± 0.03 | 1.27-1.43 | ||
| Male | 118 | 12.28 ± 0.08 | 11.80-13.70 | 26.23 ± 0.37 | 21.47-33.69 | 1.37 ± 0.00 | 1.22-1.58 | |||
Tabla 5. Claves de edad-longitud por sexo deSymphodus ocellatusen el sureste del mar Negro.
| Length (cm) | Females (N) | Males (N) | |||||||||||
| Age (year) | Age (year) | Total | |||||||||||
| N | 0 | 1 | 2 | 3 | N | 0 | 1 | 2 | 3 | N | |||
| 7.00 | 0 | 1 | 1 | 1 | |||||||||
| 9.50 | 0 | 1 | 1 | 1 | |||||||||
| 10.00 | 1 | 1 | 14 | 14 | 15 | ||||||||
| 10.50 | 7 | 7 | 19 | 19 | 26 | ||||||||
| 11.00 | 6 | 5 | 1 | 33 | 28 | 5 | 39 | ||||||
| 11.50 | 9 | 2 | 7 | 50 | 24 | 26 | 59 | ||||||
| 12.00 | 18 | 15 | 3 | 81 | 37 | 44 | 99 | ||||||
| 12.50 | 0 | 50 | 50 | 50 | |||||||||
| 13.00 | 1 | 1 | 14 | 14 | 15 | ||||||||
| 13.50 | 3 | 3 | 9 | 9 | 12 | ||||||||
| 14.00 | 2 | 2 | 1 | 1 | 3 | ||||||||
| Total | 47 | 0 | 15 | 23 | 9 | 273 | 2 | 85 | 68 | 118 | 320 | ||
| Mean length | 10.76 | 11.80 | 13.05 | 8.20 | 10.86 | 11.73 | 12.46 | ||||||
La curva de crecimiento de von Bertalanffy se ajustó a las longitudes por edad para todos los peces y para ambos sexos (Tabla 2). Los parámetros de crecimiento de von Bertalanffy estimados para los sexos combinados fueronL ∞= 12.63 cm,k= 0.791 año-1yt 0 = -1.080 años. La diferencia de los valores deL ∞ ,kyt 0 entre sexos fue significativa según el modelo fit1LT seleccionado con base en el criterio de información de Akaike (P< 0.001). Las hembras alcanzaron una LT asintótica mayor (L ∞ = 14.15 cm) que los machos (L ∞= 12.66 cm) y también crecieron ligeramente más rápido (Ø= 2.068 en hembras) que los machos (Ø= 1.975).
Análisis de los incrementos marginales de los otolitos
La Figura 7s muestra que la mayoría de los otolitos presentaron bordes hialinos en el primer y segundo trimestre y bordes opacos en el tercero y cuarto trimestre. También se observaron algunos bordes opacos en la primera mitad del año en abril. El porcentaje de bordes de otolitos opacos comenzó a aumentar en febrero y para abril más del 50% de los otolitos tenían bordes opacos; después de abril, el porcentaje empezó a disminuir hasta julio y posteriormente aumentó de julio a diciembre (Fig. 7s). Por lo tanto, en el sureste del mar Negro, los incrementos de crecimiento hialino en los otolitos deS. ocellatusse forman en invierno. Los valores más bajos de IMA e IMR se observaron de enero a febrero y los más altos de marzo a septiembre, aunque disminuyeron de junio a julio (Fig. 7b). Tras analizar el tipo de borde por grupo de edad, se observó una tendencia a la baja de marzo a julio para las edades de 2 y 3 años, seguida de un fuerte ascenso hasta octubre. Para los individuos de 1 año de edad, diciembre exhibió un porcentaje de bordes opacos superior al 50% (Fig. 7c).

Figura 7. Resultados del análisis de los incrementos marginales de otolitos deSymphodus ocellatusen el sureste del mar Negro: (a) proporción mensual de bordes opacos (negros) e hialinos (grises); (b) valores medios mensuales del incremento marginal relativo (RMD) y el incremento marginal absoluto (AMD); (c) proporción mensual de bordes opacos por grupo de edad.
Discusión
Este estudio es la primera aproximación a la descripción de los aspectos biológicos deS. ocellatusen el sureste del mar Negro basada en muestras mensuales recolectadas desde junio de 2015 hasta mayo de 2016. No obstante, se necesitan estudios adicionales que incluyan tiempos de muestreo más largos para determinar si las diferencias estacionales encontradas en este estudio son constantes a lo largo del tiempo.
Composición por sexo y proporción de sexos
El mayor valor de LT deS. ocellatusobtenido en el presente estudio (13.70 cm) fue claramente inferior al mayor valor de LT de 18.50 cm registrado previamente dentro de su distribución (Altın et al. 2015), aunque nuestro valor fue mayor que los reportados para los mares Egeo, Mediterráneo y Mármara (6.60-10.70 cm; Valle et al. 2003, Özaydın et al. 2007, İlhan et al. 2008, Gürkan et al. 2010, Keskin y Gaygusuz 2010, Kasapoglu y Duzgunes 2013, Bilge et al. 2014, Kurtele et al. 2019). Esta diferencia en LT probablemente no se deba al tamaño de la muestra porque en otros estudios se analizó un número variable de especímenes. Por lo tanto, esta diferencia puede deberse a la variabilidad biogeográfica en la tasa de crecimiento y a las diferencias en la presión pesquera local (Pallaoro y Jardas 2003), que probablemente influyen en la estructura de las poblaciones en diferentes áreas.
La información sobre la proporción de sexos es necesaria para comprender las relaciones entre la dinámica de la población, los individuos y el medio ambiente (Vicentini y Araújo 2003). La proporción de sexos varía entre especies, poblaciones y periodos dentro de la misma población, y muchos factores, como las condiciones ambientales, la disponibilidad de alimentos y el comportamiento reproductivo, pueden hacer que la proporción de sexos difiera de 1.00:1.00 (Nikolsky 1963, Vandeputte et al. 2012). La gran desviación de la proporción de sexos teórica y esperada de 1.00:1.00 que se encontró en este estudio indica que los machos claramente dominaban sobre las hembras. Una proporción mayor, aunque no muy alta, de machos deS. ocellatustambién se ha encontrado en otras áreas. Por ejemplo, se obtuvo una proporción de sexos de 1.11:1.00 para especímenes deS. ocellatuscapturados a lo largo de la costa del mar Negro de Ucrania (Peskov y Manilo 2018) con 80 especímenes recolectados entre 1958 y 2013. De manera similar, los machos de su congénereSymphodus tincatambién fueron predominantes durante los periodos reproductivos a lo largo del periodo de muestreo en estudios realizados a lo largo de la costa de Croacia (1.43:1.00; Pallaoro y Jardas 2003) y en el noreste de Túnez (1.38:1.00; Ben Slama et al. 2010). Para el tabernero (Ctenolabrus rupestris), Sayer et al. (1995) reportaron una proporción de sexos de 1.12:1.00 en diferentes áreas costeras de Escocia.
La proporción de sexos puede variar por temporada o región dependiendo de las preferencias de hábitat de cada sexo. Por ejemplo, se han observado tendencias de agrupamiento basadas en el sexo y patrones de migración diferenciales basados en el sexo y la edad (Nilsson 1970). Sin embargo, se requieren investigaciones adicionales basadas en tamaños y tiempos de muestreo más grandes para abordar completamente este tema en el sureste del mar Negro. La proporción mucho mayor de machos a hembras observada de mayo a septiembre en este estudio coincide con una parte del periodo estimado de desove, lo que podría indicar un comportamiento diferencial basado en el sexo deS. ocellatuscon respecto a su distribución y, por lo tanto, a la reproducción.
Symphodus ocellatusexhibe 3 fenotipos masculinos (paternal, satélite y furtivo) con diferentes características físicas y de comportamiento (Taborsky et al. 1987). Los machos paternales cortejan a las hembras, construyen y defienden los nidos, y brindan cuidado parental. Los machos furtivos no defienden ni cuidan los nidos y no cortejan a las hembras (Taborsky et al. 1987, Alonzo et al. 2000). Los machos tipo satélite se asocian con un macho paternal y cortejan a las hembras, pero no construyen nidos ni brindan cuidado parental (Alonzo y Warner 2000, Alonzo 2008). Numerosos machos se encuentran en las áreas de anidación durante la temporada de desove, y las proporciones de estos 3 fenotipos masculinos pueden variar entre sitios (Alonzo y Warner 2000, Alonzo y Heckman 2010).
Relaciones longitud-peso, factor de condición e índice gonadosomático
El valor de la pendiente (b) de las RLP para los sexos combinados que se estimó en este estudio (2.36) fue muy bajo en comparación con los de otros estudios realizados en otras áreas mediterráneas (3.08-3.22; Tabla 6). Dos estudios con los tamaños de muestra más grandes y valores de LT representativos deS. ocellatus(Keskin y Gaygusuz 2010, Altın et al. 2015) reportaron valores altos debsimilares (3.10-3.20) en áreas mediterráneas relativamente cercanas a nuestra área de estudio. El presente estudio se ve limitado en comparación con otros estudios debido a que no incluimos especímenes menores de 9.50 cm (excepto uno), lo cual podría haber ocasionado el bajo valor debque obtuvimos. Carlander (1977) y Froese (2006) demostraron que los valores deb<2.5 o >3.5 a menudo se derivan de muestras con rangos de tamaño estrechos. Las diferencias entre la condición de especímenes grandes y pequeños pueden variar entre años, localidades y temporadas y dan como resultado diferentes relaciones de peso-longitud (Froese 2006).
Tabla 6. Parámetros de la relación longitud-peso deSymphodus ocellatusestimados en el presente estudio y de otros estudios en el Mediterráneo y el mar Negro.
| N | Total length range (cm) | Total weight range (g) | a | b | r 2 | |
| Mediterranean | ||||||
| Valle et al. (2003) | 456 | 3.00-9.00 | - | 0.009 | 3.170 | 0.960 |
| Kurtela et al. (2019) | 118 | 2.20-7.80 | 0.10-7.00 | 0.012 | 3.010 | 0.970 |
| Aegean Sea | ||||||
| Özaydın et al. (2007) | 216 | 4.70-9.70 | - | 0.009 | 3.220 | 0.960 |
| İlhan et al. (2008) | 328 | 4.70-9.20 | 1.10-10.56 | 0.009 | 3.190 | 0.970 |
| Gürkan et al. (2010) | 10 | 4.30-6.60 | 0.59-2.79 | 0.004 | 3.480 | 0.980 |
| Bilge et al. (2014) | 274 | 4.60-9.00 | - | 0.010 | 3.130 | 0.950 |
| Altın et al. (2015) | 1922 | 1.22-18.50 | 0.01-81.69 | 0.010 | 3.200 | 0.980 |
| Marmara Sea | ||||||
| Keskin and Gaygusuz (2010) | 575 | 1.80-10.70 | - | 0.010 | 3.080 | 0.970 |
| Black Sea | ||||||
| Present study (females) | 47 | 10.00-13.70 | 15.23-47.53 | 0.102 | 2.200 | 0.940 |
| Present study (males) | 273 | 6.90-13.70 | 6.77-79.97 | 0.065 | 2.380 | 0.930 |
| Present study (combined sexes) | 320 | 6.90-13.70 | 6.77-79.97 | 0.069 | 2.360 | 0.930 |
Los valores medios deKoscilaron entre 0.880 y 1.100. Un valor alto deKimplica que las condiciones ambientales son adecuadas para una determinada población de peces (Blackwell et al. 2000). Como el valor deKen nuestro estudio fue superior a 1.000, las condiciones ambientales en el sureste del mar Negro son adecuadas paraS. ocellatus. Sin embargo, el número de hembras en nuestro estudio fue muy bajo y varió mensualmente. Esto puede influir enKdado que el valor deKse ve afectado por variables como la longitud del pez, el método de muestreo, el ambiente, la fuente de alimento, el periodo de desove y la tasa de crecimiento (Le Cren 1951).
En este estudio, los valores más bajos deKse observaron en invierno, mientras que los valores más altos se observaron en primavera y verano. Le Cren (1951) también informó que elKdisminuye en invierno, aumenta en primavera y verano y vuelve a disminuir en otoño. La baja temperatura del mar es un factor que influye negativamente en los procesos metabólicos (e.g., asimilación, digestión, ingestión) y, por ende, en la tasa de crecimiento de los peces. Por lo tanto, el invierno es un periodo de supervivencia particularmente importante para los peces (revisado por Hurst 2007). Durante los periodos de baja disponibilidad de alimentos y/o temperatura, elKdisminuye. Los valores deKestimados en este estudio aumentaron a medida que se acercaba la temporada de desove, lo que probablemente se relacionó con la aparición de condiciones ambientales favorables, y posteriormente disminuyeron drásticamente después del verano.
El hermafroditismo, un cambio de sexo con la edad, se observa en algunas especies deSymphodus(Quignard 1966, Remacle 1970), comoSymphodus melanocercus, aunque esto no se ha observado enS. ocellatus(Warner y Lejeune 1985). Se ha reportado que los machos deS. ocellatusmuestran diferentes comportamientos reproductivos (Lejeune 1985). Por ejemplo, algunos machos construyen nidos y cuidan a los huevos (Gerbe 1864, Šoljan 1930, Taborsky et al. 1987), mientras que las hembras visitan estos nidos y ponen sus huevos en múltiples nidos (Taborsky et al. 1987).
Fiedler (1964), Voss (1976) y Lejeune (1985) reportaron que el periodo de reproducción deS. ocellatuspuede durar hasta 2 meses y ocurre entre mayo y junio en el mar Mediterráneo. Además, Quignard y Pras (1986) reportaron que la temporada de desove deS. ocellatusocurre durante 4 meses en primavera y verano (abril-julio) en el mar Mediterráneo, mientras que Bentivegna y Benedetto (1989) reportaron que la temporada de desove ocurre de mayo a agosto en la bahía de Nápoles en el mar Mediterráneo. Salekhova (1971) reportó que el desove de las especies deCrenilabruses multiporcional, y la reproducción en el mar Negro ocurre de abril a agosto, cuando la temperatura del agua oscila entre 12 y 26 °C, con un pico de desove desde finales de mayo hasta finales de junio. El pico de desove de mayo a junio reportado en este estudio para la costa de Rize en el sureste del mar Negro concuerda con los de estudios previos en áreas cercanas. A lo largo de las costas de Túnez, se reportó que los periodos reproductivos de la especie congénereS. tincay la familia Labridae ocurren de abril a junio (Ouannes-Ghorbel et al. 2002, Ben Slama et al. 2010) y de marzo a junio (Dieuzeide et al. 1954).
La temperatura del mar es un factor ambiental crítico que afecta el crecimiento de los peces, el desarrollo embrionario y larvario y la actividad reproductiva (Avşar 2005). Los cambios estacionales en la temperatura del mar afectan la reproducción de los peces. Por ejemplo, el aumento de temperatura estimula la reproducción en especies de peces que ponen huevos en primavera, mientras que la disminución de temperatura estimula la reproducción en especies que ponen huevos en otoño (Pankhurst y Munday 2011).
Edad y crecimiento
En este estudio se estimaron por primera vez los parámetros de crecimiento deS. ocellatusen el mar Negro. Además, presentamos una primera aproximación para establecer la edad y el crecimiento de esta especie en el mar Negro basada en datos de otolitos. Dada la ausencia de otros estudios de edad deS. ocellatusen el mar Negro, se realizó una comparación con el único otro estudio disponible, que se realizó hace 4 décadas (Pauly 1978) en el vecino mar Mediterráneo (Tabla 7). La edad máxima (5 años) deS. ocellatusestimada por Quignard y Pras (1986) fue superior a la edad máxima de 3 años estimada en este estudio.
Tabla 7. Una comparación de los parámetros de crecimiento de von Bertalanffy deSymphodus ocellatusySymphodus mediterraneusen el presente estudio en el mar Negro y en otras áreas del Mediterráneo.
| Reference | Species | Study area | Sex | L ∞(cm) | k(year-1) | t 0 (year) | Ø |
| Pauly D. (1978) | Symphodus ocellatus | Mediterranean Sea | Female | 10.300 | 0.645 | - | 1.840 |
| Male | 10.800 | 0.949 | - | 2.040 | |||
| Present study | Symphodus ocellatus | Black Sea | |||||
| Female | 14.150 | 0.764 | -0.188 | 2.068 | |||
| Male | 12.660 | 0.764 | -1.151 | 1.975 | |||
| Combined | 12.630 | 0.791 | -1.080 | 2.000 | |||
| Škeljo et al (2015) | Symphodus mediterraneus | Mediterranean Sea | Female | 14.110 | 0.330 | -1.420 | 1.810 |
| Male | 16.090 | 0.500 | -0.830 | 2.110 | |||
| All | 13.760 | 0.460 | -1.080 | 1.930 |
Se puede utilizar un índice de rendimiento para determinar los parámetros de crecimiento promedio para una especie dada (Sparre y Venema 1992) y es beneficioso cuando se evalúa el crecimiento bajo estrés ambiental (Pauly 1991). La tasa de crecimiento ligeramente más rápida en las hembras con longitudes asintóticas más grandes que los machos en este estudio contrasta con lo reportado en estudios previos deS. ocellatusen aguas del Mediterráneo frente a Francia (Pauly 1978) y de la especie congénereSymphodus mediterraneus(Škeljo et al. 2015), que exhibió mayores valores deØ,L ∞ yken machos que en hembras. Peskov y Manilo (2018) investigaron el tamaño por edad y la variabilidad de sexos enS. ocellatusa lo largo de la costa de Ucrania del mar Negro. Según sus resultados, los machos se caracterizaron por presentar valores significativamente más altos que las hembras. Sayer et al. (1995) señalaron la gran diferencia en el tamaño relativo de machos y hembras y el desarrollo gonadal anual para explicar las diferentes tasas de crecimiento entre sexos.
Las diferencias en el crecimiento pueden deberse a diferencias latitudinales en las variables oceanográficas, como la temperatura, o a diferencias biológicas en el mantenimiento del metabolismo y la dieta entre las poblaciones (Pauly 1994, Landa et al. 2002). La temperatura del agua afecta la fisiología de los peces y la disponibilidad de alimentos, lo que a su vez afecta la producción biológica (Weatherley y Gill 1987) y el crecimiento (Elizarov 1965). Por tanto, las condiciones ecológicas regionales pueden explicar la variación regional en el crecimiento, aunque no es posible discernir las causas detrás de las diferencias en el crecimiento sexual entre este estudio y el de Pauly (1978). Sin embargo, la diferencia de crecimiento observada enS. ocellatusentre las costas de Francia y el mar Negro podría deberse a diferencias en los recursos tróficos y la temperatura del agua.
El análisis de los bordes de los otolitos reveló que la periodicidad de la formación de losannulienS. ocellatuses probablemente anual. Así, los bordes opacos predominan en otoño y los bordes hialinos predominan durante los primeros meses del año (aunque no se dispone de información para enero). La formación de bandas opacas o hialinas se puede atribuir a variables como los ciclos estacionales de temperatura del mar, las condiciones de luz, los hábitos de alimentación de los peces y los ciclos reproductivos (Beckman y Wilson 1995).
Symphodus ocellatusno es una especie de pez comercialmente importante y no es una especie de pez objetivo en el mar Negro. Como tal, no se han definido límites mínimos de tamaño de desembarque para las capturas. El presente estudio proporciona los primeros datos sobre el crecimiento y la reproducción deS. ocellatusen el sureste del mar Negro de Turquía, que pueden ser de gran interés para futuras evaluaciones de la población para gestionar de forma sostenible sus poblaciones restantes. Se necesita más investigación para aumentar la precisión de las estimaciones presentadas en este estudio con respecto al periodo de reproducción de las hembras.
Agradecimientos
Agradezco a Semih Engin por su apoyo en la identificación de las especies de peces en este estudio. También agradezco al Sr. İbrahim Çolak por proporcionar muestras de peces cada mes.
REFERENCIAS
Alonzo SH. 2008. Female mate choice copying affects sexual selection in wild populations of the ocellated wrasse. Animal Behaviour. 75:1715-1723. https://doi.org/10.1016/j.anbehav.2007.09.031 [ Links ]
Alonzo SH, Heckman KL. 2010. The unexpected but understandable dynamics of mating, paternity and paternal care in the ocellated wrasse. Proc Royal Soc B. 277:115-122. https://doi.org/10.1098/rspb.2009.1425 [ Links ]
Alonzo SH, Taborsky M, Wirtz P. 2000. Male alternative reproductive behaviors in a Mediterranean wrasse,Symphodus ocellatus: Evidence from otoliths for separate life-history pathways. Evol Ecol Res. 2:997-1007. [ Links ]
Alonzo SH, Warner RR. 2000. Allocation to mate guarding or increased sperm production in a Mediterranean wrasse. Am Nat. 156:266-275. htps://doi.org/10.1086/303391 [ Links ]
Altın A, Ayyıldız H, Kale S, Alver C. 2015. Length-weight relationships of forty-nine fish species from shallow waters of Gökçeada Island, northern Aegean Sea. Turk. J Zool. 39(5):971-975. https://doi.org/10.3906/zoo-1412-15 [ Links ]
Avşar D. 2005. Fisheries Biology and Population Dynamics. Adana (Turkey): Akademisyen Kitapevi. 332 p. [ Links ]
Baty F, Ritz C, Charles S, Brutsche M, Flandrois JP, Delignette-Muller ML. 2015. A toolbox for nonlinear regression in R: The Package nlstools. Journal of Statistical Software. 66(5):1-21. https://doi.org/10.18637/jss.v066.i05 [ Links ]
Beckman DW, Wilson CA. 1995. Seasonal timing of opaque zone formation in fish otoliths. In: Secor DJ, Dean JM, Campana SE (eds.), Recent Developments in Fish Otolith Research. Columbia (OH): Belle W. Baruch. p. 27-44. [ Links ]
Bell JD, Harmelin-Vivien ML. 1983. Fish fauna of French Mediterranean Posidonia oceanica seagrass meadows. 2 - Feeding habits. Téthys. 11(1):1-14. [ Links ]
Ben-Slama K, Jouini A, Ben-Sallem R, Somalo S, Sáenz Y, Estepa V, Boudabous A, Torres C. 2010. Prevalence of broad-spectrum cephalosporin-resistantEscherichia coliisolates in food samples in Tunisia, and characterization of integrons and antimicrobial resistance mechanisms implicated. Int J Microbiol Food. 137(2-3):281-286. https://doi.org/10.1016/j.ijfoodmicro.2009.12.003 [ Links ]
Bentivegna F, Benedetto F. 1989. Gonochorism and seasonal variation in the gonads of the labridSymphodus(Crenilabrus)ocellatus(Forsskal). J Fish Biol. 34(3):343-348. https://doi.org/10.1111/j.1095-8649.1989.tb03317.x [ Links ]
Bilge G, Yapıcı S, Filiz H, Cerim H. 2014. Weight-length relations for 103 fish species from the southern Aegean Sea, Turkey. Acta Ichthyol Piscat. 44(3):263-269. https://doi.org/10.3750/AIP2014.44.3.11 [ Links ]
Blackwell BG, Brown ML, Willis DW. 2000. Relative weight (Wr) status and current use in fisheries assessment and management. Rev Fish Sci. 8(1):1-44. https://doi.org/10.1080/10641260091129161 [ Links ]
Budaev SV, Zworykin DD. 1998. Difference in shoaling behaviour between ocellated (Symphodus ocellatus) and long-striped (S. tinca) wrasses and its relation to other behavioural patterns. Mar Freshw Behav Phy. 31(2):115-121. https://doi.org/10.1080/10236249809387067 [ Links ]
Campana SE, Thorrold SR. 2001. Otoliths, increments, and elements: keys to a comprehensive understanding of fish populations? Can J Fish Aquat Sci. 58:30-38. https://doi.org/10.1139/cjfas-58-1-30 [ Links ]
Carlander KD. 1977. Handbook of freshwater fishery biology, volume 2. Ames (IA): The Iowa State University Press. 431 p. [ Links ]
Dagnelie P. 1975. Théorie et méthodes statistiques. Applications agronomiques. Tome II. Gembloux (Belgium): Presses agronomiques de Gembloux. 463 p. [ Links ]
Dieuzeide R, Novella M, Roland J. 1954. Catalogue des poissons des côtes algériennes. Bull Stn Aquic Pêche Castiglione. 6:1-384. [ Links ]
Elizarov AA. 1965. Long-term variations of oceanographic conditions and stocks of cod observed in the areas of west Greenland, Labrador and Newfoundland. ICNAF. 6:827-831. [ Links ]
Fiedler VK. 1964. Verhaltensstudien an Lippfischen der GattungCrenilabrus(Labridae, Perciformes). Z Tierpsychol. 21(5):521-591. https://doi.org/10.1111/j.1439-0310.1964.tb01207.x [ Links ]
Froese R. 2006. Cube law, condition factor and weight-length relationships: history, meta-analysis and recommendations. J Appl Ichthyol. 22(4):241-253. https://doi.org/10.1111/j.1439-0426.2006.00805.x [ Links ]
Gerbe Z. 1864. Observations sur la nidification des Crenilabres. Rev Mag Zool. 16:255-258. [ Links ]
Gürkan S, Bayhan B, Akcinar SC, Taskavak E. 2010. Length-weight relationship of fish from shallow waters of Candarli Bay (North Aegean Sea, Turkey). Pakistan J Zool. 42(4):495-498. [ Links ]
Harmelin JG. 1987. Structure et variabilité de l’ichtyofaune d’une zone rocheuse protégeé en Méditerranée (Pare national de Port-Cros, France). Mar Ecol. 8(3):263-284. https://doi.org/10.1111/j.1439-0485.1987.tb00188.x [ Links ]
Holden MJ, Raitt DFS. 1974. Manual of fisheries science. Part 2: Methods of resource investigation and their application. Rome (Italy): FAO Fish. Technical Report 115 (Rev. 1). 223 p. [ Links ]
Hureau JC. 1986. Labridae. In: Whitehead PJP, Bauchot ML, Hureau JC, Nielsen J, Tortonese E (eds.), Fishes of the northeastern Atlantic and the Mediterranean. Paris (France): UNESCO. p. 919-942. [ Links ]
Hurst TP. 2007. Causes and consequences of winter mortality in fishes. J Fish Biol . 71(2):315-345. https://doi.org/10.1111/j.1095-8649.2007.01596.x [ Links ]
[ICES] The International Council for the Exploration of the Sea. 2012. Report of the second workshop on age reading of red mullet and striped red mullet (WKACM2), 2-6 July 2012. Boulogne-sur-Mer (France): ICES. 52 p. Technical Report ICES CM 2012/ACOM:60 [ Links ]
[ICES] The International Council for the Exploration of the Sea. 2017. Workshop on Ageing Validation methodology ofMullusspecies (WKVALMU), 15-19 May 2017. Conversano (Italy). Technical Report ICESCM2017/ SSGIEOM. 74 p. [ Links ]
Ílhan DU, Akalın S, Tosunoglu Z, Ozaydın O. 2008. Length-weight relationships of fiveSymphodusspecies (Pisces: Perciformes) from İzmir Bay, Aegean Sea. Ege JFAS. 25(3):245-246. [ Links ]
Kasapoglu N, Duzgunes E. 2013. Length-weight relationships of marine species caught by five gears from the Black Sea. Mediterr Mar Sci. 15(1):95-100. https://doi.org/10.12681/mms.463 [ Links ]
Keskin Ç, Gaygusuz Ö. 2010. Length-Weight Relationships of fishes in shallow waters of Erdek Bay (Sea of Marmara, Turkey). Eur J Biol. 69(2):87-94. [ Links ]
King M. 1995. Fisheries biology, assessment and management. Oxford (England): Fishing News Books. 341 p. [ Links ]
Kurtela A, Antolović N, Glavić N, Kožul V. 2019. Length-weight relations and monthly occurrence of juvenile fish species from the Donji Molunat Bay, Croatia (South-East Adriatic Sea). Naše more. 66(3):1-5. https://doi.org/10.17818/NM/2019/3.7 [ Links ]
Landa J, Antolínez A, Barrado J, Fontenla J, Hernández C, Villamor B, Dueñas C, Navarro MR. 2014. Age determination procedures for benthic fish in Spanish Institute of Oceanography (IEO). Santander (Spain): Instituto Español de Oceanografia. 34 p. http://www.repositorio.ieo.es/e-ieo/bitstream/handle/10508/9859/Age%20estimation%20procedures%20of%20IEO%20for%20benthic%20fish%20species_Landa%20et%20al.pdf?sequence=1&isAllowed=y. Technical Report Int. Doc. IEO. https://doi.org/10.13140/2.1.4966.9445 [ Links ]
Landa J, Pérez N, Piñeiro C. 2002. Growth patterns of the four spot megrim (Lepidorhombus boscii) in the northeast Atlantic. Fish Res. 55(1-3):141-152. https://doi.org/10.1016/S0165-7836(01)00302-2 [ Links ]
Le Cren ED. 1951. The length-weight relationship and seasonal cycle in gonad weight and condition in Perch,Perca fluviatilis. J Anim Ecol. 20(2):201-219. https://doi.org/10.2307/1540 [ Links ]
Lejeune P. 1985. Le comportement social des Labridés mediterranéens: etude ecoethologique des comportements reproducteurs et sociaux des Labridés méditerranéens des genresSymphodusRafinesque, 1810, et Coris Lacepede, 1802. Cah Ethol Appl. 5:1-208. [ Links ]
Levi F, Boutoute M, Mayzaud P. 2005. Lipid composition ofSymphodus ocellatus(Perciforme: Labridae) in the north-western Mediterranean: influence of two different biotopes. MarBio. 146:805-814. https://doi.org/10.1007/s00227-004-1465-9 [ Links ]
Mouillot D, Culioli JM, Lepretre A, Tomasini JA. 1999. Dispersion statistic and sample size estimating for three species (Symphodus ocellatus,Serranus scribaandDiplodus annularis) in the Lavezzi Islands Marine Reserve (South Corsica, Mediterranian Sea). Mar Ecol . 20(1):19-34. https://doi.org/10.1046/j.1439-0485.1999.00064.x [ Links ]
Navarro MR, Landa J, Villamor B, Domínguez-Petit R. 2021. First approach to the growth and age corroboration of Northeast Atlantic chub mackerel (Scomber colias) in Northern Iberian waters. Estuar Coast Shelf Sci. 259:107433. https://doi.org/10.1016/j.ecss.2021.107433 [ Links ]
Nikolsky GV. 1963. The ecology of fishes. London (UK): Academic Press. 352 p. [ Links ]
Nilsson L. 1970. Local and seasonal variation in sex-ratios of diving ducks in south Sweden during the non-breeding season. Scandinavian Journal of Ornithology.1(2):115-128. https://doi.org/10.2307/3676029 [ Links ]
Ogle DH, Doll JC, Wheeler P, Dinno A. 2021. FSA: Fisheries Stock Analysis. R package version 0.9.1: Fish R Core Team; accessed 2021 July 17. https://github.com/droglenc/FSA. [ Links ]
Ogle DH. 2020. FSAsim: Simulate Data for Fisheries Stock Assessment Methods. Accessed 2020 Feb 12. http://derekogle.com/fishr, https://github.com/droglenc/FSAsim. [ Links ]
Ouannes-Ghorbel M, Bradai MN, Bouain A. 2002. Spawning period and sexual maturity ofSymphodus(Crenilabrus)tinca(Labridae) in Sfax coasts (Tunisia). Cybium. 26:89-92. [ Links ]
Özaydın O, Uçkun D, Akalın S, Leblebici S, Tosunoğlu Z. 2007. Length-weight relationships of fishes captured from Izmir Bay, central Aegean Sea. J Appl Ichthyol . 23(6):695-696. https://doi.org/10.1111/j.1439- 0426.2007.00853.x [ Links ]
Pallaoro A, Jardas I. 2003. Some biological parameters of the peacock wrasse,Symphodus(Crenilabrus)tinca(L. 1758) (Pisces: Labridae) from the middle eastern Adriatic (Croatian coast). Sci Mar. 67(1):33-41. https://doi.org/10.3989/scimar.2003.67n133 [ Links ]
Panfili J, Pontual (de) H, Troadec H, Wrigth PJ. 2002. Manual of Fish Sclerochronology. Brest (France): Ifremer-IRD coedition. p. 464. [ Links ]
Pankhurst NW, Munday PL. 2011. Effects of climate change on fish reproduction and early life history stages. Mar Freshw Res. 62(9):1015-1026. https://doi.org/10.1071/MF10269 [ Links ]
Pauly D. 1978. A preliminary compilation of fish length growth parameters. Berichte des Institut für Meereskundean der Christian-Albrechts-Universiitat Kiel. 55:1-200. [ Links ]
Pauly D. 1991. Growth performance in fishes: rigorous description of patterns as a basis for understanding causal mechanisms. Aquabyte. 4:3-6. [ Links ]
Pauly D, Munro JL. 1984. Once more on growth comparison in fish and invertebrates. ICLARM Fishbyte. 2(1):21-23. [ Links ]
Pauly D. 1994. A framework for latitudinal comparisons of flatfish recruitment. Neth J Sea Res. 32(2):107-118. https://doi.org/10.1016/0077-7579(94)90035-3 [ Links ]
Peskov VN, Manilo LG. 2018. Size-at-age and sex variability of plastic values in ocellated wrasse,Symphodus ocellatus(Linnaeus, 1758) (Labridae, Perciformes), in Northern part of the Black Sea. Зб пр Зоол муз. 49:3-15. [ Links ]
Quignard JP. 1966. Recherches sur les Labridae (poissons tèlèostèens perciformes) des cǒtes europèennes. Nat Monspel Ser Zool. 5:1-247. [ Links ]
Quignard JP, Pras A. 1986. Labridae. In: Whitehead PJP, Bauchot M-L, Hureau J-C, Nielsen J, Tortonese T (eds.), Fishes of the north-eastern Atlantic and the Mediterranean Vol. 2. Paris (France): UNESCO . p. 919-942. [ Links ]
Remacle C. 1970. Contribution à l'ètude de la sexualitè chez certains Labridae et Sparidae (teleostèens perciformes). Bulletin de l'Institut royal des sciences naturelles de Belgique. Entomol biol. 46:1-13. [ Links ]
Ricker WE. 1975. Computation and interpretation of biological statistics of fish populations. J Fish Res. 191:1-367. [ Links ]
Rizzo E, Bazzoli N. 2020. Chapter 13 - reproduction and embryogenesis. In: Baldisserotto B, Urbinati EC, Cyrino JEP (eds.), Biology and Physiology of Freshwater Neotropical Fish. Cambridge (MA): Academic Press. p. 287-313. [ Links ]
Salekhova LP. 1971. Embrionalnyi i ranniy postembrionalnyi periody razvitiya chernomorskih zelenushek rodaCrenilabrus. Biologiya morya. Vyp. 23. Voprosy ekologii ryb yuznyh morey. (Respubl. mezhvedomstvennyi sborn.). Kiev (Ukraine): Naukova dumka p. 36-77. [ Links ]
Sayer MDJ, Gibson RN, Atkinson RJA. 1995. Growth, diet and condition of goldsinny on the west coast of Scotland. J Fish Biol . 46(2):317-340. https://doi.org/10.1111/j.1095-8649.1995.tb05972.x [ Links ]
Sinopoli M, Cattano C, Chemello R, Timpanaro A, Timpanaro V, Gristina M. 2014. Nest building in a Mediterranean wrasse (Symphodus ocellatus): are the algae used randomly chosen or actively selected. Mar Ecol . 36(4):942-949. https://doi.org/10.1111/maec.12187 [ Links ]
Škeljo F, Brčić J, Vuletin V, Ferri J. 2015. Age and growth of the axillary wrasse,Symphodusmediterraneus (L.) from the eastern Adriatic Sea. Mar Biol Res. 11(7):780-784. https://doi.org/10.1080/17451000.2015.1016963 [ Links ]
Škeljo F, Ferri J. 2012. The use of otolith shape and morphometry for identification and size-estimation of five wrasse species in predator-prey studies. J Appl Ichthyol . 28(4):524-530. https://doi.org/10.1111/j.1439-0426.2011.01925.x [ Links ]
Šoljan T. 1930. Nestbau fines adriatischen lippfisches (Crenilabrus ocellatusforsk.). Z Morphol Oekol Tiere. 17:145-153. https://doi.org/10.1007/BF00406256 [ Links ]
Sparre P, Venema SC. 1992. Introduction to tropical fish stock assessment. Part 1. Manual. Rome (Itlay): [FAO] Food and Agriculture Organization of the United Nations. 376 p. Fisheries Technical Paper No. 306. [ Links ]
Stiver KA, Alonzo SH. 2013. Does the risk of sperm competition help explain cooperation between reproductive competitors? A study in the ocellated wrasse (Symphodus ocellatus). Am Nat . 181(3):357-368. https://doi.org/10.1086/669149 [ Links ]
Stiver KA, Harris RM, Townsend JP, Hofmann HA, Alonzo SH. 2014. Neural gene expression profiles and androgen levels underlie alternative reproductive tactics in the ocellated wrasse,Symphodus ocellatus. Ethology. 121(2):152-167. https://doi.org/10.1111/eth.12324 [ Links ]
Taborsky M, Hudde B, Wirtz P. 1987. Reproductive behaviour and ecology ofSymphodus(Crenilabrus)ocellatus, a European wrasse with four types of male behaviour. Behaviour. 102(1-2):82-117. https://doi.org/10.1163/156853986X00063 [ Links ]
Treble MA, Campana SE, Wastle RJ, Jones CM, Boje J. 2008. Growth analysis and age validation of a deepwater Arctic fish, the Greenland halibut (Reinhardtius hippoglossoides). Can J Fish Aquat. 65(6):1047-1059. https://doi.org/10.1139/F08-030 [ Links ]
Uzer U, Öztürk B, Yıldız T. 2019. Age composition, growth, and mortality of European hakeMerluccius merluccius(Actinopterygii: Gadiformes: Merlucciidae) from the northern Aegean Sea, Turkey. Acta Ichthyol Piscat . 49(2):109-117. https://doi.org/10.3750/AIEP/02465 [ Links ]
Valle C, Bayle JT, Ramos AA. 2003. Weight-length relationships for selected fish species of the western Mediterranean Sea. J Appl Ichthyol . 19(4):261-262. https://doi.org/10.1046/j.1439-0426.2003.00492.x [ Links ]
Vandeputte M, Quillet E, Chatain B. 2012. Are sex ratios in wild European sea bass (Dicentrarchus labrax) populations biased?. Aquat Living Resour. 25(1):77-81. https://doi.org/10.1051/alr/2012002 [ Links ]
Vicentini RN, Araújo FG. 2003. Sex ratio and size structure ofMicropogonias furnieri(Desmarest, 1823) (Perciformes, Sciaenidae) in Sepetiba Bay, Rio de Janeiro, Brazil. Braz J Biol 63(4):559-566. https://doi.org/10.1590/S1519-69842003000400003 [ Links ]
Vitale F, Worsøe-Clausen L, Ní Chonchúir G. 2019. Handbook of fish age estimation protocols and validation methods. Copenhagen (Denmark): ICES Cooperative Research. 180 p. Report No. 346. http://doi.org/10.17895/ices.pub.5221 [ Links ]
Von Bertalanffy L. 1938. A quantitative theory of organic growth (inquiries of growth laws II). Hum Biol. 10(2):181-213. [ Links ]
Voss J. 1976. A propos de quelques poissons de la Me´diterrane´e: le genreSymphodusRafinesque, 1810:Symphodus(Crenilabrus) melops L.,Symphodus ocellatusForskal, 1775. Revue française d’Aquariologie Herpétologie. 3:93-98. [ Links ]
Warner RR, Lejeune P. 1985. Sex change limited by paternal care: a test using four Mediterranean labrid fishes, genusSymphodus. Mar Biol. 87:89-99. https://doi.org/10.1007/BF00397010 [ Links ]
Weatherley AH, Gill HS. 1987. The biology of fish growth. London (UK): Academic Press . 443 p. [ Links ]
Recibido: 05 de Octubre de 2021; Aprobado: 25 de Julio de 2022; Publicado: 18 de Mayo de 2023











 texto em
texto em