Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.49 Ensenada ene./dic. 2023 Epub 08-Dic-2023
https://doi.org/10.7773/cm.y2023.3363
Artículos
Ciclo reproductivo y talla de madurez sexual de Selene peruviana (Perciformes: Carangidae) desembarcadas en las costas del Pacífico ecuatoriano
1Departamento de Biología, Facultad Ciencias del Mar y Ambientales, Universidad de Cádiz, 11510 Puerto Real, Cádiz-España.
2Facultad Ciencias del Mar, Universidad Laica “Eloy Alfaro” de Manabí, Av. Circunvalación - Vía a San Mateo, Manta-Ecuador.
El pez luna peruano, Selene peruviana, es un importante recurso desembarcado en las principales caletas pesqueras del Ecuador. A nivel local, existe poca información sobre la biología de esta especie, lo cual dificulta el desarrollo de planes de manejo. El presente estudio evalúa aspectos reproductivos de S. peruviana como la talla de madurez sexual y el ciclo reproductivo. Se obtuvieron muestras de capturas artesanales e industriales desde enero de 2017 hasta diciembre de 2018. Las características morfométricas, el sexo y la etapa de madurez de 886 especímenes fueron registrados y se estimó el índice gonadosomático (IGS), el índice hepatosomático (IHS) y el factor de condición relativo (Kn). La relación talla-peso y la talla de madurez sexual (L50) se evaluaron mediante la ecuación de alometría y análisis multimodelos, respectivamente. La talla media de captura (longitud total, LT) fue de 23.62 cm para los machos y 22.97 cm para las hembras. Se obtuvo una proporción de sexos (M:H) de 0.70:1.00 (χ2 = 26.28, P < 0.05). El factor alométrico de la relación longitud-peso para sexos combinados (b) fue 2.63 (t = 12.16, P < 0.05) y el coeficiente de determinación (r 2) fue 0.89, lo que sugiere una relación alométrica negativa. La L50 (LT) se estimó en 22.61, 23.86 y 23.27 cm para machos, hembras y sexos combinados, respectivamente. Los valores mensuales de IGS, IHS y Kn mostraron diferencias significativas (K-W, P < 0.05) entre los meses de estudio. Los valores máximos de IGS se observaron durante febrero y marzo, siendo el periodo de mayor actividad reproductiva. Los índices de IHS y Kn mostraron tendencias similares. La talla de madurez sexual fue similar a la talla media de captura, lo que podría indicar que S. peruviana se encuentra en el límite de su talla óptima de captura.
Palabras clave: factor de condición; índice hepatosomático; índice gonadosomático; alometría; Selene peruviana
The Peruvian moonfish (Selene peruviana) is an important fisheries resource that is landed in the main fishing harbors of Ecuador. At the local level, little information is available regarding the biology of this species, which hinders the development of management plans. The present study evaluates the reproductive characteristics of S. peruviana such as the size at sexual maturity and reproductive cycle. Specimens were obtained from artisanal and industrial catches from January 2017 to December 2018. The morphometric characteristics, sex, and maturity stage of 886 specimens were determined, and the gonadosomatic index (GSI), hepatosomatic index (HSI), and relative condition factor (Kn) were estimated. The length-weight relationship and length at sexual maturity (L50) were evaluated with an allometry equation and multi-model analyses, respectively. The mean capture size (total length, TL) was 23.62 cm for males and 22.97 cm for females. A sex ratio (M:F) of 0.70:1.00 (χ 2 = 26.28, P < 0.05) was obtained. The allometric factor of the length-weight relationship for both sexes (b) was 2.63 (t = 12.16, P < 0.05), and the coefficient of determination (r 2) was 0.89, which suggests that negative allometric growth was present. The L50 (TL) was estimated to be 22.61, 23.86, and 23.27 cm for males, females, and sexes combined, respectively. The monthly GSI, HSI, and Kn values were significantly different (K-W, P < 0.05) among study months. The maximum GSI values were observed in February and March, which constituted the period of highest reproductive activity. The HSI and Kn values exhibited similar trends. The size at sexual maturity was similar to the average catch size, which could indicate that S. peruviana is currently at the limit of its optimal catch size.
Key words: condition factor; hepatosomatic index; gonadosomatic index; allometry; Selene peruviana
INTRODUCCIÓN
La familia Carangidae presenta una gran variedad de especies de peces con 31 géneros (Nelson 2006, Froese y Pauly 2023). Estas especies se distribuyen en aguas tropicales y subtropicales de los océanos Atlántico, Pacífico e Índico y algunos tienen un alto valor económico y son explotados tanto por la pesca artesanal como por la industrial. Por ejemplo, la pesquería de jurel (Trachurus murphyi) en el océano Pacífico Sur se está convirtiendo en una de las pesquerías más importantes del mundo (Gerlotto et al. 2012, Lucano et al. 2016). Uno de los géneros más representativos de la familia Carangidae es Selene, el cual está compuesto por 8 especies que se distribuyen en las aguas costeras tropicales de los océanos Atlántico y Pacífico (Froese y Pauly 2022).
En Ecuador, Selene peruviana (Guichenot, 1866), conocida localmente como Carita, es un recurso importante para la pesca artesanal e industrial. Selene peruviana se encuentra en la plataforma continental en hábitats pelágicos y demersales y forma cardúmenes cerca del fondo entre 10 y 80 m de profundidad (Martinez 2005). Volúmenes considerables de esta especie se capturan con redes de cerco, arrastre y enmalle. Por ejemplo, la flota sardinera ecuatoriana capturó 5,402.8 t de S. peruviana como captura incidental en 2004. La cantidad de captura incidental ha disminuido desde entonces, con 2,680.49 t de captura incidental en 2019 (IPIAP 2022). Su carne, como la de varios miembros de la familia Carangidae, es muy cotizada y de alto consumo (Jiménez y Béarez 2004). Los efectos de la sobreexplotación de las pesquerías costeras se ven agravados debido a la contaminación, el cambio climático y el desarrollo urbano (Díaz et al. 2016) y se reflejan en reducciones en los volúmenes de captura, la biodiversidad, el tamaño de los organismos, las tasas de crecimiento, la capacidad reproductiva, la abundancia y la biomasa (González et al. 2007).
Para adquirir un conocimiento completo de las características biológicas de una población y para realizar evaluaciones exhaustivas de las poblaciones pesqueras, es fundamental contar con información sobre la proporción de sexos y los cambios en las fases de madurez que ocurren a lo largo del año (Holden y Raitt 1975). Estas características hacen posible la determinación del potencial reproductivo de estas poblaciones (Williams 2007). A nivel regional, existe poca investigación sobre la biología de S. peruviana. En Ecuador, la información documentada sobre su biología es escasa. Por lo tanto, el presente estudio contribuye al conocimiento de la dinámica reproductiva a través del análisis de la talla de madurez sexual y su ciclo reproductivo. Nuestros resultados ayudan establecer una línea base para futuras investigaciones y contribuye informacion valiosa para el manejo pesquero de este importante recurso.
MATERIALES Y MÉTODOS
Localidades de muestreo
Los muestreos de S. peruviana se realizaron entre enero 2017 y diciembre 2018. Los ejemplares fueron recolectados de las capturas artesanales con redes de enmalle en la caleta pesquera de Los Arenales (0°51ʹ02.93ʺ S, 80°32ʹ02.84ʺ O) y del desembarque de la flota industrial que opera con redes de cerco en el puerto pesquero de Manta (0°57ʹ00.18ʺ S, 80°42ʹ32.98ʺ O; Fig. 1). Las costas del Ecuador presentan una marcada estacionalidad ambiental. La estación lluviosa o húmeda ocurre de enero a mayo cuando se registra un aumento de la temperatura superficial del mar (TSM). La estación seca ocurre de julio a noviembre y se caracteriza por una disminución de la TSM, con junio y diciembre considerados periodos de transición (Perugachi et al. 2014, Prado y Cajas 2016).
Figura 1 Localización del área de estudio. Los sitios de muestreo se identifican con un circulo negro.
Los especímenes fueron trasladados al laboratorio de biología de la Facultad de Ciencias del Mar de la Universidad Laica Eloy Alfaro de Manabí. Se tomaron mediciones morfométricas de todos los especímenes y se extrajeron sus órganos. La longitud total (LT) se midió con un ictiómetro digital (precisión de 1 mm). El peso total (Pt), peso de la gónada (Pg) y peso del hígado (Ph) se midieron con una balanza digital (precisión de 0.01 g). El sexo se determinó por la observación de las gónadas y la etapa de madurez gonadal se estimó visualmente por características macroscópicas de las gónadas utilizando la escala de Holden y Raitt (1975), con modificaciones. Las etapas de madurez gonadal fueron las siguientes: etapa I (inmaduro), etapa II (madurando), etapa III (madura o grávida), etapa IV (desove) y etapa V (regeneración).
Relación longitud-peso
Para estimar la relación talla-peso se utilizó la ecuación de alometría potencial (Ricker 1975, Froese 2006):
donde Pt es el peso total de la especie, a es el intercepto, LT es la longitud total, b es la pendiente que describe el tipo de crecimiento y ϵi es el error multiplicativo del i-ésimo pez. Para estimar los parámetros a y b se utilizó el método de mínimos cuadrados linealizando la ecuación (1) mediante una transformación logarítmica de Pt y LT.
Estimación de la talla de madurez
La talla de madurez sexual (L50) se estimó a partir de las frecuencias acumuladas de las etapas III, IV y V utilizando 6 modelos sigmoides (Tabla 1).
Tabla 1 Modelos utilizados para la estimación de la talla de madurez sexual (L50).
| Author | Model |
| Gompertz (1825) |
|
| Richards (1959) |
|
| Bakhayokho (1983) |
|
| King (1995) |
|
| White (2002) |
|
| Brewer & Griffiths (2005) |
|
Parameters: Pi is the proportion of mature individuals in each size range (Lt), L50 is the length at which 50% of individuals reach sexual maturity, θ and r, the rate of change, m and k, adjustment parameters, a and b intercept and slope, and α is the amplitude of the maturity ogive.
El ajuste de los modelos se realizó minimizando el negativo del logaritmo de verosimilitud (-LN[L]; Neter et al. 1996) en función de la probabilidad de una distribución binomial. El mejor ajuste de los modelos se verificó mediante el criterio de información de Akaike (CIA; Akaike 1973):
donde k es el número de parámetros a estimar en el modelo y -LN[L] es el logaritmo negativo de verosimilitud. El modelo que menos valor ofrezca en el CIA (CIAmin) será el que menos información pierda y el que ofrezca el mejor ajuste a los datos. Se calcularon los pesos de Akaike (Pi) para ver cuál era el modelo que mejor se ajustaba entre todos los candidatos:
donde ʌi corresponde a la diferencia de CIA y CIAmin de cada modelo.
Temporada de desove
La temporada de desove se determinó analizando la variación temporal del índice gonadosomático (IGS) para conocer el periodo o periodos de mayor intensidad reproductiva de la especie en un ciclo anual (Brown-Peterson et al. 2011). La variación del IGS se analizó juntamente con la variación del factor de condición relativa (Kn) y la del índice hepatosomático (IHS; Le Cren 1951, Vazzoler 1996, Smylie et al. 2016, Wang et al. 2016):
donde Pg, Pt y Ph son el peso de las gónadas, el peso total del pescado y el peso del hígado, respectivamente; LT es la longitud total de los peces y b el factor de alometría.
Análisis estadísticos
La normalidad y la homocedasticidad de los datos se evaluaron mediante las pruebas de Shapiro-Wilks y Bartlett, respectivamente. Diferencias en la distribución de la longitud entre los sexos fueron comparadas utilizando una prueba de Kolmogorov-Smirnov. Las diferencias mensuales en las tallas de S. peruviana por sexo, IGS, IHS y Kn se evaluaron mediante un análisis de varianza de un solo sentido (ANDEVA) y pruebas a posteriori de Tukey-Kramer. Cuando los datos no cumplían con los supuestos de normalidad y homocedasticidad, se utilizó la prueba de Kruskal-Wallis. La comparación de la proporción de sexos con la esperada (M:H) de 1:1 se realizó mediante la prueba de Chi-cuadrado (χ 2). Para el análisis del tipo de crecimiento, el factor alométrico (b) se comparó con 3 usando las pruebas t de Student. Se utilizó el coeficiente de correlación de Pearson para medir la asociación de los valores del IGS entre sexos (Zar 2010). Las pruebas estadísticas se realizaron en Statgraphics Centurion (Statpoint Technologies, Inc., Warrenton, VA, EE. UU.) y R (R Core Team 2020). La significancia se determinó a partir de α = 0.05 (P < 0.05).
RESULTADOS
Distribución de tallas
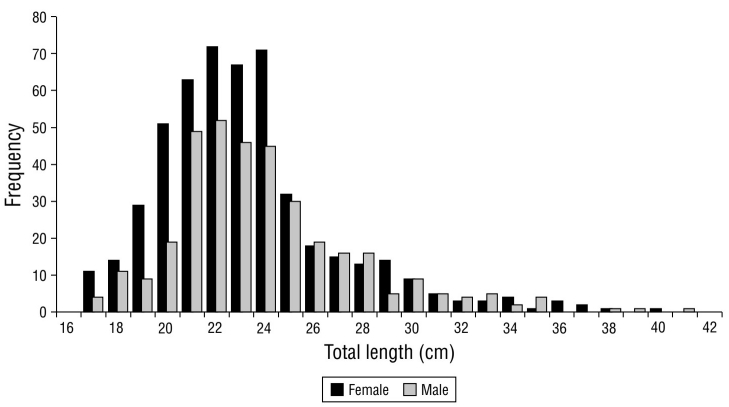
Se analizaron un total de 886 especímenes (400 en 2017 y 486 en 2018; Tabla 2). En la distribución de frecuencias de tallas para sexos combinados se observó un intervalo entre 10.50 y 41.30 cm LT y una LT promedio de 23.16 ± 3.81 cm. No hubo una diferencia significativa en el tamaño general de los individuos entre 2017 y 2018 (t de Student, P > 0.05). Hembras y machos tuvieron longitudes promedio de 22.97 ± 3.73 y 23.62 ± 3.79 cm LT, respectivamente (Fig. 2). Las distribuciones de frecuencia de tamaño difirieron significativamente entre sexos (prueba K-S = 2.03; P < 0.05).
Tabla 2 Resumen estadístico mensual de tallas obtenidas para 2017 y 2018.
| 2017 | 2018 | |||||||
| Month | n | Average | Range | SD | n | Average | Range | SD |
| Jan | 9 | 17.06 | 15.50-18.00 | ± 0.82 | 32 | 22.83 | 18.20-27.30 | ± 2.51 |
| Feb | 41 | 26.40 | 17.30-39.50 | ± 4.62 | 21 | 27.70 | 21.20-35.50 | ± 4.65 |
| Mar | 26 | 22.29 | 18.50-25.00 | ± 1.75 | 35 | 22.70 | 18.10-27.90 | ± 2.82 |
| Apr | 31 | 20.95 | 18.70-26.20 | ± 1.59 | 15 | 21.95 | 19.90-23.30 | ± 1.025 |
| May | 67 | 24.31 | 18.00-40.80 | ± 4.11 | 42 | 21.55 | 10.50-27.00 | ± 2.86 |
| Jun | 56 | 22.60 | 17.20-29.90 | ± 2.37 | 134 | 22.15 | 17.00-30.10 | ± 2.91 |
| Jul | 63 | 22.51 | 19.40-34.80 | ± 2.24 | 75 | 22.16 | 19.00-28.50 | ± 1.65 |
| Aug | 36 | 26.80 | 22.90-30.50 | ± 2.20 | 20 | 23.68 | 17.00-32.80 | ± 4.95 |
| Sep | 20 | 21.30 | 16.60-23.90 | ± 1.61 | 24 | 26.58 | 15.00-37.50 | ± 6.14 |
| Oct | 11 | 20.66 | 12.40-23.50 | ± 2.95 | 24 | 26.79 | 18.00-35.90 | ± 5.87 |
| Nov | 31 | 23.70 | 19.50-38.70 | ± 3.52 | 27 | 22.89 | 17.30-30.00 | ± 4.13 |
| Dec | 9 | 21.25 | 20.00-22.30 | ± 0.79 | 37 | 23.36 | 18.70-41.30 | ± 3.92 |
| Total | 400 | 23.43 | 12.40-40.80 | ± 3.69 | 486 | 22.99 | 10.50-41.30 | ± 3.96 |
Relación longitud-peso
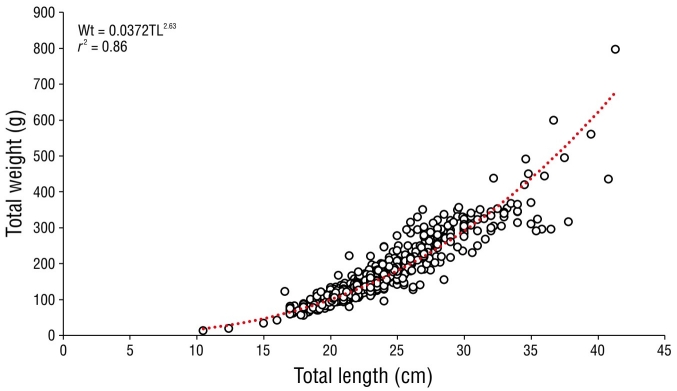
El modelo potencial para todos los organismos capturados fue Pt = 0.0361LT2.63 con un coeficiente de determinación r 2 de 0.89 (Fig. 3). Los factores alométricos (b) de las hembras y los machos fueron 2.62 y 2.49, respectivamente, y significativamente menores que 3. Se encontró una diferencia significativa entre sexos con respecto al parámetro de isometría (Prueba t de Student = 12.16, P < 0.05). Por lo tanto, el crecimiento se consideró negativamente alométrico para ambos sexos (Tabla 3).
Tabla 3 Número total de individuos, tallas máximas y mínimas y parámetros de la relación peso-longitud de Selene peruviana.
| Sex | N | Min. | Max. | Average | SD | a | b | r2 | P |
| Male | 353 | 17.00 | 40.80 | 23.62 | 3.79 | 0.057 | 2.49 | 0.86 | <0.05 |
| Female | 503 | 16.60 | 41.30 | 22.97 | 3.73 | 0.038 | 2.62 | 0.89 | <0.05 |
| Combined sexes | 886 | 10.50 | 41.30 | 23.16 | 3.81 | 0.037 | 2.63 | 0.89 | <0.05 |
Proporción de sexos
De los 886 especímenes analizados, 353 fueron machos, 503 hembras y en 30 individuos no se pudo identificar el sexo. Esto resultó en una proporción de sexo (M:H) de 0.7:1.0 que fue significativamente diferente del valor esperado de 1:1 (χ 2 = 26.28; P < 0.05).
Tamaño de madurez sexual
La LT del ejemplar maduro más pequeño fue de 17.00 cm para ambos sexos. Se calcularon las curvas de madurez para machos, hembras (Fig. 4) y sexos combinados con los 6 modelos descritos. El mayor valor de L50 se obtuvo con el modelo de Richard (31.12 cm LT, intervalo de confianza del 95% [IC] ± 0.87) en hembras, mientras que el menor L50 se obtuvo con el modelo de Gompertz (20.59 cm LT, IC ± 0.97) para machos. Los modelos de Bakhayokho, King y White permitieron determinar la longitud promedio de madurez sexual de S. peruviana, con valores de 22.61 cm LT (IC ± 0.98), 23.86 cm LT (IC ± 0.91) y 23.27 cm LT (IC ± 0.67) para machos, hembras y sexos combinados, respectivamente (Tabla 4).
Tabla 4 Ajuste e inferencia multimodelo para machos, hembras y sexos combinados de Selene peruviana. AIC: Criterio de Información de Akaike, ʌi: diferencia entre AIC y AICmin de cada modelo; L50: talla de madurez sexual; Wi%: peso de cada modelo.
| Model | Combined sexes | Female | Male | |||||||||
| L50 | AIC | ʌi | >Wi% | L50 | AIC | ʌi | Wi% | L50 | AIC | ʌi | Wi% | |
| Gompertz (1825) | 20.91 | 93.61 | 3.70 | 4.24 | 21.29 | 86.41 | 2.92 | 5.97 | 20.59 | 63.22 | 0.15 | 23.61 |
| Richards (1959) | 29.05 | 91.08 | 1.16 | 15.03 | 31.12 | 84.31 | 0.82 | 17.14 | 24.12 | 272.66 | 209.59 | 0.00 |
| Bakhayokho (1983) | 23.27 | 89.91 | 0.00 | 26.91 | 23.86 | 83.50 | 0.00 | 25.63 | 22.61 | 63.07 | 0.00 | 25.46 |
| King (2007) | 23.27 | 89.91 | 0.00 | 26.91 | 23.86 | 83.50 | 0.00 | 25.63 | 22.61 | 63.07 | 0.00 | 25.46 |
| White (2002) | 23.27 | 89.91 | 0.00 | 26.91 | 23.86 | 83.50 | 0.00 | 25.63 | 22.61 | 63.07 | 0.00 | 25.46 |
| Brouwer & Griffiths (2005) | 21.41 | 526.81 | 436.90 | 3.61 | 21.54 | 358.95 | 275.45 | 0.00 | 21.35 | 218.91 | 155.84 | 0.00 |

Figura 4 Curvas de madurez sexual con los ajustes de los modelos de Gompertz (1825), Richards (1959), Bakhayokho (1983), King (2007), White (2002) y Brouwer y Griffiths (2005) para (a) machos y (b) hembras de Selene peruviana.
Etapas de madurez gonadal
El análisis mensual de las etapas de madurez gonadal identificó individuos maduros e inmaduros durante la mayor parte del periodo de estudio con variaciones en sus porcentajes. En 2017 y 2018, se observaron los mayores porcentajes de especímenes machos inmaduros en mayo, junio y julio (Fig. 5a, b). Los periodos con mayor abundancia de ejemplares con gónadas maduras fueron agosto-octubre de 2017, febrero-abril 2018 y agosto-septiembre de 2018 (Fig. 5a). Las hembras de S. peruviana presentaron un patrón similar al de los machos, con los mayores porcentajes individuos con gónadas inmaduras en abril-junio de 2017 (Fig. 5c) y junio-julio de 2018 (Fig. 5d). El mayor porcentaje de ejemplares con gónadas maduras y en desove se observaron en febrero y marzo de ambos años (Fig. 5c, d).
Ciclo reproductivo
Los valores mensuales de IGS presentaron diferencias significativas durante el 2017 (H = 136.93, P < 0.05), mostrando sus valores más altos en la época de lluvias durante febrero y marzo y los valores más bajos en la época seca de mayo-agosto, con un ligero aumento en septiembre. El IHS presentó diferencias significativas (H = 50.44, P < 0.05) y valores con tendencia similar a los del IGS, mientras que el Kn presentó pequeñas variaciones a lo largo de 2017 (H = 174.03, P < 0.05; Fig. 6a). En 2018, S. peruviana presentó un patrón similar en los valores del IGS, con los picos más altos en febrero y marzo y los más bajos en junio y julio (H = 100.40, P < 0.05). Los valores de IHS mostraron diferencias significativas en los meses de estudio (H = 107.74, P < 0.05) y una tendencia similar a los valores de IGS (Fig. 6b), mientras que el Kn presentó diferencias significativas (H = 28.04, P < 0.05) en los meses de estudio con una ligera variación respecto al IGS de 2018 (Fig. 6b).

Figura 6 Variación mensual del índice gonadosomático (GSI), índice hepatosomático (HSI) y factor de condición relativa (Kn) para sexos combinados de Selene peruviana en (a) 2017 y (b) 2018.
El análisis de correlación de Pearson no mostró correlación estadísticamente significativa entre los valores de IGS e IHS (r = 0.35, P > 0.05) o entre los de IGS y Kn (r = 0.21, P > 0.05).
DISCUSIÓN
En el presente estudio, el intervalo de tallas de S. peruviana difiere de lo informado por Tapia-García (1997), Tripp-Valdez et al. (2012) y Salazar et al. (2015). Estas diferencias en dicho parámetro pueden deberse al arte de pesca utilizado. En esos estudios, las muestras se colectaron durante campañas oceanográficas con redes de arrastre (luz de malla de 1 3/4”) durante la temporada de pesca del camarón. Sin embargo, el intervalo de tallas observado en el presente estudio es similar a los reportados por Llanos et al. (2005) y Vera (2007), lo cual puede atribuirse a que los especímenes en esos estudios fueron recolectados en campañas de pesca comercial en la región de Tumbes, en el norte de Perú. Debido a la proximidad de esta región a Ecuador, las condiciones ambientales de estas áreas son similares, al igual que las artes de pesca (Tabla 5).
Tabla 5 Parámetros de tamaño, reproducción y crecimiento de Selene peruviana reportados en diferentes estudios.
| Species | Average size (cm TL) | Range (cm TL) | Size maturity (combined, cm TL) | Size maturity (males, cm TL) | Size maturity (female, cm TL) | b | Sex ratio (M:F) | Site | Reference | Country |
| Selene peruviana | 4.70-26.00 | Gulf of Tehuantepec, Mexico | Tapia-García (1997) | Mexico | ||||||
| Selene peruviana | 8.50-26.50 | Gulf of California | Tripp-Valdez et al. (2012) | Mexico | ||||||
| Selene peruviana | 17.80 | 14.00-23.00 | Tumbes Peru region | Salazar et al. (2015) | Peru | |||||
| Selene peruviana | 19.50 | 13.00-34.00 | 1.2:1.00 | Tumbes region | Llanos et al. (2005) | Peru | ||||
| Selene peruviana | 11.00-35.00 | 0.97:1.00 | Tumbes region | Vera (2007) | Peru | |||||
| Selene peruviana | 4.50-27.00 | 2.74 | East Coast of the mouth of the Gulf of California | Nieto-Navarro (2010) | Mexico | |||||
| Selene setapinnis | 9.74 | 2.90-21.70 | 2.79 | Sao Paulo, South East Brazil | Muto et al. (2000) | Brazil | ||||
| Selene vomer | 4.45 | 2.20-24.30 | 2.74 | |||||||
| Selene brownii | 2.84 | Gulf of Mexico | Farias-Tafolla et al. (2015) | Mexico | ||||||
| Selene vomer | 2.44 | |||||||||
| Selene dorsalis | 19.09 | 21.29 | 3.03 | 1.00:0.97 | Côte d’Ivoire | Arra et al. (2018) | Africa | |||
| Selene setapinnis | 1.08:1.00 | Gulf of Paria and the Orinoco River Delta | Molinet et al. (2008) | Venezuela | ||||||
| Selene setapinnis | 23.10 | 14.00-40.30 | 23.70 | Margarita Island | Tagliafico et al. (2012) | Venezuela | ||||
| Selene setapinnis | 21.50 | 20.50 | South East region of Brazil | Bastos et al. (2015) | Brazil |
El crecimiento alométrico negativo observado en S. peruviana fue similar al reportado por Nieto-Navarro (2010) para Selene setapinnis y por Muto et al. (2000) para Selene vomer en Sao Paulo, sureste de Brasil. Farias-Tafolla et al. (2015) también reportaron un crecimiento alométrico negativo para Selene brownii y S. vomer en el golfo de México. Estas similitudes en los resultados pueden atribuirse a que las especies de Selene tienen cuerpos rectangulares que son altamente comprimidos lateralmente, lo que hace que las especies de Selene sean morfológicamente únicas (Reed et al. 2001) en comparación con las otras 31 géneros de la familia Carangidae que presentan morfologías fusiformes (Jacobina et al. 2013). Por lo tanto, se considera que el tipo de crecimiento en las especies de Selene estaría determinado por la forma del cuerpo, lo que les permite aumentar más su longitud que su peso al crecer (Tabla 5).
La proporción de sexos de cada especie es altamente variable (Claro 1994). La proporción de sexos encontrada para S. peruviana resultó ser diferente a lo reportado por Llanos et al. (2005), quienes encontraron una relación (M:H) de 1.20:1.00 para la misma especie. Del mismo modo, Arra et al. (2018) reportaron una relación de 1.03:1.00 para Selene dorsalis en Costa de Marfil (África Occidental), mientras que Molinet et al. (2008) reportaron una relación de 1.08:1.00 para S. setapinnis entre el golfo de Paria y el delta del río Orinoco. En el presente estudio, el número de hembras fue mayor que el de machos, lo que se puede atribuir a la segregación espaciotemporal de las hembras que se acercan a la costa durante la época reproductiva o a diferencias en factores como la longevidad y la mortalidad (Sylla et al. 2016). Moe (1969) considera que la explotación pesquera intensa y sostenida probablemente disminuye la tasa de transición, aumentando así el potencial reproductivo de la población al aumentar el número de hembras. Sin embargo, en el presente estudio no se observaron diferencias significativas entre las tallas de machos y hembras de S. peruviana, por lo tanto, es poco probable que la presión de pesca afecte la proporción de sexos (Tabla 5).
En los peces, el inicio de la madurez sexual está más relacionado con la longitud que con una determinada edad del individuo (Saborido-Rey 2008). Para estimar la L50, los datos observados deberían distribuirse idealmente a lo largo de la curva desde el punto de inflexión hasta el tamaño asintótico (Birch 1999). Sin embargo, esta condición es difícil de lograr en poblaciones explotadas debido a la selectividad de las artes de pesca (Trippel y Harvey 1991). Los modelos ajustados con el método de verosimilitud están siendo ampliamente utilizados en estudios pesqueros en la actualidad y la inferencia multimodelo es útil para estimar un modelo global (Hernández-Covarrubias et al. 2013). El CIA estableció que los modelos de Bakhayokho, King y White ofrecían el mejor ajuste a los datos, por lo que estos 3 modelos se utilizaron para la estimación general de L50.
Como no existen registros de talla de madurez sexual para S. peruviana en años anteriores en Ecuador, no se puede analizar temporalmente la influencia de la presión pesquera en la madurez sexual de este recurso. Sin embargo, en el presente estudio, la talla de madurez sexual es similar a la talla promedio de captura, lo que podría indicar que S. peruviana se encuentra en el límite de la talla óptima de captura. En el futuro, esto podría causar inestabilidad en el aporte de nuevos individuos a la población (Ochoa-Ubilla et al. 2016).
La talla de madurez sexual se puede comparar con otras especies del género Selene. Nuestros resultados son similares a los reportados por Tagliafico et al. (2012) para S. setapinnis en el sur del mar Caribe. También llama la atención que la L50 de los machos de S. peruviana fue menor que la de las hembras, lo cual también fue reportado por Arra et al. (2018) para S. dorsalis en la Costa de Marfil, pero se diferencia de lo reportado por Bastos et al. (2015) para S. setapinnis en el sureste de Brasil, quienes reportaron que la L50 de los machos fue mayor que el de las hembras. Las condiciones oceanográficas entre los océanos Pacífico y Atlántico son diferentes, y esta variación en el tamaño en la madurez sexual se puede observar entre especies en la misma región y en la misma especie en diferentes ambientes (Saborido-Rey 2008). Un mayor tamaño en la madurez sexual de las hembras ha sido reportado por otros autores que lo han atribuido al gasto energético durante la maduración, lo cual es típico de especies tropicales (Lucano-Ramírez et al. 2016) (Tabla 5).
Valores elevados del IGS se asocian a etapas avanzadas de maduración gonadal (Grier y Uribe-Aranzábal 2009). Asimismo, la variación en el peso del hígado está asociada con la asignación de energía para diferentes procesos vitales (Mcbride et al. 2015). En el presente estudio se encontraron especímenes maduros durante la mayor parte de los meses evaluados, lo que indica que S. peruviana tiene un periodo reproductivo largo, encajándose en la categoría de “generadores de ingresos” (McBride et al. 2015). La variación del IGS de S. peruviana fue similar a la descrita por Llanos et al. (2005), quienes reportaron una tendencia decreciente de mayo a agosto (otoño e invierno en Perú o estación seca en Ecuador) para la misma especie. Tapia-García (1997) estableció que S. peruviana en el golfo de Tehuantepec en México tiene un periodo reproductivo de febrero a noviembre (con un pico entre marzo y mayo), lo que difiere de lo encontrado en el presente estudio, ya que el periodo reproductivo comenzó en septiembre con picos máximos en febrero y marzo. El mismo autor afirmó que la maduración y el desove en hembras y machos es sincrónico, situación que también se observó en ambos sexos en el presente estudio. Esta condición podría atribuirse a que S. peruviana suele encontrarse formando grandes cardúmenes, los cuales son característicos de especies de Carangidae (ARAP 2011). Este largo periodo reproductivo es característico de las especies tropicales con ciclos de vida cortos que les permiten soportar las variaciones ambientales (Kaiser 1973, Tapia et al. 1997, Perera 2008) y periodos de transición ambiental. En este estudio, se observó una mayor variación durante la transición de la temporada de lluvias a la temporada seca. Esto puede ser resultado de la disponibilidad de alimentos durante este periodo, lo cual es un factor importante para la reproducción (Zapata et al. 1999, Acevedo et al. 2017).
En algunas especies de peces, los valores de IGS están inversamente relacionados con el Kn e IHS (González y Oyarzún 2002, Plua-Santana 2020). En el presente estudio, esta relación solo se observó en septiembre de 2018 para los valores del IGS y Kn. El aumento de la actividad reproductiva durante la época de lluvias se puede atribuir a un aumento de la temperatura del mar que proporciona la extensión del ciclo reproductivo debido a una mayor productividad primaria y por lo tanto una mayor disponibilidad de alimento. En contraste, durante la estación seca, la temperatura del mar desciende y la actividad reproductiva disminuye, lo que se evidencia por la disminución de las etapas maduras durante este periodo. El patrón similar de variación del IGS, IHS y Kn podría indicar una estrategia reproductiva en la que la especie no utiliza sus reservas de energía almacenadas en el hígado durante el proceso de maduración gonadal. En cambio, la energía requerida para la formación del óvulo y el espermatozoide podría provenir del alimento disponible durante los periodos reproductivos (Acevedo et al. 2007, Zamora-Mendoza 2020) sin influir en la condición corporal de la especie ni en la acumulación de lípidos durante la vitelogénesis.
AGRADECIMIENTOS
Este estudio fue financiado en parte por la Universidad Laica Eloy Alfaro de Manabí, a través del proyecto de investigación Evaluación de parámetros biológicos y dinámica poblacional para el manejo de recursos marinos. Los autores agradecen a José Alió Mingo y Pol Carrasco por las sugerencias y asistencia técnica con el manuscrito.
REFERENCIAS
Acevedo, J, Angulo, W, Ramírez, M, Zapata, LA. 2007. Reproducción del pez Brotula clarkae (Pisces: Ophidiidae) en el Pacífico colombiano. Rev Biol Trop. 55(3-4):957-967. https://doi.org/10.15517/RBT.V55I3-4.32902 [ Links ]
Akaike, H. 1973. Information theory and an extension of the maximum likelihood principle. In: Petrov, BN, Csáki, F (eds.), 2nd International Symposium on Information Theory, Tsahkadsor, Armenia, USSR, September 2-8, 1971, Budapest: Akadémiai Kiadó. p. 267-281. [ Links ]
ARAP. 2011. Guía para la identificación de peces de interés comercial para el Pacífico de Panamá. Panama: Autoridad de los Recursos Acuaticos de Panamá. 100 p. [ Links ]
Arra, S, Sylla, S, Kouame, A, Zan-BI, T, Ouattara, M. 2018. Reproductive biology of the African moonfish, Selene dorsalis (Gill 1862) (Carangidae) in continental shelf of Côte d’Ivoire fishery (West Africa). Int J Fish Aquat Stud. 6(2):358-363. [ Links ]
Bakhayokho, M. 1983. Biology of the cuttlefish Sepia officinalis hierredda off the Senegal coast. FAO Fish Technical Paper 231:204-263. [ Links ]
Bastos, C, Cergole, M, Magro, M, Bastos, G, Trevizan, F. 2015. Selene setapinnis (Mitchell 1815). In: Cergole, M.C., Ávila-da-Silva, A.O., Rossi-Wongtschowski, C. (eds.), Analise das Principais Pescarias Comerciais da Região Sudeste-Sul do Brasil: Dinâmica Populacional das Espécies em Explotação. São Paulo (Brazil): Instituto Oceanográfico - USP. (Série Documentos Revizee- Score Sul.). p. 151-155. [ Links ]
Birch, C. 1999. A new generalized logistic sigmoid growth equation compared with the Richards growth equation. Ann Bot. 83:713-723. [ Links ]
Brewer, SL, Griffiths, MH. 2005. Reproductive biology of Carpenter Seabream (Argyrozona argyrozona) (Pisces: Sparidae) in a marine protected area. Fish Bull. 103(2):258-269. [ Links ]
Brown-Peterson, NJ, Wyanski, DM, Saborido-Rey, F, Macewicz, BJ, Lowerre-Barbieri, SK. 2011. A standardized terminology for describing reproductive development in fishes. Mar Coast Fish. 3(1):52-70. https://doi.org/10.1080/19425120.2011.555724 [ Links ]
Claro, R, García-Arteaga, J. 1994. Crecimiento. Ecología de los peces marinos de Cuba. Quintana Roo (Mexico): Instituto de Oceanología, Academia de Ciencias de Cuba y Centro de Investigaciones de Quintana Roo (CIQRO). p. 321-402. [ Links ]
Díaz, JM, Vieira, CA, Díazgranados, MC. 2016. Ordenamiento y manejo pesquero en la costa norte del Pacífico colombiano. Chap. 3. In: Díaz, J.M., Guillot, L., Velandia, M.C. (eds.), La pesca artesanal en la costa norte del Pacífico colombiano: un horizonte ambivalente. Bogotá (Colombia): Fundación MarViva. p. 45-57. [ Links ]
Farias-Tafolla, B, De La Cruz-Torre, J, Ponce-Rodriguez, A, Gersenoie-Rodriguez, J, Martinez-Perez, J, Chavez-Arteaga, M. 2015. Comparison of the allometry coefficient of the length-weight and length-length relationship between Selene brownii, S. vomer and S. setapinnis caught in the Gulf of Mexico. Int J Morphol. 33(4):1237-1241. [ Links ]
Froese, R. 2006. Cube law, condition factor and weight-length relationships: history, meta-analysis and recommendations. J App Ichthyol. 22(4):241-253. https://doi.org/10.1111/j.1439-0426.2006.00805.x [ Links ]
Froese, R, Pauly, D (eds.). 2023. Selene peruviana. FishBase 99: concepts, structure and source of data. Manila (Philippines): ICLARM. 322 p. [ Links ]
Gerlotto, F, Gutiérrez, M, Bertrand, A. 2012. Insight on population structure of the Chilean jack mackerel (Trachurus murphyi). Aquat Living Resour. 25(4):341-355. https://doi.org/10.1051/alr/2012036 [ Links ]
Gompertz, B. 1825. On the nature of the function expressive of the law of human mortality. Philos Trans R Soc London. 115:513-585. [ Links ]
González, N, Prado, M, Castro, F, Solano, V, Jurado, M. 2007. Análisis de la pesquería de peces pelágicos pequeños en el Ecuador (1981-2007). Documento Interno. Guayaquil (Ecuador): Instituto Nacional de Pesca, Guayaquil, Ecuador. 40 p; [accessed 2022 Aug 20]. http://institutopesca.gob.ec/wp-content/uploads/2017/07/Peces-pelágicos-pequeños-1981-2007.pdf [ Links ]
González, P, Oyarzún, C. 2002. Variabilidad de índices biológicos en Pinguipes chilensis Valenciennes 1833 (Perciformes, Pinguipedidae): ¿Están realmente correlacionados? = Biological index variability in Pinguipes chilensis Valenciennes 1833 (perciformes, pinguipedidae): are they correlated? Gayana (Concepción). 66(2):249-253. https://doi.org/10.4067/S0717-65382002000200023 [ Links ]
Grier, HJ, Uribe-Aranzábal, MC. 2009. The testis and spermatogenesis in teleost. In: Jamieson, BGM (ed.), Reproductive Biology and Phylogeny of Fishes (Agnathans and Neotelestomi). Phylogeny-Reproductive System-Viviparity-Spermatozoa. Enfield (CT): Science Publishers Inc. p. 119-142. [ Links ]
Hernández-Covarrubias, V, Patiño-Valencia, J, Aguirre-Villaseñor, H. 2013. Inferencia multimodelo: cálculo de la talla media de madurez del ostión de roca Striostrea prismatica en Nayarit, México. Cien Pesquera. 22(1):11-18. [ Links ]
Holden, M, Raitt, D. 1975. Manual de Ciencia Pesquera. Parte 2: Métodos para investigar los recursos y su aplicación. FAO documento tecnico de pesca. Rome (Italy): [FAO] Food and Agriculture Organization of the United Nations. 211 p. Paper No.: 115. [ Links ]
[IPIAP] Instituto Público de Investigación de Acuicultura y Pesca. 2022. Desembarques mensuales de Peces Pelágicos Pequeños, desglose del grupo otras especies periodo 2004-2019. Proceso de Investigación de los Recursos Bioacuáticos y su Ambiente. Programa “Peces Pelágicos Pequeños”. Guayaquil (Ecuador): IPIAP. [accessed 2022 Aug 20]. https://institutopesca.gob.ec/wp-content/uploads/2021/02/DesembPPP-2004-2019_Desglose-Otros.pdf . 33 p. [ Links ]
Jacobina, UP, Vicari, MR, Martinez, PA, de-Bello-Cioffi, M, Bertollo, LAC, Molina, WF. 2013. Atlantic moonfishes: independent pathways of karyotypic and morphological differentiation. Helgol Mar Res. 67(3):499-506. https://doi.org/10.1007/s10152-012-0338-8 [ Links ]
Jalabert, B. 2005. Particularities of reproduction and oogenesis in teleost fish compared to mammals. Reprod Nutr Dev. 45(3):261-279. https://doi.org/10.1051/rnd:2005019 [ Links ]
Jiménez, P, Béarez, P. 2004. Peces marinos del Ecuador continental Volumen 2. Quito (Ecuador): SIMBIOE/NAZCA/IFEA. 406 p. [ Links ]
Kaiser, CE. 1973. Gonadal maturation and fecundity of horse mackerel Trachurus murphy (Nichols) off the coast of Chile. T Am Fish Soc. 102:101-108. [ Links ]
King, M. 2007. Fisheries biology assessment and management. 2nd ed. Oxford (United Kingdom): Blackwell Publishing. 400 p. https://doi.org/10.1002/9781118688038 [ Links ]
Llanos, J, Inga, C, Ordinola, E, Rujel, J. 2005. Biological fishing research carried out in the Tumbes region, Peru, 1996-2005 Informe. Instituto del Mar del Perú. 37(3-4):95-113. [ Links ]
Le Cren, CD. 1951. The length-weight relationship and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis). J Anim Ecol. 20:201-219. [ Links ]
Lucano-Ramírez, G, Rivera-Rios, EG, Ruiz-Ramírez, S, González-Sansón, G, Perez-Toedo, A. 2016. Reproducción de Carangoides vinctus (Perciformes: Carangidae) en el Pacífico central mexicano = Reproduction of Carangoides vinctus (Perciformes: Carangidae) in the Mexican Central Pacific. Lat Amer J Aquat Res. 44(3):610-622. https://doi.org/10.3856/vol44-issue3-fulltext-20 [ Links ]
Martinez, J. 2005. White Fish Handbook. Manual de la Pesca Blanca. 2nd ed. Manta (Ecuador): Poligrafica C.A. 174 p. [ Links ]
McBride, RS, Somarakis, S, Fitzhugh, GR, Albert, A, Yaragina, NA, Wuenschel, MJ, Alonso-Fernández, A, Basilone, G. 2015. Energy acquisition and allocation to egg production in relation to fish reproductive strategies. Fish Fish. 16(1):23-57. https://doi.org/10.1111/faf.12043 [ Links ]
Moe, M. 1969. Biology of the red grouper Epinephelus morio (Valenciennes) from the eastern Gulf of Mexico. Fla Dept Nat Res, Mar Res Lab Prof Pap. 10:1-95. [ Links ]
Molinet, R., Arocha, F., Cárdenas, J., Malavé, L., Sánchez, D., Achury, A., Alió, J., Hernández, H., Marcano, L., Papadakis, P., et al. 2008. Evaluación de los recursos pesqueros en el oriente venezolano. Petróleos de Venezuela S. A. Caracas (Venezuela): Universidad Simón Bolívar. 176 p. [ Links ]
Muto, E, Soares, L, Rossi-Wongtschowski, C. 2000. Length-weight relationship of marine fish species off Sao Sebastiao system, Sao Paulo, Southeastern Brazil. Naga. [accessed 2022 Aug 20]. http://hdl.handle.net/1834/25989 ; 23(4):27-29. [ Links ]
Nelson, JS. 2006. Fishes of the world. 4th Ed. Hoboken (NJ): John Wiley & Sons. 601 p. [ Links ]
Neter, J, Kutner, M, Nachtschien, J, Wasserman, J. 1996. Applied linear statistical models. Chicago (IL): McGrawHill/Irwin. 1408 p. [ Links ]
Nieto-Navarro, J. 2010. Length-weight relationship of demersal fish from the eastern coast of the mouth of the Gulf of California, (June 2014). J Fish Res Aquat Sci. 5(6):494-502. [ Links ]
Ochoa-Ubilla, BY, Mendoza-Nieto, KX, Vivas-Moreira, R, Urdánigo-Zambrano, JU, Ferrer-Sánchez, Y. 2016. Estructura de tallas de captura y relación longitud-peso de peces nativos en el humedal Abras de Mantequilla, Ecuador. Rev Cien Tecnol UTEQ. 9(2):19-27. https://doi.org/10.18779/cyt.v9i2.191 [ Links ]
Perea, A, Mori, J, Buitrón, B, Sánchez, J. 2013. Aspectos reproductivos del jurel Trachurus murphyi. Rev Peru Biol. 20(1):29-34. https://doi.org/10.15381/rpb.v20i1.2616 [ Links ]
Perera-García, MA, Mendoza-Carranza, M, Páramo-Delgadillo, S. 2008. Dinámica reproductiva y poblacional del robalo, Centropomus undecimalis (Perciformes: Centropomidae), en barra San Pedro, Centla, México. Universidad y Ciencia. 24(1):49-59. [ Links ]
Perugachi-Salamea, C, González-Narváez, M, Pambabay-Calero, J, García-Arévalo, I, Vargas-Ayala, F, Shigla-Cuji, G, Nath-Nieto, J. 2014. Caracterización oceanográfica del perfil costero ecuatoriano a través de métodos estadísticos aplicados a las estaciones fijas de monitoreo del INOCAR, serie a partir de 1981. Acta Oceanográfica Del Pacífico. 19(2):7-21. [ Links ]
Plua-Santana, Y. 2020. Evaluación de la dinámica reproductiva de la hojita, Chloroscombrus orqueta Jordan y Gilbert 1883 (Pisces: Carangidae) desembarcada en Manabí Ecuador: periodo abril-noviembre 2019 [BSc thesis]. [Manta (Ecuador)]: Facultad de Ciencias del Mar, Universidad Laica Eloy Alfaro de Manabí. 16 p. [ Links ]
Prado, M, Cajas, J. 2016. Variabilidad del plancton en estaciones fijas frente a la costa ecuatoriana durante el 2007. Revista Ciencias del Mar y Limnología. 10(2):54-64. [ Links ]
R Core Team R 2020. A language and environment for statistical computing. Vienna (Austria): R Foundation for Statistical Computing; [accessed 2023 march 07]; Vienna (Austria): R Foundation for Statistical Computing; [accessed 2023 march 07]; http://www.R-project.org /. [ Links ]
Reed, DL, deDegravelle, MJ, Carpenter, KE. 2001. Molecular systematics of Selene (Perciformes: Carangidae) based on cytochrome b sequences. Mol Phylogenet Evol. 21(3):468-475. https://doi.org/10.1006/mpev.2001.1023 [ Links ]
Ricker, W. 1975. Computation and interpretation of biological statistics of fish populations. Bull Fish Res Bd Can. 191:1-382. [ Links ]
Richards, FJA. 1959. A flexible growth functions for empirical use. J Exp Bot. 10:290-300 [ Links ]
Saborido-Rey, F. 2008. Ecología de la reproducción y potencial reproductivo en las poblaciones de peces marinos. Instituto de Investigaciones Marinas (CSIC) Universidad de Vigo. (34):1-71. [ Links ]
Salazar-Céspedes, C, Chacón-Nieto, G, Alarcón-Vélez, J, Luque-Sánchez, C, Cornejo-Urbina, R, Chalking, F. 2015. Flota de arrastre de fondo de menor escala en la Región Tumbes = Trawl fishery of small scale in the Tumbes Region. Informe [IMARPE] Instituto del Mar del Perú. 42(2):185-219. [ Links ]
Smylie, M, Shervette, V, McDonough, C. 2016. Age, growth, and reproduction in two coastal populations of longnose gars. Trans Amer Fish Soc. 145(1):120-135. https://doi.org/10.1080/00028487.2015.1111256 [ Links ]
Sylla, S, Zan-Bi, TT, Konan, KJ, Tia, CB, Kabre, JAT, Kone, T. 2016. Biología reproductiva del ronco ojo grande Brachydeuterus auritus en la pesquería de Costa de Marfil (África Occidental). Revista Científica de Ciencias Biológicas. 5(5):158-166. [ Links ]
Tagliafico, A, Rago, N, Lárez, A. 2012. Estructura de talla de 20 especies de peces capturados por la flota artesanal de La Isla de Margarita, Venezuela. Ciencia. 20(4):217-232. [ Links ]
Tapia-García, M. (ed.). 1997. Diversidad, dinámica y patrones reproductivos de la comunidad de peces demersales del golfo de Tehuantepec. Informe final SNIB-CONABIO proyecto No. B094. Mexico City (Mexico): Universidad Autónoma Metropolitana. Unidad Iztapalapa. 117 p. [ Links ]
Trippel, EA, Harvey, HH. 1991. Comparison of methods used to estimate age and length of fishes at sexual maturity using populations of white sucker (Catostomus commersoni). Canad J Fish Aquat Sci. 48(8):1446-1459. https://doi.org/10.1139/f91-172 [ Links ]
Tripp-Valdez, A, Arreguín-Sánchez, F, Zetina-Rejón, MJ. 2012. The food of Selene peruviana (Actinopterygii: Perciformes: Carangidae) in the southern gulf of California. Acta Ichthyol Piscat. 42(1):1-7. https://doi.org/10.3750/AIP2011.42.1.01 [ Links ]
Vazzoler, A. 1996. Biologia da Reprodução de Peixes Teleosteos: Teoria e Prática. Paraná (Brazil): EDUEM/Nupelia. 119 p. [ Links ]
Vera, M. 2007. Estudio biológico pesquero de los recursos costeros frente al litoral de la Región Tumbes. Informe Anual 2006. Informe Interno. Lima (Peru): Instituto del Mar del Perú. 34 p. [ Links ]
Wang, QL, Zhang, HT, Ren, YQ, Zhou, Q. 2016. Comparison of growth parameters of tiger puffer Takifugu rubripes from two culture systems in China. Aquaculture. 453:49-53. https://doi.org/10.1016/j.aquaculture.2015.11.022 [ Links ]
Williams, K. 2007. Evaluation of the macroscopic staging method for determining maturity of female walleye pollock Theragra chalcogramma in Shelikof Strait, Alaska. Alaska Fish Res Bull. 12(2):252-263. [ Links ]
Zamora-Mendoza, JR. 2020. Dinámica de la reproducción de la corvina de roca, Brotula clarkae (Hubbs 1994) (Pisces: Ophidiidae) desembarcada en el Puerto de Jaramijó, Manabí, Ecuador: período julio 2018 a enero 2019 [BSc thesis]. [Manta (Ecuador)]: Facultad de Ciencias del Mar, Universidad Laica Eloy Alfaro de Manabí. 14 p. [ Links ]
Zapata, LA, Rodríguez, G, Beltrán-León, B, Gómez, G, Cediel, A, Avila, R, Hernández, C. 1999. Evaluación de recursos demersales por el método de área barrida en el Pacífico colombiano INPA-Boletín Científico 6. Bogota (Colombia): Santafé de Bogotá-INPA. p. 177-226. [ Links ]
Zar, JH. 2010. Biostatistical analysis. New Jersey (USA): Prentice Hall. 944 p. [ Links ]
Recibido: 21 de Mayo de 2022; Aprobado: 15 de Octubre de 2022











 texto en
texto en