Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dez. 2023 Epub 08-Dez-2023
https://doi.org/10.7773/cm.y2023.3321
Artículos
Distribución espaciotemporal del potencial reproductivo del stock de hembras de langostino colorado (Pleuroncodes monodon) en la zona centro-sur de Chile
1Programa de Doctorado en Ciencias con mención en Manejo de Recursos Acuáticos Renovables, Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción, 4030000 Concepción, Chile.
2Centro de Investigación en Ecosistemas de la Patagonia, 5950000 Coyhaique, Chile.
3Asesorías Ocean Technology and Aquaculture Chile, 4030000 Concepción, Chile.
Pleuroncodes monodon es 1 de las 3 especies que sustentan las pesquerías demersales de crustáceos en Chile, con niveles de desembarque que han mostrado amplias variaciones y una muy lenta recuperación en la última década. La unidad de pesquería sur se encuentra en estado de recuperación desde 2017, después de una intensa sobrepesca, la que afectó tanto al potencial reproductivo como a la distribución geográfica del stock. En el presente estudio, se usó información de lances de pesca de 14 campañas de evaluación directa de P. monodon para estimar la densidad del potencial reproductivo del stock de hembras en el periodo 2005-2018 en la zona centro-sur (32.0° S a 37.0° S) de Chile mediante un análisis geoestadístico. El promedio anual de huevos potenciales se estimó en 78,055.0 millones de huevos potenciales, con una densidad promedio de 74.0 millones de huevos por kilómetro cuadrado. Se reconocieron 2 zonas de agregación del potencial reproductivo, una entre 33.5° S y 34.5° S (zona norte) y otra entre 35.5° S y 36.5° S (zona sur). La densidad promedio de huevos potenciales fue mayor en la zona norte que en la zona sur, aunque en la zona sur se localizaron focos con máximos cercanos a 100 millones de huevos por kilómetro cuadrado, lo que no ocurrió en la zona norte. La población de P. monodon proviene de una sola área de cría, ubicada en la zona sur. En el periodo de 2008 a 2012, el stock de hembras presentó una migración neta con rumbo norte de casi 226.4 km (desde 36°20ʹ52.5ʺ S hasta 34°18ʹ39.1ʺ S), aunque posteriormente se redujo con rumbo norte-sur por la presión pesquera.
Palabras clave: Pleuroncodes monodon; densidad potencial de huevos; geoestadística; zona centro-sur de Chile
Pleuroncodes monodon is 1 of the 3 species sustaining the demersal crustacean fisheries in Chile, with landings that have had strong variations and a very slow recovery in the past decade. The southern fishing unit has been in the recovery status since 2017, following several years of intense overfishing, which affected the reproductive potential and the geographical distribution of the stock. In this study, fishing haul information from 14 direct evaluation surveys of P. monodon were used to estimate, by using geostatistics, the density of the reproductive potential of the female stock in central and southern Chile (32.0° S to 37.0° S) from 2005 to 2018. The annual mean potential eggs was estimated at 78,055.0 million potential eggs, with a mean density of 74.0 million eggs per square kilometer. Two areas of aggregation of the reproductive potential are recognized, one between 33.5° S and 34.5° S (northern zone) and the other between 35.5° S and 36.5° S (southern zone). The mean density of potential eggs was higher in the northern zone than in the southern zone, although in the southern zone there were foci with values close to 100 million eggs per square kilometer, which was not the case for the northern zone. The P. monodon population comes from a single breeding area located in the southern zone. In the 2008-2012 period, the female stock showed a net migration of 226.4 km northward (from 36°20ʹ52.5ʺ S to 34°18ʹ39.1ʺ S), although it was later reduced southward by the fishing pressure.
Key words: Pleuroncodes monodon; potential egg density; geostatistical analysis; central and southern Chile
INTRODUCCIÓN
El langostino colorado, Pleuroncodes monodon, pertenece a la familia Munididae (Poore et al. 2011) y se distribuye desde el sur de México (16°00ʹ N) hasta la zona frente a Perú (6°25ʹ S) y Chile (41°00ʹ S) (Flores et al. 2020). En Chile, P. monodon habita fondos fangosos y duros sobre la plataforma continental, desde el borde superior del talud hasta 450 m de profundidad (Bahamonde et al. 2002), y ha sido registrada tanto en aguas someras como en sectores abisales asociados a fondos anóxicos (Gallardo et al. 2017). El periodo reproductivo de P. monodon es prolongado, con la presencia de hembras ovígeras de febrero a diciembre (Palma y Arana 1997) y desoves múltiples en sincronía entre el desarrollo embrionario y el desarrollo gonadal (Flores et al. 2020).
Pleuroncodes monodon es de importancia comercial en la pesquería de crustáceos demersales de la zona central de Chile. La pesquería de P. monodon, administrativamente está compuesta por la unidad de pesquería norte (UPN), desde 23°21ʹ00ʺ S hasta 32°10ʹ23ʺ S, y la unidad de pesquería sur (UPS), desde 32°10ʹ23ʺ S hasta 38°28ʹ35ʺ S (Cavieres et al. 2018). Desde el inicio de la década de 1970, esta pesquería ha ejercido fuerte presión sobre el stock de P. monodon (Cavieres 2017, Zilleruelo et al. 2020). Su pesca ha sido regulada a través de la aplicación de cuotas globales anuales, cuotas individuales de pesca por armador y límites máximos de captura por armador (Canales et al. 1997, Párraga et al. 2012), pero la principal medida reguladora ha correspondido a vedas extractivas prolongadas, particularmente en los años de 1980 a 1982, 1989 a 1991 y 2001 a 2005 (Acuña et al. 2005). Además, desde 1997, se han aplicado vedas biológicas para proteger el crecimiento individual de los ejemplares de P. monodon, entre enero y febrero, así como vedas reproductivas durante septiembre (Cavieres 2017). Sin embargo, el conjunto de medidas de regulación para la explotación y la conservación de P. monodon ha sido insuficiente para permitir una clara recuperación (Ibarra y Yáñez 2021). Actualmente, la UPN se encuentra en estado de sobreexplotación, y la UPS, en régimen de recuperación, después de mantenerse en sobrepesca desde 2000 hasta 2017, aunque con reducción del indicador de los niveles del potencial reproductivo del 55% (2019) al 48% (Ibarra y Yáñez 2021).
El potencial reproductivo es definido como la capacidad de una población para producir huevos y larvas viables que luego podrán incorporarse a la pesquería o al stock como reclutas (Trippel 1999). Por lo tanto, está relacionado con la madurez, la fecundidad, la calidad del huevo y el tiempo del desove (Wright 2013). Aunque se ha cuestionado el uso de este índice en lugar de la biomasa del stock desovante en las evaluaciones de stocks (Marshall et al. 2006, Cerviño et al. 2013), Kell et al. (2016) demostraron que ambos parámetros describen dinámicas diferentes. La inclusión del potencial reproductivo mejora la percepción de la productividad. Kell et al. (2016) basaron su conclusión en el análisis comparativo de series de tiempo de 3 poblaciones del mar del Norte (bacalao Gadus morhua, arenque Clupea harengus y platija Pleuronectes platessa). Por lo tanto, consideramos importante hacer el seguimiento del potencial reproductivo del stock de hembras de P. monodon y, así, analizar su comportamiento en el espacio y el tiempo.
En este estudio se incluye el componente espacial en el funcionamiento y la estructura de las poblaciones marinas, aspecto que se ha enfatizado en las últimas décadas (Cressie et al. 1993, McKinley y Atkinson 2020). Esto permite una mejor comprensión de la dinámica de la población que si solo se tomara en cuenta la visión temporal de la población (Dunning et al. 1995). Ignorar la estructura espacial conduce a sesgos en la evaluación y la ordenación pesquera de las poblaciones, lo que puede llevar al recurso a la sobrepesca, a desequilibrios en la estructura de tallas del stock, así como al colapso de la población y/o fracaso en la reconstrucción de los stocks (Cadrin 2020), especialmente si hay sobrepesca en áreas reconocidas como de renovación o cría de un recurso.
Roa et al. (1995) identificaron un área de cría de P. monodon, la cual estuvo conformada por 2 poblaciones adultas interconectadas, una extensa ubicada entre 35°10ʹ S y 36°15ʹ S (población de Achira) y otra más pequeña localizada entre 36°35ʹ S y 36°50ʹ S (población del Biobío) (Roa y Bahamonde 1993, Roa y Tapia 2000). De allí, la distribución de P. monodon se extiende hacia el norte y el sur sobre la plataforma continental de Chile central, desde 34.0° S hasta 37.0° S. La zona de cría es la responsable de la renovación de reclutas. Esta zona es importante para la recuperación del stock de P. monodon, y puede llegar a ser afectada por la presión pesquera, como ha ocurrido con el potencial reproductivo.
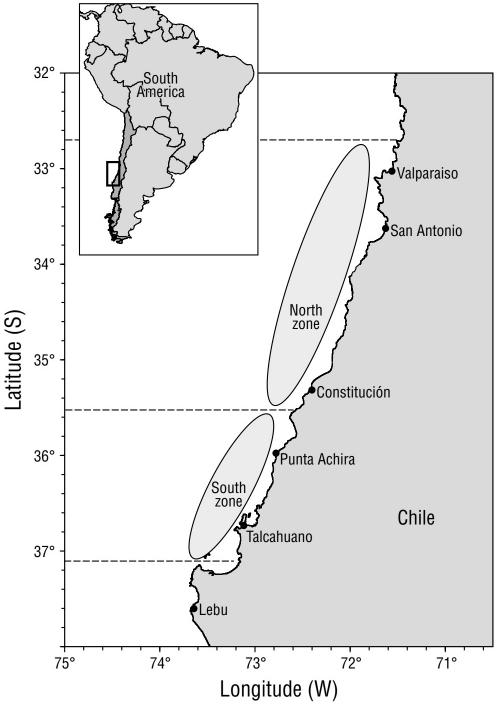
Los objetivos de este trabajo fueron estimar el potencial reproductivo del stock de hembras de P. monodon en la zona centro-sur de Chile (32.0° S-37.0° S) y evaluar, a través de mapas, su distribución espacial y temporal desde 2005 hasta 2018.
MATERIALES Y MÉTODOS
Fuente de datos
Se utilizó la base de datos de lances de pesca de las campañas de evaluación directa de langostino colorado (P. monodon) y langostino amarillo (Cervimunida johni), desde 2005 hasta 2018. Las evaluaciones directas realizadas entre 1993 y 2004 emplearon distintos criterios metodológicos tanto en la obtención como en el procesamiento de los datos, lo que se estandarizó a partir del año 2005, razón por la cual en este trabajo se excluyeron esos años.
Las campañas fueron realizadas en naves comerciales de pesca de arrastre langostinera que operan con personal científico abordo. Se utilizaron lanchas a motor dentro de las 5 millas náuticas o Área de Reserva para la Pesca Artesanal (ARPA), con características promedio de eslora de 17 m, toneladas de registro grueso de 41 t y capacidad de bodega de 53 m3. Fuera del ARPA, se utilizaron naves pesqueras de altamar con características promedio de eslora de 21 m, toneladas de registro grueso de 84 t y capacidad de bodega de 116 m3 (Párraga et al. 2012). En ambos casos, los lances efectivos de pesca tuvieron una duración aproximada de 15 min dependiendo de las condiciones ambientales y la topografía del fondo.
En este trabajo se analizan información y datos de 14 campañas de evaluación y 9,601 lances de pesca, los que contenían información georreferenciada por región administrativa, profundidad (m), captura (kg) por especie y otros datos de cada lance. La distribución de tamaños (longitud de cefalotórax [LC], en milímetros) de P. monodon se obtuvo de los informes de campañas (Acuña et al. 2006). En las campañas se aplicó muestreo estratificado por celdas, con intensificación en las áreas de pesca históricamente exitosas, para evaluar la abundancia y la densidad de los focos en los caladeros. Se registró y estandarizó la captura por lance (Acuña et al. 2006).
Área de estudio
El área de estudio abarca la zona centro-sur de Chile desde 32.0° S hasta 37.0° S, lo que cubre 556 km lineales (Fig. 1). El área fue divida en una zona norte (32.5° S-35.5° S) y una zona sur (35.5° S-37.0° S). El criterio aplicado fue la distribución de los focos de abundancia de P. monodon (Acuña et al. 2012, 2014).
Estimación del potencial reproductivo
La distribución de P. monodon es de tipo contagiosa y altamente agregada (Acuña et al. 2008, Queirolo et al. 2017) y está conformada por agregaciones de abundancia de tamaño variable (Ahumada et al. 2013). Se define como foco de abundancia a la agregación de hembras ovígeras de P. monodon que cumplen con las siguientes características: (1) mayor número de huevos potenciales por unidad de área y (2) persistencia de al menos 7 años. Se consideró este periodo por ser el tiempo en el que el stock de P. monodon alcanza la estructura de tallas completa, la adecuada para que la población amplíe su distribución geográfica (Roa y Bahamonde 1993). Se eligió el percentil del 30% (P = 30), es decir, el 70% de las agregaciones que alcanzaron densidades ≥44.7 millones de huevos potenciales por kilómetro cuadrado. Se aplicó la prueba de rangos de Spearman (Sokal y Rolf 2012) para probar la relación entre el tamaño y la densidad de las agregaciones para cada año. Para la estimación del potencial reproductivo de P. monodon, se utilizó el peso (g), la LC (mm) y el estado de madurez de 452,087 ejemplares; de estos, solo se consideraron las hembras ovígeras (133,440), particularmente las maduras, de acuerdo con Palma y Arana (1997).
El potencial reproductivo se estimó para cada foco desde el año 2005 hasta el año 2018 usando el modelo indexado por posición espacial (Kell et al. 2016), cuya expresión es la siguiente:
donde E es el número de huevos por unidad de área para cada año, Z h(x,y) es la densidad numérica de hembras en la posición (x, y), P (x, y) es la fracción de hembras que portan huevos en la posición (x, y), y G (x, y) es el número de huevos por hembra en la posición (x, y), expresado como millones de huevos potenciales por kilómetro cuadrado (referido en este trabajo como mhp·km-2). El número de huevos por hembra fue estimado por distintos métodos, según el grupo de trabajo que realizó la evaluación; así, Acuña et al. (2004, 2008, 2010, 2012) y Queirolo et al. (2015, 2016) utilizaron el método gravimétrico, mientras que Queirolo et al. (2017) utilizaron el método autodiamétrico. Varias de las evaluaciones reportaron la estimación de una función de fecundidad-talla o fecundidad-peso, que se utilizó en aquellos años. En los casos en que no se determinó la fecundidad, se utilizó el año más cercano, dado que para todos los años no se dispuso de la composición de tamaños del stock ni de la proporción de hembras maduras.
La densidad en número de hembras se calculó con la siguiente expresión:
donde Z
Ph
es la densidad en peso (t·km-2) de las hembras en el punto (x, y) y
donde Z
tot
(x, y) es la densidad total (machos y hembras);
Distribución espacial del potencial reproductivo
Se aplicó un análisis geoestadístico (Petitgas 1993, Rivoirard et al. 2000). Esta metodología es utilizada en Chile desde 1993 para el estudio de la distribución espacial de la densidad poblacional de langostinos (Roa y Tapia 1998, Acuña et al. 2012, Queirolo et al. 2018, Ossa et al. 2019). Se fundamenta en 2 aspectos: (1) la densidad de huevos potenciales por unidad de superficie medida localmente, que es la realización de una variable aleatoria que explica rigurosamente el error en su determinación, y (2) el promedio del proceso aleatorio del potencial reproductivo es constante en el área de estudio y la covarianza entre 2 puntos de muestreo depende solo de sus distancias relativas (Isaaks y Srivastava 1989). El análisis se basó en un modelo de covarianza espacial o semivariograma (Journel y Huijbregts 1978). Por lo tanto, para cada año se estimó el semivariograma experimental estandarizado, y se usó en todos los análisis para obtener un modelo más eficiente. Se calculó en 2 direcciones, norte-sur (90°) y este-oeste (0°), para observar las diferencias direccionales en la estructura del proceso, i.e., anisotropía. Los modelos se ajustaron mediante el método de mínimos cuadrados (Cressie 1993), y se relacionó la estructura observada con el supuesto proceso generador. Los modelos considerados para las densidades fueron los siguientes: Matérn, esférico, exponencial y gaussiano (Matérn 1987).
El método de interpolación usado para estimar la densidad media del potencial reproductivo de P. monodon sobre cada área de distribución de la abundancia poblacional fue el de kriging puntual ordinario. Se consideró la distancia mínima promedio entre las estaciones de muestreo como la distancia internodal de la cuadrícula de interpolación. Los mapas anuales de distribución de la densidad media del potencial reproductivo fueron elaborados con PBSmapping (Schnute et al. 2010; https://www.r-project.org, accedida el 31 de enero de 2020) y Surfer v-9.9.
Análisis espaciotemporal de la distribución del potencial reproductivo
Se determinó la variación espacial del potencial reproductivo de hembras de P. monodon a partir de 2 índices como sigue:
(1) centro de gravedad (CG): indica la dispersión de los focos anuales del potencial reproductivo (huevo·km-2), y se localizó de la siguiente manera:
(2) inercia del centro de gravedad (I): determina el rango de variación espaciotemporal de la densidad del potencial reproductivo, y se obtuvo de la siguiente manera:
CG e I fueron usados para analizar la evolución y el desplazamiento de los focos reproductivos de P. monodon.
RESULTADOS
Proporción sexual y fracción de hembras maduras de Pleuroncodes monodon
La proporción de hembras para toda el área de estudio fue menor que el 50% entre 2004 y 2014 (Fig. 2a), con incremento importante en su proporción (>50%) entre 2015 y 2018. Este incremento coincidió con la mayor proporción de hembras ovígeras (78%; Fig. 2b).
Potencial reproductivo y densidad del potencial reproductivo
El potencial reproductivo promedio anual de hembras de P. monodon de 2005 a 2018 fue de 78,055.0 millones de huevos potenciales y la densidad promedio estimada fue de 74.0 mhp·km-2 (desviación estándar = 47.4).
La densidad de huevos potenciales fue diferente entre las zonas (Fig. 2). En la zona norte, varió entre 195.0 mhp·km-2 en 2012 y 33.0 mhp·km-2 en 2014. Para la zona sur, las densidades fueron menores, entre 12.0 mhp·km-2 en 2006 y 141.0 mhp·km-2 en 2011.
En general, el área promedio cubierta por la densidad del potencial reproductivo fue diferente entre las zonas norte y sur. Se observó una mayor superficie cubierta en la zona sur (1,045 km2) que en la zona norte (754 km2) (Fig. 3). Además, en la zona sur se observó una asociación positiva y moderadamente fuerte entre el área cubierta y la densidad del potencial reproductivo, mientras que en la zona norte, la relación fue débil o inexistente (prueba de correlación de rangos de Spearman estimada, respectivamente, para cada zona: r sZS = 0.79, P = 0.05; r sZN = 0.31, P = 0.05).
Identificación de focos
Para las zonas norte y sur, se observaron agregaciones anuales de la densidad del potencial reproductivo, con un mayor número en la zona norte, de 3 (en 2017) a 14 (en 2008) agregaciones, que en la zona sur, de 3 (en 2005) a 8 (en 2012) agregaciones (Fig. 4). Solo se reconocieron como focos del potencial reproductivo de hembras de langostino colorado a las agregaciones ubicadas entre 35°00ʹ S y 36°20ʹ S. En ese sector se estimaron promedios de densidades del potencial reproductivo cercanos a 100.0 mhp·km-2. Estos valores fueron superiores al percentil del 30%; además, fueron persistentes de 2006 a 2018.
Distribución espacial de hembras de Pleuroncodes monodon
Análisis geoestadístico
El cálculo de los semivariogramas experimentales estandarizados unidireccionales reveló la ausencia de efecto anisotrópico en la distribución espacial de las agregaciones para cada año y para cada zona (Tabla 1).
Tabla 1 Parámetros del variograma teórico ajustado a la densidad del potencial reproductivo de Pleuroncodes monodon. S, sur; N, norte; Gaus, gausiano; Sphe, esférico; Mat, Matérn.
| Year | Zone | Model | Nugget | Sill | Range (km) | Unexplained variance (%) | Anistropy |
| 2005 | S | Gaus | 56.9 | 362.5 | 26.8 | 13.6 | 0; 30 |
| 2006 | S | Sphe | 57.3 | 96.7 | 11.3 | 37.2 | No |
| 2007 | S | Gaus | 94.0 | 2,130.8 | 28.0 | 4.2 | No |
| 2008 | N | Sphe | 344.8 | 419.7 | 138.8 | 45.1 | No |
| S | Gaus | 1,735.3 | 4,758.4 | 28.2 | 26.7 | 45; 30 | |
| 2009 | N | Gaus | 290.8 | 138.1 | 111.1 | 67.8 | No |
| S | Sphe | 0.0 | 9,190.7 | 10.8 | 0.0 | 45; 30 | |
| 2011 | N | Gaus | 2,246.3 | 6,542.8 | 71.4 | 25.6 | No |
| S | Mat | 913.7 | 13,932.3 | 60.7 | 6.2 | 45; 30 | |
| 2012 | N | Mat | 5,076.3 | 24,230.0 | 9.9 | 17.3 | 45; 30 |
| S | Sphe | 3,941.1 | 18,020.7 | 107.3 | 18.0 | 45; 30 | |
| 2013 | N | Mat | 1,341.7 | 5,130.4 | 13.7 | 20.7 | 0; 30 |
| S | Sphe | 3,204.0 | 9,508.5 | 18.0 | 25.2 | No | |
| 2014 | N | Sphe | 78.9 | 229.8 | 203.4 | 25.6 | No |
| S | Gaus | 1,626.4 | 569.4 | 26.6 | 74.1 | No | |
| 2015 | N | Sphe | 142.5 | 491.7 | 89.2 | 22.5 | 45; 30 |
| S | All | 149.7 | 283.3 | 2.0 | 34.6 | No | |
| 2016 | N | Sphe | 592.4 | 518.0 | 109.0 | 53.4 | No |
| S | Sphe | 1,916.9 | 1,219.9 | 33.9 | 61.1 | No | |
| 2017 | N | Gaus | 412.9 | 770.6 | 76.9 | 34.9 | 45; 30 |
| S | Sphe | 5,708.1 | 5,201.0 | 49.1 | 52.3 | No | |
| 2018 | N | Sphe | 279.0 | 406.4 | 100.8 | 40.7 | No |
| S | Gaus | 63.2 | 1,716.1 | 161.4 | 3.6 | No |
El 39% de los 15 años analizados indicó presencia de anisotropía en dirección noroeste-sureste (NW-SE, 45°) con respecto al área de estudio y la orientación de la costa. En esos casos, se escogió el modelo de semivariograma teórico que obtuvo la menor suma de cuadrado residual. Cuando hubo ausencia del efecto anisotrópico, el 60% de la distribución de los parches se ajustó al modelo esférico, y variaron los rangos de distancias entre parches por zona. En la Tabla 1 se presentan los ajustes y la varianza no explicada (VNE) de los parámetros del variograma teórico. En la zona norte, el rango de la distancia entre parches se presentó entre 10 km (VNE = 17.3%) y 203 km (VNE = 25.6%), y para la zona sur, el rango fue de 2 km (VNE = 34.6%) hasta 161 km (VNE = 3.6%), lo que indica que las agregaciones de la zona norte fueron más independientes entre sí que en la zona sur (Fig. 5).
Análisis espacial
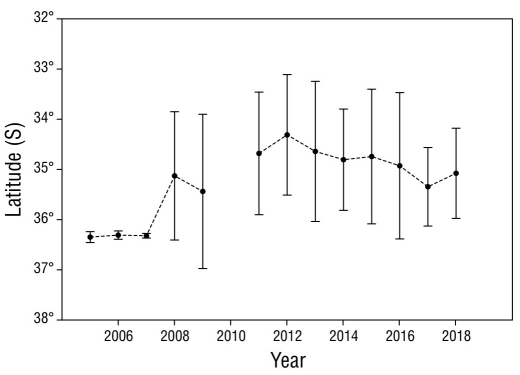
Los análisis del CG y la I sugieren que el desplazamiento de las densidades del potencial reproductivo fue desde 36°20ʹ52ʺ S (en 2005) hasta 34°18ʹ39ʺ S (en 2012), es decir, un desplazamiento superior a 2° con rumbo norte, que equivale a 120 millas náuticas, con un recorrido promedio de 16 km·año-1. Sin embargo, de 2005 a 2007, el CG se mantuvo cercano de 36.0° S, con un rango de dispersión promedio de 0.08° (~3 km·año-1). A partir del año 2008, el rango de dispersión aumentó a valores sobre 13 km·año-1 (Fig. 6).
Mapeo de la distribución del potencial reproductivo de Pleuroncodes monodon
En el mapa de distribución anual de las densidades del potencial reproductivo de hembras de P. monodon (Fig. 7), se identificaron 2 sectores bien marcados con altos valores, uno frente a San Antonio (33°30ʹ S a 34°00ʹ S) y el otro entre punta Achira y Biobío (34°40ʹ S a 36°20ʹ S), los cuales estuvieron presentes 6 años o más. Para el sector frente a San Antonio, entre los años 2005 y 2009, hubo predominio de ejemplares machos en el área de estudio y la proporción de hembras alcanzó su menor valor en toda la serie (~20% en 2006). A partir de 2008, se observó un incremento en la proporción de hembras y, con ello, el potencial reproductivo, que alcanzó valores promedio de 194.5 mhp·km-2 entre los años 2011 y 2013; luego, el potencial reproductivo disminuyó drásticamente y se mantuvo en valores promedio de 47.0 mhp·km-2 durante los últimos años. En el sector entre punta Achira y Biobío se observó mayor concentración de hembras maduras durante todo el periodo de estudio, con la presencia de 2 máximos importantes del potencial reproductivo con promedios de 115.0 mhp·km-2 entre 2011 y 2014. En 2015 el potencial reproductivo disminuyó, pero volvió a repuntar con un tercer máximo en 2017 con promedios cercanos a los 140.0 mhp·km-2.
DISCUSIÓN
En este trabajo, el promedio anual de huevos potenciales de P. monodon para la zona centro-sur de Chile en el periodo 2005-2018 se estimó en 78,055 millones y la densidad promedio anual en 73.7 mhp·km-2. Los niveles de densidad estimados aquí están dentro de los intervalos reportados por Palma y Arana (1997) para los focos de pesca entre 36.0° S y 37.0° S (punta Achira y norte del cañón del Biobío), que fueron estimados a partir de muestras obtenidas de 15 campañas de monitoreo de P. monodon entre agosto de 1988 y octubre de 1989. Palma y Arana (1997) indicaron valores del potencial reproductivo de entre 1,808 y 33,966 huevos a partir de hembras ovígeras de P. monodon de 22.0 a 43.9 mm LC. En el presente estudio se hizo el ejercicio con nuevas estimaciones de áreas anuales utilizando solo las hembras ovígeras para cada año, y se estimaron densidades de entre 8.5 y 159.0 mhp·km-2. Estas estimaciones están por debajo de los 9,000 millones de huevos por kilómetro cuadrado reportados por Tapia (1999) para la misma zona (34.0° S-37.0° S) y con la misma metodología. Su estudio estuvo basado en una campaña de evaluación realizada en fondos “no arrastables” en noviembre de 1996 y centrada en áreas cercanas a los fondos duros de la plataforma. Según Cadrin (2020), puede darse una expansión secuencial de recursos a nuevas áreas, pero una especificación errada de la estructura espacial de un recurso puede jugar un papel importante en el declive de las pesquerías, ya que produce una sobreestimación de la productividad en la evaluación del stock. En este sentido, es posible que en el estudio de Tapia (1999) hubiese una sobreestimación del potencial reproductivo de P. monodon. Además, en 1996 la biomasa de P. monodon fue estimada en 122,000 y 132,000 t con métodos directos e indirectos, respectivamente (Roa et al. 1997); casi una década después, estás cifras fueron analizadas por Acuña et al. (2005), quienes encontraron que la biomasa de P. monodon para ese año no sobrepasó las 98,000 t. Si bien, después de las vedas, hay incremento en la biomasa total y la biomasa explotable, principalmente en la zona centro sur de Chile, las biomasas estimadas a partir de las campañas no sobrepasan las 90,000 t (Ibarra y Yáñez 2021), ni los desembarques, las 8,000 t.
También, se ha observado que, después de una veda prolongada de P. monodon, ocurre una expansión y recuperación del recurso, producto del ingreso importante de la clase anual recluta (Roa et al. 1997, Cavieres et al. 2018), tal como ocurrió después de las vedas de 1989 a 1991 (Roa y Bahamonde 1993) y de 2001 a 2005 (Acuña et al. 2005). En ambos casos se reportó un buen reclutamiento y el incremento en la biomasa total y la biomasa explotable (Acuña et al. 2012, Cavieres et al. 2018).
En nuestro análisis geoestadístico para los años entre 2005 y 2007 se observó el predominio de ejemplares machos en el área de estudio, y la proporción de hembras alcanzó su menor valor en toda la serie (~20% en 2006), lo cual se reflejó en la ausencia del potencial reproductivo de P. monodon en el mapa de distribución para ese periodo. Estos resultados son concordantes con lo señalado por Acuña et al. (2010) para el periodo de 2005 a 2007, quienes observaron el ingreso de reclutamientos abundantes que permitieron una recuperación importante de la biomasa desde 2006 hasta 2009, lo cual fue favorecido por la veda extractiva aplicada al recurso entre 2001 y 2005 (Acuña et al. 2005, Cavieres et al. 2018). Es así como la biomasa de crucero pasó de 10,000 t en 2005 a 70,000 t en 2007. Sin embargo, en las capturas se registró un incremento en la proporción de machos y el predominio de hembras portadoras de huevos en estado de desarrollo inicial (Acuña et al. 2010). El predominio de los machos en las capturas también fue reportado para el año 2007 por Acuña et al. (2009). Aunque no fueron claros los cambios observados en la proporción sexual de P. monodon, Acuña et al. (2009) indicaron que el predominio de machos pudo haber estado relacionado con las fechas en las que se realizó el estudio, correspondiente al final del periodo reproductivo de esta especie.
En el presente trabajo no se realizó ningún análisis estacional debido a que el origen de la información provino de campañas de investigación para la estimación de la biomasa presente (standing stock) de P. monodon y otras 2 especies de crustáceos aplicando el método del área barrida, lo que necesita registros cuantitativos de capturas por cada lance de pesca. El Fondo de Investigación Pesquera de Chile (https://www.fip.cl/proyectos) financia cuasianualmente ese tipo de proyectos a través de concursos públicos, los cuales se realizan durante unas pocas semanas en meses de invierno, exclusivamente. Sin embargo, se reconoce la existencia de variaciones estacionales en algunos indicadores poblacionales, como el extenso periodo reproductivo (de febrero a diciembre) y la fracción de hembras ovígeras y sus huevos, tal como lo reportaron Bascur et al. (2017) para P. monodon en la zona central de Chile.
La comparación de la serie del potencial reproductivo de hembras de P. monodon con la del reclutamiento estimado por Cavieres et al. (2018) parece indicar que la tendencia de un buen reclutamiento, como el ocurrido en 2004, se refleja en la tendencia del potencial reproductivo 6 años después (Fig. 8). Sin embargo, es un periodo corto y, por diferencias en los criterios metodológicos, no se pudo incluir información desde la década de 1990.

Figura 8 Reclutamiento (miles de individuos) vs. potencial reproductivo (millones de huevos potenciales, mpe) para Pleuroncodes monodon de 2005 a 2018 en la zona centro-sur de Chile.
En cuanto a la expansión del recurso, en este estudio se encontró un hallazgo interesante, y fue el desplazamiento latitudinal de la distribución del potencial reproductivo desde 36°20ʹ52.5ʺ S hasta 34°18ʹ39.1ʺ S entre 2005 y 2012, con una expansión de 226.4 km, que explica la existencia del sector norte de alto potencial reproductivo mencionado anteriormente (Fig. 7). Para P. monodon, Roa y Bahamonde (1993) registraron 60 km como su mayor intervalo de expansión entre 1989 y 1991.
El centro de gravedad del potencial reproductivo se mantuvo cercano a los 36°19ʹ S entre los años 2005 y 2007, con un intervalo de dispersión promedio de 3 km·año-1 (I = 0.08° S). Sin embargo, a partir de 2008, el intervalo se incrementó a 13 km·año-1 (I = 1.28° S) hasta alcanzar los 34°18ʹ S en 2012 (ver Fig. 5). Estos resultados son coherentes con lo reportado por Acuña et al. (2009), quienes indicaron concentración de la densidad poblacional de langostino colorado cerca a los 36°19ʹ S, entre 1999 y 2006, con poca dispersión latitudinal (I < 0.17° S). Es posible que, después de una intensa presión pesquera, este recurso se contrae de norte a sur, debido a que la pesca conduce a fuertes disminuciones en la producción de huevos del stock a medida que se eliminan las clases de mayor edad. Después de las vedas, se recupera lentamente y se va expandiendo a partir de los focos del stock del potencial reproductivo de hembras ovígeras encontrados entre los 35°00ʹ y 36°50ʹ S. Estos focos con densidades del potencial reproductivo cercanas a 100 mhp·km-2 son los que se expanden hacia el norte y sur de la costa chilena, lo que refuerza la hipótesis de que la población de P. monodon proviene desde una sola área de cría ubicada entre los 35.5° y 36.5° S (Roa y Bahamonde 1993).
El uso del potencial reproductivo en la evaluación de stock de los recursos pesqueros ha sido polémico por su forma de estimación. Sin embargo, es importante incluirlo porque permite construir modelos espaciotemporales clave para abordar problemas de conservación en zonas de agregación o cría de esta especie. A través de este enfoque, se pudieron identificar y delimitar los hábitats esenciales tanto de hembras ovígeras como de cría, lo que permitió diseñar y priorizar áreas marinas protegidas con el objetivo de alcanzar una pesca responsable capaz de mantener la renovación no solo de P. monodon, sino también de las especies asociadas a su ecosistema.
Por último, la geoestadística ha sido aplicada ampliamente desde 1960 tanto en la estimación de reservas minerales y la caracterización de yacimientos petroleros como en el análisis de problemas ambientales de hidrología, ecología, climatología y oceanografía (McKinley y Atkinson 2020). Recientemente, en el estudio y la gestión de pesquerías, es usada para mapear hábitats esenciales de peces con la finalidad de vigilar la conservación de los ecosistemas, específicamente, para evaluar la variabilidad de su distribución a lo largo del tiempo (Le Pape et al. 2014; Petitgas et al. 2018, 2020). En Chile, se usa esta metodología desde 1992 para evaluar las poblaciones de crustáceos, pero se ha publicado poco al respecto. Se analizó el crecimiento y la expansión poblacional de P. monodon, después de una veda de 3 años (Roa y Bahamonde 1993), y se observaron las diferencias espaciales en el crecimiento y la madurez (Roa y Tapia 2000). Estos estudios fueron soporte para el uso de la geoestadística y la estandarización metodológica en la evaluación de los crustáceos en Chile (Acuña et al. 2004, 2005; Queirolo et al. 2018). Sin embargo, es la primera vez que es utilizada para estimar el potencial reproductivo de P. monodon y observar su distribución en el tiempo.
AGRADECIMIENTOS
Agradecemos a la Dirección de Postgrado de la Universidad de Concepción y a la Agencia Nacional de Investigación y Desarrollo de Chile su apoyo financiero a través de la beca de doctorado nacional F21160713. También, agradecemos al Fondo de Investigación Pesquera y Acuicultura (https://www.subpesca.cl) y al Ministerio de Economía a través del Instituto de Fomento Pesquero (https://www.ifop.cl), quienes financiaron las campañas de evaluación de los crustáceos demersales de 1993 a 2013 y de 2014 a 2018, respectivamente, y proporcionaron la información. Los autores del presente trabajo declaran que no existe ningún conflicto de interés.
REFERENCIAS
Acuña, E, Alarcón, R, Arancibia, H, Cid, L, Cortes, A, Cubillos, L. 2010. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2009. Informes Técnicos FIP. FIP/IT N° 2009-15. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 366 p. [ Links ]
Acuña, E, Alarcón, R, Arancibia, H, Cid, L, Cortés, A, Cubillos, L, Haye, P, León, R, Martínez, G, Neira, S. 2004. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII regiones, año 2004. Informe Final. Proyecto FIP Nº. 2004-11. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 405 p. [ Links ]
Acuña, E, Alarcón, R, Arancibia, H, Cid, L, Cortés, A, Cubillos, L, León, R. 2006. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2006. Informe Final Proyecto FIP Nº 2006-04. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 424 p. [ Links ]
Acuña, E, Alarcón, R, Arancibia, H, Cid, L, Cortés, A, Cubillos, L, León, R. 2009. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2007. Informe Final. Proyecto FIP Nº 2007-19. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 418 p. [ Links ]
Acuña, E, Alarcón, R, Arancibia, H, Cortés, A, Cubillos, L, Cid, L. 2014. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2013. Informe Final Proyecto FIP 2013-02. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 384 p. [ Links ]
Acuña, E, Alarcón, R, Cid, L, Arancibia, H, Cubillos, L, Cortés, A. 2005. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2005. Informe Final Proyecto FIP Nº 2005-09. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 349 p. [ Links ]
Acuña, E, Alarcón, R, Cid, L, Cortés, A, Cubillos, L, Godø, O, León, R, López, V, Pérez, E, Rodríguez, P. 2008. Estandarización de procedimientos metodológicos para la evaluación de crustáceos demersales a través del método de área barrida. Informes Técnicos FIP/IT Nº 2006-19. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 326 p. [ Links ]
Acuña, E, Alarcón, R, Cortés, A, Cid, L, Arancibia, H, Cubillos, L. 2012. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2011. Informe Final Proyecto FIP I/T Nº 2011-01. Valparaíso (Chile): Subsecretaría de Pesca y Acuicultura. 457 p. [ Links ]
Ahumada, M, Queirolo, D, Acuña, E, Gaete, E. 2013. Caracterización de agregaciones de langostino colorado (Pleuroncodes monodon) y langostino amarillo (Cervimunida johni) mediante un sistema de filmación remolcado = Characterization of red squat lobster (Pleuroncodes monodon) and yellow squat lobster (Cervimunida johni) aggregations using a towed video system. Lat Am J Aquat Res. 41(1):199-208. https://doi.org/103856/vol41-issue1-fulltext-20 [ Links ]
Bahamonde, R, Canales, C, Barbieri, MA, Leiva, B, Arana, P, Palma, S, Melo, T. 2002. Evaluación directa de langostino colorado y langostino amarillo entre la II y VIII Regiones, año 2001. Informe Final Proyecto FIP 2001-06. Valparaíso (Chile): Instituto de Fomento Pesquero. 202 p. [ Links ]
Bascur, M, Guzmán, F, Mora, S, Urzúa, Á. 2017. Seasonal changes in the biochemical composition of females and offspring of red squat lobster, Pleuroncodes monodon (Decapoda, Munididae), from the Southeastern Pacific. Mar Ecol. 38(2):e12419. https://doi.org/10.1111/maec.12419 [ Links ]
Cadrin, SX. 2020. Defining spatial structure for fishery stock assessment. Fish Res. 221:105397. https://doi.org/10.1016/j.fishres.2019.105397 [ Links ]
Canales, C, Montenegro, C, Pool, H, Peñailillo, T, Díaz, C. 1997. Análisis y evaluación directa de la pesquería de langostino colorado en la zona centro-sur. Informe Final Proyecto FIP 96-20. Valparaíso(Chile): Subsecretaría de Pesca y Acuicultura. 49 p. [ Links ]
Cavieres, J. 2017. Estatus y posibilidades de explotación biológicamente sustentables de los principales recursos pesqueros nacionales año 2018: Langostino colorado, 2018. Informe 2. Convenio Desempeño 2017. Valparaíso (Chile): Subsecretaría de Economía and EMT/IFOP. 132 p. [ Links ]
Cavieres, G, Yáñez, A, Zilleruelo, M, Bravo, C. 2018. Estatus y posibilidades de explotación biológicamente sustentables de los principales recursos pesqueros nacionales, año 2018: Langostino colorado, 2018. Informe 3 consolidado. Valparaíso (Chile): IFOP. 87 p. [ Links ]
Cerviño, S, Domínguez-Petit, R, Jardim, E, Mehault, S, Piñeiro, C, Saborido-Rey, F. 2013. Impact of egg production and stock structure on MSY reference points and its management implications for southern hake Merluccius merluccius. Fish Res. 138:168-178. https://doi.org/10.1016/j.fishres.2012.07.016 [ Links ]
Cressie, NAC. 1993. Statistics for spatial data. New York (NY): Wiley. 900 p. [ Links ]
Dunning, JB, Stewart, DJ, Danielson, BJ, Noon, BR, Root, TL, Lamberson, RH, Stevents, EE. 1995. Spatially explicit population model: current forms and future uses. Ecol Appl. 5:3-11. [ Links ]
Flores, A, Brown, DI, Queirolo, D, Ahumada, M. 2020. Gonadal development of female red squat lobsters (Pleuroncodes monodon, H Milne Edwards, 1837). Fish Res. 225:105508. https://doi.org/10.1016/j.fishres.2020.105508 [ Links ]
Gallardo, MÁ, González-López, AE, Ramos, M, Mujica, A, Muñoz, P, Sellanes, J, Yannicelli, B. 2017. Reproductive patterns in demersal crustaceans from the upper boundary of the OMZ off north-central Chile. Cont Shelf Res. 141:26-37. https://doi.org/10.1016/j.csr.2017.04.011 [ Links ]
Ibarra, M, Yáñez, A. 2021. Estatus y posibilidades de explotación para langostino amarillo, langostino colorado y camarón nailon. Convenio de Desempeño 2020. Estatus y posibilidades de explotación biológicamente sustentables de los principales recursos pesqueros nacionales, año 2021: Crustáceos demersales. Informe Consolidado. Valparaíso (Chile): Instituto de Fomento Pesquero (IFOP). 322 p. [ Links ]
Isaaks, EH, Srivastava, RM. 1989. An Introduction to Applied Geostatistics. New York (NY): Oxford University Press. 561 p. [ Links ]
Journel, AG, Huijbregts, CJ. 1978. Mining geostatistics. London (United Kingdom): Academic Press. 600 p. [ Links ]
Kell, LT, Nash, RDM, Dickey-Collas, M, Mosqueira, I, Szuwalski, C. 2016. Is spawning stock biomass a robust proxy for reproductive potential? Fish Fish. 17(3):596-616. https://doi.org/10.1111/faf.12131 [ Links ]
Le Pape, O, Delavenne, J, Vaz, S. 2014. Quantitative mapping of fish habitat: A useful tool to design spatialised management measures and marine protected area with fishery objectives. Ocean Coastal Manage. 87:8-19. https://doi.org/10.1016/j.ocecoaman.2013.10.018 [ Links ]
Marshall, CT, Needle, CL, Thorsen, A, Kjesbu, OS, Yaragina, NA. 2006. Systematic bias in estimates of reproductive potential of an atlantic cod (Gadus morhua) stock: implications for stock recruit theory and management. Can J Fish Aquat Sci. 63(5):980-994. [ Links ]
Matérn, B. 1987. Spatial Variation. 2nd ed. Lecture Notes in Statistics. Berlin (Germany): Springer. 151 p. [ Links ]
McKinley, JM, Atkinson, PM. 2020. A special issue on the importance of geostatistics in the era of data science. Math Geosci. 52:311-315. https://doi.org/10.1007/s11004-020-09858-1 [ Links ]
Ossa, L, Henríquez, S, Vega, R. 2019. Programa de investigación del descarte y captura de pesca incidental en pesquerías pelágicas - programa de monitoreo y evaluación de los planes de reducción del descarte y de la pesca incidental 2018-2019 Regiones. Informe Final. Instituto de Fomento Pesquero Valparaíso (Chile): Subsecretaría de Economía and EMT. 20 p. [ Links ]
Palma, SG, Arana, PE. 1997. Aspectos reproductivos del langostino colorado (Pleuroncodes monodon H. Milne Edwards, 1837), frente a la costa de Concepción, Chile = Reproductive aspects of the squat lobster (Pleuroncodes monodon H. Milne Edward, 1837), off Concepción, Chile. Investig Mar [online]. 25:203-221. http://dx.doi.org/10.4067/S0717-71781997002500015 [ Links ]
Párraga, D, Wiff, R, Quiroz, JC, Zilleruelo, M, Bernal, C, Azócar, J. 2012. Caracterización de las tácticas de pesca en la pesquería multiespecífica de crustáceos demersales en Chile = Caracterización de las tácticas de pesca en la pesquería multiespecífica de crustáceos demersales en Chile. Lat Am J Aquat Res. 40(1):30-41; accessed 14 April 2020. https://scielo.conicyt.cl/scielo.php?script=sci_arttext&pid=S071860X2012000100004&lng =es&tlng=es . [ Links ]
Petitgas, P. 1993. Geostatistics for fish stock assessments: a review and an acoustic application. ICES J Mar Sci. 50(3):285-298. https://doi.org/10.1006/jmsc.1993.1031 [ Links ]
Petitgas, P, Huret, M, Dupuy, C, Spitz, J, Authier, M, Romagnan, JB, Doray, M. 2018. Ecosystem spatial structure revealed by integrated survey data. Prog Oceanogr. 166:189-198. https://doi.org/10.1016/j.pocean.2017.09.012 [ Links ]
Petitgas, P, Renard, D, Desassis, N, Huret, M, Romagnan, JP, Doray, M, Woillez, M, Rivoirard, J. 2020. Analysing temporal variability in spatial distributions using min-max autocorrelation factors: Sardine eggs in the Bay of Biscay. Math Geosci Special Issue. 52:337-354. https://doi.org/10.1007/s11004-019-09845-1 [ Links ]
Poore, GCB, Ahyong, ST, Taylor, J. (eds). 2011. The biology of squat lobsters. Australia: CSIRO Publishing. 363 p. https://doi.org/10.1071/9780643104341 [ Links ]
Queirolo, D, Ahumada, M, Apablaza, P, Wiff, R, Páramo, J, Lima, M, Montero, J, Canales, M, Flores, A, López, F. 2017. Evaluación directa de langostino amarillo y langostino colorado entre la II y VIII Regiones, año 2016. Informe Final. Valparaíso (Chile): Subsecretaría de Economía and EMT. 70 p. [ Links ]
Queirolo, D, Ahumada, M, Wiff, R, Apablaza, P, Lima, M, Flores, A. 2018. Evaluación directa de langostino amarillo y langostino colorado entre la II y VIII Regiones, año 2017. Informe Final. Valparaíso (Chile): Subsecretaría de Economía and EMT. 70 p. [ Links ]
Queirolo, D, Ahumada, M, Wiff, R, Páramo, J, Apablaza, P, Lima, M, Montero, J, Flores, A, Canales, M. 2016. Evaluación directa de langostino amarillo y langostino colorado entre la II y VIII Regiones, año 2015. Informe Final: Subsecretaría de Economía and EMT. 259 p. [ Links ]
Queirolo, D., Ahumada, M., Wiff, R., Páramo, J., Arana, P., Sergio, P., Lima, M., Flores, A. 2015. Evaluación directa de langostino amarillo y langostino colorado entre la II y VIII Regiones, año 2014. Informe Final. Valparaíso (Chile): Subsecretaría de Economía and EMT. 259 p. [ Links ]
Rivoirard, J, Simmonds, J, Foote, KG, Fernandes, P, Bez, N. 2000. Geostatistics for estimating fish abundance. Oxford (United Kingdom): Blackwell Sciences. 216 p. https://doi.org/10.1002/9780470757123 [ Links ]
Roa, R, Bahamonde, R. 1993. Growth and expansion of an exploited population of the squat lobster (Pleuroncodes monodon) after 3 years without harvesting. Fish Res. 18(3-4):305-319. https://doi.org/10.1016/0165-7836(93)90159-5 [ Links ]
Roa, R, Gallardo, VA, Ernst, B, Baltazar, M, Cañete, JI, Enríquez-Briones, S. 1995. Nursery ground, age structure and abundance of juvenile squat lobster Pleuroncodes monodon on the continental shelf off central Chile. Mar Ecol Prog Ser. 116:47-54. https://doi.org/10.3354/meps116047 [ Links ]
Roa, R, Tapia, F. 1998. Spatial differences in growth and sexual maturity between branches of a large population of the squat lobster Pleuroncodes monodon. Mar Ecol Prog Ser. 167:185-196. https://doi.org/10.3354/meps167185 [ Links ]
Roa, R, Tapia, F. 2000. Cohorts in space: geostatistical mapping of the age structure of the squat lobster Pleuroncodes monodon population off central Chile. Mar Ecol Prog Ser. 196:239-251. https://doi.org/10.3354/meps196239 [ Links ]
Roa, R, Tapia, F, Cid, L, Quiñones, R, Ernst, B, Figueroa, D, Arancibia, H, Galleguillo, R, Retamal, M. 1997. Evaluación directa del stock de langostino colorado en la zona centro-sur. Informe Final Proyecto Fondo de Investigación Pesquera (FIP), 96-23. Valparaíso(Chile): Subsecretaría de Pesca y Acuicultura. 131 p. [ Links ]
Schnute, JT, Boers, N, Haigh, R, Couture-Beil, A. 2010. PBSmapping: Mapping Fisheries Data and Spatial Analysis Tools. British Columbia (Canada): R project; accessed 19 November 2020. http://cran.r-project.org/package=PBSmapping . [ Links ]
Sokal, R, Rohlf, FJ. 2012. Biometry. 4th ed. New York (NY): W. H. Freeman. 960 p. [ Links ]
Tapia, F. 1999. Distribución espacial del potencial reproductivo de la población de langostino colorado (Pleuroncodes monodon) de Chile centro-sur [MSc thesis]. Concepción (Chile): Universidad de Concepción. 58 p. [ Links ]
Trippel, EA. 1999. Estimation of stock reproductive potential: history and challenges for Canadian Atlantic gadoid stock assessments. J Northw Atl Fish Sci. 25:61-81. https://doi.org/10.2960/j.v25.a6 [ Links ]
Wright, PJ. 2013. Methodological challenges to examining the causes of variation in stock reproductive potential. Fish Res. 138:14-22 p. https://doi.org/10.1016/j.fishres.2012.06.002 [ Links ]
Zilleruelo, M, Bravo, C, Párraga, D. 2020. Programa de Seguimiento de las Pesquerías de Crustáceos Demersales 2019: Crustáceos Demersales. Informe Técnico IFOP-Convenio de Desempeño 2019. Valparaíso (Chile): Instituto de Fomento Pesquero. 147 p. [ Links ]
Recibido: 29 de Octubre de 2021; Aprobado: 15 de Octubre de 2022











 texto em
texto em