Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencias marinas
versión impresa ISSN 0185-3880
Cienc. mar vol.49 Ensenada ene./dic. 2023 Epub 08-Dic-2023
https://doi.org/10.7773/cm.y2023.3365
Artículos
Familias de micromoluscos durante 2 periodos contrastantes en Bahía de los Ángeles, golfo de California, México
1Departamento de Ecología Marina, Centro de Investigación Científica y de Educación Superior de Ensenada, 22860 Ensenada, Baja California, Mexico.
Los moluscos marinos brindan importantes servicios ecosistémicos debido a que generan hábitats para organismos bentónicos, filtran agua, biodepositan carbono orgánico en el fondo marino y sirven como fuente de alimento para otros organismos. Los estudios de diversidad de moluscos requieren métodos de muestreo e identificación de especies muy tardados. Por lo tanto, no sorprende que la mayoría de los estudios se centren en los macromoluscos, los cuales son fácilmente recolectados y procesados, ignorando las especies de micromoluscos cuya identificación es difícil y tardada. Si no se comprende la ecología y distribución de los micromoluscos, es imposible evaluar sus poblaciones e implementar medidas de conservación. Aquí presentamos microgasterópodos recolectados en Bahía de los Ángeles a nivel de familia en 2 muestreos, en septiembre de 2013 (verano) y en febrero de 2014 (invierno). En cada temporada, muestreamos 6 estaciones costeras y realizamos mediciones de profundidad, salinidad, temperatura, granulometría y contenido de materia orgánica. Se recolectaron 20,353 ejemplares: 15,310 en verano y 5,043 en invierno. Se identificaron 7 familias: Barleeidae, Caecidae, Cerithiidae, Eulimidae, Pyramidellidae, Rissoidae y Tornidae. Caecidae y Barleeidae presentaron la máxima densidad en verano e invierno, respectivamente (278,044 ind·m-2, 142,222 ind·m-2). Tornidae presentó las densidades más bajas para verano e invierno (~1,867 ind·m-2, ~1,411 ind·m-2). Barleeidae, Caecidae, Cerithiidae, Rissoidae y Tornidae se clasificaron como herbívoros y detritívoros; Eulimidae y Pyramidellidae, como carnívoros y ectoparásitos. Tornidae y Eulimidae muestran relaciones simbióticas con varias especies de invertebrados. El análisis bayesiano indicó una alta probabilidad de diferencias para verano (BF > 3). Al comparar la misma estación entre muestreos, solo la estación 6 mostró diferencias entre periodos (BF > 3). Este estudio brinda información valiosa que amplía el conocimiento de la biodiversidad de micromoluscos en la zona costera de Bahía de los Ángeles, un importante sitio de conservación en México.
Palabras clave: microgasterópodos; niveles tróficos; gremios tróficos; golfo de California
Marine mollusks provide important ecosystem services. They create habitats for benthic organisms, filter water, biodeposit organic carbon in the seafloor, and serve as food sources for other organisms. Studies of mollusk diversity require time-consuming methods to process samples and identify species. Thus, it is not surprising that most studies have focused on macromollusks that can be collected and processed easily, ignoring micromollusk species. Without understanding the ecology and distributions of micromollusks properly, it is impossible to assess their populations and implement adequate conservation measures. Here we present microgastropods collected in Bahia de los Angeles at the family level for September 2013 (summer) and February 2014 (winter). During each season, we sampled 6 coastal sediment stations, and analyzed depth, salinity, temperature, granulometry, and organic matter. A total of 20,353 specimens were collected: 15,310 in summer and 5,043 in winter. Seven micromollusk families were identified: Barleeidae, Caecidae, Cerithiidae, Eulimidae, Pyramidellidae, Rissoidae, and Tornidae. Caecidae and Barleeidae exhibited the highest densities among all families in summer and winter, respectively (278,044 ind·m-2, 142,222 ind·m-2). The lowest densities for summer and winter were observed for the Tornidae family (~1,867 ind·m-2, ~1,411 ind·m-2). Barleeidae, Caecidae, Cerithiidae, Rissoidae, and Tornidae were classified as herbivorous and detritivorous; Eulimidae and Pyramidellidae, as carnivorous and ectoparasitic. Tornidae and Eulimidae showed symbiotic relationships with various invertebrate species. The Bayesian analysis of variance indicated a high probability of differences only in summer (BF > 3). When comparing the stations in both periods, all stations, except station 6, showed differences between periods (BF > 3). The canonical correlation analysis indicated some associations between family abundances and temperature. This study provides valuable information that expands the knowledge of micromollusk biodiversity in the coastal area of Bahia de los Angeles, an important site for conservation in Mexico.
Key words: microgastropods; feeding guild; biodiversity; Gulf of California
INTRODUCCIÓN
Mollusca es un filo antiguo. De hecho, los primeros registros indican que los moluscos se remontan al periodo Cámbrico (Ponder y Lindberg 2008). Hasta la fecha, se han descrito 85,000 especies vivientes de moluscos (Chapman 2009), de las cuales ~30,000 especies se encuentran solo en ambientes marinos. Los moluscos marinos brindan importantes servicios ecosistémicos; crean hábitats para organismos bénticos (e.g., bancos de ostras y mejillones y arrecifes de vermétidos), filtran agua, biodepositan carbono orgánico en el fondo marino y sirven como fuente de alimento para otros organismos (Gazeau et al. 2013).
Los micromoluscos (adultos <5 mm, Geiger et al. 2007; adultos <10 mm, Barrera y Tunnell 2001) son de gran importancia ecológica. Estos diminutos moluscos son consumidos por muchos organismos en niveles tróficos superiores y constituyen alimentos importantes en sus dietas. Por ejemplo, tanto la jaiba azul (Callinectes sapidus) como el pulpo rojo (Octopus maya) consumen grandes cantidades de micromoluscos. Además, moluscos más grandes también consumen micromoluscos después de perforar sus caparazones con sus rádulas (Naim 1988). Los cangrejos ermitaños juveniles utilizan las conchas de micromoluscos vacías, mientras que las conchas vacías y ocupadas sirven como sustratos para los briozoos y otras especies incrustantes. Además, muchos gasterópodos microherbívoros se alimentan de algas o epífitas que crecen sobre los caparazones de micromoluscos (Shacklock y Doyle 1983, Naim 1988, Narciso et al. 2005, Srivastava y Sinh 2021). Dada su importancia como fuentes de alimento dentro de las redes tróficas y como sustratos para otros organismos, no se puede ignorar el papel de los micromoluscos dentro de los ecosistemas.
Se necesita información sobre los gremios tróficos para comprender cómo funcionan las comunidades bénticas y cómo se transfiere la energía a través de las redes alimentarias (Pimm 1982, Arruda et al. 2003, Pagliosa 2005). Dado que los micromoluscos son componentes importantes de los ecosistemas en términos de riqueza y abundancia, desempeñan un papel importante en el proceso de transferencia de energía como depredadores y presas de otros organismos. Sin embargo, para los estudios de las poblaciones de moluscos se necesitan esfuerzos de muestreo muy tardados, técnicas y equipos específicos y capacitación especializada para identificar las especies adecuadamente. Esto es especialmente cierto para los micromoluscos, ya que los estudios de su composición taxonómica presentan desafíos aún mayores que los de los macromoluscos debido a la disponibilidad limitada de claves e información taxonómica. Los micromoluscos adultos miden máximo 10 mm, y algunos son casi invisibles a simple vista, por lo que la clasificación de los individuos de los sedimentos marinos es laboriosa. Como resultado, la mayor parte de la información sobre los moluscos se ha centrado en los macromoluscos y ha ignorado o subestimado la abundancia y diversidad de los micromoluscos (Narciso et al. 2005, Middelfart et al. 2016).
Sasaki (2008) señaló que encontrar y describir especies de micromoluscos representa una frontera ilimitada para generar nuevos conocimientos, ya que estas especies se han descrito en pocos hábitats: cuevas submarinas, respiraderos hidrotermales, sedimentos, algas filamentosas coralinas y algunos entornos crípticos, como aquellos formados por madera hundida (Olabarria y Chapman 2001). Por lo tanto, la búsqueda de micromoluscos necesita expandirse en ambientes que no se han estudiado a fondo y pueden albergar una gran diversidad y riqueza de especies. Algunos de estos ambientes pueden incluso estar contenidos dentro de otros organismos. Por ejemplo, la familia Eulimidae contiene especies parásitas que se alimentan de equinodermos, como los pepinos de mar y las estrellas de mar, y la familia Pyramidellidae contiene especies ectoparásitas que se alimentan de los fluidos corporales de varios invertebrados, especialmente de los gusanos poliquetos u otros moluscos (Ankel 1949, Robertson y Mau-Lastovicka 1979, Esparza-Carrera et al. 2018).
En México, la mayoría de los estudios de micromoluscos marinos se han realizado en el golfo de México, como el estudio de Blanco et al. (2016) de microgasterópodos en isla Verde, Veracruz, y los de García-Cubas (1969), García-Cubas (1982) y García-Cubas (1991). Sin embargo, también se han realizado otros estudios a lo largo de la costa del Pacífico de México. En el estado de Guerrero, Garcés-Salazar (2011) analizó microbivalvos y García-Tello (2013) reportó 71 especies de microgasterópodos. Hansen-Bernal (2014) también estudió micromoluscos de la costa del Pacífico de México y examinó aquellos asociados con macroalgas en la zona intermareal. Esparza-Carrera et al. (2018) recolectaron especímenes de 52 familias y 121 especies de micromoluscos de la costa del Pacífico tropical de México, de los cuales 76% eran gasterópodos y 13% bivalvos.
También se han realizado estudios de micromoluscos en el golfo de California. Schwartzlose et al. (1992) recopilaron información bibliográfica de diversos taxones de moluscos en el golfo de California. Entre estos estudios, Baker et al. (1928) describieron moluscos Pyramellidae, Baker et al. (1930, 1938) recolectaron especímenes de Rissoidae y Epitoniidae y Skoglund (1965) estudió microgasterópodos de Cholla Bay, Sonora, en la parte superior del golfo de California. Además, Castillo-Rodríguez (2014) y Tripp-Quezada et al. (2018) estudiaron la composición y estructura de comunidades de micromoluscos en el golfo de California. En Nayarit, Tapia-Díaz (2018) recolectó ejemplares de 29 familias, 41 géneros y 53 especies de micromoluscos.
Otros estudios han abarcado áreas más amplias. Aguilera-Vilchis y Rivas-Lechuga (2022) analizaron el estado del conocimiento del género Caecum en México y reportaron 31 especies en la costa del Pacífico de México y 26 especies en la costa del Atlántico. Bartsch (1920) describió 13 especies de Barleeia de San Diego y otras áreas costeras de California y 4 especies de Rissoellidae de Mazatlán en la entrada al golfo de California y múltiples sitios a lo largo de la península de Baja California, que incluían la laguna San Ignacio, la bahía de Todos Santos, punta Abreojos y cabo San Lucas. Un siglo después, Raines (2020) revisó miles de especímenes desde Alaska hasta Chile a lo largo del Pacífico oriental y describió 43 especies de Caecidae; 5 eran nuevas para la ciencia.
Aunque se dispone de cierta información para las especies de micromoluscos en México, esta es bastante limitada. Por lo tanto, es necesario mejorar nuestro conocimiento sobre las distribuciones y la ecología de las especies de micromoluscos en México para evaluar adecuadamente las poblaciones, especialmente aquellas en regiones prioritarias para la conservación de la flora y la fauna. Actualmente, Bahía de los Ángeles (BLA) está protegida. Esta bahía costera en el golfo de California, ecológicamente importante y biológicamente productiva, proporciona áreas de anidación y alimentación para varias especies de tortugas marinas (Seminoff et al. 2008) y un área de agregación para tiburones ballena (Rhincodon typus) que llegan cada verano para alimentarse (Rodríguez-Dowdell et al. 2008). La falta de información sobre los micromoluscos de BLA ha impedido que se implementen medidas de conservación adecuadas en esta importante área de conservación. Por lo tanto, el objetivo de este estudio fue identificar las familias de microgasterópodos que se encuentran en BLA.
MATERIALES Y MÉTODOS
Área de estudio y recolección de muestras
BLA (28°95ʹ N y 113°55ʹ W; Fig. 1) se encuentra en Baja California, México, a lo largo de la costa occidental del golfo de California en la Reserva de la Biosfera Bahía de los Ángeles, Canal de Ballenas y Salsipuedes. Las mareas son semidiurnas, y el clima es árido y muy influenciado por las regiones desérticas de la península, con escasas precipitaciones y altas tasas de evaporación (Cavazos 2008). BLA tiene poca influencia antropogénica y sus variados hábitats que albergan diversos organismos bénticos están relativamente intactos.
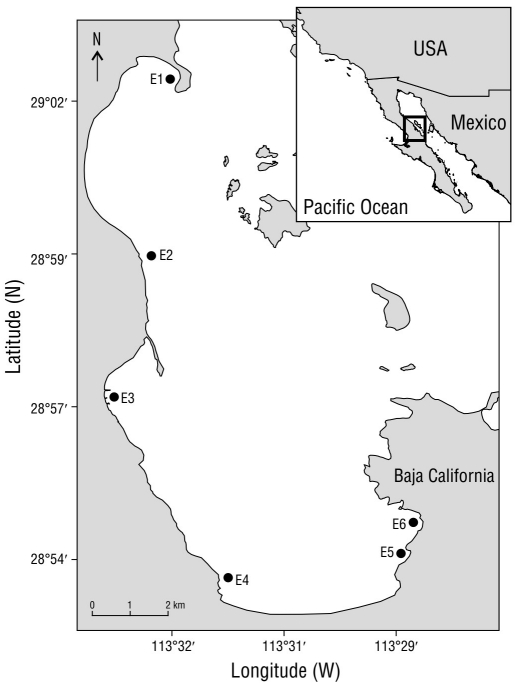
Figura 1 Área de estudio y ubicación de las estaciones de muestreo (E1-E6, puntos negros). Las estaciones cubrían toda la bahía y tenían profundidades que oscilaban entre 10 y 15 m.
Blanco-Betancourt et al. (2004) describieron temperaturas superficiales del mar (TSM) en BLA que oscilaron entre 28.7 °C en verano y 15.3 °C en invierno. Amador-Buenrostro et al. (1991) indicaron que la circulación observada en la bahía es producida por su configuración y batimetría; ellos identificaron un giro persistente frente a punta La Gringa en las áreas norte y central de la bahía y encontraron que las corrientes más fuertes (3 cm·s-1) se encuentran en punta La Gringa y en la región sur de la bahía. Las corrientes inducidas por el viento pueden alcanzar velocidades de 25 cm·s-1.
Se recolectaron un total de 24 muestras de sedimentos de 6 estaciones distribuidas a lo largo de la costa (10-15 m de profundidad) en septiembre de 2013 y febrero de 2014, que se consideraron representativas de las condiciones de verano e invierno, respectivamente. Las 6 estaciones estaban relativamente equidistantes entre sí (Fig. 1). Durante el verano e invierno, se recolectaron 4 muestras en cada estación utilizando un Petite Ponar Grab (Wildco, Yulee, FL, EE. UU.). Las muestras se tamizaron con una malla de 1 mm (Couto et al. 2010) y se fijaron con una solución de formaldehído al 5%. Se tomaron muestras adicionales para determinar el contenido de materia orgánica (MO), la cual se evaluó con el método de pérdida por ignición (Byers et al. 1978). También se tomaron medidas de la TSM y salinidad (SL) en cada estación utilizando un medidor YSI Pro2030 (Yellow Springs, OH, EE. UU.). Para el análisis granulométrico, muestras de sedimento de 20 g se tamizaron en seco a través de una serie de tamices de malla (90 µm a 1 cm) y se agitaron mecánicamente durante 15 min. El sedimento retenido en cada tamiz se pesó con una balanza Denver (resolución de ± 0.01 g). La clasificación granulométrica se obtuvo con Sysgran v.3.0 (Folk y Ward 1957, Rendón-Márquez 1995).
Análisis faunístico
Las muestras se lavaron en el laboratorio con agua corriente utilizando un tamiz de malla de 500 µm y toda la fauna se almacenó en etanol al 70%. Los organismos se agruparon en los siguientes taxones: crustáceos, equinodermos, moluscos, poliquetos y misceláneos. Las muestras de sedimentos se procesaron para separar macrofauna y micromoluscos. Los organismos se contaron e identificaron a nivel de familia según los criterios de Abbott (1974), Brusca (1980) y McLean y Gosliner (1996) utilizando un microscopio Wild M10 Stereo Zoom (Leica, Wetzlar, Alemania). Los gremios tróficos de cada familia se determinaron utilizando la información disponible en la literatura (Tripp-Quezada et al. 2018, Arvizu-Ruiz y Reyes Bonilla 2021, Srivastava y Singh 2021).
Análisis de datos
Utilizamos un análisis de varianza bayesiano (ANDEVA) debido a su naturaleza probabilística (Box y Tiao 2011) para detectar diferencias en la densidad de micromoluscos entre verano e invierno. Se realizó un análisis de correlación canónica (ACC) para analizar la composición de los grupos bentónicos a nivel de familia y las posibles relaciones con variables ambientales (TSM, SL y MO). Todos los análisis se realizaron en R v.4.0.0 (R Core Team 2020). Para el ACC, no consideramos a la familia Tornidae porque, cuando incluimos esta familia, los datos no cumplieron con los requisitos para el análisis, lo que probablemente se debió a la baja abundancia de esta familia en ambas temporadas.
RESULTADOS
Se recogieron un total de 20,353 ejemplares con 15,310 en verano y 5,043 en invierno. Identificamos 7 familias de micromoluscos en las muestras en ambas temporadas: Barleeidae, Caecidae, Cerithiidae, Eulimidae, Pyramidellidae, Rissoidae y Tornidae. Como Eulimidae estuvo representada por muy pocos organismos en ambas temporadas (<30 individuos), esta familia fue descartada de los análisis estadísticos para evitar sesgos por exceso de ceros. La Tabla 1 muestra la abundancia total por familia en ambos periodos y los gremios tróficos y niveles tróficos correspondientes. Los valores de densidad también mostraron un patrón similar, con 679,200 ind·m-2 y 223,111 ind·m-2 en verano e invierno, respectivamente. En verano, la familia Caecidae presentó la densidad máxima (278,044 ind·m-2), mientras que en invierno Barleeidae presentó la densidad más alta (142,222 ind·m-2) de todas las familias. Durante ambas temporadas, Tornidae tuvo las densidades más bajas (1,867 y 1,411 ind·m-2 en verano e invierno, respectivamente). La estación 6 presentó la densidad media más alta para ambos periodos (~69,288 y 39,807 ind·m-2 en verano e invierno, respectivamente), mientras que la estación 2 presentó la densidad media mínima para ambos periodos (15,556 y 4,467 ind·m-2 en verano e invierno, respectivamente).
Tabla 1 Abundancia total por familia en verano e invierno, así como los gremios de alimentación correspondientes. c = carnívoro, d = detritívoro, e = ectoparásito y h = herbívoro.
| Family (Feeding guild, Trophic level) |
Summer (abundance) |
Winter (abundance) |
| Barleeiidae (h, d) | 4,821 | 3,200 |
| Caecidae (h, d) | 6,256 | 470 |
| Cerithiidae (h, d) | 2,488 | 807 |
| Eulimidae (c, e) | 28 | 21 |
| Pyramidellidae (c, e) | 1,454 | 412 |
| Rissoidae (h, d) | 221 | 88 |
| Tornidae (h, d) | 42 | 45 |
| Total | 15,310 | 5,043 |
Durante el verano, la TSM osciló entre 30.0 y 29.4 °C, mientras que en invierno osciló entre 15.8 y 16.4 °C. En contraste, la salinidad tuvo valores más bajos en verano (~32) que en invierno (~34). Además, las concentraciones de MO oscilaron entre 1.00% y 2.22% en verano y entre 1.28% y 2.70% en invierno (Tabla 2). Los resultados del análisis de granulometría para las arenas de verano (finas a gruesas) e invierno (medianas a gruesas) se muestran en la Tabla 3.
Tabla 2 Media (± desviación estándar [SD]), temperatura (°C), salinidad y materia orgánica (%) para verano e invierno en Bahía de los Ángeles (BLA).
| Temperature | Salinity | Organic matter | ||||
| Summer | Winter | Summer | Winter | Summer | Winter | |
| Mean ± SD | 30.1 ± 0.4 | 15.8 ± 0.7 | 33.2 ± 0.1 | 34.5 ± 0.7 | 1.6 ± 0.4 | 2.04 ± 0.6 |
| Minimum | 29.4 | 15.2 | 32.0 | 33.1 | 1.0 | 1.3 |
| Maximum | 30.0 | 16.4 | 32.3 | 35.0 | 2.2 | 2.7 |
Tabla 3 Resultados de granulometría de verano e invierno para cada estación muestreada.
| Station | Summer | Winter |
| E1 | Fine sand | Medium sand |
| E2 | Medium sand | Medium sand |
| E3 | Fine sand | Medium sand |
| E4 | Medium sand | Medium sand |
| E5 | Medium sand | Coarse sand |
| E6 | Coarse sand | Coarse sand |
El análisis de correlación de Spearman mostró una correlación significativa entre la TSM (r = 0.890, P < 0.05) y la abundancia en verano, aunque no se observaron correlaciones significativas con ninguna variable abiótica en invierno (r < 0.305, P > 0.05 para todas las variables abióticas). Los resultados del ANDEVA bayesiano indicaron una baja probabilidad de diferencias en la densidad media entre las estaciones en invierno (BF = 0.25). Por el contrario, algunas estaciones presentaron altas probabilidades de ser diferentes en verano (Tabla 4). Además, la mayoría de las estaciones, con excepción de la estación 6, tuvieron altas probabilidades de presentar diferencias entre temporadas (Tabla 4). El ACC presentó un alto coeficiente de correlación canónica (r = 0.880, P < 0.01) entre la temperatura y la representación lineal de las familias Caecidae, Cerithiidae y Pyramidellidae; Barleeidae, Rissoidae y Tornidae no se relacionaron de manera específica con ninguna estación o variable abiótica (Fig. 2).
Tabla 4 Dado que no encontramos diferencias en las estaciones de invierno, las primeras 2 columnas muestran diferencias entre las estaciones de verano y el factor de Bayes (BF10) a favor de la hipótesis alternativa. Las últimas 2 columnas muestran las diferencias de una misma estación entre las estaciones con su respectivo factor de Bayes (BF). El BF indica las veces que la probabilidad de diferencias es mayor que la probabilidad de no diferencias.
| Differences | BF10 | Differences | BF10 |
| E2S vs. E4S | 16.072 | E1W vs. E1S | 6.643 |
| E2S vs. E5S | 5.719 | E2W vs. E2S | 5.719 |
| E3S vs. E4S | 5.930 | E3W vs. E3S | 4.579 |
| E3S vs. E5S | 3.245 | E4W vs. E4S | 24.406 |
| E5W vs. E5S | 6.156 |
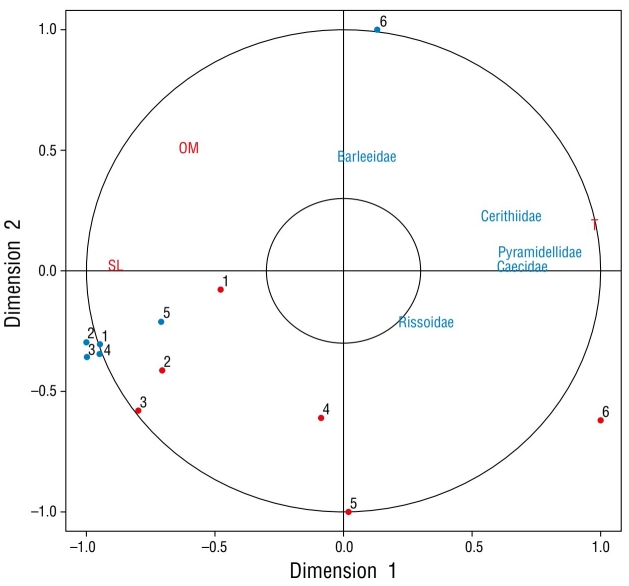
Figura 2 La gráfica del análisis de correlación canónica (ACC) de las familias probadas (ACC r = 0.88; P < 0.01). Los números indican las 6 estaciones muestreadas. Los puntos rojos y los puntos azules son estaciones de verano e invierno, respectivamente. T = temperatura, SL = salinidad, OM = materia orgánica.
DISCUSIÓN
En general, se identificaron un total de 7 familias en BLA: Barleeidae, Caecidae, Cerithiidae, Eulimidae, Pyramidellidae, Rissoidae y Tornidae. De estas, las familias más abundantes fueron Caecidae y Barleeidae. Esto probablemente se deba a que los moluscos Barleeidae son abundantes y están ampliamente distribuidos (Hansen-Bernal 2014), lo que puede deberse en parte a que estos moluscos exhiben un desarrollo directo sin una etapa planctotrófica (Ponder 1983), que también puede contribuir a su diversidad relativamente alta. Las familias Tornidae y Eulimidae fueron los micromoluscos menos abundantes en este estudio.
Raines (2019) señala que, si bien la familia Caecidae no es muy diversa, tiende a ser muy prolífica en aguas poco profundas. Esto podría haber resultado en la gran abundancia observada en nuestro estudio (6,256 organismos). Bartsch (1920) reportó la presencia de Caecidae a lo largo de la costa noroeste del Pacífico de los Estados Unidos; para la misma región, Raines (2019) agregó una nueva especie de esta familia a las reportadas por McLean (1978). Aguilera-Vilchis y Rivas-Lechuga (2022) analizaron la familia Caecidae y listaron 31 especies de Caecum en la costa del Pacífico de México.
Aunque solo encontramos 7 familias de micromoluscos en nuestra área de estudio, las abundancias fueron más altas que las reportadas previamente. Tapia-Díaz (2018) realizó un extenso estudio de micromoluscos en Nayarit en el sur del golfo de California durante el invierno de 2013 y encontró solo 288 micromoluscos. En cambio, en el presente estudio recolectamos 20,353 individuos. Solo durante el invierno recolectamos 5,043 organismos, que son muchos más que los recolectados por Tapia-Díaz (2018). García-Tello (2013) recolectó 9,440 organismos (51 familias) en Acapulco, en la costa del Pacífico de México, que también es mucho menor que el número total de organismos recolectados en el presente estudio. Esto indica que el golfo de California es un sistema altamente productivo.
Esparza-Carrera et al. (2018) recolectaron micromoluscos en Tenacatita, Jalisco (11 familias) y Manzanillo, Colima (9 familias), mientras que Esparza-Carrera y Esqueda-González (2019) recolectaron micromoluscos en Manzanillo, Colima (4 familias), Tenacatita, Jalisco (5 familias), bahía Banderas, Jalisco (11 familias), y Mazatlán, Sinaloa (13 familias). Hansen-Bernal (2014) recolectó micromoluscos en áreas con macroalgas de Michoacán, Jalisco y Guerrero y encontró 12 familias; los géneros más abundantes fueron Barleeia y Fossarus. En nuestro estudio, recolectamos 7 familias de microgasterópodos. La riqueza de familias de nuestro estudio es ligeramente menor, pero solo recolectamos muestras en 6 estaciones en BLA. No obstante, la riqueza de familias en nuestro estudio es superior a las de Manzanillo y Tenacatita.
El análisis de los gremios tróficos reveló que 5 de las 7 familias estaban compuestas por herbívoros y detritívoros. Las 2 familias restantes, Pyramidellidae y Eulimidae, estaban compuestas por carnívoros y ectoparásitos. Estas 2 familias fueron más abundantes en verano que en invierno. Esto puede deberse a que los moluscos fueron muy abundantes en el verano de 2013 (Ángeles-González et al. 2021) y a que las especies de Pyramidellidae se alimentan principalmente de otros moluscos y gusanos anélidos (Robertson y Mau-Lastovicka 1979).
Ángeles-González et al. (2021) encontraron diferencias significativas en la abundancia de fauna bentónica entre verano e invierno en BLA durante los mismos años que los de nuestro estudio, con mayores abundancias para verano que para invierno. Esta misma tendencia también se informó en otros estudios (golfo de California, Brusca 1980; BLA, Barnard y Grady 1968). Sin embargo, nuestros resultados contrastan con los del Pacífico. Por ejemplo, Olabarría et al. (2001) encontraron mayores abundancias en invierno que en verano a lo largo de la costa de Sinaloa. Como indicó Alvarez-Borrego (2008), las corrientes de marea de la Región de las Grandes Islas son muy intensas. De hecho, las tasas de disipación de energía en la región superan los 0.3 W·m-2 (Argote et al. 1995). La mezcla intensa crea una situación similar a la de un afloramiento constante. Las frías aguas superficiales y subterráneas resultantes podrían ser responsables de las mayores abundancias observadas en verano (15,310) en comparación con las observadas en invierno (5,043) en este estudio.
Ángeles-González et al. (2021) mostraron una relación directa entre TSM y SL y la abundancia de fauna macrobentónica en BLA. Encontramos resultados similares para la mayoría de las familias de micromoluscos, aunque el ACC no reveló ninguna asociación entre las otras variables abióticas y la abundancia de fauna microbentónica en BLA. Además, el análisis de correlación de Spearman indicó una relación significativa entre la abundancia y la temperatura (TSM; r = 0.89, P < 0.05) en verano, pero no en invierno. No encontramos correlaciones significativas entre la abundancia y cualquier otra variable abiótica (r < 0.305, P > 0.05). Además, el ACC y los análisis de correlación no indicaron ninguna asociación entre la MO y la abundancia para ninguna temporada, lo que podría deberse a que la mayoría de las familias en este estudio se alimentan de depósitos. Debido a que el depósito de detritos está compuesto de materia orgánica muerta cuyo contenido de nitrógeno y carbono y valor nutricional varía (Kenneth 1988), asumimos que la MO siempre estuvo disponible y, por lo tanto, la abundancia no debería correlacionarse con la MO.
Los detritívoros regeneran nutrientes que pueden ser utilizados por microalgas, macroalgas y pastos marinos a través de sus actividades de alimentación. Estas actividades favorecen la presencia de especies de herbívoros que pueden aprovechar el fitobentos. El alimento sedimentario de los detritívoros incluye desechos de macroalgas a la deriva, diatomeas bentónicas y restos de algas. Se ha encontrado que un aumento en los detritívoros mejora la actividad de bioturbación, que a su vez proporciona nutrientes para macroalgas y pastos marinos mientras favorece un aumento en la abundancia de herbívoros (Byren 2004, Andrade-Díaz 2016).
Hasta donde sabemos, no hay registros de micromoluscos en BLA, aunque existen registros de las familias de moluscos Caecidae, Cerithiidae, Eulimidae, Tornidae, Pyramidellidae y Rissoidae en BLA y en todo el golfo de California (Coan 1968, Hendrickx et al. 2007). Sin embargo, la familia Barleeidae solo ha sido reportada por Hendrickx et al. (2007) en el golfo de California y a lo largo de la costa del Pacífico de México en Tijuana, Baja California, por Tapia-Díaz (2018) en Puerto Vallarta, Jalisco, y más recientemente por Gama-Kwick et al. (2021) y GBIF (2020) en las costas de Guerrero.
En México, los estudios de micromoluscos se encuentran en las primeras etapas y los malacólogos aún tienen mucho camino por recorrer. Es probable que numerosas especies de micromoluscos ya estén en peligro debido a la contaminación y cambio climático, ya que son organismos calcificadores que deben construir caparazones para sobrevivir (Doney et al. 2012, Gazeau et al. 2013, Díaz-Castañeda et al. 2019). Por lo tanto, es importante estudiar estos organismos bénticos para comprender cómo pueden responder comunidades enteras a los cambios en las condiciones ambientales. Los estudios de las comunidades bentónicas requieren un gran esfuerzo, ya que involucran técnicas especiales de muestreo y trabajo de laboratorio e identificación de organismos que demandan mucho tiempo, pero son muy necesarios. En este estudio, la proximidad de los sitios de muestreo a la costa y su poca profundidad pueden haber influido en el número de familias y su abundancia en las muestras. Sin embargo, debido a la importancia ecológica de los micromoluscos, creemos que este estudio aporta información valiosa para abordar la falta de conocimiento asociado con este grupo importante.
AGRADECIMIENTOS
Los autores agradecen a Maricarmen Necoechea por su ayuda en la identificación de familias de micromoluscos y a Andrea Lievana-MacTavish por la edición en inglés. También agradecemos a Adán Avilés por corregir las figuras.
REFERENCIAS
Abbott, RT. 1974. American Seashells. New York (NY): Van Nostrand Reinhold. 663 p. [ Links ]
Aguilera-Vilchis, C, Rivas-Lechuga, G. 2022. Estado del conocimiento del género Caecum Fleming, 1813 (Gastropoda: Caecidae) en México. XXV Congreso Nacional de Zoología; 2022 October 24-28, Ciudad de México, México. Mexico. [ Links ]
Álvarez-Borrego, S. 2008. Oceanografía de la región de las grandes islas. In: Danemann, DG, Ezcurra, E (eds.), Bahía de Los Ángeles: recursos naturales y comunidad. Línea base 2007, Capítulo 2. Mexico: Pronatura Noroeste AC., Semarnat, INE, San Diego Natural History Museum. p. 45-64. [ Links ]
Amador-Buenrostro, A, Serrano-Guzmán, SJ, Argote-Espinoza, ML. 1991. Modelado numérico de la circulación inducida por el viento en Bahía de Los Ángeles, BC, México. Cienc Mar. 17(3):39-57. https://doi.org/10.7773/cm.v17i3.822 [ Links ]
Andrade-Díaz, C 2016. Trophic structure and flow in marine benthic communities of the Magellan region southern Chile [dissertation]. Bremen (Germany): Bremen University. 104 p. [ Links ]
Ángeles-González, LE, Solana-Arellano, E, Díaz-Castañeda, V, Flores-Uzeta, O, Necoechea-Zamora, M. 2021. Soft-bottom macrofauna along the coast of Bahía de Los Ángeles, Gulf of California, during the summer and winter = Macrofauna de fondo blando a lo largo de la costa de bahía de Los Ángeles, golfo de California, durante el verano y el invierno. Cienc Mar. 47(1):49-59. https://doi.org/10.7773/cm.v47i1.3146 [ Links ]
Ankel, WE. 1949. Die Mundbewaffnung der Pyramidelliden [The Pyramidellid’s mouth weapon]. Arch Molluskenkd. 77:79-82. [ Links ]
Argote, ML, Amador, A, Lavín, MF, Hunter, JR. 1995. Tidal dissipation and stratification in the Gulf of California. J Geophys Res. 100(8):16103-16118. [ Links ]
Arruda, E, Domaneschi, O, Amaral, AC. 2003. Mollusc feeding guilds on Sandy beaches in Sao Paulo State, Brazil. Mar Biol. 143:691-701. [ Links ]
Arvizu-Ruiz, A, Reyes-Bonilla, H. 2021. Characterization of food guilds of the class Gastropoda on the northeast rocky coast of the Gulf of California. CICIMAR Ocean. 36(1-2):37-46. [ Links ]
Baker, F, Hanna, GD, Strong, AM. 1928. Some Pyramidellidae from the Gulf of California. Proc Calif Acad Sci. 17(7):205-246. [ Links ]
Baker, F, Hanna, GD, Strong, AM. 1930. Some rissoid Mollusca from the Gulf of California. Proc Calif Acad Sci. 19(4):23-40. [ Links ]
Baker, F, Hanna, GD, Strong, AM. 1938. Some Mollusca of the families Cerithiopsidae, Cerithiidae and Cyclostrematidae from the Gulf of California and adjacent waters. Proc. Calif. Acad. Sci. 23:217-244. [ Links ]
Barnard, JL, Grady, JR. 1968. A Biological Survey of Bahia de Los Angeles, Gulf of California, Mexico. Trans San Diego Soc Nat Hist. 15(6):51-66. [ Links ]
Bartsch, P. 1920. The west American mollusks of the families Rissoellidae and Synceratidae, and the rissoid genus Barleeia. Proc US Natl Mus. 58 (2331):159-176. [ Links ]
Barrera, N, Tunnell, JW. 2001. Micromolluscan faunal survey of the East and West Flower Garden Banks, Long-term monitoring of the East and west Flower Gardens Banks, 1998-1999 Annual Report. New Orleans (LA): Texas A & M University, NOAA. p. 99-108. [ Links ]
Blanco-Betancourt, R, Pacheco-Ruiz, R, Guzmán-Calderón, JM, Zertuche-Gonzalez, JA, Chee-Barragán, A, Martínez-Díaz-de-León, A, Gálvez-Téllez A, López-Vivas JM. 2004. Base de datos de la temperatura de agua de mar de seis bahías de la costa noroccidental del Golfo de california, México. Reporte técnico 2004(1). Ensenada (BC): IIO. p. 1-35. [ Links ]
Blanco, C, Cano, S, Cortes, C, Montoya, B. 2016. Micromoluscos (gastropodos) presentes en sedimentos del arrecife de Isla Verde, Veracruz. Facultad de Estudios Superiores Iztacala, UNAM, México. Mexico City: UNAM; [accessed 2023 Aug 5]. https://www.academia.edu/26295084/Micromoluscos_Gastr%C3%B3podos_gasteropodos_del_arrecife_Verde_Veracruz . [ Links ]
Box, GE, Tiao, GC. 2011. Bayesian inference in statistical analysis (Vol. 40). India: John Wiley and Sons. 608 p. [ Links ]
Brusca, RC. 1980. Common intertidal invertebrates of the Gulf of California. Tucson (AZ): University of Arizona Press. 558 p. [ Links ]
Byers, SCH, Mills, CEL, Steward, PL. 1978. A comparison of methods of determining organic carbon in marine sediments, with suggestion for a standard method. Hidrobiologia. 58(1):43-47. [ Links ]
Byren, L. 2004. Deposit-feeding macrofauna: tracer studies from the Baltic Sea [dissertation]. [Sweden]: Sotockholm University. 104 p. [ Links ]
Castillo-Rodríguez, ZG. 2014. Biodiversidad de Molusco marinos en México. Revista Mexicana de Biodiversidad. Suplemento-Biodiversidad de México-enero. 85:419-430. https://doi.org/10.7550/rmb.33003 [ Links ]
Cavazos, T. 2008. Clima. In: Danemann, DG, Ezcurra, E (eds.), Bahía de Los Ángeles: recursos naturales y comunidad. Línea base 2007, Capítulo 3. Mexico: Pronatura Noroeste AC., Semarnat, INE, San Diego Natural History Museum. p. 67-90. [ Links ]
Chapman, AD. 2009. Numbers of Living Species in Australia and the World. 2nd ed. Canberra (Australia): Australian Biological Resources Study; [accessed 2012 Jun 17]. http://www.environment.gov.au/biodiversity/abrs/publications/other/species-numbers/2009/04-02-groups-invertebrates.html#mollusca . [ Links ]
Coan, EV. 1968. A biological survey of Bahía de los Ángeles, Gulf of California, México. III. Benthic Mollusca. San Diego Soc Nat Hist Trans. 15(8):107-132. [ Links ]
Couto, T, Patrício, J, Neto, J, Ceia, F, Franco, J, Marques, JC. 2010. The influence of mesh size in environmental quality assessment of estuarine macrobenthic communities. Ecol Ind. 10(6):1162-1173. https://doi.org/10.1016/j.ecolind.2010.03.019 [ Links ]
Díaz-Castañeda, V, Cox, ET, Gazeau, F, Fitzer, S, Delille, J, Alliouane, S, Gattuso, JP. 2019. Ocean acidification affects calcareous tube growth in adults and reared offspring of serpulid polychaetes. J Exp Biol. 222(13):1-11.https://doi.org/10.1242/jeb.196543 [ Links ]
Doney, S, Rockelshaus, M, Duffy, JE, Barry, JP, Chan, F, English, CA, Galindo, HM, Grebmeier, JM, Hollowed, AB, Knowlton, N, et al. 2012. Climate change impacts on marine ecosystems. Mar Science. 4:11-37. [ Links ]
Esparza-Carrera, M, Esqueda-González, MC, Ruiz-Ramos, R, Velázquez- Hernández, M, Ruiz-Jara, E. 2018. Conference: Registros de Micromoluscos del Pacifico Tropical Mexicano. [accessed 2018 Sep]. https://www.researchgate.net/publication/327925459_REGISTROS_DE_MICROMOLUSCOS_EN_EL_PACIFICO_TROPICAL_MEXICANO . [ Links ]
Esparza-Carrera, M, Esqueda-González, MC. 2019. Conference: Micromoluscos, minúsculos habitantes del Pacífico Tropical Mexicano. Jalisco (Mexico): Universidad de Guadalajara; [accessed 2019 Oct]. https://www.researchgate.net/publication/346955652_MICROMOLUSCOS_MINUSCULOS_HABITANTES_DEL_PACIFICO_TROPICAL_MEXICANO . [ Links ]
Folk, RL, Ward, WC. 1957. Brazos River bar-A study in the significance of grain size parameters. J Sediment Petrol. 27:3-26. https://doi.org/10.1306/74D70646-2B21-11D7-8648000102C1865D [ Links ]
Gama-Kwick, N, Aguilar-Estrada, LG, Quiroz-González, N, Ruíz-Boijseauneau, I. 2021. Nuevos registros de gasterópodos (Mollusca) asociados a macroalgas intermareales de Guerrero, México. Rev Mex Biodiversidad. 92:e923441. [ Links ]
Garcés-Salazar, SJ. 2011. Micromoluscos bivalvos de la bahía de Acapulco, Guerrero: composición específica y diversidad [BSc thesis]. [Mexico City (Mexico)]: Facultad de Ciencias, Universidad Nacional Autónoma de México. 75 p. [ Links ]
García-Cubas, A. 1969. Ecologia y distribucion de los micromoluscos recientes de la Laguna de Tamiahua Veracruz, Ciudad de Mexico. Boletin del Instituto de Geologia, Universidad Nacional Autónoma de México. 91:1-53. [ Links ]
García-Cubas, A. 1982. Moluscos de un Sistema lagunar tropical en el sur del Golfo de Mexico (Laguna de Términos Campeche) = Mollusks of a tropical lagoon system in the southern Gulf of Mexico (Laguna de Términos, Campeche). Contribución 294. 1st ed. Mexico City (Mexico): Instituto de Ciencias del Mar y Limnologia, UNAM. 181 p. [ Links ]
García-Cubas, A. 1991. Ecología y distribución de los micromoluscos recientes de Laguna Madre, Tamaulipas Mexico. Boletin Instituto de Geologia 86: Universidad Nacional Autónoma de México. p. 1-44. [ Links ]
García-Tello, ID. 2013. Moluscos gasterópodos de la Bahía de Acapulco, Guerrero, México: sistematica e indicadores ecológicos [BSc thesis]. [Mexico City (Mexico)]: Facultad de Ciencias, Universidad Nacional Autónoma de México. 86 p. [ Links ]
Gazeau, F, Parker, LM, Coumeau, S, Gattuso, JP, O’Connor, WA, Martin, S, Pörtner, HO, Ross, PM. 2013. Impacts of ocean acidification on marine shelled molluscs. Mar Biol. 160(8):2207-2245.https://doi.org/10.1007/s00227-013-2219-3 [ Links ]
[GBIF ] GLOBAL BIODIVERSITY INFORMATION FACILITY BIF Secretariat. 2020. Backbone Taxonomy: GBIF; [accessed 2020 Jan 13]. https://www.gbif.org/species/5284517. https://doi.org/10.15468/39omei [ Links ]
Geiger, DL, Marshall, BA, Ponder, WF, Sasaki, T, Warén, A. 2007. Techniques for collecting, handling, preparing, storing and examining small molluscan specimens. Mollus Res. 27(1):1-50. [Accesed 2014 Mar 29]. https://www.molluscabase.org/aphia.php?p=sourcedetails&id=176243 . [ Links ]
Hansen-Bernal, S. 2014. Micromoluscos asociados con macroalgas del intermareal rocoso de Michoacán, Oaxaca y Guerrero, México [BSc thesis]. [Mexico City (Mexico)]: Facultad de Ciencias, Universidad Nacional Autónoma de México. 40 p. [ Links ]
Hendrickx, ME, Brusca, RC, Cordero, M, Ramírez, GR. 2007. Marine and brackish-water molluscan biodiversity in the Gulf of California, Mexico. Sci Mar. 71(4):637-647. [ Links ]
Kenneth, RT. 1988. Nitrogen. In: Blackburn, TH, Sorensen, J (eds.), Benthic Food Chains, Chapter 9: Nitrogen Cycling in Coastal Marine Environment, SCOPE. Nueva Jersey (NY): John Wiley & Sons. p. 191-206. [ Links ]
McLean, JH. 1978. Marine Shells of Southern California. Revised Edition: Natural History Museum of Los Angeles County Science Series 24. p. 104. [ Links ]
McLean, JH, Gosliner, TM. 1996. The Gastropoda. In: Paul, H, Scott, J, Blake, AJ, Lissner, AL (eds.), Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel, Vol. 9: The Mollusca part 2. Santa Barbara (CA): Santa Barbara Museum of Natural History press. p. 1-228. [ Links ]
Middelfart, PU, Kirkendale, LA, Wilson, NG. 2016. Australian tropical marine micromolluscs: an overwhelming bias. Diversity. 8(3):17. https://doi.org/10.3390/d8030017 [ Links ]
Narciso, S, Prieto-Arcas, A, Acosta-Balbás, V. 2005. Microgasterópodos asociados con el banco natural de la pepitona Arca zebra (Swainson, 1833; Mollusca: Bivalvia) ubicado en la localidad de Chacopata, Estado Sucre, Venezuela = Microgastropods associated with the natural bank of Arca zebra (Swainson, 1833; Mollusca: Bivalvia) located in Chacopata, Sucre State, Venezuela. Cienc Mar. 31(1A):119-124. http://dx.doi.org/10.7773/cm.v31i11.71 [ Links ]
Naim, O. 1988. Distributional pattern of mobile fauna associated with Halimeda on the Tiahura coral-reef complex (Morea, French Polynesia). Coral Reefs. 6(3):237-250. http://dx.doi.org/10.1007/bf00302020 [ Links ]
Olabarria, C, Chapman, MG. 2001. Comparisons of patterns of spatial variation of microgastropods between two contrasting intertidal habitats. Mar Ecol Prog Ser. 220:201-211. http://doi.org/10.3354/meps220201 [ Links ]
Pimm, SL. 1982. Food webs. In: Food Webs. Population and Community Biology ebook. Dordrecht (Holland): Springer. 219 p. https://doi.org/10.1007/978-94-009-5925-5_1 [ Links ]
Ponder, W. 1983. Review of the genera of Barleeidae (Mollusca: Gastropoda: Rissoacea). Rec Aust Mus. 35(6):231-281. https://doi.org/10.3853/j.0067-1975.35.1983.320 [ Links ]
Ponder, WF, Lindberg, DR. 2008. Phylogeny and evolution of the Mollusca. Berkeley (CA): University of California press. 469 p. [ Links ]
Pagliosa, P. 2005. Another diet of worms: the applicability of polychaete feeding guilds as a useful conceptual framework and biological variable. Mar Ecol. 26(3-4):246-254.https://doi.org/10.1111/j.1439-0485.2005.00065.x [ Links ]
Raines, BK. 2019. Caecidae of the northeast Pacific (Gastropoda: Caenogastropoda). Zoosymposia. 13:097-103. https://doi.org/10.11646/zoosymposia.13.1.10 [ Links ]
Raines, BK. 2020. A Rosetta stone for eastern Pacific Caecidae (Gastropoda: Caenogastropoda). Zootaxa. 4827(1):1-146. https://doi.org/10.11646/zootaxa.4827.1.1 [ Links ]
R Core Team. 2020. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria; [accessed 2020 May 5]. https://www.r-project.org/index.html . [ Links ]
Rendón-Márquez, G. 1995. Técnicas petrográficas para el estudio de rocas y sedimentos en el Laboratorio de Petrología. Informe técnico CTGOT6501. Ensenada (BC): Comunicación Académica Serie Geología CICESE. 33 p. [ Links ]
Rodríguez-Dowdell, N, Enríquez-Andrade, R, Cárdenas-Torres, N. 2008. Tiburón Ballena. In Danemann, DG, Ezcurra, E (eds.), Bahía de Los Ángeles: recursos naturales y comunidad. Línea base 2007, Capítulo 13. Mexico: Pronatura Noroeste AC., Semarnat, INE, San Diego Natural History Museum. p. 363-384. [ Links ]
Robertson, R, Mau-Lastovicka, T. 1979. The ectoparasitism of Boonea and Fargoa (Gastropoda: Pyramidellidae). Biol Bull. 157(2):320-333. https://doi.org/10.2307/1541058 [ Links ]
Skoglund, C. 1965. Gastropods of Cholla Bay, Sonora, Mexico. Biological Studies in the Gulf of California Vol. II. 17 p. [ Links ]
Sasaki, T. 2008. Micromolluscs in Japan: taxonomic composition, habitats, and future topics. Zoosymposia. 1:147-232. https://doi.org/10.11646/zoosymposia.1.1.12 [ Links ]
Seminoff, JA, Reséndiz-Hidalgo, A, Jiménez-de-Reséndiz, B, Nichols, WJ, Todd-Jones, T. 2008. Tortugas marinas. In: Danemann, DG, Ezcurra, E (eds.), Bahía de Los Ángeles: recursos naturales y comunidad. Línea base 2007, Capítulo 16. Mexico: Pronatura Noroeste AC., Semarnat, INE, San Diego Natural History Museum . p. 457-494. [ Links ]
Srivastava, AK, Singh, VK. 2021. Feeding Behaviours in Gastropod Molluscs. J Cell Mol Bio. [accessed 2021 April 16]; 5(1):013. https://www.researchgate.net/profile/Arun-Srivastava-4/publication/350995090_Feeding_Behaviours_in_Gastropod_Molluscs_Journal_of_Cell_Molecular_Biology/links/607e9f858ea909241e1071b3/Feeding-Behaviours-in-Gastropod-Molluscs-Journal-of-Cell-Molecular-Biology.pdf [ Links ]
Schwartzlose, R, Álvarez-Millán, D, Brueggeman, P. 1992. Gulf of California: Bibliography of Marine Sciences, California digital library, University of California. California: UC San Diego. 425 p. https://escholarship.org/uc/item/2973x3tq. [ Links ]
Shacklock, PF, Doyle, RW. 1983. Control of epiphytes in seaweed cultures using grazers. Aquaculture. 31(2-4):141-151. https://doi.org/10.1016/0044-8486(83)90308-3 [ Links ]
Tapia-Díaz, P. 2018. Micromoluscos de Nayarit, México: sistemática e indicadores ecológicos [BSc thesis]. [Mexico City (Mexico)]: Facultad de Ciencias, Universidad Nacional Autónoma de México. 56 p. [ Links ]
Tripp-Quezada, A, Tripp-Valdez, A, Tripp-Valdez, MA, Capetillo-Piñar, N, Villalejo-Fuerte, M. 2018. Composición y estructura de la comunidad de moluscos de fondos blandos de la isla Santa Cruz, golfo de California, México = Composition and community structure of soft bottom mollusks on Santa Cruz Island, Gulf of California, Mexico. Hidrobiológica. 28(1):51-59. https://doi.org/10.24275/uam/izt/dcbs/hidro/2018v28n1/Tripp [ Links ]
Recibido: 08 de Junio de 2022; Aprobado: 16 de Marzo de 2023











 texto en
texto en 



