Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dez. 2022 Epub 17-Nov-2023
https://doi.org/10.7773/cm.y2022.3201
Artículos
Ecología trófica de neonatos y juveniles del tiburón sedoso, Carcharhinus falciformis, frente a la costa de Guerrero, México
1Universidad Autónoma de Guerrero, Facultad de Ecología Marina, 39390 Acapulco, Guerrero, Mexico.
2Universidad del Mar, Campus Puerto Ángel Ciudad Universitaria, 70902 San Pedro Pochutla, Oaxaca, Mexico.
El tiburón sedoso Carcharhinus falciformis es una de las especies de tiburón más importantes en las capturas de la pesquería de pequeña escala de la costa mexicana del Pacífico. En el presente trabajo reportamos los principales componentes alimentarios de C. falciformis capturados por la flota pesquera de pequeña escala en Acapulco, Guerrero, México, de acuerdo con la talla (neonatos y juveniles) y el sexo (machos y hembras), así como la amplitud de su nicho y nivel trófico. Se recolectaron en total 165 estómagos de C. falciformis, de los cuales 57 presentaron contenido estomacal y 108 se encontraron vacíos. Se identificaron en total 11 componentes alimentarios: 4 crustáceos, 3 peces, 2 cefalópodos, 1 tortuga marina y 1 ave. De acuerdo con el índice de importancia relativa especifica de la presa (%IIREP), el grupo de los crustáceos representó el 77.17% de la dieta. El cangrejo Portunus xantusii fue el componente más importante de la dieta de neonatos, juveniles, machos y hembras. Las dietas entre neonatos y juveniles y entre machos y hembras no presentaron grandes diferencias (índice de Morisita-Horn: 0.86 y 0.80, respectivamente). El tiburón sedoso presentó una amplitud de nicho estrecha en todas las categorías, lo que indicó una estrategia de alimentación de tipo especialista (índice de Levin <0.60). De acuerdo con el modelo de Amundsen, C. falciformis mostró una preferencia por P. xantusii. El nivel trófico determinado para C. falciformis indicó que es un depredador secundario.
Palabras clave: Carcharhinus falciformis; estrategia de alimentación; juveniles; neonatos; nivel trófico
The silky shark, Carcharhinus falciformis, is one of the most important shark species in the small-scale fishery landings on the Pacific coast of Mexico. In the present work, we report the main food components of C. falciformis caught by small-scale fisheries in Acapulco, Guerrero, Mexico, according to size (neonates and juveniles) and sex (males and females), as well as reporting the niche breadth and trophic level. A total of 165 stomachs of C. falciformis were collected, of which 57 contained food and 108 were empty. A total of 11 prey groups were identified: 4 crustaceans, 3 fish, 2 cephalopods, 1 sea turtle, and 1 bird. According to the prey-specific index of relative importance (%PSIRI), crustaceans accounted for 77.17% of the diet. The crab Portunus xantusii was the most important component of the diet of neonates, juveniles, males, and females. The diets did not show great differences between neonates and juveniles and between males and females (Morisita-Horn index: 0.86 and 0.80, respectively). The silky shark presented a narrow niche breadth in all categories, indicating a specialist-type feeding strategy (Levin’s index <0.60). According to Amundsen’s model, C. falciformis showed preference for P. xantusii. The trophic level determined for C. falciformis indicated that it is a secondary predator.
Key words: Carcharhinus falciformis; feeding strategy; juveniles; neonates; trophic level
INTRODUCCIÓN
El tiburón sedoso, Carcharhinus falciformis (Bibron, 1839) (Familia Carcharhinidae), es una especie ampliamente distribuida en mares tropicales, y se encuentra en el Atlántico occidental, Atlántico oriental, Indo-Pacífico y Pacífico oriental, en este último desde el sur de Baja California, México, hasta el norte de Chile (Compagno et al. 1989, Menni y Lucifora 2007). Aunque es considerada una especie vulnerable (IUCN 2019), C. falciformis es uno de los tiburones más abundantes en las capturas de la pesquería artesanal de las aguas del Pacífico frente a México, y es una de las especies más importantes en las pesquerías de los estados de Baja California Sur, Chiapas y Yucatán (Bonfil 2008, Cabrera-Chávez-Costa et al. 2010). Además, es la especie de tiburón más capturada como fauna incidental en la pesca de atún aleta amarilla y barrilete en el océano Pacífico oriental (Duffy et al. 2015).
Los tiburones son considerados depredadores apicales en muchos ecosistemas costeros y pueden ejercer influencia de arriba hacia abajo en las comunidades, lo que ayuda a controlar a las poblaciones de niveles tróficos inferiores (Cortés 1999, Heithaus et al. 2010). Los estudios sobre la ecología trófica de tiburones ayudan a comprender el papel que estos depredadores desempeñan dentro de un ecosistema y su importancia como un vínculo entre los niveles superiores e inferiores de la cadena alimentaria (Cortés 1999, Borrell et al. 2011, Bornatowski et al. 2014, Barría et al. 2018, Hayden et al. 2019). Además, la información de estos estudios es importante porque nos permite hacer inferencias sobre la relación depredador-presa; identificar la importancia relativa de una presa particular en la dieta de un tiburón, incluso identificar la abundancia, la distribución y las preferencias de la presa; y determinar si los tiburones presentan una segregación espacial para reducir las interacciones competitivas entre conespecíficos, por sexo o por posibles cambios ontogenéticos en la dieta (Estupiñán-Montaño et al. 2017).
Sobre la ecología trófica de C. falciformis, su dieta cambia dependiendo de su área de distribución, lo que le permite utilizar distintas fuentes de alimentación, como peces, calamares, argonautas y cangrejos pelágicos (Myers 1999, Rosas-Luis et al. 2017). Mientras que algunos tiburones presentan un nicho trófico amplio (generalistas), otros presentan un nicho trófico estrecho (especialistas), lo que muestra importantes diferencias en los hábitos alimentarios entre las especies (Cortés 1999, Barría et al. 2015). Duffy et al. (2015) mencionaron que, en las zonas de pesca de atún del océano Pacífico oriental (México y Panamá), C. falciformis tiende a seleccionar a sus presas y, dependiendo del área, se alimenta principalmente de los peces Thunnus albacares, Cubiceps pauciradiatus, Katsuwonus pelamis y de algunas especies de la familia Carangidae y del calamar Dosidicus gigas. En Ecuador, C. falciformis se alimenta principalmente de los peces K. pelamis y T. albacares (Rosas-Luis et al. 2017). Por su parte, Cabrera-Chávez-Costa et al. (2010) determinaron que C. falciformis es un depredador especialista debido al mayor consumo de la langostilla Pleuroncodes planipes, la macarela Scomber japonicus y el calamar D. gigas en Baja California Sur, México. En contraste, Flores-Martínez et al. (2016) consideraron que es una especie generalista y un consumidor terciario que se alimenta principalmente del calamar D. gigas en la costa de Chiapas, México.
Los elasmobranquios, son organismos de crecimiento lento, madurez tardía y baja fecundidad, por lo que, en general, son especies muy vulnerables a la sobreexplotación, como es el caso del tiburón sedoso, C. falciformis (Schaefer et al. 2021). A pesar de su amplia importancia ecológica y económica, no existen estudios sobre esta especie en el área de estudio, por lo que el presente trabajo representa el primer registro de la ecología trófica de organismos inmaduros de C. falciformis en el estado de Guerrero, México. Los objetivos de este estudio fueron (1) describir el espectro trófico de la especie, (2) identificar variaciones en la dieta entre etapas de madurez y sexos, (3) determinar la amplitud del nicho trófico y la estrategia de alimentación de la especie y (4) estimar su nivel trófico.
MATERIALES Y MÉTODOS
Recolección de muestras
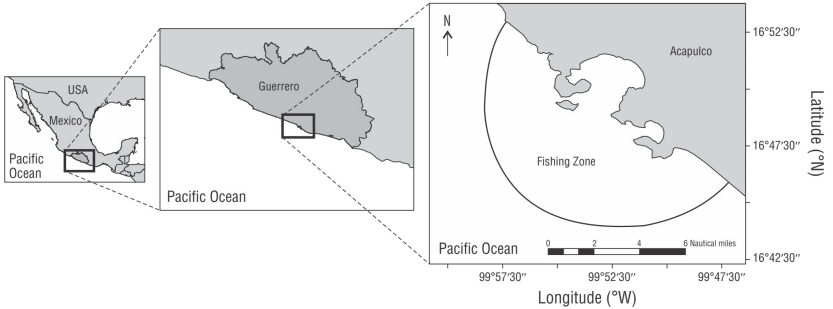
Las muestras biológicas de C. falciformis se obtuvieron de las capturas de la flota pesquera de pequeña escala que opera en Acapulco, Guerrero, México (16°52ʹ-16°41ʹ N y 99°29ʹ-100°11ʹ W) (Fig. 1). La zona de pesca se distingue por la fuerza del viento, que está influenciada por la topografía del continente americano, y por la presencia de la corriente costera de Costa Rica y el cuenco de Tehuantepec, que se caracterizan por presentar altas temperaturas y pequeñas oscilaciones anuales (Kessler 2006). La pesca de pequeña escala en el área de estudio se realiza con embarcaciones menores de fibra de vidrio con motor fuera de borda, y la jornada laboral puede extenderse de 4 a 6 días. Se utilizan, como artes de pesca, líneas de mano (anzuelo número 5, garra de águila) y cimbras o palangres (150-200 m, ceda trenzada número 3) y, como carnada, el ojotón, Selar crumenophthalmus.
La recolección de las muestras se hizo semanalmente durante los periodos octubre-diciembre de 2016 y junio, noviembre y diciembre de 2017. Se registró la longitud total (LT) y el peso total (PT) de todos los organismos recolectados. El sexo se determinó con base en las características sexuales externas (presencia o ausencia de gonopterigios). Los estómagos fueron extraídos y congelados para su posterior análisis.
Trabajo de laboratorio
Según su estado de digestión, cada presa encontrada en el contenido del estómago se contó, pesó e identificó al nivel taxonómico más bajo posible con claves especializadas. Los peces que presentaron un estado de digestión mínimo se identificaron con las claves de Allen y Robertson (1994) y Fischer et al. (1995). Para los peces con alto grado de digestión, la identificación se realizó por medio de las características vertebrales con base en en las claves de Clothier (1950). Para la identificación de cefalópodos, se usaron los trabajos de Iverson y Pinkas (1971) y Wolff (1982), que se basan en la identificación de los picos. Los crustáceos se identificaron con las claves de Fischer et al. (1995).
Para evitar posibles sesgos asociados a la alimentación oportunista mientras se capturaban los organismos, solo se consideraron aquellas presas con alguna evidencia de digestión. Asimismo, se descartaron a las especies que se utilizaron como cebo para su captura, y solo se tomaron en cuenta las presas encontradas dentro de los estómagos. Las presas no identificadas dentro de cada grupo funcional también se incluyeron en el análisis cuantitativo de la dieta.
Análisis de datos
Las muestras se compararon entre tallas (neonatos y juveniles) y sexos (machos y hembras). Con base en el trabajo de Alejo-Plata et al. (2007), consideramos como neonatos a aquellos organismos que presentaron tallas de 48 a 71 cm LT y como juveniles a aquellos que presentaron tallas de 72 a 170 cm LT. La mayoría de los organismos obtenidos se consideraron inmaduros.
Tamaño de muestra
Se construyó una curva de acumulación de presas para determinar si el tamaño de la muestra era representativo de la dieta de C. falciformis. Esta curva se generó en el programa EstimateS (Colwell 2009) aplicando 500 iteraciones a los valores de riqueza de especies en los estómagos analizados. Este procedimiento permitió estimar la media y la varianza de cada muestra y, con base en ello, graficar el número acumulado de presas promedio en cada muestra versus el grupo de estómagos analizados. Para tener una medida estándar de la precisión, se calculó el coeficiente de variación (CV) de los 4 puntos finales, en general y por categorías (talla y sexo) (Bizzarro et al. 2009). Si el CV era menor o igual que 0.05, el número de estómagos examinados se consideró adecuado para representar la dieta (Jiménez-Valverde y Hortal 2003, Hernández-Aguilar et al. 2012). Para evaluar la representatividad del tamaño de muestra se utilizó la función de Clench (Soberón y Llorente 1993): S n = (a × n)/(1 + b × n), donde S n es el número de especies acumuladas, n es el número de estómagos muestreados y a y b son parámetros del modelo.
Composición de la dieta
El índice de importancia relativa específica de la presa (%IIREP) (Brown et al. 2011) se usó para evaluar de manera integral la importancia de cada categoría de presa en la dieta del tiburón sedoso. Se calculó de la siguiente manera:
donde %FO es la frecuencia de ocurrencia (%FO = número de estómagos que contienen presas i/número total de estómagos con contenido estomacal × 100) y %PN i y %PW i son, respectivamente, los índices de abundancia específica numérica y gravimétrica de la presa %PA = ∑%A ij /n i , donde %A ij es la abundancia (expresada en número o peso) de la presa de la categoría i en el j-ésimo estómago y n i es el número de estómagos que contienen la presa i.
Amplitud de nicho y estrategia de alimentación
El índice de Levin (B i ) (Krebs 1999) se usó como una medida de la amplitud de nicho. Este índice evaluó de manera cuantitativa si los organismos fueron generalistas (alimentación variada sin selección) o especialistas (preferencia por ciertas presas). Se calculó de la siguiente manera:
donde P ij es la proporción de la dieta del depredador i que incluye la presa j, y n es el número de categorías de presas. Los valores de este índice oscilan entre 0 y 1; un B i inferior a 0.6 indica depredadores especializados, mientras que un B i superior a 0.6 indica depredadores generalistas (Labropoulou y Eleftheriou 1997).
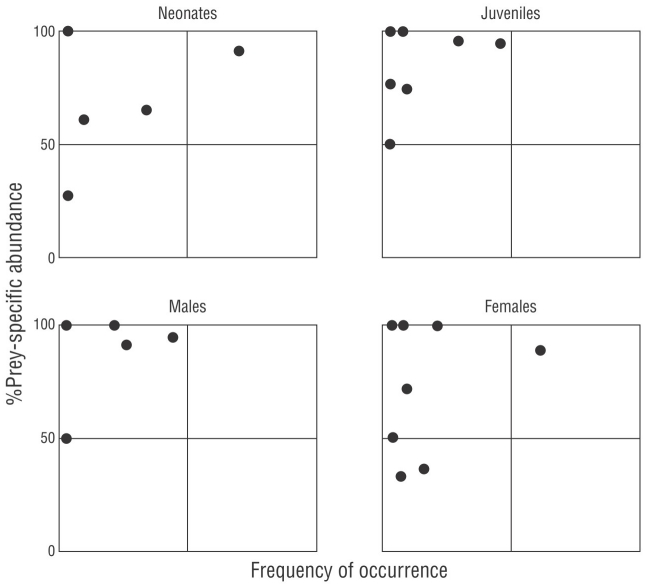
Además, para conocer la estrategia de alimentación de C. falciformis, se usó el modelo de Costello (1990) modificado por Amundsen et al. (1996). Este análisis se basa en la representación en 2 dimensiones de la abundancia específica para cada presa y la %FO de los diferentes tipos de presas en la dieta. Esta representación permitió visualizar la estrategia alimentaria (generalista o especialista), la importancia de las presas (como raras o dominantes) y el comportamiento trófico de la población; es decir, si una presa es consumida en gran cantidad por unos pocos individuos (especialización individual) o si es consumida por la mayoría de los individuos estudiados (especialización poblacional) (Amundsen et al. 1996). Los puntos ubicados en la parte superior derecha del gráfico de Amundsen reflejan una población de depredadores con una amplitud de nicho estrecha (Amundsen et al. 1996). Los puntos ubicados en la parte superior izquierda son indicativos de la especialización de los depredadores individuales, es decir, especialización en diferentes tipos de presas, y de cada categoría de presa consumida por solo una fracción limitada de los depredadores.
Superposición del nicho trófico
La rutina EcosimR para la superposición de nicho (Gotelli et al. 2014) se usó para evaluar la superposición de la dieta por talla (neonatos y juveniles) y sexo (machos y hembras). La rutina fue modificada usando el índice de Morisita-Horn en lugar del índice de Pinkas (Horn 1966, Smith y Zaret 1982). Se calculó con la siguiente ecuación:
donde P xi es la proporción de la presa i del número total de presas consumidas por el depredador x, P yi es la proporción de la presa i del número total de presas consumidas por el depredador y, y n es el número total de presas. Valores de Cλ de 0.00 a 0.29 indican superposición dietética baja; valores de Cλ de 0.30 a 0.59, superposición moderada; y valores de Cλ de 0.60 a 1.00, superposición alta (Langton 1982). Se comparó una distribución nula con los valores del índice de superposición para saber si las diferencias en la dieta fueron el resultado de procesos biológicos y no fueron aleatorias. Se realizaron un total de 1,000 simulaciones del índice con el algoritmo de aleatorización RA3 en EcosimR (Gotelli et al. 2014).
Nivel trófico
El nivel trófico de C. falciformis se calculó con el método propuesto por Cortés (1999):
donde P j es la proporción de cada categoría de presa en la dieta del depredador y NT j es el nivel trófico de cada categoría de presa j. Los niveles tróficos de las presas se obtuvieron de las bases de datos disponibles en línea: FishBase (Froese y Pauly 2015) y Sea Around Us (Pauly y Zeller 2015). Para las presas no identificadas, se utilizó el nivel trófico promedio correspondiente a su grupo funcional: teleósteos (3.24), crustáceos (2.52), cefalópodos (3.20), tortugas marinas (2.40) y aves (3.87) (Cortés 1999).
RESULTADOS
Las tallas de C. falciformis fluctuaron entre 48.00 y 222.00 cm LT, y la LT promedio fue de 90.80 cm, con una desviación estándar de 30.47 cm LT. Se obtuvieron, en total, 165 estómagos de C. falciformis, de los cuales el 34.54% presentó contenido estomacal y el 65.45% se encontró vacío. Las curvas de acumulación de presas sugirieron que el número de estómagos analizados fueron suficientes para caracterizar la dieta de C. falciformis en general y por categoría, es decir, el CV fue menor o igual que 0.05 en todos los casos (Tabla 1).
Tabla 1 Resultados de las curvas de acumulación de presas del tiburón sedoso, Carcharhinus falciformis, capturado frente a la costa de Guerrero, México.
| Category | Number of sampled organisms | Number of stomachs with food | % Representation of sample size | Coefficient of variation |
| General | 165 | 57 | 76.36 | ≤0.05 |
| Neonates | 48 | 17 | 80.16 | ≤0.05 |
| Juveniles | 113 | 39 | 75.37 | ≤0.05 |
| Males | 63 | 22 | 80.07 | ≤0.05 |
| Females | 102 | 35 | 75.33 | ≤0.05 |
La dieta de C. falciformis estuvo integrada por 11 componentes alimentarios, pertenecientes a 5 grupos taxonómicos: 4 Crustacea, 3 Teleostei, 2 Mollusca, 1 Reptilia y 1 Aves. De acuerdo con el %IIREP, el grupo de crustáceos representó el 77.17% de importancia en la dieta (Tabla 2).
Tabla 2 Composición de la dieta general del tiburón sedoso, Carcharhinus falciformis, capturado frente a la costa de Guerrero, México. %FO, frecuencia de ocurrencia; %PN, índice de abundancia específica numérica; %PW, índice de abundancia específica gravimétrica; y %PSIRI, índice de importancia relativa específica de la presa.
| Prey item | %FO | %PN | %PW | %PSIRI |
| Mollusca | ||||
| Cephalopoda | 7.02 | 41.95 | 66.83 | 3.82 |
| Stigmatoteuthis hoylei | 1.75 | 0.12 | 50.00 | 0.44 |
| Crustacea | ||||
| Portunidae | 3.51 | 100.00 | 100.00 | 3.51 |
| Portunus xantusii | 54.39 | 90.82 | 91.37 | 49.54 |
| Euphylax robustus | 1.75 | 100.00 | 100.00 | 1.75 |
| Unidentified crustaceans | 22.81 | 99.99 | 96.15 | 22.37 |
| Teleostei | ||||
| Balistidae | ||||
| Balistes polylepis | 1.75 | 25.00 | 50.00 | 0.66 |
| Mugilidae | ||||
| Mugil sp. | 1.75 | 100.00 | 100.00 | 1.75 |
| Unidentified teleost | 17.54 | 84.20 | 68.27 | 13.37 |
| Reptilia | ||||
| Lepidochelys olivacea | 3.51 | 24.85 | 33.78 | 1.03 |
| Aves | ||||
| Unidentified birds | 1.75 | 100.00 | 100.00 | 1.75 |
| Total | 100.00 |
Variación de la dieta por tallas
La dieta de neonatos de C. falciformis estuvo compuesta de 5 componentes alimentarios: 2 Crustacea, 1 Teleostei, 1 Mollusca y 1 Reptilia. El grupo de crustáceos representó el 68.64% de la dieta, de acuerdo con el %IIREP, y el cangrejo Portunus xantusii fue la presa más importante dentro de este grupo (%IIREP = 62.76). El grupo de peces representó el 25.08% de la dieta. El grupo de moluscos, representados por cefalópodos, presentó un valor de importancia del 5.15%. Las crías de la tortuga marina Lepidochelys olivacea representaron el 1.13% (Fig. 2).
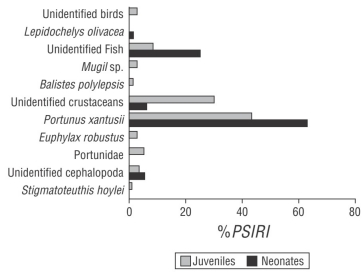
Figura 2 Índice de importancia relativa específica de la presa (%PSIRI) para neonatos y juveniles del tiburón sedoso, Carcharhinus falciformis, capturado frente a la costa de Guerrero, México.
Los juveniles de C. falciformis presentaron una dieta integrada por 10 componentes alimentarios: 4 Crustacea, 3 Teleostei, 2 Mollusca y 1 Aves. Según el %IIREP, el grupo de crustáceos representó el 81.32% de la dieta; dentro de este grupo, P. xantusii fue la presa más importante (%IIREP = 43.50). El grupo de peces representó el 12.14% de la dieta; Mugil sp. y Balistes polylepis presentaron valores de importancia del 2.56% y 0.96%, respectivamente. El grupo de moluscos representó el 3.98% de la dieta, dentro del cual Stigmatoteuthis hoylei representó el 0.64%. Las aves representaron el 2.56% de importancia (Fig. 2). El valor del índice de Morisita-Horn obtenido entre neonatos y juveniles fue de 0.86, lo que indicó que las dietas no presentaron grandes diferencias.
Variación de la dieta por sexo
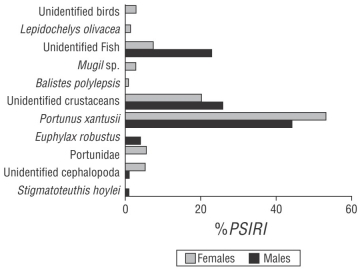
La dieta de los machos de tiburón sedoso estuvo integrada por 6 componentes alimentarios: 3 Crustacea, 2 Mollusca y 1 Teleostei. De acuerdo con el %IIREP, el grupo de crustáceos fue el componente más importante de la dieta, con un valor del 74.77%; destacó P. xantusii con el 44.09%. El 22.72% de la dieta lo representaron los peces. El grupo de moluscos representó el 2.50% (Fig. 3). Las hembras presentaron una dieta integrada por 9 componentes alimentarios: 3 Crustacea, 3 Teleostei, 1 Mollusca, 1 Reptilia y 1 Aves. El grupo de crustáceos fue el más importante de la dieta (%IIREP = 78.68); destacó P. xantusii con el 52.97%. El grupo de peces representó el 11.42% de la dieta, dentro del cual Mugil sp. representó el 2.85% y B. polylepis el 1.07%. Los cefalópodos representaron el 5.35% de la dieta. Las crías de la tortuga marina L. olivacea representaron el 1.67% de la dieta y las aves el 2.85% (Fig. 3). El valor del índice de Morisita-Horn obtenido fue de 0.80, lo que indicó que las dietas entre machos y hembras no presentaron grandes diferencias.
Amplitud de nicho y estrategia de alimentación
Los valores de B i obtenidos para todas las categorías fueron inferiores a 0.60 (neonatos = 0.40, juveniles = 0.16, machos = 0.20, hembras = 0.23), lo que indicó que C. falciformis presentó una estrategia de alimentación del tipo especialista. De acuerdo con el modelo de Amundsen, C. falciformis prefirió el cangrejo P. xantusii (ubicado en la parte superior del gráfico, Fig. 4), aunque también se observó variación en el uso de recursos entre individuos (puntos ubicados en la parte superior izquierda, Fig. 4). Se observó la misma tendencia por tallas y por sexo (Fig. 4).
DISCUSIÓN
El tiempo transcurrido entre el momento en que se capturaron los tiburones y el desembarque en el área de estudio fue de 4 a 6 d, tiempo suficiente para que los jugos gástricos descompusieran y digirieran las presas consumidas por estos depredadores, incluso después de su muerte (Bowen 1996, Calle-Morán y Galván-Magaña 2020). Esto podría explicar el alto porcentaje de estómagos vacíos y el avanzado grado de digestión de las presas, lo cual se ha reportado previamente para tiburones capturados con palangre. Por ejemplo, Cabrera-Chávez-Costa et al. (2010) reportaron que el 46.0% de los estómagos de C. falciformis analizados, en Baja California Sur, se encontró vacío, mientras que Flores-Martínez et al. (2016) reportaron el 83.6% de estómagos vacíos para la misma especie en Chiapas.
En cuanto al grado de digestión de las presas, los cefalópodos (picos) y los peces (vertebras), debido al tejido blando de su cuerpo, se encontraron en un estado de digestión avanzado, mientras que los crustáceos, que presentan estructuras más duras, se encontraron en un estado de digestión intermedio. Esto dificultó que el nivel de identificación de las presas llegara hasta el mínimo taxón posible en algunos casos y, por consecuencia, provocó que las diferencias que pudieran detectarse entre categorías alimentarias disminuyeran. No obstante, incluso con estas limitaciones, el número de estómagos analizados fue suficiente para caracterizar el espectro trófico de C. falciformis y observar tendencias generales en su dieta.
Variación de la dieta por tallas
La composición de la dieta de neonatos y juveniles de C. falciformis fue similar, ya que ambos se alimentaron principalmente de crustáceos y tuvieron como presa más importante a P. xantusii. Este resultado coindice con lo reportado para la misma especie en Oaxaca, en donde P. xantusii integró el mayor porcentaje de la dieta (Ruíz-Pérez et al. 2016). No obstante, contrasta con lo reportado por otros autores para organismos de mayores tallas a las reportadas en el presente estudio, ya que señalaron que C. falciformis se alimentó principalmente de calamares y peces (Cabrera-Chávez-Costa et al. 2010, Flores-Martínez et al. 2016, Rosas-Luis et al. 2017).
Cabrera-Chávez-Costa et al. (2010) indicaron que las hembras juveniles de C. falciformis necesitan más energía para su crecimiento y, por lo tanto, deben alimentarse de presas a las que puedan tener acceso y que puedan capturar sin tanto gasto de energía; en cambio, las adultas pueden dirigir su alimentación a una presa específica que cubra sus requerimientos energéticos, ya sea por cantidad o por calidad del alimento. En general, se ha observado que a medida que un tiburón aumenta de tamaño, también aumenta la eficiencia para capturar a su presa, ya que sus sentidos están totalmente desarrollados (Lowe et al. 1996, Borrell et al. 2011). Los tiburones grandes son capaces de capturar presas grandes y rápidas, como peces y calamares, los cuales aportan mayor contenido energético; por el contrario, los tiburones pequeños tienden a alimentarse de presas que no son tan rápidas y que son de bajo contenido energético, como los crustáceos (Lowe et al. 1996, Cabrera-Chávez-Costa et al. 2010).
Cortés y Gruber (1990) indicaron que las variaciones en la dieta de los tiburones pueden deberse a que los organismos juveniles suelen moverse sobre los arrecifes y alimentarse sobre el fondo, mientras que los adultos suelen encontrarse más cerca de la superficie y alimentarse en áreas oceánicas. Los tiburones juveniles ocupan las zonas costeras como áreas de crianza cuando son pequeños, y es ahí donde también aprenden a cazar y se alimentan de presas que pueden proporcionar una fuente de alimento abundante o son fáciles de capturar, como los crustáceos (McElroy et al. 2006). El sustrato predominantemente blando (arenoso) con parches de arrecifes coralinos, arrecifes rocosos, islotes y montes submarinos en el área de estudio da como resultado un sistema altamente heterogéneo (Palacios-Salgado 2014) que puede ser aprovechado por los neonatos y los juveniles de C. falciformis para alimentarse.
Variación de la dieta por sexo
Cabrera-Chávez-Costa et al. (2010) indicaron que la dieta del tiburón sedoso en la costa de Baja California Sur presentó un solapamiento alto entre ambos sexos, en el cual las hembras presentaron como presas principales a P. planipes, D. gigas y Coryphaena equiselis, mientras que los machos consumieron P. planipes, D. gigas, S. japonicus, Auxis spp. y Argonauta nouryi. Los resultados del presente trabajo mostraron un solapamiento alto entre machos y hembras de C. falciformis, ya que compartieron como presa principal a P. xantusii. Al respecto, Pittenger (1984) mencionó que los tiburones pueden compartir el espacio en sitios donde el alimento está disponible y es abundante, lo que podría indicar que en nuestra área de estudio, los machos y las hembras de tiburón sedoso comparten el mismo espacio y se alimentan de especies similares. Se ha mencionado que cuando los machos y las hembras utilizan el mismo lugar de alimentación, la competencia se compensa con la existencia de abundantes recursos alimentarios (Colwell y Futuyma 1971), lo que puede ser indicativo de la abundancia de las presas en el área de estudio.
Por otro lado, Lowe et al. (1996) indicaron que los tiburones más grandes, que por consecuencia pueden alimentarse de presas más grandes, tienen acceso a diferentes hábitats y pueden segregarse por género y tamaño y que esto ayuda a reducir la competencia por la comida. Por tanto, es probable que en el área de estudio, no se observó una segregación por sexo porque la mayoría de las muestras que se obtuvieron fueron de organismos de tallas pequeñas.
Amplitud de nicho y estrategia de alimentación
Los tiburones presentan un comportamiento selectivo (Cabrera-Chávez-Costa et al. 2010, Ruíz-Pérez et al. 2016) y generalista (Compagno 1984, Castro 1996, Flores-Martínez et al. 2016) según la abundancia y la disponibilidad de sus presas. En zonas con poca diversidad suelen alimentarse de las presas que se encuentren disponibles, y muestran un comportamiento generalista (Compagno 1984, Castro 1996). En áreas más diversas tienden a seleccionar a las presas que les aportan más valor energético (Cabrera-Chávez-Costa et al. 2010). Estas diferencias reafirman la naturaleza oportunista de la especie y su variación en la dieta de acuerdo con su distribución geográfica, ya que en la parte noroeste de México, C. falciformis se alimenta principalmente de cefalópodos (Cabrera-Chávez-Costa et al. 2010) y en el sur consume principalmente crustáceos (Ruíz-Pérez et al. 2016).
Aunque observamos que los valores de la amplitud del nicho trófico fueron bajos, lo cual indica que C. falciformis presentó una estrategia de alimentación especialista, los valores obtenidos para los neonatos de ambos sexos siempre fueron mayores que los obtenidos para los juveniles. Los resultados sugieren que los organismos de menores tallas presentan una alimentación con tendencia generalista, mientras que los de mayores tallas tienden a tener una mayor selección de sus presas de acuerdo con sus necesidades energéticas (Cabrera-Chávez-Costa et al. 2010).
Nivel trófico
El nivel trófico reportado para C. falciformis en el presente estudio (3.70) es menor que lo reportado por otros autores para la misma especie. Por ejemplo, Cortés (1999) determinó un nivel trófico de 4.20, Flores-Martínez et al. (2016) determinaron un nivel trófico de 4.30-4.40 para organismos con tallas de 70.00 a 203.00 LT y Estupiñán-Montaño et al. (2017) reportaron un nivel trófico de 4.57 para organismos con tallas de 95.00 a 310.00 cm LT. Los resultados de estos autores sugieren que C. falciformis es un depredador terciario, lo que destaca su papel potencial como depredador ápice en el ecosistema (Cortés 1999). No obstante, en nuestro estudio reportamos un estrecho intervalo de longitudes (la mayoría de los animales muestreados eran inmaduros), lo que podría explicar por qué nuestros resultados indicaron que C. falciformis actúa como un consumidor secundario en la red alimentaria.
Varios autores han señalado que existe una relación positiva entre el tamaño corporal y la posición trófica, donde los niveles tróficos pueden aumentar a medida que crecen los peces (Cousins 1980, Cohen et al. 1993, Heithaus et al. 2013). Esto se debe a que a medida que los peces aumentan de tamaño, su eficiencia para capturar presas también aumenta, ya que sus sentidos están completamente desarrollados y son capaces de capturar presas más grandes y más rápidas (Flores-Martínez et al. 2016). Aunque no encontramos diferencias en la posición trófica entre neonatos y juveniles, se esperaría que el nivel trófico de los adultos fuera mayor (Borrell et al. 2011).
La preferencia de C. falciformis por el grupo de crustáceos portúnidos lo posiciona como un depredador importante de estas especies. De esta manera, la depredación ejercida puede regular el tamaño poblacional de sus presas, lo que sugiere que su eliminación podría causar cambios en las abundancias de otras especies (Bornatowski et al. 2014, Navia et al. 2016). El conocimiento sobre los hábitos alimentarios de la especie podría utilizarse para la construcción de modelos tróficos que ayuden a comprender el papel que este depredador juega dentro del ecosistema marino y las consecuencias que puede causar su eliminación; por lo tanto, podría brindar información que contribuya al manejo sustentable de los recursos pesqueros en el área de estudio.
AGRADECIMIENTOS
Agradecemos al Consejo Nacional de Ciencia y Tecnología (CONACYT, México) la beca otorgada a ASR. También agradecemos a los pescadores que nos apoyaron con las muestras biológicas y a los revisores anónimos que contribuyeron al mejoramiento de este manuscrito. Los autores declaramos que no existe conflicto de interés.
REFERENCIAS
Alejo-Plata, C., Gómez-Márquez, J.L., Ramos, S., Herrera, E. 2007. Presencia de neonatos y juveniles del tiburón martillo Sphyrna lewini (Griffith & Smith, 1834) y del tiburón sedoso Carcharhinus falciformis (Müller & Henle, 1839) en la costa de Oaxaca, México = Presence of neonates and juveniles of the hammerhead shark Sphyrna lewini (Griffith & Smith, 1834) and the silky shark Carcharhinus falciformis (Müller & Henle, 1839) off the coast of Oaxaca, Mexico. Rev Biol Mar Ocean. 42(3):403-413. http://doi.org/10.4067/S0718-19572007000300020 [ Links ]
Allen, G.R., Robertson, D.R. 1994. Fishes of the Tropical Eastern Pacific. Honolulu (HI): University of Hawaii Press. 332 p. [ Links ]
Amundsen, P.A., Gabler, H.M., Staldvik, F.J. 1996. A new approach to graphical analysis of feeding strategy from stomach contents data-modification of the Costello (1990) method. J Fish Biol. 48(4):607-614. https://doi.org/10.1111/j.1095-8649.1996.tb01455.x [ Links ]
Barría, C., Coll, M., Navarro, J. 2015. Unravelling the ecological role and trophic relationships of uncommon and threatened elasmobranchs in the western Mediterranean Sea. Mar Ecol Prog Ser. 539:225-240. https://doi.org/10.3354/meps11494 [ Links ]
Barría, C., Navarro, J., Coll, M. 2018. Feeding habits of four sympatric sharks in two deep-water fishery areas of the western Mediterranean Sea. Deep Sea Res Part I. 142:34-43. https://doi.org/10.1016/j.dsr.2018.09.010 [ Links ]
Bizzarro, J.J., Robison, H.J., Rinewalt, C.S., Ebert, D.A. 2009. Comparative feeding ecology of four sympatric skate species off central California, USA. Environ Biol Fish. 84(2):241. https://doi.org/10.1007/s10641-008-9428-5 [ Links ]
Bonfil, R. 2008. The Biology and Ecology of the Silky Shark, Carcharhinus falciformis. In: Pikitch, T.J., Camhi, M.D., Pikitch, E.K., Babcock, E.A. (eds.), Sharks of the Open Ocean: Biology, Fisheries and Conservation. UK: Blackwell Publishing Ltd. p. 114-127. ISBN: 978-0632-05995-9 https://doi.org/10.1002/9781444302516.ch10 [ Links ]
Bornatowski, H., Navia, A.F., Braga, R.R., Abilhoa, V., Correa, M.F.M. 2014. Ecological importance of sharks and rays in a structural foodweb analysis in southern Brazil. ICES J Mar Sci. 71(7):1586-1592. https://doi.org/10.1093/icesjms/fsu025 [ Links ]
Borrell, A., Cardona, L., Kumarran, R.P., Aguilar, A. 2011. Trophic ecology of elasmobranchs caught off Gujarat, India, as inferred from stable isotopes. ICES J Mar Sci. 68(3):547-554. https://doi.org/10.1093/icesjms/fsq170 [ Links ]
Bowen, S.H. 1996. Quantitative description of the diet. In: Murphy, B.R. and Willis, D.W. (eds.), Fisheries Techniques, 2nd ed. Bethesda (MD): American Fisheries Society. p. 513-532. [ Links ]
Brown, S.C., Bizzarro, J.J., Cailliet, G.M., Ebert, D.A. 2012. Breaking with tradition: redefining measures for diet description with a case study of the Aleutian skate Bathyraja aleutica (Gilbert 1896). Environ Biol Fish. 95(1):3-20. https://doi.org/10.1007/s10641-011-9959-z [ Links ]
Cabrera-Chávez-Costa, A.A., Galván-Magaña, F., Escobar-Sánchez, O. 2010. Food habits of the silky shark Carcharhinus falciformis (Müller & Henle, 1839) off the western coast of Baja California Sur, Mexico. J Appl Ichthyol. 26(4):499-503. https://doi.org/10.1111/j.1439-0426.2010.01482.x [ Links ]
Calle-Morán, M.D., Galván-Magaña, F. 2020. Diet composition and feeding habits of the pelagic thresher shark Alopias pelagicus in Eastern Central Pacific Ocean, Ecuadorian waters. J Mar Biol Assoc UK. 100(5):837-845. https://doi.org/10.1017/S0025315420000569 [ Links ]
Castro, J.I. 1996. The sharks of North American waters. Texas (USA): Texas A&M University Press. 180 p. [ Links ]
Clothier, C.R. 1950. A key to some southern California fishes based on vertebral characters. Fish Bull. 79:1-83. [ Links ]
Cohen, J.E., Pimm, S.L., Yodzis, P., Saldana, J. 1993. Body sizes of animal predators and animal prey in food webs. J Anim Ecol. 62(1):67-78. https://www.jstor.org/stable/5483 [ Links ]
Colwell, R.K. 2009. EstimateS 8.2.0: Statistical estimation of species richness and shared species from samples. User’s Guide and Application. Storrs (CT): Department of Ecology and Evolutionary Biology, University of Connecticut. [ Links ]
Colwell, R.K., Futuyma, D.J. 1971. On the measurement of niche breadth and overlap. Ecology. 52(4):567-576. https://doi.org/10.2307/1934144 [ Links ]
Compagno, L.J.V. 1984. Catálogo de especies: Tiburones del mundo. Un catálogo anotado e ilustrado de especies de tiburones conocidas hasta la fecha. Parte 1, Hexanchiformes a Lamniformes = Species catalog: Sharks of the world. An annotated and illustrated catalogue of shark species known to date. Part 1, Hexanchiformes to Lamniformes. Vol. 4. Roma (Italy): FAO. p. 1-25. [ Links ]
Compagno, L.J.V., Ebert, D.A., Smale, M.J. 1989. Guide to the sharks and rays of southern Africa. London (UK): New Holland (Publ.) Ltd. 158 p. [ Links ]
Cortés, E. 1999. Standardized diet compositions and trophic levels of sharks. ICES J Mar Sci. 56(5):707-717. https://doi.org/10.1006/jmsc.1999.0489 [ Links ]
Cortés, E., Gruber, S. 1990. Diet, feeding habits and estimates of daily ration of young lemon sharks, Negaprion brevirostris (Poey). Copeia. 1990(1):204-218. https://doi.org/10.2307/1445836 [ Links ]
Costello, M.J. 1990. Predator feeding strategy and prey importance: a new graphical analysis. J Fish Biol. 36(2):261-263. https://doi.org/10.1111/j.1095-8649.1990.tb05601.x [ Links ]
Cousins, S.H. 1980. A trophic continuum derived from plant structure, animal size and a detritus cascade. J Theor Biol. 82(4):607-618. https://doi.org/10.1016/0022-5193(80)90181-2 [ Links ]
Duffy, L.M., Olson, R.J., Lennert-Cody, C.E., Galván-Magaña, F., Bocanegra-Castillo, N., Kuhnert, P.M. 2015. Foraging ecology of silky sharks, Carcharhinus falciformis, captured by the tuna purse-seine fishery in the eastern Pacific Ocean. Mar Biol. 162:571-593. https://doi.org/10.1007/s00227-014-2606-4 [ Links ]
Estupiñán-Montaño, C., Pacheco-Triviño, F., Cedeño-Figueroa, L.G., Galván-Magaña, F., Estupiñán-Ortiz, J.F. 2017. Diet of three shark species in the Ecuadorian Pacific, Carcharhinus falciformis, Carcharhinus limbatus and Nasolamia velox. J Mar Biol Assoc UK. 98(4):927-935. https://doi.org/10.1017/S002531541600179X [ Links ]
Fischer, W., Krupp, F., Schneider, W., Sommer, C., Carpenter, K.E., Niem, C.H. 1995. Guía FAO para la identificación de especies para los fines de la pesca = FAO Guide for the Identification of Species for Fishing Purposes. Roma (Italy): FAO. p. 1-1813. [ Links ]
Flores-Martíne,z I.A., Torres-Rojas, Y.E., Galván-Magaña, F., Ramos-Miranda, J. 2016. Diet comparison between silky sharks (Carcharhinus falciformis) and scalloped hammerhead sharks (Sphyrna lewini) off the south-west coast of Mexico. J Mar Biol Assoc UK. 97(2):337-343). https://doi.org/10.1017/S0025315416000424 [ Links ]
Froese, R., Pauly, D. 2015. FishBase. World Wide Web electronic publication. Stockholm (Sweden): FishBase; accessed 2016 Nov 10. http://www.fishbase.org [ Links ]
Gotelli, N.J., Hart, E.M., Ellison, A.M. 2014. EcoSimR (Version. 0.1.0, R Package). [Place unknow]: Gotelli Lab; accessed 2019 August 4. https://github.com/GotelliLab/EcoSimR/issues [ Links ]
Hayden, B., Palomares, M.L.D., Smith, B.E., Poelen, J.H. 2019. Biological and environmental drivers of trophic ecology in marine fishes-a global perspective. Sci rep. 9:11415. https://doi.org/10.1038/s41598-019-47618-2 [ Links ]
Heithaus, M.R., Frid, A., Vaudo, J.J., Worm, B., Wirsing, A.J. 2010. Unravelling the ecological importance of elasmobranchs. In: Carrier, J.C., Musick, J.A., Heithaus, M.R. (eds.), Shark and Their Relatives II. 1st ed. Boca Raton (FL): CRC Press, Taylor and Francis Group. p. 611-637. ISBN-13: 978-1420080476 [ Links ]
Heithaus, M.R., Vaudo, J.J., Kreicker, S., Layman, C.A., Krützen, M., Burkholder, D.A., Gastrich, K., Bessey, C., Sarabia, R., Cameron, K., et al. 2013. Apparent resource partitioning and trophic structure of large-bodied marine predators in a relatively pristine seagrass ecosystem. Mar Ecol Prog Ser. 481:225-237. https://doi.org/10.3354/meps10235 [ Links ]
Hernández-Aguilar, S.B., Abitia-Cárdenas, L.A., Moreno-Sánchez, X.G., Arrellano-Martínez, M., González-Rodríguez, E. 2012. Trophic spectrum of the sailfish Istiophorus platypterus caught off Acapulco in the southern Mexican Pacific. J Mar Biol Assoc UK. 93(4):1097-1104. https://doi.org/10.1017/S0025315412001622 [ Links ]
Horn, H.S. 1966. Measurement of “overlap” in comparative ecological studies. Am Nat. 100(914):419-424. https://doi.org/10.1086/282436 [ Links ]
[IUCN] International Union for Conservation of Nature. 2019. The IUCN Red List of Threatened Species. Version 2019-2. [Place unknown]: IUCN; accessed 2019 Oct 7. https://www.iucnredlist.org [ Links ]
Iverson, L.K., Pinkas, L. 1971. A pictorial guide to beaks of certain eastern Pacific cephalopods. California Department of Fish and Game. Fish Bull. 152:83-105. [ Links ]
Jiménez-Valverde, A., Hortal, J. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos = Species accumulation curves and the need to assess the quality of biological inventories. Rev Ibé Arac. 8:151-161. [ Links ]
Kessler, W.S. 2006. The circulation of the eastern tropical Pacific: A review. Prog Oceanogr. 69(2-4):181-217. https://doi.org/10.1016/j.pocean.2006.03.009 [ Links ]
Krebs, C.J. 1999. Ecological methodology. 2nd ed. Menlo, Park (CA): Addison Wesley Longman. 620 p. [ Links ]
Labropoulou, M., Eleftheriou, A. 1997. The foraging ecology of two pairs of congeneric demersal fish species: importance of morphological characteristics in prey selection. J Fish Biol. 50(2):324-340. https://doi.org/10.1111/j.1095-8649.1997.tb01361.x [ Links ]
Langton, R.W. 1982. Diet overlap between Atlantic cod, Gadus morhua, silver hake, Merluccius bilinearis, and fifteen other northwest Atlantic finfish. Fish Bull. 80:745-759. [ Links ]
Lowe, C.G., Wetherbee, B.M., Crow, G.L., Tester, A.L. 1996. Ontogenetic dietary shifts and feeding behavior of the tiger shark Galeocerdo cuvier, in Hawaiian waters. Environ Biol Fish. 47:203-211. https://doi.org/10.1007/BF00005044 [ Links ]
McElroy, W.D., Wetherbee, B.M., Mostello, C.S., Lowe, C.G., Crow, G.L., Wass, R.C. 2006. Food habits and ontogenetic changes in the diet of the sandbar shark, Carcharhinus plumbeus, in Hawaii. Environ Biol Fish. 76:81-92. https://doi.org/10.1007/s10641-006-9010-y [ Links ]
Menni, R.C., Lucifora, L.O. 2007. Condrictios de la Argentina y Uruguay. ProBiota, FCNyM, UNLP, Serie Técnica-Didáctica. Argentina. 11:1-15. [ Links ]
Myers, R.F. 1999. Micronesian reef fishes: a comprehensive guide to the coral reef fishes of Micronesia, 3rd revised and expanded edition. Barrigada (Guam): Coral Graph. 330 p. [ Links ]
Navia, A.F., Cruz-Escalona, V.H., Giraldo, A., Barausse, A. 2016. The structure of a marine tropical food web, and its implications for ecosystem-based fisheries management. Ecol Mod. 328:23-33. https://doi.org/10.1016/j.ecolmodel.2016.02.009 [ Links ]
Palacios-Salgado, D.S., Ramírez-Valdez, A., Rojas-Herrera, A.A., Granados-Amores, J., Melo-García, M.A. 2014. Marine fishes of Acapulco, Mexico (Eastern Pacific Ocean). Mar Biodiv. 44:471-490. https://doi.org/10.1007/s12526-014-0209-4 [ Links ]
Pauly, D., Zeller, D. 2015. Sea Around Us: concepts, design and data. [Place unknown]: Sea Around Us; accessed 2018 Jan 01. http://www.seaaround.org [ Links ]
Pittenger, G.G. 1984. Movements, distributions, feeding, and growth of the Pacific angel shark, Squatina californica off Santa Barbara, California. Copeia. 1986:987-994. [ Links ]
Rosas-Luis, R., Navarro, J., Loor-Andrade, P., Forero, M.G. 2017. Feeding ecology and trophic relationships of pelagic sharks and billfishes coexisting in the central eastern Pacific Ocean. Mar Ecol Prog Ser. 573:191-201. https://doi.org/10.3354/meps12186 [ Links ]
Ruíz-Pérez, N.E., Cerdenares-Ladrón de Guevara, G., López-Herrera, D.L., Altamirano-Ramírez, I.R. 2016. Relaciones tróficas entre cinco especies de peces pelágicos que cohabitan en las costas de Oaxaca, México = Trophic interactions between five pelagic fish species cohabiting in the coast of Oaxaca, Mexico. Hidrobiológica. 26(1):77-85. [ Links ]
Schaefer, K., Fuller, D., Castillo-Geniz, J.L., Godinez-Padilla, C.J., Dreyfus, M., Aires-da-Silva, A. 2021. Post-release survival of silky sharks (Carcharhinus falciformis) following capture by Mexican flag longline fishing vessels in the northeastern Pacific Ocean. Fish Res. 234:105779. https://doi.org/10.1016/j.fishres.2020.105779 [ Links ]
Smith, E.P., Zaret, T.M. 1982. Bias in estimating niche overlap. Ecology. 63(5):1248-1253. https://doi.org/10.2307/1938851 [ Links ]
Soberón-M, J., Llorente-B, J. 1993. The use of species accumulation functions for the prediction of species richness. Cons Biol. 7(3):480-488. https://doi.org/10.1046/j.1523-1739.1993.07030480.x [ Links ]
Wolff, G.A. 1982. A beak key for eight eastern tropical Pacific cephalopods species, with relationship between their beak dimensions and size. Fish Bull. 80(2):357-370. [ Links ]
Recibido: 09 de Septiembre de 2020; Aprobado: 07 de Septiembre de 2021











 texto em
texto em