Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dez. 2022 Epub 17-Nov-2023
https://doi.org/10.7773/cm.y2022.3167
Artículos
Variabilidad estacional de la biomasa de copépodos en un vórtice ciclónico en la bahía de la Paz, sur del golfo de California, México
1Posgrado en Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 04510 Mexico City, Mexico.
2Unidad Académica de Ecología y Biodiversidad Acuática, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 04510 Mexico City, Mexico.
3Unidad Académica Mazatlán, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 82040 Mazatlán, Sinaloa, Mexico.
Los copépodos, como uno de los principales grupos que componen el zooplancton marino, juegan un papel importante por su posición en la red trófica. Se evaluó la biomasa de copépodos en un vórtice ciclónico durante 2 estaciones climáticas contrastantes en la bahía de La Paz, al sur del golfo de California, la cual se caracteriza por una alta productividad biológica. Durante 2 campañas oceanográficas en invierno de 2006 y verano de 2009, se determinó la estructura física de la columna de agua mediante un CTD y se recolectaron muestras de zooplancton mediante arrastres oblicuos. Se utilizaron datos de satélite para visualizar los patrones de distribución de clorofila a (Cla). Los resultados mostraron un vórtice ciclónico en ambas estaciones, con un diámetro de ~25 km y velocidades geostróficas >50 cm·s-1 en su periferia, con elevada Cla (~3 mg·m-3 en invierno). La máxima biomasa de calanoides ocurrió en invierno, con hasta 6.6 mg·100 m-3 en el oeste de la bahía, cerca de la costa; además, su distribución coincidió con el patrón de Cla y circulación, ya que formó un anillo siguiendo la periferia del vórtice, con un segundo pico cerca de la conexión con el golfo. Los valores medios de biomasa de copépodos mostraron un patrón de alternancia calanoides-ciclopoides entre invierno y verano dentro del vórtice ciclónico, con más biomasa de calanoides que ciclopoides en invierno y lo contrario en verano. Los resultados resaltan el impacto del vórtice en el ecosistema planctónico a través de su influencia sobre las condiciones hidrográficas en la columna de agua. Otros factores, como las interacciones ecológicas, la dinámica poblacional y los hábitos alimenticios, también pueden jugar un papel importante. El comportamiento alimentario es afectado por altas concentraciones de Cla, que representan una fuente de alimento para copépodos observados alrededor del vórtice.
Palabras clave: copépodos; biomasa; vórtice ciclónico; bahía de La Paz; golfo de California
As one of the main groups comprising marine zooplankton, copepods play an important role due to their position in the trophic web. We assessed the copepod biomass in a cyclonic eddy during 2 contrasting seasons in the Bay of La Paz, southern Gulf of California, which is characterized by high biological productivity. Two oceanographic expeditions took place in the winter of 2006 and the summer of 2009; a CTD probe was used to determine the physical structure of the water column, and oblique zooplankton hauls collected zooplankton samples. Satellite data were used to visualize the chlorophyll a (Chla) distribution patterns. The results showed a well-defined cyclonic eddy in both seasons, with a diameter of ~25 km and geostrophic velocities >50 cm·s-1 in its periphery. At the edges of the eddy, Chla was high, reaching ~3 mg·m-3 in winter. The maximum calanoid copepod biomass occurred in winter, reaching 6.6 mg·100 m-3 in the western bay close to the coast; moreover, their distribution corresponded well with the Chla and circulation patterns, forming a belt shape following the periphery of the eddy, with a second peak close to the connection with the gulf. The mean values of copepod biomass exhibited a pattern with alternating calanoids-cyclopoids between winter and summer within the cyclonic eddy, with calanoid biomass higher than cyclopoid biomass in winter, which was the opposite of summer. The results highlight the impacts of the eddy on the planktonic ecosystem through its influence on the hydrographic conditions in the water column. Other factors, such as ecological interactions, population dynamics, and feeding habits, may also play a role. Feeding behavior is affected by the high concentrations of Chla, which represent a source of food for copepods observed around the eddy.
Key words: copepods; biomass; cyclonic eddy; Bay of La Paz; Gulf of California
INTRODUCCIÓN
La bahía de La Paz (BP) es la cuenca más grande del golfo de California (Fig. 1a). La región es muy dinámica, con una amplia variabilidad estacional e interanual debido a la interacción océano-atmósfera. En invierno, los vientos son predominantemente del noroeste, con velocidades elevadas que superan los 10 m·s-1. En verano, los vientos predominantes soplan del sureste con una velocidad aproximada de 5 m·s-1, con periodos de calma frecuentes (Monreal-Gómez et al. 2001).

Figura 1 Ubicación del golfo de California y la bahía de La Paz (México). Las isolíneas indican batimetría (m). Los símbolos indican estaciones con lances de CTD (+), estaciones con muestreo de zooplancton en invierno (∆) y estaciones con muestreo de zooplancton en verano (☐).
La BP es reconocida por su elevada biodiversidad, la cual ha sido relacionada con la hidrodinámica de la región (Monreal-Gómez et al. 2001, Durán-Campos et al. 2015, Coria-Monter et al. 2017), que involucra la presencia de un vórtice ciclónico cuasipermanente que ejerce un impacto importante en el ecosistema planctónico y soporta la producción en los niveles tróficos superiores. Por ejemplo, este vórtice ciclónico promueve un bombeo de Ekman que origina el ascenso de aguas ricas en nutrimentos que fertilizan la capa eufótica (Coria-Monter et al. 2017). Lo anterior induce una distribución diferencial del fitoplancton entre diatomeas y dinoflagelados (Coria-Monter et al. 2014) y una agregación diferencial de zooplancton dentro del área de influencia del vórtice (Durán-Campos et al. 2015), lo cual impacta a todo el ecosistema pelágico, en particular el planctónico.
Los copépodos son probablemente los organismos multicelulares más abundantes en la Tierra (Mauchline et al. 1998, Kiørboe 2011), y en los ecosistemas marinos son de suma importancia debido a la posición que ocupan en la red trófica (Brierley 2017). Los copépodos son organismos que se alimentan de manera indiscriminada de partículas en suspensión (Boltovskoy 1999). De esta manera, pueden ser depredadores (carnívoros), alimentarse de modo mixto (omnívoros) o ser estrictamente herbívoros (Ohtsuka et al. 1996); sin embargo, en determinadas circunstancias, algunos organismos pueden cambiar de un modo de alimentación a otro (Tartarotti et al. 2014). Dado que los copépodos representan un vínculo directo entre los niveles tróficos inferiores y los superiores, incluidas aquellas especies que sustentan importantes pesquerías en todo el mundo (Richardson 2008), los copépodos también pueden ser considerados de manera indirecta como organismos de elevado valor comercial. Además, los copépodos contribuyen a la eliminación de dióxido de carbono atmosférico a través de la sedimentación de los compuestos de carbono orgánico e inorgánico de sus heces fecales, lo que contribuye al funcionamiento de la bomba biológica o de carbono (Brierley 2017).
En términos generales, la biomasa del zooplancton es un indicador de producción, y la estimación de este parámetro es esencial para evaluar la estructura trófica y el funcionamiento de cualquier ecosistema acuático (Melão y Rocha 2004). Los cambios en la biomasa del zooplancton están estrechamente relacionados con diversos factores, entre los que destacan variaciones en la salinidad (Vera-Mendoza y Salas-de-León 2014), el régimen de temperatura (Webster y Lucas 2012), la disponibilidad de alimento (Durán-Campos et al. 2019) y la mortalidad por depredación.
Otra fuente de variabilidad en la biomasa del zooplancton está relacionada con la presencia de procesos hidrodinámicos, los cuales modifican la estructura hidrográfica de la columna de agua y, por lo tanto, ejercen un efecto importante en la producción biológica al introducir nutrimentos hacia la zona eufótica con un consecuente aumento en la biomasa del fitoplancton que, a su vez, genera a una mayor disponibilidad de alimento para los organismos del zooplancton (Estrada et al. 2012). Estos procesos hidrodinámicos ocurren en toda la columna de agua a diferentes escalas e incluyen ondas internas, frentes y vórtices (Mann y Lazier 2006).
Los vórtices de mesoescala (10-100 km de radio) son estructuras altamente energéticas de primordial importancia en cualquier ecosistema marino (Gaube et al. 2018). Se reconocen 3 tipos de vórtices, ciclónicos, anticiclónicos y de “media agua”, los cuales ejercen un impacto notable en el ecosistema planctónico (McGillicuddy 2016). Se ha demostrado que la presencia de vórtices ciclónicos modifica la estructura y la biomasa de las comunidades zooplanctónicas en diferentes regiones del mundo, incluidas el suroeste de Gran Canaria, las islas Canarias (Hernández-León et al. 2001), las costas del noroeste de África (Yebra et al. 2004), el mar Mediterráneo (Molinero et al. 2008), el mar de los Sargazos (Eden et al. 2009), el océano Pacífico frente al centro-sur de Chile (Morales et al. 2010), la bahía de Hudson en Canadá (Estrada et al. 2012) y el canal de Madagascar (Noyon et al. 2019).
A pesar de que el impacto de los vórtices en la biomasa del zooplancton ha sido relativamente bien documentado en diferentes regiones del mundo, se han realizado pocos estudios sobre el efecto de estas estructuras en grupos particulares del zooplancton, como los copépodos (e.g., Yebra et al. 2004, Cruz-Hernández et al. 2018, Jagadeesan et al. 2020), principalmente debido a las incertidumbres que persisten sobre el impacto que tienen los vórtices confinados sobre la comunidad de copépodos. Como contribución a este tema, el presente estudio tuvo como objetivo evaluar la distribución de la biomasa de copépodos en un vórtice ciclónico en la BP, golfo de California. Se adquirieron datos hidrográficos y muestras de zooplancton durante 2 expediciones oceanográficas en 2 épocas contrastantes del año: el invierno de 2006 y el verano de 2009. La hipótesis planteada fue que la biomasa de los copépodos cambiaría con base en la época del año y la hidrodinámica del vórtice, debido a su impacto en las condiciones hidrográficas de la columna de agua y la disponibilidad de alimento. Nuestra intención es que este estudio contribuya a una mejor comprensión del impacto de los vórtices en grupos particulares del zooplancton, como los copépodos, en uno de los ecosistemas marinos más productivos del mundo (Álvarez-Borrego 2012, Arreguín-Sánchez et al. 2017).
MATERIALES Y MÉTODOS
Se obtuvieron datos hidrográficos de alta resolución y muestras de zooplancton en la BP durante 2 cruceros de investigación (Fig. 1a-b) realizados en el invierno (22-26 de febrero) de 2006 y el verano (13-17 de agosto) de 2009, a bordo del B/O El Puma (Universidad Nacional Autónoma de México). Mediante una sonda CTD calibrada por el fabricante antes de cada crucero (instrumentos Neil Brown y SeaBird 19 plus utilizados en 2006 y 2009, respectivamente), se adquirieron datos en 45 estaciones hidrográficas a lo largo de la bahía (Fig. 1b). La sonda fue bajada a una velocidad de 1 m·s-1, y se configuró para almacenar datos a 24 Hz. Para recolectar organismos del zooplancton, se seleccionaron la cuenca Alfonso y la región norte de la BP que incluye la conexión con el golfo de California con base en investigaciones previas que han documentado la presencia de un vórtice ciclónico cuasipermanente (Monreal-Gómez et al. 2001). Luego, se definieron las estaciones pertenecientes al centro, la periferia o la parte exterior de dicho vórtice en ambas épocas. En estas regiones, inmediatamente después del lance de CTD, se efectuaron arrastres oblicuos en un total de 13 estaciones en invierno y 9 estaciones en verano (Fig. 1b); en ambos casos, los arrastres se realizaron utilizando redes bongo con una boca de 60 cm de diámetro y una luz de malla de 333 µm. Los organismos del zooplancton fueron recolectados entre 200 m de profundidad y la superficie, con un tiempo de arrastre de 15 min a 1 m·s-1. Las estaciones estaban ubicadas en la cuenca Alfonso y en el extremo norte de la BP cerca de su conexión con el golfo de California. El volumen de agua filtrado en cada arrastre se calculó utilizando flujómetros calibrados (General Oceanics) colocados en la boca de cada red. Una vez a bordo, los organismos se fijaron durante 24 h con una solución de formaldehído al 4% con borato de sodio añadido y finalmente se conservaron en etanol al 70%. El etanol representa actualmente uno de los fluidos más comunes para la preservación de organismos del zooplancton, ya que conserva el color de los organismos (Santhanam et al. 2019). De esta manera, las muestras se conservaron en frascos herméticos en condiciones de oscuridad con precauciones especiales durante el tiempo de conservación; por ejemplo, el etanol se reemplazó cada 3 meses para evitar el color amarillo en las muestras, para evitar la evaporación del etanol y para evitar que las propiedades del solvente se vieran afectadas.
Los datos provenientes del CTD se procesaron siguiendo las rutinas sugeridas por
el fabricante, y se promediaron los datos a intervalos de 1 dbar. La temperatura
conservativa (Θ, °C), la salinidad absoluta (SA, g·kg-1) y
la densidad del agua de mar (ρ, kg·m-3) se
calcularon de acuerdo con los algoritmos de la ecuación termodinámica del agua
de mar-2010 (TEOS-10, por sus siglas en inglés) (IOC et al. 2010). Las corrientes geostróficas (u,
v) se calcularon a partir de los datos del CTD de acuerdo
con Pond y Pickard (1995):
Se obtuvieron imágenes satelitales de la concentración de Cla, como un indicador de la biomasa del fitoplancton, en las fechas que se realizaron ambos cruceros de investigación. Las imágenes, con una resolución de 1 km píxel, fueron obtenidas del Grupo de Procesamiento de Biología Oceánica (OBPG) de la NASA y procesadas utilizando los niveles 1 y 2 con ayuda del programa SeaDAS proporcionado por OBPG. Al momento de procesar y generar las imágenes, se aplicaron diferentes máscaras/banderas (STRAYLIGHT, CLDICE, LAND y HILT) para eliminar datos de mala/baja calidad. Para probar la significancia estadística de los datos de satélite y del CTD se realizaron análisis de correlación.
En el laboratorio, las muestras de zooplancton fueron secuencialmente divididas con un fraccionador Folsom. Los copépodos de cada muestra fueron identificados a nivel de grupo de acuerdo con Boltovskoy (1999) y fueron contados y separados con un microscopio de disección Carl Zeiss. Nosotros concluimos que la identificación de los copépodos a nivel de grupo contribuye al conocimiento de su ecología, ya que nos permitió visualizar patrones de distribución en un vórtice ciclónico y determinar la relación que guarda con la concentración de Cla. Investigaciones anteriores han demostrado que la identificación del zooplancton marino a nivel de grupo es suficiente para evaluar aspectos de ecología trófica y patrones de distribución de los organismos de diferentes regiones alrededor del mundo (e.g., Ayón et al. 2008), particularmente en la BP (e.g., Durán-Campos et al. 2015, 2019; Coria-Monter et al. 2020). Los copépodos separados de las muestras se colocaron en una caja de petri de vidrio y se dividieron en 3 grupos: copépodos calanoides, copépodos ciclopoides y copepoditos (todos los estadios). En este estudio no se consideró la identificación y la separación de cada estadio de copepodito (calanoides o ciclopoides); por el contrario, se combinaron todos los estadios. En este sentido, estamos conscientes de que lo anterior puede implicar cierto sesgo; sin embargo, se sabe que los copepoditos (ya sean calanoides o ciclopoides) tienden a ser omnívoros (Ohtsuka et al. 1996, Boltovskoy 1999, Tartarotti et al. 2014). Por lo tanto, consideramos como válida la combinación de todos los estadios de copepoditos tomando en cuenta que el objetivo de este estudio fue evaluar el papel del forzamiento físico en la biomasa de este grupo de organismos y su relación con la biomasa del fitoplancton, expresada como Cla.
Para cuantificar la biomasa de cada grupo de organismos (peso húmedo, mg·100 m-3) de cada estación, se eliminó el etanol de las muestras usando un sistema de filtración manual Millipore a través de filtros de membrana de nitrocelulosa (0.45 µm, 47 mm de diámetro; Millipore Corp., EE. UU.) previamente pesados. Posteriormente, los filtros fueron pesados con ayuda de una balanza analítica (Sartorius BP211D, resolución: 0.1 mg·210 g-1), y se obtuvieron las diferencias de peso. Finalmente, la biomasa (mg·100 m-3) se obtuvo siguiendo los protocolos descritos en Durán-Campos et al. (2015) y Durán-Campos et al. (2019).
RESULTADOS
Los patrones de circulación geostrófica de cada crucero se analizaron en la base de la termoclina. En invierno (2006) la capa de mezcla se observó a 50 m de profundidad; en verano (2009), a 30 m de profundidad. En ambos casos, los patrones de corrientes se caracterizaron por la presencia de un vórtice ciclónico localizado en la cuenca Alfonso; sin embargo, la intensidad de las corrientes y la forma del vórtice mostraron diferencias entre cada época. En invierno (2006), los resultados mostraron un vórtice localizado en la parte norte de la bahía con un diámetro de 25 km y una velocidad de aproximadamente 50 cm·s-1 en su periferia que ocupó la parte más profunda de la bahía y la región de boca Grande, en la conexión con el golfo de California, donde ocurren intercambios entre las cuencas. En esta región, las velocidades mostraron un aumento, y la circulación se bifurcó hacia el interior de la bahía y hacia el norte (Fig. 2a-c). A 30 m de profundidad, las velocidades geostróficas (no mostradas) fueron ligeramente más intensas que las observadas a 50 m de profundidad; sin embargo, el patrón de circulación fue similar a ambas profundidades. La circulación también mostró una corriente en sentido de las manecillas del reloj en la región suroeste de la bahía cerca de la costa. En verano (2009), a 30 m de profundidad, las velocidades geostróficas mostraron la presencia de un vórtice ciclónico bien definido que abarcó la misma área que en invierno (2006), con un diámetro de 30 km; sin embargo, en la base de la termoclina (30 m de profundidad), las velocidades geostróficas alcanzaron 70 cm·s-1 en la periferia del vórtice (Fig. 2d-f).
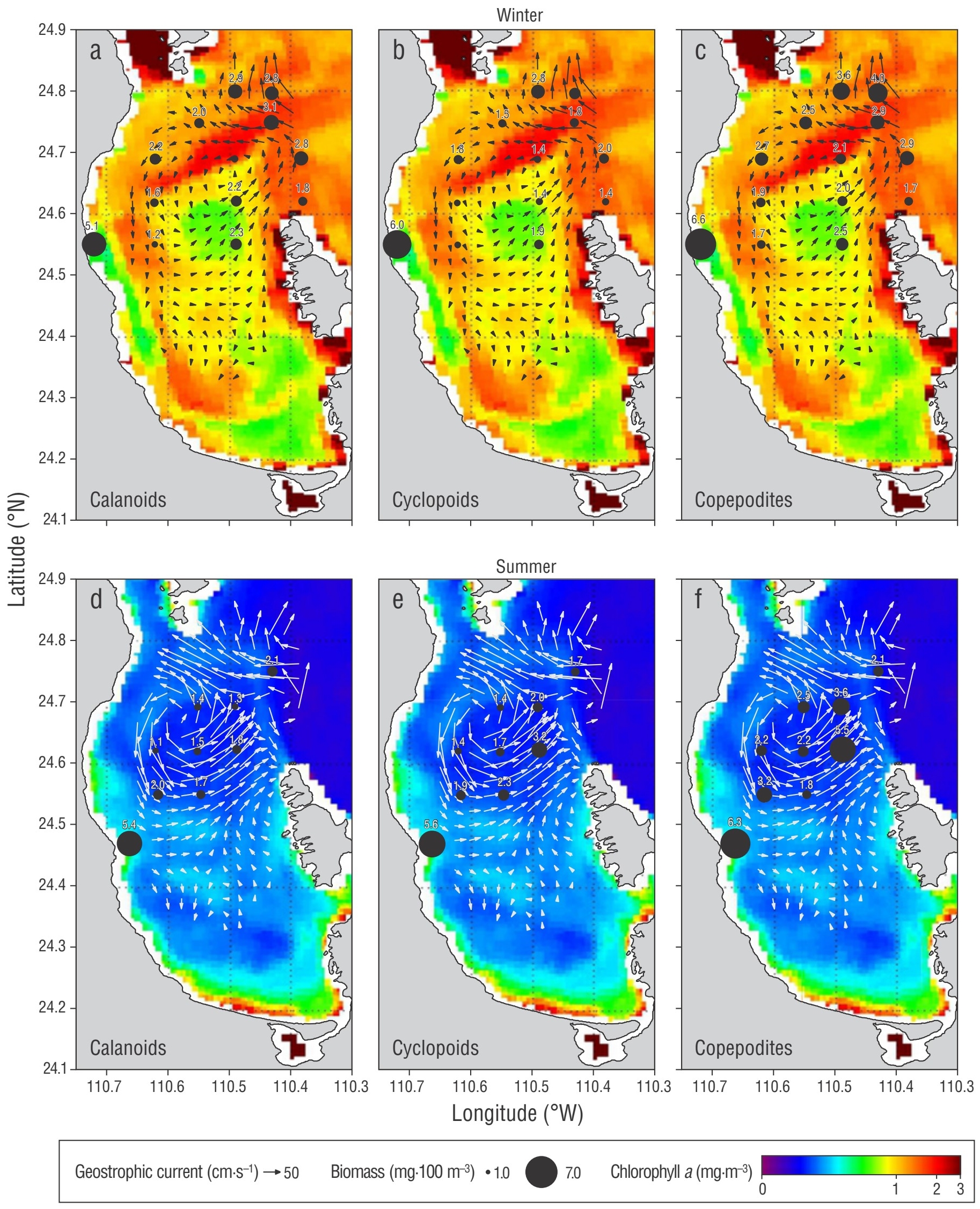
Figura 2 Corrientes geostróficas (relativas al fondo) (cm·s-1), distribución de clorofila a superficial (mg·m-3) y biomasa de copépodos (el diámetro de los círculos es proporcional a los valores de biomasa) (mg·100 m-3). Panel superior: patrón de corrientes geostróficas en el invierno de 2006 en la base de la termoclina (50 m), distribución de clorofila a superficial y biomasa de copépodos calanoides (a), copépodos ciclopoides (b) y todos los estadios de copepoditos (c). Panel inferior: patrón de corrientes geostróficas en el verano de 2009 en la base de la termoclina (30 m), distribución de clorofila a superficial y biomasa de copépodos calanoides (d), copépodos ciclopoides (e) y todos los estadios de copépoditos (f).
La concentración de Cla derivada del satélite (como indicador de la biomasa del fitoplancton) mostró un acoplamiento con el patrón de circulación. Durante el invierno de 2006, se observó un patrón de distribución en el norte de la bahía en conexión con el golfo de California, donde altos valores de Cla (~ 3 mg·m-3) formaron un anillo en torno al vórtice ciclónico, los cuales decrecieron gradualmente hacia su centro (Fig. 2 a-c); durante el verano de 2009, la concentración de Cla fue menor que la de invierno, y se observaron valores relativamente elevados en la región costera sur de la BP, con un pico secundario (0.8 mg·m-3) que mostró una distribución circular alrededor del vórtice ciclónico (Fig. 2 d-f). Los resultados de la Cla y la temperatura superficial del mar respaldan estas observaciones. Como era de esperar, se encontró una correlación inversa y estadísticamente significativa entre la Cla y la temperatura superficial del mar tanto en invierno (R = -0.60, P = 0.0002) como en verano (R = -0.69, P = 0.0001) (Fig. 3). Para establecer el acoplamiento entre el patrón de circulación obtenido en cada crucero, con las concentraciones de Cla derivadas del satélite y los copépodos de interés en este estudio (calanoides, ciclopoides y todos los estadios de copepoditos), los resultados de la biomasa obtenida para cada grupo fueron sobrepuestos en una imagen (Fig. 2). Los resultados mostraron un patrón de distribución con cambios progresivos (disminución de biomasa) desde la conexión con el golfo de California hacia el interior de la bahía, así como desde la periferia hasta el centro del vórtice ciclónico. Se observó un pico de biomasa de copépodos en la costa occidental de la bahía, cerca de punta Las Tarabillas (Fig. 1b), donde se localiza un arroyo intermitente.
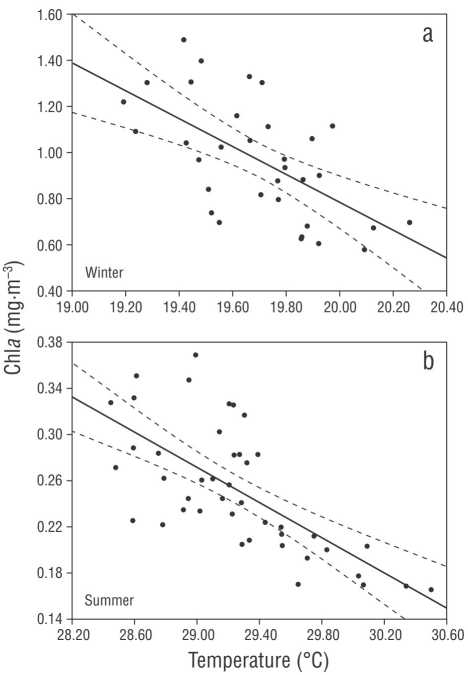
Figura 3 Correlación inversa y estadísticamente significativa entre la temperatura superficial del mar (registrada con CTD) y la clorofila a. (a) Invierno (R = -0.60, P = 0.0002) y (b) verano (R = -0.69, P = 0.0001).
En invierno, hubo 2 regiones con valores máximos de biomasa para los 3 grupos de interés: una ubicada a la entrada de la bahía, en la región de boca Grande, con valores de entre 1.4 y 5.1 mg·100 m-3, y la otra en la región occidental cercana a la costa, con valores mayores que 5.0 mg·100 m-3 (Fig. 2 a-c) asociados con el arroyo intermitente antes mencionado. Los copépodos calanoides y los copepoditos mostraron un patrón de cambios dentro del vórtice, con valores elevados en la periferia, que definió su circunferencia. Durante el verano, los valores más elevados de biomasa observados en la región occidental de la BP cerca de la costa (>5.0 mg·100 m-3) coincidieron con altos valores secundarios observados en la periferia del vórtice (Fig. 2d-f). En invierno, la biomasa de copépodos calanoides fue mayor (con diferencias estadísticamente significativas, P = 0.0200) que la observada en verano.
La distribución de la biomasa de los copépodos ciclopoides en ambas estaciones también mostró un patrón de cambios progresivos desde el centro hacia la periferia del vórtice, con los valores más altos en las estaciones pertenecientes a la periferia y un máximo cercano a la costa occidental de la bahía. Para determinar las diferencias en la biomasa de copépodos obtenida para cada grupo y entre las diferentes estaciones hidrográficas de cada crucero, se definieron las estaciones pertenecientes al centro, la periferia y la región fuera del área de influencia del vórtice ciclónico, para después calcular la media y su desviación estándar. Los resultados se resumen en la Tabla 1 y muestran las diferencias entre las 3 regiones (diferencias estadísticamente significativas, P < 0.0400) en invierno y verano; los valores más bajos se encontraron en las estaciones del centro del vórtice, mientras que, a excepción de la estación cercana a punta Las Tarabillas mencionada anteriormente, los valores más altos se observaron en las estaciones de la periferia. Según estos valores de biomasa, hubo un patrón de alternancia de copépodos calanoides-ciclopoides entre invierno y verano; en el centro y la periferia del vórtice ciclónico en invierno, la biomasa de calanoides fue mayor respecto a la de ciclopoides (con diferencias estadísticamente significativas, P = 0.0200), contrario a lo que sucedió en verano (Tabla 1).
Tabla 1 Biomasa de copépodos (mg·100 m-3), media y su desviación estándar, en las estaciones hidrográficas relacionadas con el centro, la periferia y la región fuera de influencia de los vórtices ciclónicos en invierno y verano. Las abreviaturas son CC, copépodos calanoides; CyC, copépodos ciclopoides; and Cop, todos los estadios de copepoditos.
| Winter 2006 | Summer 2009 | |||||
| CC | CyC | Cop | CC | CyC | Cop | |
| Center | 3.5 ± 0.55 | 2.7 ± 0.01 | 4.1 ± 0.08 | 4.0 ± 0.18 | 4.5 ± 0.17 | 6.8 ± 0.16 |
| Edge | 17.0 ± 0.61 | 12.8 ± 0.28 | 18.8 ± 0.51 | 6.8 ± 0.31 | 9.4 ± 0.61 | 14.2 ± 1.54 |
| Outside | 10.8 ± 1.28 | 11.0 ± 2.03 | 14.2 ± 1.61 | 7.4 ± 2.30 | 7.3 ± 2.75 | 8.4 ± 2.99 |
DISCUSIÓN
En la última década, se han realizado esfuerzos importantes para entender las causas que soportan la elevada productividad biológica del sur del golfo de California y regiones adyacentes, como la BP. A la fecha, se ha llevado a cabo un programa sistemático de monitoreo de la región, que incluye la implementación de expediciones oceanográficas multidisciplinarias en diferentes estaciones del año. Como resultado, se ha documentado la presencia de un vórtice ciclónico cuasipermanente confinado al interior de la BP en diferentes épocas, cuyo origen ha sido atribuido a un efecto combinado del patrón de vientos de la región y la batimetría de la región (Monreal-Gómez et al. 2001, Coria-Monter et al. 2017). El vórtice ciclónico induce cambios en la estructura hidrográfica de la columna de agua, lo cual genera cambios en la distribución tridimensional de los parámetros hidrográficos de la BP, y promueve la elevación de la termoclina, la picnoclina y la nutriclina (Sánchez-Mejía et al. 2020). De esta manera, el vórtice ciclónico induce un ascenso de nutrimentos (particularmente nitratos), los cuales fertilizan la zona eufótica y promueven altos valores de Cla en el área de influencia del vórtice (Coria-Monter et al. 2017, Sánchez-Mejía et al. 2020). También, se ha reportado que este vórtice ejerce un impacto importante en las comunidades planctónicas, lo cual genera una distribución diferencial del fitoplancton desde el centro hacia la periferia, con un predominio de dinoflagelados en el centro y de diatomeas en la periferia (Coria-Monter et al. 2014), mientras que se han documentado agregaciones diferenciales de los principales grupos funcionales del zooplancton de la región (Durán-Campos et al. 2015).
Los resultados de este estudio mostraron que el vórtice ciclónico influyó en la distribución de la biomasa de copépodos a través de sus efectos sobre las condiciones hidrográficas, lo que promovió valores elevados de biomasa sobre la periferia del vórtice como resultado de diferentes procesos, como las interacciones ecológicas, la dinámica poblacional y los hábitos de alimentación, particularmente por las altas concentraciones de Cla observadas en la periferia del vórtice, que potencialmente representan una fuente de alimento para los copépodos de interés en este estudio. Nuestros resultados coinciden con los obtenidos por Hernández-León et al. (2001), quienes documentaron una alta variabilidad de la biomasa del zooplancton en un vórtice ciclónico de las islas Canarias (España), con valores bajos en el centro del vórtice debido al efecto divergente inducido por la estructura física.
La influencia ejercida por la presencia de vórtices ciclónicos, particularmente en las poblaciones de copépodos, ha sido analizada en algunas regiones alrededor del mundo. La distribución horizontal y vertical de 2 especies de copépodos calanoides en el noroeste de África fue analizada por Yebra et al. (2004), quienes demostraron que la presencia de vórtices, tanto ciclónicos como anticiclónicos, ejercen una influencia importante en las poblaciones de copépodos mediante los efectos hidrográficos de los vórtices, pero los vórtices también generaron advección de agua fría rica en Cla en forma de filamentos, lo que benefició a las poblaciones de ambas especies. En el sur del golfo de California, la distribución vertical de la comunidad de copépodos calanoides dentro de un vórtice ciclónico fue documentada por Cruz-Hernández et al. (2018), quienes encontraron diferencias entre el centro y la periferia del vórtice, con marcados cambios en la distribución vertical de las especies y la termoclina como la región propicia para la supervivencia de estos organismos.
Los resultados obtenidos en este estudio también podrían relacionarse con el mecanismo “de abajo a arriba” (bottom-up) debido a la presencia del vórtice ciclónico que impactó a las comunidades del fitoplancton; el vórtice generó elevados valores de Cla que, a su vez, influyeron en la biomasa de los copépodos, lo que puede beneficiar a los organismos situados en los niveles tróficos superiores (e.g., peces) que se alimentan en esta región, como fue señalado anteriormente por Durán-Campos et al. (2019). Las elevadas concentraciones de Cla en torno al vórtice se atribuyen a los mecanismos de fertilización por nutrimentos documentados en estas estructuras junto con los procesos de mezcla que ocurren en la periferia, lo cual asegura la disponibilidad de nutrimentos para las comunidades del fitoplancton y para los organismos herbívoros del zooplancton, como los copépodos (Mahadevan 2016).
En el sur del golfo de California y al interior de la BP, se han observado cambios en la biomasa del fitoplancton con la estación del año, con altos valores de Cla (>3 mg·m-3) durante el invierno y valores bajos durante el verano como resultado de los periodos típicos de calentamiento y enfriamiento en las capas superficiales en verano e invierno; estos cambios inducen mezcla en invierno, lo que aumenta la concentración de nutrimentos disponibles para el fitoplancton y conduce a valores altos de Cla (Álvarez-Borrego 2012, Durán-Campos et al. 2020). Martínez-López et al. (2012) también reportaron este patrón de alta producción biológica durante el invierno en la cuenca Alfonso, al interior de la BP.
Los cambios progresivos observados en la biomasa de copépodos alrededor de los vórtices podrían también ser inducidos por la advección generada por los movimientos divergentes producidos por la estructura ciclónica, como fue señalado por Hernández-León et al. (2001) para los vórtices de la región de Gran Canaria, islas Canarias. En este orden de ideas, los altos valores de biomasa de copépodos observados en los 3 grupos analizados en este estudio cerca de la conexión con el golfo de California pueden ser atribuidos a la presencia del umbral batimétrico, donde ocurren procesos importantes (e.g., saltos hidráulicos) que fertilizan la zona eufótica (Salas-Monreal et al. 2012). Sin embargo, la biomasa más alta se observó en la parte occidental de la bahía, cerca de la costa, en punta Las Tarabillas. Esto puede explicarse por la presencia de la industria minera de fosfatos que fertiliza la región, la cual provoca florecimientos de fitoplancton que estimulas la producción de zooplancton.
La baja concentración de Cla observada en el centro del vórtice en ambas estaciones del año podría estar relacionada con el predominio de ciertos grupos de fitoplancton heterótrofo (e.g., dinoflagelados) (Lee 2008, Coria-Monter et al. 2014). Además, la alta abundancia de copépodos asociada con altos valores de Cla en forma de anillo está relacionada con el predominio de diatomeas, como ya lo reportó Coria-Monter et al. (2014).
En resumen, los resultados presentados aquí resaltan la influencia de los procesos físicos en la distribución de la Cla y de los copépodos, lo cual permite avanzar en la comprensión de los procesos ecológicos que ocurren en la interfaz físico-biológica. Una evaluación completa de estos acoplamientos plantea grandes desafíos. En este sentido, se requieren observaciones in situ más completas para mejorar la evaluación de los diferentes aspectos de los vórtices, incluso las diferencias en los parámetros hidrográficos y la dinámica, lo cual puede afectar las comunidades del zooplancton que soportan muchas de las pesquerías de especies pelágicas de importancia comercial (que generalmente son depredadores del zooplancton, particularmente copépodos). Finalmente, un mejor entendimiento de la ecología de copépodos es clave para comprender mejor la producción pesquera y lograr una mejor gestión de los recursos marinos.
AGRADECIMIENTOS
El tiempo de buque para realizar ambos cruceros de investigación a bordo del B/O El Puma fue cubierto por la Universidad Nacional Autónoma de México. El Consejo Nacional de Ciencia y Tecnología (CONACYT, México) otorgó a FARD una beca de posgrado durante la realización de este trabajo. Agradecemos el valioso apoyo del capitán y su tripulación, así como del personal científico que participó en ambos cruceros. Agradecemos al OBPG de la NASA los productos satelitales utilizados en este estudio. Sergio Castillo Sandoval brindó apoyo técnico durante los análisis de laboratorio, Jorge Castro mejoró las figuras presentadas y los 2 revisores anónimos proveyeron comentarios valiosos. Los autores no tienen conflictos de interés que declarar.
REFERENCIAS
Álvarez-Borrego, S. 2012. Phytoplankton biomass and production in the Gulf of California: a review. Bot Mar. 55(2):119-128. https://doi.org/10.1515/bot.2011.105 [ Links ]
Arreguín-Sánchez, F., del-Monte-Luna, P., Zetina-Rejón, M.J., Albañez-Lucero, M.O. 2017. The Gulf of California large marine ecosystem: Fisheries and other natural resources. Environ Dev. 22:71-77. https://doi.org/10.1016/j.envdev.2017.03.002 [ Links ]
Ayón, P., Criales-Hernandez, M.I., Schwamborn, R., Hirche, H.-J. 2008. Zooplankton research off Peru: A review. Progr Oceanogr. 79(2-4):238-255. https://doi.org/10.1016/j.pocean.2008.10.020 [ Links ]
Boltovskoy, D. 1999. South Atlantic zooplankton. Mar del Plata (Argentina): Publicaciones especiales del INIDEP. 1076 p. [ Links ]
Brierley, A.S. 2017. Plankton. Curr Biol. 27(11):R478-R483. https://doi.org/10.1016/j.cub.2017.02.045 [ Links ]
Coria-Monter, E., Monreal-Gómez, M.A., Salas-de-León, D.A., Aldeco-Ramírez, J., Merino-Ibarra, M. 2014. Differential distribution of diatoms and dinoflagellates in a cyclonic eddy confined in the Bay of La Paz, Gulf of California. J Geophys Res: Oceans. 119(9):6258-6268. https://doi.org/10.1002/2014JC009916 [ Links ]
Coria-Monter, E., Monreal-Gómez, M.A., Salas-de-León, D.A., Durán-Campos, E. 2020. Zooplankton abundance during summer in the Bay of La Paz (southwestern Gulf of California, Mexico). Lat Am J Aquat Res. 48(5):794-805. http://doi.org/10.3856/vol48-issue5-fulltext-2515 [ Links ]
Coria-Monter, E., Monreal-Gómez, M.A., Salas-de-León, D.A., Durán-Campos, E., Merino-Ibarra, M. 2017. Wind driven nutrient and subsurface chlorophyll-a enhancement in the Bay of La Paz, Gulf of California. Estuar Coast Shelf Sci. 196:290-300. https://doi.org/10.1016/j.ecss.2017.07.010 [ Links ]
Cruz-Hernández, J., Sánchez-Velasco, L., Godínez, V.M., Beier, E., Palomares-García, J.R., Barton, E.D., Santamaría del Ángel, E. 2018. Vertical distribution of calanoid copepods in a mature cyclonic eddy in the Gulf of California. Crustaceana. 91(1):63-84. https://doi.org/10.1163/15685403-00003751 [ Links ]
Durán-Campos, E., Monreal-Gómez, M.A., Salas-de-León, D.A., Coria-Monter, E. 2019. Zooplankton functional groups in a dipole eddy in a coastal region of the southern Gulf of California. Reg Stud Mar Sci. 28:100588. https://doi.org/10.1016/j.rsma.2019.100588 [ Links ]
Durán-Campos, E., Monreal-Gómez, M.A., Salas-de-León, D.A., Coria-Monter, E. 2020. Field and satellite observations on the seasonal variability of the surface chlorophyll-a in the Bay of La Paz, Gulf of California, Mexico. Int J Oceans Oceanogr. 14(1):157-167. https://doi.org/10.37622/IJOO/14.1.2020.157-167 [ Links ]
Durán-Campos, E., Salas-de-León, D.A., Monreal-Gómez, M.A., Aldeco-Ramírez, J., Coria-Monter, E. 2015. Differential zooplankton aggregation due to relative vorticity in a semi-enclosed bay. Estuar Coast Shelf Sci. 164:10-18. https://doi.org/10.1016/j.ecss.2015.06.030. [ Links ]
Eden, B.R., Steinberg, D.K., Goldthwait, S.A., McGillicuddy, Jr D.J. 2009. Zooplankton community structure in a cyclonic and mode-water eddy in the Sargasso Sea. Deep-Sea Res Pt I. 56(10):1757-1776. https://doi.org/10.1016/j.dsr.2009.05.005 [ Links ]
Estrada, R., Harvey, M., Gosselin, M., Starr, M., Galbraith, P.S., Straneo, F. 2012. Late-summer zooplankton community structure, abundance, and distribution in the Hudson Bay system (Canada) and their relationships with environmental conditions, 2003-2006. Prog Oceanogr. 101(1):121-145. https://doi.org/10.1016/j.pocean.2012.02.003 [ Links ]
Gaube, P., McGillicuddy, Jr D.J., Moulin, A.J. 2018. Mesoscale eddies modulate mixed layer depth globally. Geophys Res Lett. 46:1505-1512. https://doi.org/10.1029/2018GL080006 [ Links ]
Hernández-León, S., Almeida, C., Gómez, M., Torres, S., Montero, I., Portillo-Hahnefeld, A. 2001. Zooplankton biomass and indices of feeding and metabolism in island-generated eddies around Gran Canaria. J Mar Syst. 30:51-66. https://doi.org/10.1016/S0924-7963(01)00037-9 [ Links ]
[IOC ] Intergovernmental Oceanographic Commission, [SCOR] Scientific Committee on Oceanic Research, [IAPSO] International Association for the Physical Sciences of the Oceans. 2010. The international thermodynamic equation of seawater-2010. Calculation and use of thermodynamic properties. Intergovernmental Oceanographic Comission, Manual and guides, No. 56: Paris (France): UNESCO. http://www.teos-10.org/pubs/TEOS-10_Manual.pdf [ Links ]
Jagadeesan, L., Srinivas, T.N.R., Surendra, A., Sampath-Kumar, G., Aswindev, M.P., Ignatious, J. 2020. Copepods size structure in various phases of a cold-core eddy - Normalised Abundance Size Spectra (NASS) approach. Cont Shelf Res. 206:104197. https://doi.org/10.1016/j.csr.2020.104197 [ Links ]
Kiørboe, T. 2011. What makes pelagic copepods so successful? J Plankton Res. 33(5):677-685. https://doi.org/10.1093/plankt/fbq159 [ Links ]
Lee, R.E. 2008. Phycology. 4th ed. Cambridge (UK): Cambridge University Press. 534 p. [ Links ]
Mahadevan, A. 2016. The impact of submesoscale physics on primary productivity of plankton. Annu Rev Mar Sci. 8:161-184. http://doi.org/10.1146/annurev-marine-010814-015912 [ Links ]
Mann, K.H., Lazier, J.R.N. 2006. Dynamics of marine ecosystems: Biological-physical interactions in the oceans. 3rd ed. Boston (USA): Blackwell Scientific Publications. 496 p. [ Links ]
Martínez-López, A., Álvarez-Gómez, I.G., Durazo, R. 2012. Climate variability and silicoflagellate fluxes in Alfonso Basin (southern Gulf of California). Bot Mar. 55:177-185. https://doi.org/10.1515/bot-2012-0101 [ Links ]
Mauchline, J., Blaxter, J.H.S., Southward, A.J., Tyler, P.A. 1998. The Biology of Calanoid Copepods. 1st ed. San Diego (California, USA): Academic Press. 710 p. [ Links ]
McGillicuddy, Jr D.J. 2016. Mechanisms of physical-biological-biogeochemical interaction at the oceanic mesoscale. Annu Rev Mar Sci. 8:125-159. https://doi.org/10.1146/annurev-marine-010814-015606 [ Links ]
Melão, M.G.G., Rocha, O. 2004. Life history, biomass and production of two planktonic cyclopoid copepods in a shallow subtropical reservoir. J Plankton Res. 26(8):909-923. https://doi.org/10.1093/plankt/fbh080 [ Links ]
Molinero, J.C., Ibanez, F., Souissi, S., Bosc, E., Nival, P. 2008. Surface patterns of zooplankton spatial variability detected by high frequency sampling in the NW Mediterranean. Role of density fronts. J Mar Sys. 69(3-4):271-282. https://doi.org/10.1016/j.jmarsys.2005.11.023 [ Links ]
Monreal-Gómez, M.A., Molina-Cruz, A., Salas-de-León, DA. 2001. Water masses and cyclonic circulation in Bay of La Paz, Gulf of California, during June 1998. J Mar Sys. 30(3-4):305-315. https://doi.org/10.1016/S0924-7963(01)00064-1 [ Links ]
Morales, C.E., Loreto-Torreblanca, M., Hormazabal, S., Correa-Martínez, M., Nuñez, S., Hidalgo, P. 2010. Mesoscale structure of copepod assemblages in the coastal transition zone and oceanic waters off central-southern Chile. Prog Oceanogr. 84(3-4):158-173. https://doi.org/10.1016/j.pocean.2009.12.001 [ Links ]
Noyon, M., Morris, T., Walker, D., Huggett, J. 2019. Plankton distribution within a young cyclonic eddy off south-western Madagascar. Deep-Sea Res Pt II. 166:141-150. https://doi.org/10.1016/j.dsr2.2018.11.001 [ Links ]
Ohtsuka, S., Bottger-Schnack, R., Okada, M., Onbé, T. 1996. In situ feeding habits of Oncaea (Copepoda: Poecilostomatoida) from the upper 250 m of the central Red Sea, with special reference to consumption of appendicularian houses. Bull Plankton Soc Jpn. 43(2):89-105. [ Links ]
Pond, S., Pickard, G.L. 1995. Introductory Dynamical Oceanography. 2nd ed. Oxford: Butterworth-Heinemann. 329 p. [ Links ]
Richardson, A.J. 2008. In hot water: zooplankton and climate change. ICES J Mar Sci. 65(3):279-295. https://doi.org/10.1093/icesjms/fsn028 [ Links ]
Salas-Monreal, D., Salas de León, D.A., Monreal-Gomez, M.A, Riverón-Enzástiga, M.L., Mojica-Ramírez, E. 2012. Hydraulic jump in the Gulf of California. Open J Mar Sci. 2:141-149. http://dx.doi.org/10.4236/ojms.2012.24017 [ Links ]
Sánchez-Mejía, J.M., Monreal-Gómez, M.A., Durán-Campos, E., Salas-de-León, D.A., Coria-Monter, E., Contreras-Simuta, M.G., Merino-Ibarra, M. 2020. Impact of a Mesoscale Cyclonic Eddy on the Phytoplankton Biomass of Bay of La Paz in the Southern Gulf of California. Pac Sci. 74(4):331-344. https://doi.org/10.2984/74.4.2 [ Links ]
Santhanam, P., Pachiappan, P., Begum, A. 2019. A method of collection, preservation and identification of marine zooplankton. In: Santhanam, P., Begum, A., Pachiappan, P. (eds.), Basic and Applied Zooplankton Biology. Singapore: Springer Nature Singapore Pte Ltd. 442 p. https://doi.org/10.1007/978-981-10-7953-5_1 [ Links ]
Tartarotti, B., Saul, N., Chakrabarti, S., Trattner, F., Steinberg, C.E.W., Sommaruga, R. 2014. UV-induced DNA damage in Cyclops abyssorum tatricus populations from clear and turbid alpine lakes. J Plankton Res. 36(2):557-566. [ Links ]
Vera-Mendoza, R., Salas-de-León, D.A. 2014. Effect of environmental factors on zooplankton abundance and distribution in river discharge influence areas in the southern Gulf of Mexico. In: Amezcua, F., Bellgraph, B. (eds.), Fisheries management of Mexican and Central American Estuaries, Estuaries of the world. 1st ed. Netherlands: Springer. p. 93-112. [ Links ]
Webster, C.N., Lucas, C.H. 2012. The effects of food and temperature on settlement of Aurelia aurita planula larvae and subsequent somatic growth. J Exp Mar Biol Ecol. 436-437:50-55. https://doi.org/10.1016/j.jembe.2012.08.014 [ Links ]
Yebra, L., Hernández-León, S., Almeida, C., Bécognée, P., Rodríguez, J.M., 2004. The effect of upwelling filaments and island-induced eddies on indices of feeding, respiration and growth in copepods. Prog Oceanogr. 62:151-169. [ Links ]
Recibido: 30 de Mayo de 2021; Aprobado: 06 de Septiembre de 2021











 texto em
texto em 



