Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dez. 2022 Epub 17-Nov-2023
https://doi.org/10.7773/cm.y2022.3269
Artículos
Evaluación del efecto de la temperatura en la fotosíntesis y la respiración de algas coralinas articuladas utilizando la evolución de oxígeno y la fluorescencia de la clorofila a
1Centro de Investigaciones y Estudios Avanzados del Politécnico Nacional, Departamento de Recursos del Mar, 97310 Mérida, Yucatán, Mexico.
2Universidad Autónoma de Baja California, Instituto de Investigaciones Oceanológicas, 22860 Ensenada, Baja California, Mexico.
3Universidad Nacional Autónoma de México, Instituto de Ciencias del Mar y Limnología, Unidad Académica de Sistemas Arrecifales, 77580, Puerto Morelos, Quintana Roo, México.
Las algas coralinas forman hábitats vegetales sumergidos, ecológicamente importantes y abundantes, alrededor del mundo. El desempeño algal, no obstante, está amenazado por el cambio climático y la acidificación del océano. Estudios previos han sugerido que su desempeño fotosintético estará comprometido, principalmente a elevadas temperaturas. El entendimiento del impacto de diversos escenarios del cambio climático requiere comprensión exhaustiva de la respuesta fotosintética a los gradientes de temperatura. Este estudio evaluó el efecto a corto plazo de la temperatura (10-35 °C) en la fotosíntesis bruta (FSB), la respiración y la tasa del transporte de electrones (TTE) de 3 especies de algas coralinas articuladas (Lithothrix aspergillum, Corallina officinalis y Bossiella orbigniana) para entender mejor su metabolismo e investigar la relación entre la FSB y la TTE en función de la temperatura. Los resultados mostraron que el metabolismo coralino es altamente sensible a la temperatura, pero las respuestas fueron específicas para cada especie y pueden estar relacionadas con su aclimatación/adaptación lumínica; L. aspergillum, alga adaptada a alta luz, fue la menos afectada negativamente. La razón fotosíntesis: respiración fue óptima a 20-25 °C, según el régimen térmico local, pero se redujo significativamente a temperaturas altas; esto indica fuertes desbalances de carbono y resalta la relevancia del estrés térmico para el desempeño fotosintético coralino. Se encontró una fuerte correlación entre la FSB y la TTE entre los 10 y 30 °C para todas las especies, pero se observó una clara desviación de esta linealidad por encima de las irradiancias de saturación y a temperaturas elevadas (≥30 °C). Lo anterior sugiere que la TTE no es un buen indicador de la actividad fotosintética bajo condiciones de estrés lumínico o térmico. Esta información debería ser útil para estudios que implementen escenarios de cambio global y fluorometría de pulso de amplitud modulada (PAM) en algas coralinas.
Palabras clave: algas coralinas; fluorescencia PAM; fotosíntesis; temperatura
Coralline algae form abundant and ecologically important submerged aquatic vegetation habitats throughout the world. However, algal performance is threatened by climate change and ocean acidification. Previous studies suggest that their photosynthetic performance will be compromised mainly at elevated temperatures. Understanding the impact of diverse climate change scenarios requires a clear and thorough comprehension of the photosynthetic response to temperature gradients. The objective of this study was to evaluate the short-term effect of temperature (10-35 °C) on the gross photosynthesis (GPS), respiration, and electron transport rates (ETRs) of 3 articulated coralline algae (Lithothrix aspergillum, Corallina officinalis, and Bossiella orbigniana) for a better understanding of their metabolism and to investigate the relationship between GPS and ETR as a function of temperature. The results showed that the coralline algal metabolism is highly sensitive to temperature, but responses were species-specific and can be related to their light adaptation/acclimation; the high-light-adapted L. aspergillum was least negatively affected. The photosynthesis to respiration ratio was optimal between 20 and 25 °C according to the local thermal regime but was significantly reduced toward higher temperatures, indicating strong carbon imbalances and highlighting the relevance of thermal stress for coralline algal performance. A strong correlation between GPS and ETR was found between 10 and 30 °C in all species, but both above saturation irradiances and at elevated temperatures (≥30 °C), a clear deviation from linearity occurred. This suggests that ETR is not a good proxy to estimate photosynthetic activity under light or thermal stress. This information should be useful for studies implementing global change scenarios and pulse amplitude modulated (PAM) fluorometry in coralline algae.
Key words: coralline algae; PAM fluorescence; photosynthesis; temperature
INTRODUCCIÓN
Las algas coralinas son vegetación acuática abundante y ecológicamente importante en zonas costeras alrededor del mundo (Foster 2001). Estas algas llegan a formar mantos densos en diferentes regiones del mundo, incluído el golfo de California, o bien, tapetes densos que forman importantes micro y macro hábitats para invertebrados y otras algas en las costas rocosas del Pacífico Norte y el Atlántico Norte (Foster 2001, Steller et al. 2003). Asimismo, las algas coralinas son el mayor componente de la dieta y/o sustrato para el asentamiento de organismos de pesquerías importantes como las langostas y el abulón (Jernakoff et al. 1993, Linnane et al. 2000). Debido a su abundancia y habilidad para calcificar, las algas coralinas son reconocidas como organismos clave en el ciclo del carbono en aguas someras costeras (Chisholm 2000, Martin et al. 2006). El esqueleto de carbonato de calcio de estas algas les sirve como protección física y juega también un papel importante en el proceso de absorción de luz (Vásquez-Elizondo y Enríquez 2017), pero las hace vulnerables a la acidificación del océano (Díaz-Pulido et al. 2012). La evidencia creciente sugiere que el estrés térmico afecta considerablemente el desempeño general de las algas coralinas (Martin y Gattuso 2009, Vásquez-Elizondo y Enríquez 2017).
Las tasas fotosintéticas de las algas coralinas han sido usualmente investigadas con técnicas de intercambio gaseoso. La fluorometría de pulso de amplitud modulada (PAM) representa una ventaja clara sobre los métodos tradicionales debido a su versatilidad, naturaleza no intrusiva y evaluación rápida de la actividad fotosintética (Maxwell y Johnson 2000). En la fluorometría PAM, la fluorescencia de la clorofila a asociada al fotosistema II (FSII) se utiliza para determinar las reacciones primarias y los mecanismos de decaimiento en el aparato fotosintético (Maxwell y Johnson 2000, Longstaff et al. 2002, Beer y Axelsson 2004). Además, la tasa del transporte de electrones (TTE) del FSII al fotosistema I (FSI) puede ser calculada y utilizada como indicador de la tasa fotosintética, pero su efectividad depende de la linealidad que exista entre la TTE y la evolución del dióxido de carbono-oxígeno (Franklin y Badger 2001, Beer y Axelsson 2004).
En la vegetación terrestre, particularmente en plantas C4, la TTE y la fijación de carbono mantienen una relación lineal (Edwards y Baker 1993), mientras que en las macrófitas marinas, la relación entre la fotosíntesis bruta (FSB) y la TTE generalmente depende de la especie y puede variar en función de la aclimatación lumínica, la temperatura y la disponibilidad de nitrógeno (Cabello-Pasini et al. 2000, Figueroa et al. 2003, Cabello-Pasini y Figueroa 2005). Por ejemplo, la FSB y la TTE mantienen una relación lineal en Ulva rigida y Macrocystis pyrifera pero se desvía a altas irradiancias en Ulva fasciata (Carr y Bjork 2003, Colombo‐Pallotta et al. 2006). Solo un estudio demostró una asociación lineal entre la FSB y la TTE relativa en el alga coralina (rodolito) Phymatolithon lusitanicum (Sordo et al. 2020). Debido a ello, es necesario realizar investigaciones extensivas para evaluar la utilidad de la TTE en las algas coralinas.
En las macrófitas marinas, la fijación del dióxido de carbono depende principalmente de la irradiancia, la temperatura y los niveles de nutrientes (Falkowski y Raven 2007). En ambientes someros costeros, las macrófitas están expuestas a fluctuaciones diarias y estacionales de temperatura, lo que induce una variación en sus tasas fotosintéticas, pero también en su pigmentación, contenido proteíco y contenido de fibras (Cabello-Pasini et al. 2003, 2004). En consecuencia, se esperaría que algas expuestas a estas condiciones fluctuantes sufrieran menos debido a los efectos adversos de estas variaciones ambientales (Martone et al. 2010, Williamson et al. 2017). El efecto de la temperatura sobre la fisiología de las algas coralinas ya ha sido estudiado, pero poco se sabe sobre su efecto en la TTE. Los incrementos a corto plazo de temperatura bajo los regímenes naturales incrementa las tasas fotosintéticas, pero depende de la especie, su aclimatación lumínica y el tiempo de exposición (Guy-Haim et al. 2016, Vásquez-Elizondo y Enríquez 2016), mientras que un estrés térmico induce típicamente una pérdida de su desempeño (Martin y Gattuso 2009, Webster et al. 2011).
Una descripción detallada de la respuesta fotosintética frente a gradientes de temperatura incrementará la habilidad para entender los distintos mecanismos de respuesta e interpretar escenarios más complejos y diversos. La habilidad para evaluar la respuesta fotosintética de manera rápida (i.e., TTE), por otro lado, puede beneficiar investigaciones futuras solo si se conocen sus limitaciones. Consecuentemente, el objetivo de este estudio fue evaluar simultáneamente el efecto a corto plazo de la temperatura (10-35 °C) sobre la fotosíntesis, la respiración y la TTE de 3 especies de algas coralinas articuladas de la costa Pacífico Norte de México mientras se evaluó la relación entre la TTE y la FSB.
MATERIALES Y MÉTODOS
Material Biológico
Se recolectaron muestras de las algas coralinas articuladas Lithothrix aspergillum, Corallina officinalis y Bossiella orbigniana en la zona intermareal de punta Morro, Ensenada, Baja California, México, durante marzo de 2006. La temperatura superficial del agua de mar osciló entre los 17 y 20 °C y la irradiancia superficial alcanzó los 1,000-1,200 µmol cuantos·m-2·s-1 al atardecer en días soleados. El material recolectado se transportó al laboratorio cercano de la Universidad Autónoma de Baja California (UABC). Los organismos epífitos fueron eliminados de las muestras, y las algas se enjuagaron con agua de mar y se colocaron en contenedores de 20 L con agua de mar filtrada (0.45 µm) a 20 °C, con aeración constante para promover la circulación de agua, y a una intensidad de luz de 80 µmol cuantos·m-2·s-1. Se realizaron recambios de agua cada 12 h. Todos los experimentos se realizaron en un lapso de no más de 2 días después de la recolecta de muestras.
Evolución de oxígeno y fluorescencia de la clorofila a
Se realizaron mediciones simultáneas de oxígeno y fluorescencia de la clorofila a en el talo de las algas. Las tasas de fotosíntesis oxigénica se determinaron polarográficamente mediante las tasas de evolución de oxígeno en estado estacionario en segmentos apicales del talo (n = 4, ≈0.05-0.10 g peso fresco). Todas las mediciones se realizaron en cámaras de incubación de 5 mL (Rank Brothers; Cambridge, Reino Unido) conectadas a un baño recirculador para controlar la temperatura (ISOTEMP 1016S, Fisher Scientific; Hampton, New Hampshire, EE. UU.; estabilidad 0.5 °C). Se realizó una pre-incubación en oscuridad (0.5 h) a la temperatura experimental colocando las algas en tubos de 50 mL con agua de mar filtrada y puestos en el reservorio de agua del baño recirculador. La evolución de oxígeno se registró por al menos 8-10 min en cada paso de oscuridad/luz desde la oscuridad (respiración) y durante una serie de incrementos de irradiancia (0-960 µmol cuantos·m-2·s-1) utilizando filtros de densidad neutra (Lee filters; Osram, Reino Unido) colocados frente a lámparas de halógeno (Quartzline 300 W). Una determinación experimental (una curva fotosíntesis-irradiancia de 0-960 µmol cuantos·m-2·s-1) fue realizada en el mismo segmento experimental para asegurar que respondía en consecuencia de la historia de luz. La concentración de oxígeno se mantuvo entre el 20% y el 40% de la saturación burbujeando el agua con nitrógeno (N2) al principio de las determinaciones, que se realizaron sin recambio de agua. Los valores de irradiancia dentro de la cámara se obtuvieron utilizando un sensor de luz miniatura PAR (Diving PAM; Walz, Alemania) calibrado previamente contra un sensor coseno (LI-190SA) conectado a un radiómetro portátil (LI-1400, LI-COR; Lincoln, Nebraska, EE. UU.). La tasa máxima de fotosíntesis (Pmax) se calculó como el promedio de los valores máximos por encima de la saturación de luz, y la pendiente inicial de la curva fotosíntesis-irradiancia (α) se determinó mediante un análisis de regresión por mínimos cuadrados utilizando los valores de fotosíntesis por debajo de la saturación de luz que mostraran una respuesta lineal en función de la irradiancia de cada curva individual. La irradiancia de saturación (Ek) se determinó como la razón entre la Pmax y α. Adicionalmente, se calculó el coeficiente metabólico Q10 como la razón entre el promedio de la actividad metabólica a una temperatura final (T °C + 10 °C) a la actividad metabólica promedio inicial, siempre y cuando la respuesta fuese lineal.
Se determinó la fluorescencia de la clorofila a del FSII in vivo (n = 4) con un fluorómetro PAM portátil (Diving PAM; Walz, Alemania) de manera simultánea a la evolución de oxígeno introduciendo una fibra óptica miniatura (Diving F1, Walz) en las cámaras de incubación y manteniéndola a 45° del tejido durante los experimentos. La fibra óptica de 2 mm era translúcida, lo que evitó el sombreado del talo durante la determinación. Se determinó la fluorescencia basal (Fo) y la fluorescencia máxima (Fm) en muestras aclimatadas a oscuridad (0.5 h) antes y despúes de aplicar un pulso de luz saturante (>3,000 µmol cuantos·m-2·s-1, 0.8 s), respectivamente. La fluorescencia variable (Fv) se determinó como la diferencia entre la Fm y la Fo, y se calculó la eficiencia fotoquímica máxima (Fv/Fm) (Schreiber 2004). De forma similar, la eficiencia fotoquímica o cosecha cuántica efectiva del FSII (∆F/Fmʹ) se determinó en los talos aclimatados a cada irradiancia experimental después de haber alcanzado su estado estacionario de oxígeno. La TTE se determinó como sigue:
donde la absortancia, APAR, es la fracción de luz incidente absorbida por el talo entre los 400 y 700 nm, E es la irradiancia de llega al talo y 0.15 es la fracción de APAR redirigida al FSII para algas rojas (Orzymski et al. 1997). La absorción y la transmisión de los fragmentos experimentales se calculó de acuerdo con Vásquez-Elizondo et al. (2017). Dado que la reflectancia en las algas coralinas es considerablemente alta comparada con otras macroalgas no calcificantes, la absorción puede variar entre un 45% y 85% de la luz incidente, según el grosor del tejido y la pigmentación, y por tanto en el presente estudio se utilizó un valor estándar de APAR de 0.7 (valor de la mediana, ver Vásquez-Elizondo y Enríquez 2017). Los valores máximos de la TTE, la pendiente inicial de la curva TTE-irradiancia y la irradiancia de saturación del TTE (Ek TTE) se calcularon como se describió previamente para las curvas de la evolución de oxígeno. El peso seco (PS) de las muestras se determinó en una balanza analítica después de secar las algas por 48 h a 60 °C.
Análisis estadísticos
Se evaluaron las diferencias en los parámetros fotosintéticos (FSB, TTE) en función de la temperatura mediante pruebas de análisis de variancia de una vía después de corroborar la homocedasticidad y normalidad en los datos. Se utilizaron pruebas múltiples pareadas de Tukey para determinar diferencias entre grupos. Cuando fue necesario, se realizaron pruebas no paramétricas (Kruskal-Wallis). La significancia de la correlación entre la FSB y la TTE se determinó mediante correlaciones de Pearson. El nivel de significancia se estableció a P > 0.05. Todas las pruebas estadísticas se realizaron con el software JAMOVI.
RESULTADOS
La temperatura afectó significativamente los parámetros fotosintéticos derivados de las curvas fotosíntesis-irradiancia (P-E) (Fig. S1) en todas las algas coralinas estudiadas (P < 0.05; Tablas 1, S1). De manera general, la Pmax, la respiración en oscuridad (RD), α, y la Ek se incrementaron de manera lineal con los incrementos de temperatura hasta un óptimo, seguido de un fuerte decremento a temperaturas elevadas (Fig. 1). Las respuestas observadas frente a la temperatura fueron específicas para cada especie, y las tasas metabólicas calculadas mostraron distintos umbrales fisiológicos. Se observó un incremento lineal de la Pmax hasta un máximo a medida que la temperatura experimental se incrementaba desde los 10 °C hasta los 30 °C en L. aspergillum y desde los 10 °C hasta los 20-25 °C para las especies restantes (Fig. 1a). Los valores máximos de la Pmax fueron de 269.3 (±60.8), 139.7 (±63.6) y 80.0 (±10.9) µmol O2·g PS-1·h-1 para L. aspergillum, C. officinalis y B. orbigniana, respectivamente. Posterior a este máximo, la Pmax disminuyó fuertemente: 4, 3 y 12 veces para L. aspergillum, C. officinalis y B. orbigniana, respectivamente. Las tasas de respiración en oscuridad (RD, Fig. 1b) se incrementaron de manera lineal en todo el intervalo de temperaturas experimentales utilizadas para L. aspergillum y C. officinalis y alcanzaron un máximo a 30 °C en B. orbigniana (con un incremento sustancial de los 25 °C a los 30 °C), seguido de un fuerte decremento hacia los 35 °C. Los valores de RD más altos fueron de 73.7 (±2.0), 61.3 (±15.4) y 41.5 (±13.7) µmol O2·g PS-1·h-1 para L. aspergillum, C. officinalis y B. orbigniana, respectivamente. La pendiente inicial de la curva de la evolución de oxígeno (αoxy, Fig. 1c) mostró una tendencia similar a la Pmax y RD; incrementó con los aumentos de temperatura hasta un máximo, desde los 10 °C hasta los 30 °C en C. officinalis y B. orbigniana y hasta los 35 °C en L. aspergillum (Fig. 2c). La Ek presentó una respuesta similar entre especies en función de los incrementos de temperatura y fue, en general, más alta para L. aspergillum, particularmente entre los 20 y 25 °C (Fig. 1d). En C. officinalis, la Ek se incrementó en las muestras incubadas de 10 a 20 °C, para una posterior caída significativa y estabilización desde los 25 a 35 °C. En las especies restantes, la Ek se incrementó desde los 10 °C hasta los 25 °C en B. orbigniana y hasta los 20 °C in L. aspergillum, seguidas ambos de una fuerte caída. Las razones fotosíntesis: respiración (P:R) fueron relativamente elevadas a temperaturas bajas (~7-13) para todas las especies, pero disminuyeron significativamente con los incrementos de temperatura (30-35 °C) a valores aproximados de 1 (Tablas 1, 2). El cociente metabólico Q10 fue variable, pero generalmente decreció en todas las especies a medida que la temperatura se incrementó (Tabla 2). Mientras que L. aspergillum y C. officinalis mostraron los mayores Q10 fotosintéticos, C. officinalis y B. orbigniana presentaron los mayores Q10 respiratorios.
Tabla 1 Resultados de los análisis de variancia y Kruskal-Wallis para la comparación entre los descriptores fotosintéticos (oxígeno/fluorescencia de la clorofila) y la temperatura en las algas coralinas estudiadas. Abreviaciones: Pmax, tasa máxima de fotosíntesis; RD, respiración en oscuridad; α, pendiente inicial de la curva fotosíntesis-irradiancia; Ek, irradiancia de saturación; P:R, razón fotosíntesis a respiración; Fv/Fm, eficiencia fotoquímica máxima; ETRmax, tasa máxima de transporte de electrones, por sus siglas en inglés; αETR, pendiente inicial de la curva ETR vs. irradiancia; y Ek ETR, irradiancia de saturación del ETR, por sus siglas en inglés. Todos los análisis se realizaron entre 5 tratamientos de temperatura, excepto en Bossiella orbigniana (n = 4 tratamientos, sin datos para αETR y Ek ETR a 35 °C). Ver Tabla S1 para las comparaciones múltiples post hoc.
| Oxygen evolution | Chlorophyll a fluorescence | ||||||||
| Species | Descriptor | F, H | d.f. | P | Descriptor | F, H | d.f. | P | |
| Lithothrix aspergillum | Pmax* | 21.10 | 5,18 | <0.001 | Fv/Fm * | 15.5 | 5.0, 18.0 | 0.008 | |
| RD* | 20.80 | 5,18 | <0.001 | ETRmax | 86.6 | 5.0, 7.0 | <0.001 | ||
| α* | 19.80 | 5,18 | <0.001 | αETR | 27.4 | 5.0, 18.0 | <0.001 | ||
| Ek | 23.40 | 5,18 | <0.001 | Ek ETR | 134.0 | 5.0, 7.0 | <0.001 | ||
| P:R | 82.30 | 5, 7 | <0.001 | ||||||
| Corallina officinalis | Pmax* | 16.50 | 5,18 | 0.005 | Fv/Fm* | 15.6 | 5.0, 18.0 | 0.008 | |
| RD* | 18.40 | 5,18 | 0.002 | ETRmax | 23.3 | 5.0, 7.3 | <0.001 | ||
| α* | 14.80 | 5,18 | 0.011 | αETR* | 13.5 | 5.0, 18.0 | 0.020 | ||
| Ek | 3.40 | 5,18 | 0.024 | Ek ETR | 24.8 | 5.0, 7.8 | <0.001 | ||
| P:R* | 21.07 | 5,18 | <0.001 | ||||||
| Bosiella orbigniana | Pmax | 15.30 | 5,18 | <0.001 | Fv/Fm | 363.0 | 5.0, 7.1 | <0.001 | |
| RD* | 19.40 | 5,18 | 0.002 | ETRmax | 11.5 | 5.0, 7.8 | 0.002 | ||
| α* | 14.90 | 5,18 | 0.001 | αETR | 17.1 | 4.0, 14.0 | <0.001 | ||
| Ek* | 18.30 | 5,18 | 0.002 | Ek ETR | 4.8 | 4.0, 14.0 | 0.012 | ||
| P:R* | 17.50 | 5,18 | 0.004 | ||||||
*Kruskal-Wallis test;
Tabla 2 Medias (±desviación estándar) para las razones fotosíntesis (Pmax) a respiración en oscuridad (RD) (P:R) y cocientes metabólicos (Q10) para las algas coralinas estudiadas. N/A indica una falta de asociación lineal para el intervalo de temperaturas dado. Ver los métodos para los detalles.
| Descriptor | Temperature/ Range (°C) | Lithothrix aspergillum | Corallina officinalis | Bosiella orbigniana |
| P:R | 10 | 7.20 ± 2.50 | 13.83 ± 7.40 | 13.21 ± 9.50 |
| 15 | 8.33 ± 2.02 | 8.72 ± 2.50 | 8.56 ± 1.60 | |
| 20 | 8.63 ± 1.20 | 5.02 ± 1.70 | 5.45 ± 0.76 | |
| 25 | 7.08 ± 0.75 | 2.67 ± 0.50 | 6.67 ± 2.99 | |
| 30 | 4.01 ± 0.69 | 1.75 ± 0.37 | 1.39 ± 0.46 | |
| 35 | 1.01 ± 0.01 | 0.98 ± 0.02 | 1.02 ± 0.48 | |
| Q10 Pmax | 10-20 | 3.14 | 3.09 | 1.63 |
| 15-25 | 2.07 | 1.21 | 1.48 | |
| 20-30 | 1.40 | N/A | N/A | |
| Q10 RD | 10-20 | 2.43 | 7.79 | 2.84 |
| 15-25 | 2.38 | 4.05 | 2.13 | |
| 20-30 | 3.07 | 1.66 | 3.81 | |
| 25-35 | 2.64 | 1.27 | N/A |

Figura 1 Parámetros fotosintéticos que describen las curvas fotosíntesis-irradiancia (P-E, evolución de oxígeno) en función de la temperatura en las algas coralinas estudiadas. (a) Tasa máxima de fotosíntesis (Pmax), (b) respiración en oscuridad (RD), (c) pendiente inicial de la curva P-E (α) y (d) irradiancia de saturación (Ek). Los símbolos representan la media (n = 4) ± desviación estándar.
La respuesta de la TTE frente a la irradiancia fue similar a la observada en la fotosíntesis oxigénica (curva TTE-irradiancia; Figs. S1, S2); sin embargo, los valores de la TTE se saturaron a irradiancias mayores (>300 µmol cuantos·m-2·s-1). En general, la mayor actividad de la TTE se observó entre los 20 y 25 °C. En relación con la temperatura, esta afectó significativamente la Fv/Fm, así como también los parámetros derivados de la curva TTE-irradiancia (P<0.05; Fig. 2; Tablas 1, S1). En lo que respecta al Fv/Fm, este se mantuvo constante en alrededor de 0.55 desde los 10 °C hasta los 25 °C en todas las especies, pero se redujo gradualmente hacia temperaturas elevadas a valores de entre ~0.25 y 0.30 a los 35 °C en L. aspergillum y C. officinalis y cercanos a cero en B. orbigniana (Fig. 2a). Las TTE máximas (TTEmax, Fig. 2b) se incrementaron desde los 10 °C a valores máximos a 25 °C en L. aspergillum y a 20 °C en las especies restantes. Estos picos máximos se desplazaron 5 °C hacia temperaturas bajas en contraste con los picos máximos observados para la Pmax. A temperaturas elevadas, las TTEmax disminuyeron hacia los 35 °C en todas las especies. Los valores más elevados de las TTEmax fueron de 36.9 (±3.6), 14.9 (±5.4) y 19.4 (±5.7) µmol e -·m-2·s-1 en L. aspergillum, C. officinalis y B. orbigniana, respectivamente, y decrecieron 6 veces a 35 °C. Los valores de α, αTTE, se incrementaron ligeramente desde los 10 hasta los 25 °C en todas las especies para, posteriormente, disminuir drásticamente hacia los 35 °C, con valores máximos entre los 0.05 y 0.03 µmol e -·µmol cuantos·s-1 (Fig. 2c). Los valores de la Ek TTE respondieron distinto entre las especies (Fig. 2d). Por ejemplo, la Ek TTE se incrementó desde 10 °C hasta un máximo a 25 °C en L. aspergillum y hasta 30 °C en C. officinalis, mientras que en B. orbigniana este máximo se observó a 15 °C. En el intervalo óptimo de temperaturas (15-30 °C) los Ek TTE fueron ≥600 µmol cuantos·m-2·s-1 para L. aspergillum y aproximadamente la mitad de eso para las especies restantes y fueron generalmente mayores que los obtenidos mediante la evolución de oxígeno.

Figura 2 Eficiencia fotoquímica máxima y parámetros fotosintéticos que describen la curva entre la tasa de transporte de electrones (ETR, por sus siglas en inglés) vs. irradiancia en función de la temperatura en las algas coralinas estudiadas. (a) Eficiencia fotoquímica máxima (Fv/Fm), (b) tasa máxima de transporte de electrones (ETRmax), (c) pendiente inicial de la curva ETR vs. irradiancia (αETR) y (d) irradiancia de saturación del ETR (Ek ETR). Los símbolos representan la media (n = 4) ± desviación estándar, excepto αETR y Ek ETR para Corallina officinalis a 30 °C (media ± desviación estándar, pero n = 3). No hay datos para αETR y Ek ETR para Bossiella orbigniana a 35 °C.
Se observó una asociación lineal significativa (P < 0.05) entre la FSB y la TTE a todas las temperaturas para L. aspergillum (Fig. 3) y desde los 10 °C hasta los 30 °C en C. officinalis y B. orbigniana (Figs. 4, 5). De manera general, los coeficientes de correlación se incrementaron a medida que la temperatura se incrementaba (hasta 0.90) para, posteriormente, disminuir a los 30 °C. La asociación lineal entre la FSB y la TTE se debilitó drásticamente a los 35 °C en L. aspergillum y desapareció en las especies restantes. Adicionalmente, se observó una desviación de la linealidad en irradiancias elevadas, ya que la TTE tendía a incrementarse mientras que la FSB permanecía saturada o decrecía.

Figura 3 Asociación entre la fotosíntesis bruta (GPS, por sus siglas en inglés) y la tasa de transporte de electrones (ETR, por sus siglas en inglés) en Lithothrix aspergillum en función de la temperatura. Los valores de P indican la significancia de las correlaciones de Pearson (n = 32 por tratamiento de temperatura).
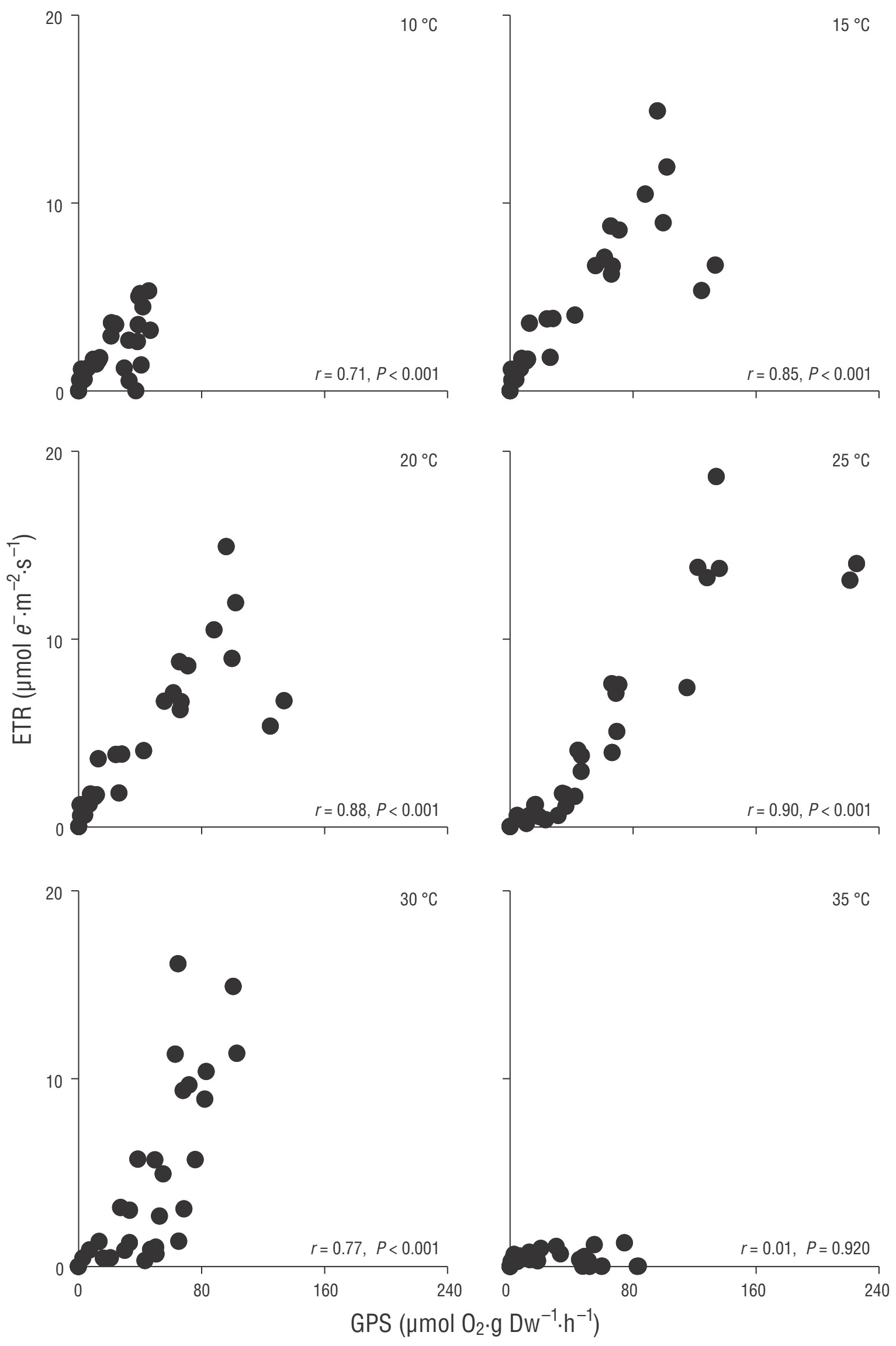
Figura 4 Asociación entre la fotosíntesis bruta (GPS, por sus siglas en inglés) y la tasa de transporte de electrones (ETR, por sus siglas en inglés) en Corallina officinalis en función de la temperatura. Los valores de P indican la significancia de las correlaciones de Pearson (n = 32 por tratamiento de temperatura, excepto 30 °C = 24).
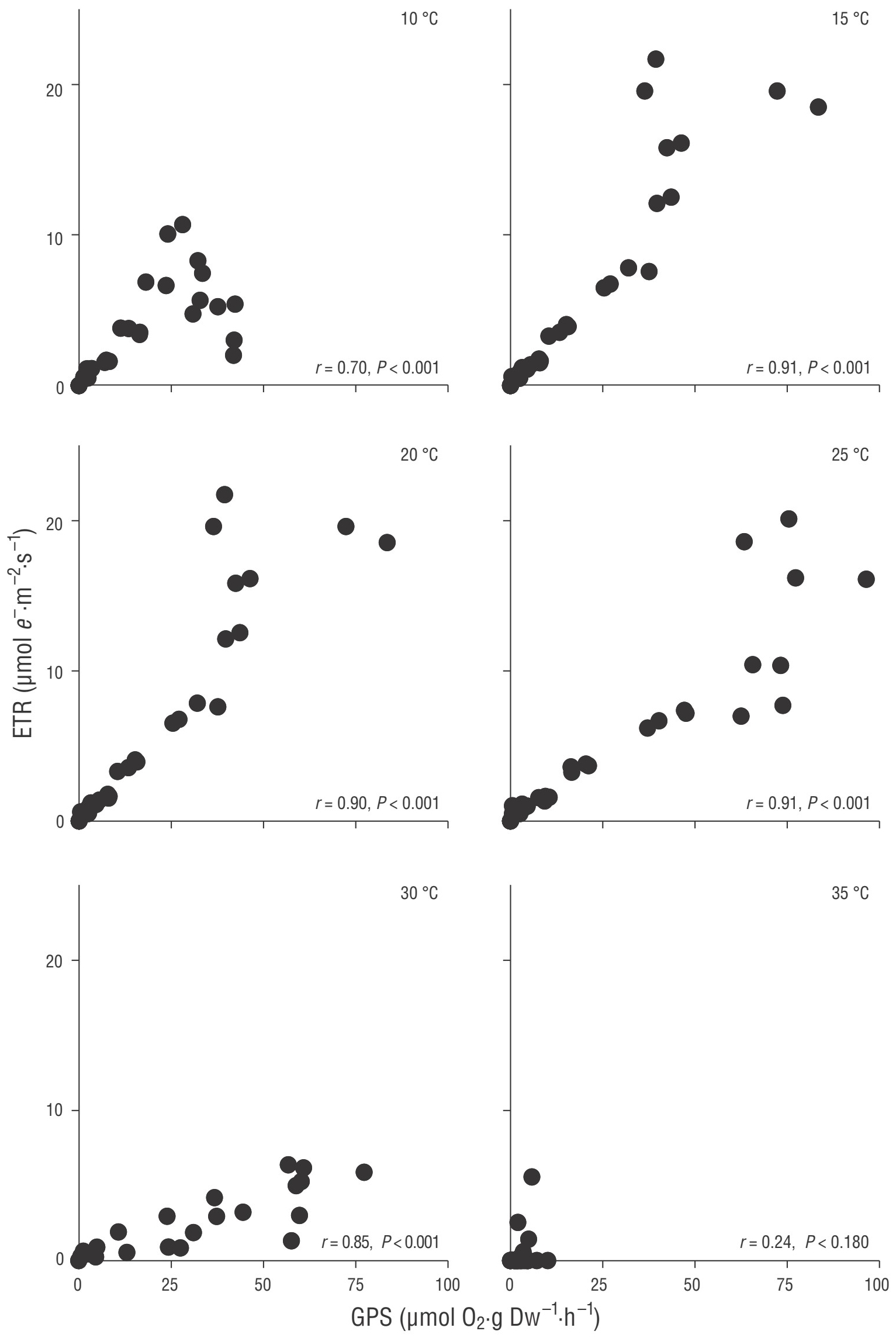
Figura 5 Asociación entre la fotosíntesis bruta (GPS, por sus siglas en inglés) y la tasa de transporte de electrones (ETR, por sus siglas en inglés) en Bossiella orbigniana en función de la temperatura. Los valores de P indican la significancia de las correlaciones de Pearson (n = 32 por tratamiento de temperatura).
DISCUSIÓN
Los resultados de este estudio muestran una fuerte sensibilidad del metabolismo de las algas coralinas a los incrementos de temperatura a corto plazo; al mismo tiempo, estas respuestas difirieron entre las especies. Esto es consistente con estudios previos en otras algas coralinas y carnosas (Newell y Pye 1968, Guy-Haim et al. 2016, Vásquez-Elizondo y Enríquez 2016). La actividad fotosintética óptima y las mayores P:R ocurrieron en un intervalo de temperatura que corresponde al régimen local anual, ~13 °C en invierno y ~22 °C en verano (Peña-Manjarrez 2009). Los valores máximos de la Pmax ocurrieron a mayores temperaturas (25-30 °C), pero las razones P:R y el Fv/Fm se encontraban ya comprometidas, lo que indica que el crecimiento óptimo ocurre a temperaturas más bajas. Las respuestas observadas pueden, además, reflejar la capacidad de la maquinaria metabólica para responder rápidamente a los cambios térmicos sin comprometer el desempeño.
Tanto la fotosíntesis como la respiración son procesos mediados por enzimas que pueden estar limitados por la disponibilidad de sustrato, y sus tasas pueden incrementarse a medida que se incrementa la temperatura dentro de un intervalo óptimo de una manera predecible (i.e., Q10). Este estudio sugiere que la Pmax y la respiración están fuertemente reguladas por la temperatura y se caracterizan, además, por cocientes metabólicos Q10 distintos (ver Newell y Pye 1968). Los mayores valores del Q10, observados en L. aspergillum, pueden indicar una mejor adaptación a las variaciones térmicas ya que también los P:R permanecieron relativamente altos a 25 y 30 °C, mientras que los Q10 más bajos (B. orbigniana y C. officinalis) pueden atribuirse a una limitación de sustrato (Eggert 2012) y/o menor tolerancia térmica. En estas 2 últimas especies, sin embargo, la RD se incrementó más rápido que la Pmax, lo que indica un desbalance entre las ganancias y las pérdidas de carbono a temperaturas elevadas, así como también una producción de ácidos orgánicos y carbohidratos en vez de solo carbohidratos (Guy-Haim et al. 2016). El incremento lineal de la RD sugiere una mayor tolerancia térmica de la maquinaria enzimática respiratoria si se comparara con de los complejos proteicos fotosintéticos y/o a un incremento de dicha actividad como una respuesta frente al estrés (Atkin y Tjoelker 2003, Guy-Haim et al. 2016). No obstante, las tasas fotosintéticas de las algas coralinas no fueron capaces de incrementarse de la misma forma por encima de los 25 °C. En contraste, el decremento de la Pmax en los límites térmicos (10 y 35 °C) corresponde a las regiones subóptimas y subletales de la curva de desempeño, que típicamente están limitadas por la cantidad de enzimas y su actividad (Atkin y Tjoelker 2003, Eggert 2012). Otros procesos, como el fotodaño, pudieron haber sido inducidos a temperaturas elevadas (30 y 35 °C), que ha sido explicado como una respuesta a un incremento del estrés lumínico y que resulta en una fuerte fotoinhibición y pérdida de pigmentación (blanqueamiento) (Martin y Gattuso 2009, Martone et al. 2010, Vásquez-Elizondo y Enríquez 2016). Las irradiancias de saturación también decrecieron a temperaturas altas, lo que corrobora el hecho de que el estrés lumínico juega un papel importante en la disrupción de la fotosíntesis durante el estrés térmico. Las temperaturas de 30-35 °C se encuentran por encima del régimen local; aun así, las algas pueden experimentar estos cambios repentinos en días muy soleados en el intermareal, lo que pudiera explicar el blanqueamiento de otras algas coralinas en temporadas cálidas (Foster et al. 1997, Martone et al. 2010).
Las respuestas específicas observadas son consistentes con la fotoadaptación de las algas: L. aspergillum no sufrió reducciones drásticas en su balance de carbono con los cambios térmicos y presenta una adaptación a alta luz (mayores tasas metabólicas y Ek), mientras que C. officinalis y B. orbigniana presentan una adaptación a baja luz (bajas tasas metabólicas y Ek). Las algas coralinas pertenecen, de acuerdo con su composición de carotenoides, a 2 de los 3 grupos principales de perfiles de carotenoides presentes en algas rojas (grupos de luteína y anteraxantina) que determinan sus mecanismos de fotoprotección. El grupo de la luteína (L. aspergillum) se caracteriza por mecanismos rápidos de regulación a la baja (fotoprotección eficiente), mientras que el grupo de la anteraxantina (B. orbigniana y C. officinalis) se caracterizan por cinéticas lentas del Fv/Fm, no relacionadas a la reparación de la proteina D1 (fotoinhibición) y, aunque eficientes, son de relajación lenta (Schubert y García-Mendoza 2008). Estas diferencias pueden también explicar parte de la variación observada en este estudio. La sensibilidad mayor de las especies adaptadas a baja luz, en comparacion con aquellas adaptadas a alta luz, ya se ha documentado anteriormente. Por ejemplo, un incremento lineal de la Pmax y la respiración fue reportado para especies de algas rojas adaptadas a alta luz y luz moderada, incluidas las algas coralinas (Cabello-Pasini et al. 2003, Vásquez-Elizondo y Enríquez 2016, Borlongan et al. 2017). En contraste, las algas submareales adaptadas a baja luz mostraron una actividad óptima en un intervalo de temperaturas mucho más estrecho (Borlongan et al. 2020). La exposición de plazos más largos a temperaturas elevadas y los escenarios de cambio climático han dado como resultado diversas respuestas en las algas coralinas, pero las respuestas dependen de la aclimatación estacional del alga. Por ejemplo, Ellisolandia elongata y Lithophyllum incrustans incrementaron su fotosíntesis con el incremento de temperatura (+3 °C) en verano y en invierno (Legrand et al. 2018). De manera similar, la fisiología de C. officinalis se incrementó durante el verano en exposiciones a corto plazo (días) a ondas de calor y escenarios de calentamiento global simulados, mientras que las exposiciones más prolongadas tuvieron efectos adversos (Rendina et al. 2019). En otro estudio, la actividad fotosintética de C. officinalis adaptada a alta luz fue insensible a 10 días de exposición a cambios de temperatura de los 20 °C a los 31 °C, pero a temperatura más altas hubo una ruptura de su desempeño (Guy-Haim et al. 2016). A pesar de que las respuestas observadas en el presente estudio pueden ser consistentemente atribuidas a las adaptaciones fisiológicas de las especies, no se puede descartar que las distintas morfologías (y sus limitantes implícitas) pueden tener un impacto importante sobre dichas respuestas, y es algo que necesita ser explorado en estudios a futuro.
En este estudio se encontró una asociación lineal entre la FSB y la TTE a temperaturas óptimas para la fotosíntesis. Este es el primer estudio que combina determinaciones simultaneas de evolución de oxígeno y TTE en función de la temperatura para las algas coralinas. Sin embargo, utilizando una única temperatura de incubación, Sordo et al. (2020) encontraron una fuerte asociación lineal entre la FSB y la TTE relativa del rodolito P. lusitanicum. De manera general, las respuestas de los parámetros derivados de las curvas TTE-irradiancia estuvieron bien relacionados con aquellos derivados de las determinaciones de la evolución de oxígeno, pero los valores máximos de las TTE se desplazaron por 5 °C hacia las temperaturas más bajas en comparación con los parámetros de la evolución de oxígeno. Además, a 35 °C, la señal de la fluorescencia (∆F/Fmʹ ) fue casi indetectable, mientras que la evolución de oxígeno mostraba actividad. En consistencia con este estudio, los resultados de Hofmann et al. (2012) encontraron una discrepancia entre los parámetros derivados de la TTE y la evolución de oxígeno para C. officinalis, pero únicamente bajo estrés de pH. En contraste, se observó una relación constante entre los parámetros de la evolución del oxígeno y la curva TTE-irradiancia en Chondrus crispus, Ulva lactuca y M. pyrifera (Cabello-Pasini et al. 2000, Cabello-Pasini y Figueroa 2005, Colombo‐Pallotta et al. 2006), aunque la temperatura no fue examinada. Además, la linealidad entre la FSB y TTE ocurrió principalmente por debajo de irradiancias de saturación (debajo de los 200 µmol cuantos·m-2·s-1), aunque dependía también de la temperatura. Lo anterior es similar a estudios previos de macroalgas y pastos marinos (ver introducción), aunque también se han reportado excepciones a ello (Franklin y Badger 2001, Carr y Bjork 2003, Colombo‐Pallotta et al. 2006). Teóricamente, la evolución de 1 mol de oxígeno conlleva al flujo de 4 electrones necesarios para la fijación de carbono, y consecuentemente, ocurre una linealidad entre la FSB y la TTE (Edwards y Baker 1993). En la aproximación utilizada en el presente estudio, fue imposible estimar dicha razón, ya que se utilizaron distintas normalizaciones para la FSB y la TTE; por lo tanto, la interpretación se limita a una evaluación cualitativa tanto de la correlación entre FSB y TTE como de sus fuentes de variación. La pérdida de la linealidad bajo saturación de luz (este estudio y otros) ha sido explicada por la presencia de distintos sumideros de electrones que ocurren simultáneamente y que promueven una fotoprotección, como la reacción de Mehler, el transporte de electrones cíclico y la fotorrespiración (Longstaff et al. 2002, Cabello-Pasini y Figueroa 2005). Esto puede ser particularmente importante para las algas rojas que carecen de ciclo de xantofilas como mecanismo de fotoprotección principal (Schubert y García-Mendoza 2008). El incremento en la actividad enzimática relacionada a la asimilación del nitrógeno también ha sido señalado como una fuente de variación en la relación FSB y TTE (Carr y Bjork 2003, Cabello-Pasini y Figueroa 2005). Lo anterior pudo haber ocurrido en periodos de óptimo desempeño en este estudio (20-25 °C) debido a que la adquisición de nutrientes se incrementa en función de la temperatura.
La alta variabilidad observada en la asociación entre la FSB y la TTE bajo saturación de luz puede estar también relacionada a la presencia característica de ficobiliproteínas en algas rojas y cianobacterias (Falkowski y Raven 2007). El movimiento de estos complejos proteicos en las membranas fotosintéticas durante y posterior a la iluminación tiene fuerte consecuencias en la absorción transversal del FSII, que resultan en cambios en la señal de fluorescencia (Schubert et al. 2011). De hecho, la utilidad de la aproximación clásica del Fv/Fm para estimar el transporte de electrones en el alga coralina Neogoniolithon sp. no es apropiada dadas las fuertes discrepancias entre la fluorescencia variable, la disipación no fotoquímica y la evolución de oxígeno, particularmente bajo estrés lumínico (Gefen-Treves et al. 2020). En este estudio, antes de la iluminación, el Fv/Fm había ya disminuido considerablemente a los 30 y 35 °C, reducción típica que precede a un estrés lumínico o una reducción en el tamaño de la antena, condiciones que no ocurrieron en las muestras (adaptadas a oscuridad). Durante la iluminación, la ∆F/Fmʹ se redujo a la mitad de la eficiencia fotoquímica máxima y fue de menos de 0.01 en saturación de luz, lo que resultó en valores de TTE no diferentes de cero. Es probable que el estrés térmico haya activado mecanismos altamente eficientes de disipación de calor, pero se necesita más información relacionada a la dinámica de fluorescencia bajo estrés lumínico y térmico en las algas coralinas para corroborar estas observaciones. Conforme a esto, el uso de la TTE bajo las condiciones descritas no es recomendado, y se deben preferir otros parámetros derivados de la fluorescencia de la clorofila a, como el Fv/Fm o Q (presión sobre el FSII), para estudios ecofisiológicos (Maxwell y Johnson 2000, Schubert et al. 2011). La aproximación experimental utilizada se centra en 2 parámetros útiles en estudios ecofisiológicos de macroalgas; no obstante, se debe tener precaución al interpretarlos utilizando la FSB y la TTE. Inclusive, aún si se encuentra una relación lineal, su incremento no necesariamente indica incremento de biomasa, y en el caso de la TTE, bajo ciertas circunstancias, actividad fotosintética elevada.
AGRADECIMIENTOS
Este estudio fue parcialmente apoyado por una beca posdoctoral a RMVE bajo el programa “Estancias Posdoctorales Nacionales 2019, 2020” del Consejo Nacional de Ciencia y Tecnología (CONACYT, México) (CVU 206050). Se agradece a Raquel Muñiz-Salazar, Juan Manuel Lopez-Vivas y Victor Macías su ayuda en el laboratorio durante el desarrollo de este trabajo.
REFERENCIAS
Atkin, O.K., Tjoelker, M.G. 2003. Thermal acclimation and the dynamic response of plant respiration to temperature. Trends Plant Sci. 8(7):343-351. https://doi.org/10.1016/S1360-1385(03)00136-5 [ Links ]
Beer, S., Axelsson, L. 2004. Limitations in the use of PAM fluorometry for measuring photosynthetic rates of macroalgae at high irradiances. Eur J Phycol. 39(1):1-7. https://doi.org/10.1080/0967026032000157138 [ Links ]
Borlongan, I.A., Gerung, G.S., Kawaguchi, S., Nishihara, G.N., Terada, R. 2017. Thermal and PAR effects on the photosynthesis of Eucheuma denticulatum and Kappaphycus striatus (so-called Sacol strain) cultivated in shallow bottom of Bali, Indonesia. J Appl Phycol. 29:395-404. https://doi.org/10.1007/s10811-016-0956-7 [ Links ]
Borlongan, I.A., Suzuki, S., Nishihara, G.N., Kozono, J., Terada, R. 2020. Effects of light quality and temperature on the photosynthesis and pigment content of a subtidal edible red alga Meristotheca papulosa (Solieriaceae, Gigartinales) from Japan. J Appl Phycol. 32(2):1329-1340. https://doi.org/10.1007/s10811-020-02045-z [ Links ]
Cabello-Pasini, A., Aguirre-von-Wobeser, E., Figueroa, F.L. 2000. Photoinhibition of photosynthesis in Macrocystis pyrifera (Phaeophyceae), Chondrus crispus (Rhodophyceae) and Ulva lactuca (Chlorophyceae) in outdoor culture systems. J Photochem Photobiol B. 57(2-3):169-178. https://doi.org/10.1016/S1011-1344(00)00095-6 [ Links ]
Cabello-Pasini, A., Figueroa, F.L. 2005. Effect of nitrate concentration on the relationship between photosynthetic oxygen evolution and electron transport rate in Ulva rigida (Chlorophyta). J Phycol. 41(6):1169-1177. https://doi.org/10.1111/j.1529-8817.2005.00144.x [ Links ]
Cabello-Pasini, A., Muñiz-Salazar, R., Ward, D.H. 2004. Caracterización bioquímica del pasto marino Zostera marina en el límite sur de su distribución en el Pacífico Norte = Biochemical characterization of the eelgrass Zostera marina at its southern distribution limit in the North Pacific. Cienc Mar. 30(1A):21-34. https://doi.org/10.7773/cm.v30i11.123 [ Links ]
Cabello-Pasini, A., Zertuche-González, J.A., Pacheco-Ruíz, I. 2003. Photosynthesis, growth and nitrogen uptake of competing marine macrophytes in the Gulf of California. Bot Mar. 46(6). https://doi.org/10.1515/BOT.2003.052 [ Links ]
Carr, H., Bjork, M. 2003. A methodological comparison of photosynthetic oxygen evolution and estimated electron transport rate in tropical Ulva (Chlorophyceae) species under different light and inorganic carbon conditions. J Phycol. 39(6):1125-1131. https://doi.org/10.1111/j.0022-3646.2003.02-077.x [ Links ]
Chisholm, J.R.M. 2000. Calcification by crustose coralline algae on the northern Great Barrier Reef, Australia. Limnol Oceanogr. 45(7):1476-1484. https://doi.org/10.4319/lo.2000.45.7.1476 [ Links ]
Colombo‐Pallotta, M.F., García‐Mendoza, E., Ladah, L.B. 2006. Photosynthetic performance, light absorption, and pigment composition of Macrocystis pyrifera (Laminariales, Phaeophyceae) blades from different depths. J Phycol. 42(6):1225-1234. https://doi.org/10.1111/j.1529-8817.2006.00287.x [ Links ]
Díaz-Pulido, G., Anthony, K.R.N., Kline, D.I., Dove, S., Hoegh-Guldberg, O. 2012. Interactions between ocean acidification and warming on the mortality and dissolution of coralline algae. J Phycol. 48(1):32-39. https://doi.org/10.1111/j.1529-8817.2011.01084.x [ Links ]
Edwards, G.E., Baker, N.R. 1993. Can CO2 assimilation in maize leaves be predicted accurately from chlorophyll fluorescence analysis? Photosynth Res. 37:89-102. https://doi.org/10.1007/bf02187468 [ Links ]
Eggert, A. 2012. Seaweed Responses to Temperature. In: Wiencke, C., Bischof, K. (eds.), Seaweed Biology: Novel Insights into Ecophysiology, Ecology and Utilization. Berlin, Heidelberg (Germany): Springer. 47-66. https://doi.org/10.1007/978-3-642-28451-9_3 [ Links ]
Falkowski, P.G., Raven, J.A. 2007. Aquatic Photosynthesis. United States of America: Princeton University Press. 512 p. [ Links ]
Figueroa, F.L., Conde-Álvarez, R., Gómez, I. 2003. Relations between electron transport rates determined by pulse amplitude modulated chlorophyll fluorescence and oxygen evolution in macroalgae under different light conditions. Photosynth Res. 75:259-275. https://doi.org/10.1023/A:1023936313544 [ Links ]
Foster, M.S. 2001. Rhodoliths: between rocks and soft places. J Phycol. 37(5):659-667. https://doi.org/10.1046/j.1529-8817.2001.00195.x [ Links ]
Foster, M.S., Riosmena-Rodríguez, R., Steller, D.L., Woelkerling, W.J. 1997. Living rhodoliths beds in the Gulf of California and their implications for paleoenvironmental interpretation. Spec Pap Geol Soc Am. 318:127-139. https://doi.org/10.1130/0-8137-2318-3.127 [ Links ]
Franklin, L.A., Badger, M.R. 2001. A comparison of photosynthetic electron transport rates in macroalgae measured by pulse amplitude modulated chlorophyll fluorometry and mass spectrometry. J Phycol. 37(5):756-767. https://doi.org/10.1046/j.1529-8817.2001.00156.x [ Links ]
Gefen-Treves, S., Kedem, I., Weiss, G., Wagner, D., Tchernov, D., Kaplan, A. 2020. Acclimation of a rocky shore algal reef builder Neogoniolithon sp. to changing illuminations. Limnol Oceanogr. 65(1):27-36. https://doi.org/10.1002/lno.11245 [ Links ]
Guy-Haim, T., Silverman, J., Raddatz, S., Wahl, M., Israel, A., Rilov, G. 2016. The carbon turnover response to thermal stress of a dominant coralline alga on the fast warming Levant coast. Limnol Oceanogr. 61(3):1120-1133. https://doi.org/10.1002/lno.10279 [ Links ]
Hofmann, L.C., Yildiz, G., Hanelt, D., Bischof, K. 2012. Physiological responses of the calcifying rhodophyte, Corallina officinalis (L.), to future CO2 levels. Mar Biol. 159(4):783-792. https://doi.org/10.1007/s00227-011-1854-9 [ Links ]
Jernakoff, P., Phillips, B.F., Fitzpatrick, J.J. 1993. The diet of post-puerulus western rock lobster, Panulirus cygnus George, at Seven Mile Beach, Western Australia. Aust J Mar Fresh Res. 44(4):649-655. https://doi.org/10.1071/MF9930649 [ Links ]
Legrand, E., Riera, P., Bohner, O., Coudret, J., Schlicklin, F., Derrien, M., Martin, S. 2018. Impact of ocean acidification and warming on the productivity of a rock pool community. Mar Environ Res. 136:78-88. https://doi.org/10.1016/j.marenvres.2018.02.010 [ Links ]
Linnane, A., Ball, B., Munday, B., Mercer, J.P. 2000. On the occurrence of juvenile lobster Homarus gammarus in intertidal habitat. J Mar Biol Assoc UK. 80(2):375-376. https://doi.org/10.1017/S0025315499002039 [ Links ]
Longstaff, B.J., Kildea, T., Runcie, J.W., Cheshire, A., Dennison, W.C., Hurd, C., Kana, T., Raven, J.A., Lurkum, A.W.D. 2002. An in situ study of photosynthetic oxygen exchange and electron transport rate in the marine macroalga Ulva lactuca (Chlorophyta). Photosynth Res. 74(3):281-293. https://doi.org/10.1023/a:1021279627409 [ Links ]
Martin, S., Castets, M.D., Clavier, J. 2006. Primary production, respiration and calcification of the temperate free-living coralline alga Lithothamnion corallioides. Aquat Bot. 85(2):121-128. https://doi.org/10.1016/j.aquabot.2006.02.005 [ Links ]
Martin, S., Gattuso, J.-P. 2009. Response of Mediterranean coralline algae to ocean acidification and elevated temperature. Glob Change Biol. 15(8):2089-2100. https://doi.org/10.1111/j.1365-2486.2009.01874.x [ Links ]
Martone, P.T., Alyono, M., Stites, S. 2010. Bleaching of an intertidal coralline alga: untangling the effects of light, temperature, and desiccation. Mar Ecol Prog Ser. 416:57-67. https://doi.org/10.3354/meps08782 [ Links ]
Maxwell, K., Johnson, G.N. 2000. Chlorophyll fluorescence-a practical guide. J Exp Bot. 51(345):659-668. https://doi.org/10.1093/jexbot/51.345.659 [ Links ]
Newell, R.C., Pye, V.I. 1968. Seasonal variations in the effect of temperature on the respiration of certain intertidal algae. J Mar Biol Assoc UK. 48(2):341-348. https://doi.org/10.1017/s0025315400034536 [ Links ]
Orzymski, J., Johnsen, G., Sakshaug, E. 1997. The significance of intracellular self-shading on the biooptical properties of brown, red, and green macroalgae. J Phycol. 33(3):408-414. https://doi.org/10.1111/j.0022-3646.1997.00408.x [ Links ]
Peña-Manjarrez, J.L., Gaxiola-Castro, G., Helenes-Escamilla, J. 2009. Environmental factors influencing the variability of Lingulodinium polyedrum and Scrippsiella trochoidea (Dinophyceae) cyst production = Factores ambientales que influyen en la variabilidad de la producción de quistes de Lingulodinium polyedrum y Scrippsiella trochoidea (Dinophyceae). Cienc Mar. 35(1):1-14. https://doi.org/10.7773/cm.v35i1.1406 [ Links ]
Rendina, F., Bouchet, P.J., Appolloni, L., Russo, G.F., Sandulli, R., Kolzenburg, R., Putra, A., Ragazzola, F. 2019. Physiological response of the coralline alga Corallina officinalis L. to both predicted long-term increases in temperature and short-term heatwave events. Mar Environ Res. 150:104764. https://doi.org/10.1016/j.marenvres.2019.104764 [ Links ]
Schreiber, U. 2004. Pulse-Amplitude-Modulation (PAM) fluorometry and saturation pulse method: An overview. In: Papageorgiou, G.C., Govindjee (eds.), Chlorophyll a Fluorescence. Advances in Photosynthesis and Respiration Vol. 19. Dordrecht (Netherlands): Springer Netherlands. 279-319. https://doi.org/10.1007/978-1-4020-3218-9_11 [ Links ]
Schubert, N., García-Mendoza, E. 2008. Photoinhibition in red algal species with different carotenoid profiles. J Phycol. 44(6):1437-1446. https://doi.org/10.1111/j.1529-8817.2008.00590.x [ Links ]
Schubert, N., García-Mendoza, E., Enríquez, S. 2011. Is the photo-acclimatory response of Rhodophyta conditioned by the species carotenoid profile? Limnol Oceanogr. 56(6):2347-2361. https//doi.org/10.4319/lo.2011.56.6.2347 [ Links ]
Sordo, L., Santos, R., Barrote, I., Freitas, C., Silva, J. 2020. Seasonal photosynthesis, respiration, and calcification of a temperate maërl bed in southern Portugal. Front Mar Sci. 7:136. https://doi.org/10.3389/fmars.2020.00136 [ Links ]
Steller, D.L., Riosmena-Rodríguez, R., Foster, M.S., Roberts, C.A. 2003. Rhodolith bed diversity in the Gulf of California: the importance of rhodolith structure and consequences of disturbance. Aquatic Conserv: Mar Freshw Ecosyst. 13(S1):S5-S20. https://doi.org/10.1002/aqc.564 [ Links ]
Vásquez-Elizondo, R.M., Legaria-Moreno, L., Perez-Castro, M.Á., Krämer, W.E., Scheufen, T., Iglesias-Prieto, R., Enriquez, S. 2017. Absorptance determinations on multicellular tissues. Photosynth Res. 132:311-324. https://doi.org/10.1007/s11120-017-0395-6 [ Links ]
Vásquez-Elizondo, R.M., Enríquez, S. 2016. Coralline algal physiology is more adversely affected by elevated temperature than reduced pH. Sci Rep. 6:19030. https://doi.org/10.1038/srep19030 [ Links ]
Vásquez-Elizondo, R.M., Enríquez, S. 2017. Light absorption in coralline algae (Rhodophyta): A morphological and functional approach to understanding species distribution in a coral reef lagoon. Front Mar Sci. 4:297. https://doi.org/10.3389/fmars.2017.00297 [ Links ]
Webster, N.S., Soo, R., Cobb, R., Negri, A.P. 2011. Elevated seawater temperature causes a microbial shift on crustose coralline algae with implications for the recruitment of coral larvae. ISME J. 5:759-770. https://doi.org/10.1038/ismej.2010.152 [ Links ]
Williamson, C.J., Perkins, R., Voller, M., Yallop, M.L., Brodie, J. 2017. The regulation of coralline algal physiology, an IN SITU study of Corallina officinalis (Corallinales, Rhodophyta). Biogeosciences. 14(19):4485-4498. https://doi.org/10.5194/bg-14-4485-2017 [ Links ]
Recibido: 12 de Marzo de 2021; Aprobado: 28 de Agosto de 2021











 texto em
texto em 



