Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.47 no.3 Ensenada Jul./Set. 2021 Epub 09-Dez-2022
https://doi.org/10.7773/cm.v47i3.3212
Artículos
Identificación de bacterias patógenas en peces capturados en el Pacífico frente a Nicaragua
1Centro Veterinario de Diagnóstico e Investigación, Departamento de Veterinaria y Zootecnia, Escuela de Ciencias Agrarias y Veterinarias, Universidad Nacional Autónoma de Nicaragua-León, Carretera a La Ceiba 1 km al Este, León, Nicaragua.
2Departamento Acuícola, Escuela de Ciencias Agrarias y Veterinarias, Universidad Nacional Autónoma de Nicaragua-León, Carretera a La Ceiba 1 km al Este, León, Nicaragua.
3Catalan Institute for Water Research, Girona, 17003, Spain.
El objetivo de este estudio fue identificar bacterias patógenas en peces procedentes de 4 comunidades en la costa del Pacífico en el occidente de Nicaragua. Se recolectaron 62 peces para realizar el análisis microbiológico a partir de muestras de músculo, las cuales fueron inoculadas en agar tiosulfato citrato bilis sacarosa y agar tripticasa de soja. La identificación bacteriana se realizó mediante pruebas bioquímicas y de tolerancia a diferentes concentraciones de NaCl, y para determinar la resistencia bacteriana, se empleó el método Kirby-Bauer. Los resultados mostraron presencia de Vibrio metschnikovii en un 30.64% (IC 95%: 18.36-42.92) de las muestras de peces, mientras que Salinivibrio costicola fue detectada en un 22.58% (IC 95%: 11.37-33.79) de las muestras. Staphylococcus coagulasa negativa (SCN) fue detectada en un 82.30% (IC 95%: 71.94-92.57) de las muestras. Especies del género Vibrio fueron detectadas a una concentración de 3.9 × 103 UFC·g-1 en las muestras de peces de la comunidad Las Peñitas y de 2.52 × 103 UFC·g-1 en las de Poneloya, y estos valores fueron significativamente mayores (P = 0.003) que aquellos encontrados para las muestras de El Tránsito (5.25 × 102 UFC·g-1). Además, el 100% de las cepas de V. metschnikovii y S. costicola fueron resistentes a amoxicilina/ácido clavulánico y sensibles a ciprofloxacina. La carga bacteriana de S. costicola es propia de ambientes marinos y no representa riesgo sanitario. Sin embargo, V. metschnikovii puede estar presente en el pescado crudo y, por lo tanto, representa un peligro para la salud pública, así como también lo es SCN, que es un indicador de contaminación antropogénica.
Palabras clave: peces; Vibrio; Nicaragua; Staphylococcus
The aim of this study was to identify pathogenic bacteria in fishes from 4 communities on the western Pacific coast of Nicaragua. A total of 62 fishes were collected for microbiological analysis using muscle samples, which were inoculated on thiosulfate-citrate-bile salts-sucrose agar and trypticase soy agar. Bacterial identification was carried out by biochemical tests and tests of tolerance to different NaCl concentrations, and the Kirby-Bauer method was used to determine the bacterial resistance. The results revealed the presence of Vibrio metschnikovii in 30.64% (95% CI: 18.36-42.92) of the fish samples, while Salinivibrio costicola was detected in 22.58% (95% CI: 11.37-33.79) of the samples. Coagulase-negative staphylococci (CoNS) were detected in 82.30% (95% CI: 71.94-92.57) of the samples. Species of the genus Vibrio were detected at a concentration of 3.9 × 103 CFU·g-1 in fish samples from the Las Peñitas community and 2.52 × 103 CFU·g-1 in samples from Poneloya, and these values were significantly higher (P = 0.003) than those found for samples from El Tránsito (5.25 × 102 CFU·g-1). Furthermore, 100% of the V. metschnikovii and S. costicola strains were resistant to amoxicillin/clavulanic acid and sensitive to ciprofloxacin. The bacterial load for S. costicola is typical of marine environments and does not represent a health hazard. However, V. metschnikovii can be present in raw fish and it therefore represents a public health hazard, as do CoNS, which are indicators of anthropogenic contamination.
Key words: fish; Vibrio; Nicaragua; Staphylococcus
Introducción
Nicaragua posee amplias costas del lado del océano Pacífico (410 km) y del lado del mar Caribe (530 km), las cuales son aprovechadas para la pesca y la acuicultura, con un aporte significativo a la economía nacional (ProNicaragua 2019). La actividad pesquera en Nicaragua no solo aporta a la seguridad alimentaria de la población al aumentar el abastecimiento de alimentos y, por tanto, proveer proteína animal y otros nutrientes, sino que también genera empleos e ingresos para satisfacer otras necesidades (FAO 2014). La pesca a pequeña escala en el lado del Pacífico del país se ha concentrado en la captura de pargos (Lutjanus spp.), meros (Epinephelus striatus), lisas (Mugil spp.), palometas (Brama brama) y corvinas (Cynoscion spp.) (FAO 2018). No obstante, la intensificación de la actividad pesquera se ha visto acompañada del aumento de enfermedades emergentes y reemergentes (Ghaly et al. 2010).
Los peces de las especies Lutjanus guttatus o Mugil cephalus capturados del medio natural pueden albergar bacterias patógenas, tales como Aeromonas spp., Vibrio cholerae, Vibrio parahaemolyticus y Vibrio vulnificus (Gomez-Gil et al. 2007, Hassen et al. 2020), por lo que podrían ser considerados un reservorio o un vehículo de infecciones transmitidas por los alimentos y, por consiguiente, una amenaza para la salud pública (Bonnin-Jusserand et al. 2019). Además, los peces capturados en aguas poco profundas adyacentes a las zonas costeras, donde las aguas marinas y dulces coinciden, pueden estar infectados por bacterias de procedencia humana, como Salmonella spp., Listeria monocytogenes y Staphylococcus aureus (Feliatra et al. 2020).
Las bacterias del género Staphylococcus pueden ser transmitidas por los peces, pero a diferencia del género Vibrio, no son propias del ambiente marino, por lo que no se consideran autóctonas (Romero-Jarero y Negrete- Redondo 2011). Además, las especies del género Vibrio como V. cholerae y V. parahaemolyticus, presentes en ecosistemas acuáticos, son causantes de infecciones del tracto gastrointestinal en humanos con alta resistencia a los antibióticos (Bonnin-Jusserand et al. 2019). En los peces también se han identificado bacterias como Escherichia coli, Enterobacter cloacae, Citrobacter spp., Salmonella Paratyphi A y B, Salmonella Enteritidis, Clostridium botulinum, Enterobacter spp., Serratia ssp., Enterococcus faecalis y Staphylococcus epidermidis (Romero-Jarero y Negrete-Redondo 2011).
En Nicaragua no existen estudios microbiológicos en peces marinos. Por ello, el objetivo de este estudio fue identificar Vibrio spp. y otras bacterias patógenas en peces procedentes de 4 comunidades en la costa del Pacífico de Nicaragua. Este es el primer estudio que describe la frecuencia de bacterias en peces procedentes de la pesca artesanal en Nicaragua.
Materiales y métodos
Muestreo
El estudio se realizó en 4 comunidades pesqueras (El Tránsito: 12º04′24′′ N, 86º72′21′′ W; Las Peñitas: 12º34′28′′ N, 87º02′38′′ W; Poneloya: 12º37′10′′ N, 87º06′00′′ W; Jiquilillo: 12º72′48′′ N, 87º45′86′′ W) en la costa del Pacífico de Nicaragua, de octubre a noviembre de 2019. Se analizaron 62 muestras, las cuales fueron distribuidas en proporción a la cantidad de peces capturados por comunidad, de forma que se incluyeron 31 peces de la comunidad Jiquilillo, 13 peces de El Tránsito, 10 peces de Las Peñitas y 8 peces de Poneloya (Fig. 1). Las especies de peces analizadas fueron Lutjanus colorado (n = 18), Caranx latus (n = 14), M. cephalus (n = 13), B. brama (n = 9) y Pomadasys spp. (n = 8).
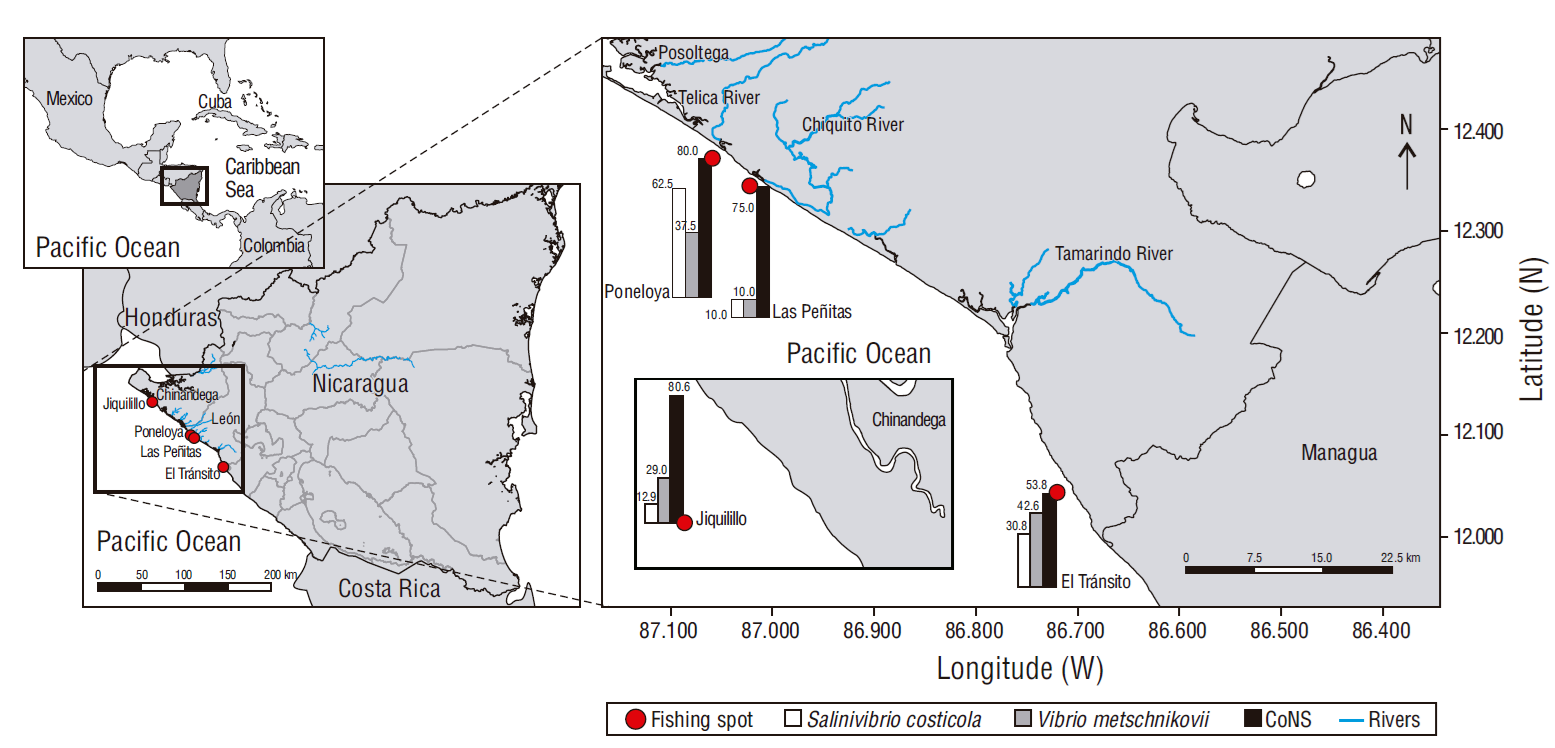
Figura 1 Frecuencia relativa de bacterias aisladas en los peces capturados en el Pacífico frente a Nicaragua. CoNC, Staphylococcus coagulasa negativa.
Se realizó una examinación externa de los peces en busca de lesiones macroscópicas como hemorragias en la piel, aletas y branquias; úlceras; ampollas; y descamaciones. Se recolectó información de variables como especie del pez, hora de captura (datos proporcionados por el pescador), procedencia (coordenadas) y peso. Las muestras se introdujeron individualmente en bolsas plásticas estériles sin ningún aditivo y fueron transportadas en una nevera portátil con refrigerante a una temperatura de entre 4 y 8 ºC para ser procesados inmediatamente (en un tiempo menor que 1 h) en el Laboratorio de Microbiología Veterinaria del Centro Veterinario de Diagnóstico e Investigación, Escuela de Ciencias Agrarias y Veterinarias, Universidad Nacional Autónoma de Nicaragua, León.
Análisis bacteriológico
Determinación de la carga de Vibrio
Se limpió la superficie de los peces con alcohol al 95%, y se realizó la necropsia con la ayuda de un bisturí estéril. Se pesó asépticamente 1 g de porción del músculo de la parte dorsal, el cual fue homogenizado con 9 mL de agua de peptona estéril (APE) con ayuda de un mortero (esterilizado previamente a 160 ºC durante 1 h) y un mezclador vórtex (Fisherbrand; Waltham, MA, EUA) durante 2 min. Inmediatamente después, se realizaron diluciones seriadas de base 10 a partir de la primera mezcla, añadiendo 9 mL de APE más 1 mL de la mezcla anterior, de tal forma que se obtuvieron las diluciones 1:10, 1:100 y 1:1,000. Luego, a volumen de 100 µL, cada dilución fue sembrada en placas de agar tiosulfato citrato bilis sacarosa (TCBS) por dispersión, las cuales fueron incubadas a 33 ºC durante 24 h.
Las bacterias del género Vibrio fueron identificadas a nivel de especie de acuerdo con la morfología de las colonias en agar TCBS (color, tamaño y bordes), la tinción de Gram, la prueba de oxidasa, la tolerancia a concentraciones de NaCl (0%, 3%, 8% y 14% de NaCl) y las pruebas bioquímicas con el kit comercial API 20E (bioMérieux, Francia).
Aislamiento de otras bacterias
Para el aislamiento de bacterias no pertenecientes al género Vibrio, las diluciones seriadas fueron sembradas en placas de agar tripticasa de soja. La identificación de Staphylococcus se realizó con base en la morfología de las colonias y la presencia de hemólisis en agar sangre al 5%, tinción de Gram y las enzimas coagulasa y DNasa.
Prueba de sensibilidad a antibióticos
Los perfiles de resistencias para Vibrio fueron determinados por el método de difusión en agar, o Kirby-Bauer, de acuerdo con el protocolo establecido por el Clinical Laboratory Standards Institute (Uddin et al. 2018). Para ello, se preparó una suspensión bacteriana a una concentración de 0.5 en escala de McFarland, la cual luego fue inoculada en placas de agar Mueller Hinton con ayuda de un hisopo estéril. Después de 5 min, se colocaron en las superficies de agar los discos impregnados con los siguientes antibióticos: tetraciclina, ciprofloxacina, amoxicilina/ácido clavulánico, ampicilina y cloranfenicol. Las placas fueron incubadas a 37 ºC durante 18-24 h; los halos de inhibición fueron medidos; y los resultados se registraron como resistente, intermedio y sensible (véase Carpenter et al. 2018).
Análisis estadístico
Se aplicó la prueba de Fisher para comparar la presencia de bacterias respecto a las comunidades muestreadas y las especies de peces. Para las cargas bacterianas, se aplicó el análisis de varianza (ANDEVA) de un factor, bajo el supuesto de distribución normal de los datos según la prueba de Shapiro-Wilk. Todos los datos fueron registrados, almacenados y analizados en SPSS v.21.
Resultados
Se aislaron bacterias con colonias amarillas en TCBS, con un diámetro de 2-3 mm, bacilos Gram negativos y crecimiento negativo en concentraciones de NaCl al 0% (p/v) y positivo en concentraciones de NaCl al 3%, 8% y 14%. Las pruebas de oxidasa, indol, citrato, hidrólisis de H2S, arginina dihidrolasa, lisina descarboxilasa, ornitina descarboxilasa, hidrólisis de urea, arabinosa y producción de gas fueron negativas, mientras que las pruebas de motilidad, Voges-Proskauer, glucosa, inositol, lactosa, manitol, sorbitol y sacarosa fueron positivas; estas reacciones fueron compatibles con Vibrio metschnikovii, que se encontró en un 30.64% (IC 95%: 18.36-42.92) de las muestras de peces analizadas. Además, se aislaron bacterias con colonias verdes en TCBS, con un diámetro de 2-3 mm, bacilos Gram negativos, y crecimiento negativo en concentraciones de NaCl al 0% y 3% y positivo al 8% y 14%. En este caso, las pruebas indol, citrato, hidrólisis de H2S, arginina dihidrolasa, lisina descarboxilasa, lactosa, inositol, sorbitol, ornitina descarboxilasa, hidrólisis de urea, arabinosa y producción de gas fueron negativas, mientras que las pruebas de motilidad, Voges-Proskauer, glucosa, manitol y sacarosa fueron positivas; estas reacciones mostraron compatibilidad con Salinivibrio costicola, la cual se encontró en un 22.58% (IC 95%: 11.37-33.79) de las muestras de peces analizadas. Se aislaron bacterias cocos Gram positivo, coagulasa negativa, catalasa positiva y DNasa negativa, las cuales fueron compatibles con Staphylococcus coagulasa negativa (SCN) en el 82.30% (IC 95%: 71.94-92.57) de las muestras.
En 5/62 muestras se encontraron coinfecciones de V. metschnikovii, S. costicola y SCN; en 2/14 muestras se encontró exclusivamente S. costicolas; y en 33/52 muestras se aisló solamente SCN (Fig. 2).
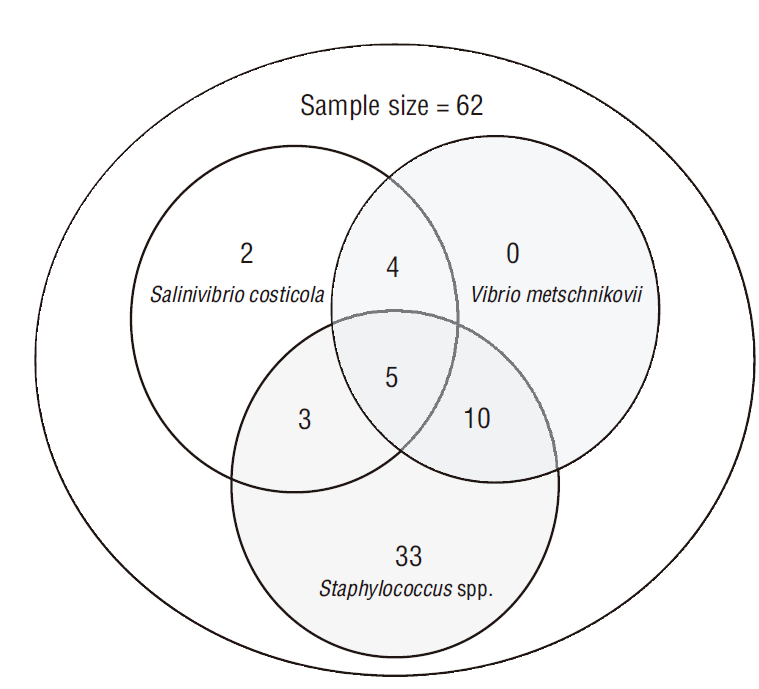
Figura 2 Coinfecciones bacterianas encontradas en los peces capturados en el Pacífico frente a Nicaragua.
Se observó diferencia significativa (χ2, P = 0.032) en el aislamiento de Vibrio spp. de los músculos de peces procedentes de las diferentes comunidades. Las frecuencias de muestras positivas fueron mayores en las comunidades de Poneloya (5/8) y El Tránsito (8/13) y menores en las comunidades de Las Peñitas (1/10) y Jiquilillo (10/31) (Fig. 1).
El porcentaje positivo a V. metschnikovii fue similar entre las especies de peces analizados (χ2, P ≥ 0.05), ya que el porcentaje más bajo se encontró en C. latus (7.10%) y el más alto en Pomadasys spp. (50.00%). Además, el porcentaje positivo a S. costicola no mostró diferencias significativas entre las especies de peces (χ2, P ≥ 0.05), con frecuencias desde un 16.70% en L. colorado hasta un 35.80% en M. cephalus. El aislamiento de SCN también fue similar entre las especies de peces (χ2, P ≥ 0.05), con frecuencias desde un 61.50% en M. cephalus hasta un 94.40% en L. colorado.
La carga bacteriana para S. costicola fue de 1.58 × 103 UFC·g-1 en las muestras de peces analizadas de la comunidad de Poneloya. Sin embargo, no se observó diferencia significativa respecto a la carga en las muestras de peces de las demás comunidades (ANDEVA, P = 0.075). La carga de V. metschnikovii fue de 3.50 × 103 UFC·g-1 en las muestras de Las Peñitas y 1.57 × 103 UFC·g-1 en las de Poneloya, mientras que en las muestras de Jiquilillo la carga promedio fue de 7.78 × 102 UFC·g-1 y en las de El Tránsito 5.50 × 102 UFC·g-1 (ANDEVA, P = 0.024). La carga de Vibro, independientemente de la especie, fue de 3.90 × 103 UFC·g-1 en las muestras de Las Peñitas, 2.52 × 103 UFC·g-1 en las de Poneloya, 9.30 × 102 UFC·g-1 en las de Jiquilillo y 5.25 × 102 UFC·g-1 en El Tránsito (ANDEVA, P = 0.003) (Tabla 1).
Tabla 1 Carga bacteriana para las diferentes especies de Vibrio en los peces de las comunidades estudiadas.
| Vibrio species | Communities | N | Mean load (CFU·g-1) | Standard deviation | P value* |
| Salinivibrio costicola | El Tránsito | 4 | 2.25 × 102 | 1.89 × 102 | 0.075 |
| Jiquilillo | 4 | 5.75 × 102 | 4.57 × 102 | ||
| Las Peñitas | 1 | 4.00 × 102 | - | ||
| Poneloya | 5 | 1.58 × 103 | 1.03 × 103 | ||
| Vibrio metschnikovii | El Tránsito | 6 | 5.50 × 102 | 4.59 × 102 | 0.024 |
| Jiquilillo | 9 | 7.78 × 102 | 7.52 × 102 | ||
| Las Peñitas | 1 | 3.50 × 103 | - | ||
| Poneloya | 3 | 1.57 × 103 | 1.58 × 103 | ||
| Vibrio spp. | El Tránsito | 8 | 5.25 × 102 | 5.94 × 102 | 0.003 |
| Jiquilillo | 10 | 9.30 × 102 | 6.66 × 102 | ||
| Las Peñitas | 1 | 3.90 × 103 | - | ||
| Poneloya | 5 | 2.52 × 103 | 1.86 × 103 |
*According to the ANOVA test
Respecto a lesiones macroscópicas, solo se pudo evidenciar la presencia de ampollas en el opérculo en un 9.70% (6/62) de los peces. La bacteria S. costicola se aisló en 4 de 6 peces con ampollas y en 10 de 56 peces sin ampollas (χ2, P = 0.020). La bacteria V. metschnikovii fue aislada en 2 de 6 peces con ampollas y en 17 de 56 de los peces sin ampollas (χ2, P = 0.603). El 82.30% (51/62) del total de las muestras presentó crecimiento de SCN. Esta bacteria se aisló en el 89.28% (50/56) de los peces sin ampolla, y su aislamiento fue significativamente menor (χ2, P ˂ 0.01) en peces con ampolla, ya que solo se encontró en el 16.66% de estos (1/6).
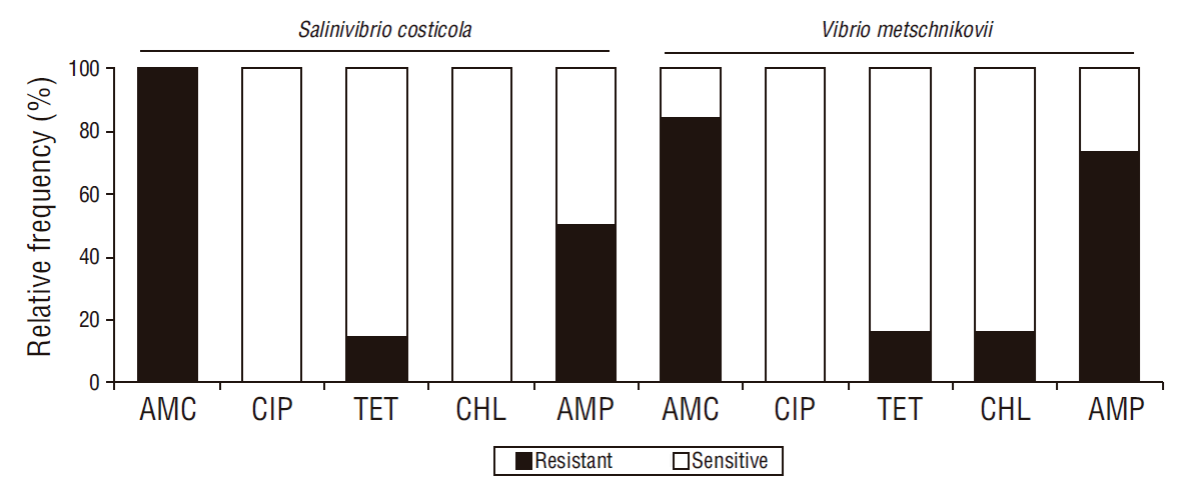
Respecto a la resistencia a los antibióticos, el 100% (14/14) de las cepas de S. costicola presentaron resistencia a amoxicilina/ácido clavulánico, pero fueron sensibles a ciprofloxacina y cloranfenicol. Por otro lado, el 100% (19/19) de los aislados de V. metschnikovii fueron resistentes a amoxicilina/ácido clavulánico y sensibles a ciprofloxacina, y solo el 84.21% (16/19) mostraron sensibilidad a cloranfenicol (Fig. 3).
Discusión
En este estudio, las especies de la familia Vibrionaceae encontradas en peces capturados frente a la costa del Pacífico de Nicaragua fueron S. costicola y V. metschnikovii. Salinivibrio costicola es propia de ambientes marinos, con poca probabilidad de afecciones clínicas en humanos por ingesta; sin embargo, V. metschnikovii debe considerarse importante al investigar enfermedades transmitidas por alimentos relacionadas con el consumo de pescados y mariscos crudos o poco cocidos (Matté et al. 2007). Se ha encontrado V. metschnikovii en una variedad de alimentos marinos (Nsofor et al. 2014), y se considera un riesgo para la salud humana, con factores de virulencia como hemolisinas y verotoxinas (Austin 2010). Además, existen informes de casos asociados a infecciones de heridas, principalmente en pacientes expuestos al ambiente marino, lo que sugiere que V. metschnikovii podría tener potencial zoonótico (Linde et al. 2004). También se reportó un caso de choque séptico severo y paro cardíaco en un paciente con V. metschnikovii (Jensen y Jellinge 2014). La vibriosis en sí es una enfermedad que se ha esparcido mundialmente en peces, y ha afectado a peces de cultivo cuando hay presencia de estrés (Martínez-Díaz y Anguas-Vélez 2002).
En este estudio, la presencia de Vibrio se detectó en un 38.71% del total de muestras, un porcentaje moderado cuando se compara con otros estudios. Por ejemplo, en un estudio realizado en Venezuela se aisló Vibrio spp. a partir de lisas y de tilapias y se obtuvo un porcentaje total de 38.90% para V. parahaemolitycus y de 33.30% para V. cholerae (Arévalo et al. 2003). Sin embargo, en otro estudio realizado en Lima (Perú) solamente se reportó un 5.90% después del aislamiento de V. parahaemolyticus en 120 muestras de peces (Aliaga et al. 2010).
En el presente estudio, la frecuencia de muestras positivas a Vibrio fue mayor para peces de la comunidad de Poneloya, aunque la carga bacteriana fue más elevada en las muestras de Las Peñitas y Poneloya. Estas 2 comunidades se encuentran cercanas a León, una ciudad con afluencia turística; además, en ambas, la zona de pesca está próxima a estuarios, con la desembocadura del río Chiquito en Las Peñitas y la del río Telica en Poneloya. En un estudio realizado en Chile se encontró que estos factores pueden influir en la carga bacteriana en los peces, ya que el 80.00% de las descargas de los ríos en los sistemas de esteros estaban contaminados debido a la mala manipulación de desechos farmacéuticos, domésticos e industriales, los cuales influyen en el hábitat y la proliferación de agentes patógenos (Escobar 2002).
Al analizar las lesiones macroscópicas, solo el 9.70% de los peces presentaron ampollas. La presencia de este tipo de lesiones se ha asociado con la presencia y la carga bacteriana de Vibrio spp. que pueden causar infecciones en los organismos acuáticos de importancia comercial (Leyton y Riquelme 2008). En este estudio no se encontró asociación entre la presencia de lesiones macroscópicas y el aislamiento de Vibrio. Esto se puede deber a que, aunque muchas especies pertenecientes al género Vibrio están presentes en todas partes del medio marino e inducen enfermedades en peces marinos, los brotes de enfermedades solo ocurren cuando los peces están estresados, por lo que es más probable observar esta asociación en peces cultivados que en aquellos obtenidos de la pesca artesanal (Martínez-Díaz y Anguas-Vélez 2002, Hashiem-Mohamed et al. 2016, Mahmoud et al. 2017).
La presencia de SCN en los peces se puede asociar a la contaminación antropogénica por las descargas de aguas servidas con alto contenido de material fecal en los esteros, los cuales distribuyen el agua a mar abierto. Se debe tomar en cuenta que los peces analizados fueron recogidos directamente de las lanchas, por lo que no hubo mucha manipulación por los pescadores; es decir, es probable que los peces se hayan contaminado en su medio natural, tal como lo demostró un estudio realizado en México, donde se detectaron Streptococcaceae, Micrococcaceae y Staphylococus en peces recién capturados (Romero-Jarero y Negrete-Redondo 2011).
En relación con los perfiles de resistencia antimicrobiana en el género Vibrio, se encontró una alta resistencia, principalmente para amoxicilina/ácido clavulánico. Se considera que la manera en que diversos antibióticos alcanzan los océanos es por medio de la descarga de los efluentes de granjas camaroneras en los océanos; aunque el uso de antibióticos se ha venido restringiendo por el impacto que provocan en el ambiente, aún son utilizados para tratar enfermedades de origen bacteriano, lo que promueve el desarrollo de cepas resistentes a los antibióticos (Divyashree et al. 2020). Un estudio realizado en México sobre la camaronicultura destacó que el uso de los antibióticos ha generado un alto perfil de resistencia en las bacterias y ha promovido la persistencia de antibióticos en el medio acuático (Santiago et al. 2009). En algunas regiones, los estuarios son altamente productivos y sirven como importantes áreas de producción acuícola, y dado que el uso de antibióticos es bastante generalizado en la acuicultura, se espera que los mariscos recolectados en estas áreas estén contaminados con bacterias que albergan genes de resistencia (Kumar et al. 2005).
En conclusión, las bacterias S. costicola, V. metschnikovii y SCN fueron aisladas de peces procedentes de las comunidades Poneloya, Las Peñitas, Jiquilillo y El Tránsito. La bacteria S. costicola es propia de ambientes marinos y no representa riesgos sanitarios, pero V. metschnikovii puede producir enfermedades mediante el consumo de pescado crudo o poco cocido. SCN también puede producir enfermedades y es un indicador de contaminación antropogénica.
Agradecimientos
Se agradece a los pescadores de las comunidades Poneloya, Las Peñitas, Jiquilillo y El Tránsito, que gentilmente colaboraron con el estudio.
REFERENCIAS
Aliaga R, Miranda J, Zevallos J. 2010. Aislamiento e identificación de Vibrio parahaemolyticus O3:K6 en pescados y moluscos bivalvos procedentes de un mercado pesquero de Lima, Perú. Rev Medica Herediana. 21(3):139-145. https://doi.org/10.20453/rmh.v21i3.1123 [ Links ]
Arévalo Z, Clavijo AM, Rolo de M, Álvarez M, Conroy D, Infante D, Santander J. 2003. Aislamiento de Vibrio cholerae a partir de lisas y tilapias en Venezuela. Rev Soc Venez Microbiol. 23:127-130. [ Links ]
Austin B. 2010. Vibrios as causal agents of zoonoses. Vet Microbiol. 140(3-4):310-317. https://doi.org/10.1016/j.vetmic.2009.03.015 [ Links ]
Bonnin-Jusserand M, Copin S, Le Bris C, Brauge T, Gay M, Brisabois A, Grard T, Midelet-Bourdin G. 2019. Vibrio species involved in seafood-borne outbreaks (Vibrio cholerae, V. parahaemolyticus and V. vulnificus): Review of microbiological versus recent molecular detection methods in seafood products. Crit Rev Food Sci Nutr. 59(4):597-610. https://doi.org/10.1080/10408398.2017.1384715 [ Links ]
Carpenter DE, Anderson K, Citron DM, Dzink-Fox JL, Hackel M, Jenkins SG, Knapp C, Koeth L, Schuetz AN, Wexler H. 2018. Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria. 9th ed. Wayne (PA): Clinical and Laboratory Standards Institute. 47 p. [ Links ]
Divyashree M, Vijaya Kumar D, Ballamoole KK, Shetty AV, Chakraborty A, Karunasagar I. 2020. Occurrence of antibiotic resistance among Gram negative bacteria isolated from effluents of fish processing plants in and around Mangalore. Int J Environ Health Res. 30(6):653-660. https://doi.org/10.1080/09603123.2019.1618799 [ Links ]
Escobar J. 2002. La contaminación de los ríos y sus efectos en las áreas costeras y el mar. Santiago de Chile (Chile): Naciones Unidas, Comisión Económica para América Latina y el Caribe [United Nations, Economic Commission for Latin America and the Caribbean]. 63 p. [ Links ]
[FAO] Food and Agriculture Organization of the United Nations. 2014. Contribución de la pesca y la acuicultura a la seguridad alimentaria y el ingreso familiar en Centroamérica. Panamá: FAO. 107 p. [ Links ]
[FAO] Food and Agriculture Organization of the United Nations. 2018. Perfiles sobre la pesca y la acuicultura por países: La República de Nicaragua. [place unknown]: FAO: [accessed 2020 Nov 19]. http://www.fao.org/fishery/facp/NIC/es. [ Links ]
Feliatra F, Nursyirwani N, Zirma AP, Lukistyowati I, Mulyadi A, Adelina A. 2020. Antibacterial potential of heterotrophic bacteria isolated in Siak River estuary, Indonesia, against pathogens in fish. AACL Bioflux. 13(3):1585-1594. [ Links ]
Ghaly AE, Dave D, Budge S, Brooks MS. 2010. Fish spoilage mechanisms and preservation techniques: Review. Am J Appl Sci. 7(7):859-877. https://doi.org/10.3844/ajassp.2010.859.877 [ Links ]
Gomez-Gil B, Fajer-Avila E, García-Vargas F. 2007. Vibrios of the spotted rose snapper Lutjanus guttatus Steindachner, 1869 from northwestern Mexico. J Appl Microbiol. 102(6):1518-1526. https://doi.org/10.1111/j.1365-2672.2006.03199.x [ Links ]
Hashiem-Mohamed M, Khalifa E, El-Sherry YM. 2016. Detection of bacterial infections in some Red Sea fish in Hurghada. J Mar Biol Oceanogr. 5(4). https://doi.org/10.4172/2324-8661.1000164 [ Links ]
Hassen B, Jouini A, Elbour M, Hamrouni S, Maaroufi A. 2020. Detection of Extended-Spectrum β-Lactamases (ESBL) producing Enterobacteriaceae from fish trapped in the lagoon area of Bizerte, Tunisia. BioMed Res Int. 2020(7132812):1-9.https://doi.org/10.1155/2020/7132812 [ Links ]
Jensen J, Jellinge ME. 2014. Severe septic shock and cardiac arrest in a patient with Vibrio metschnikovii: a case report. J Med Case Reports. 8:348. https://doi.org/10.1186/1752-1947-8-348 [ Links ]
Kumar HS, Parvathi A, Karunasagar I, Karunasagar I. 2005. Prevalence and antibiotic resistance of Escherichia coli in tropical seafood. World J Microbiol Biotechnol. 21:619-623. https://doi.org/10.1007/s11274-004-3555-8 [ Links ]
Leyton Y, Riquelme C. 2008. Vibrios en los sistemas marinos costeros = Vibrios in the marine coastal systems. Rev Biol Mar Oceanogr. 43(3):441-456. https://doi.org/10.4067/S0718-19572008000300004 [ Links ]
Linde H-J, Kobuch R, Jayasinghe S, Reischl U, Lehn N, Kaulfuss S, Beutin L. 2004. Vibrio metschnikovii, a rare cause of wound infection. J Clin Microbiol. 42(10):4909-4911. https://doi.org/10.1128/JCM.42.10.4909-4911.2004 [ Links ]
Mahmoud MM, Sayed-Hassan E, Nour-El-Deen EA, Haridy M, El-Moghny-Salem FA, Abdel-Rahman Mohamed M. 2017. Bacterial infections in some Red Sea fishes. Assiut Vet Med J. 63(155):86-93. [ Links ]
Martínez-Díaz SF, Anguas-Vélez B. 2002. Incidence of Vibrio during dermal and systemic infections of the spotted sand bass (Paralabrax maculatofasciatus Steindachner: 1868) in captivity = Incidencia de Vibrio durante infecciones dérmicas y sistémicas de la cabrilla arenera (Paralabrax maculatofasciatus Steindachner: 1868) en cautiverio. Cienc Mar. 28(4):347-356. https://doi.org/10.7773/cm.v28i4.240 [ Links ]
Matté MH, Baldassi L, Barbosa ML, Malucelli MIC, Nitrini SMOO, Matté GR. 2007. Virulence factors of Vibrio metschnikovii strains isolated from fish in Brazil. Food Control. 18(6):747-751. https://doi.org/10.1016/j.foodcont.2006.03.012 [ Links ]
Nsofor CA, Kemajou ST, Nsofor CM. 2014. Incidence and antibiotic susceptibility pattern of Vibrio species isolated from sea foods sold in Port-Harcourt, Nigeria. J Bacteriol Res. 6:13-16. https://doi.org/10.5897/JBR2013.0121 [ Links ]
ProNicaragua. 2019. Guía del inversionista 2019. [Nicaragua]: Investment Promotion Agency. 70 p. [ Links ]
Romero-Jarero JM, Negrete-Redondo MP. 2011. Presencia de bacterias Gram positivas en músculo de pescado con importancia comercial en la zona del Caribe mexicano. Rev Mex Biodivers. 82(2):599-606. https://doi.org/10.22201/ib.20078706e.2011.2.465 [ Links ]
Santiago ML, Espinoza A, Bermudez MDC. 2009. Use of antibiotics in culture shrimp. Rev Mex Cienc Farm. 40:22-32. [ Links ]
Uddin ME, Akter T, Sultana P, Sultana P, Hasan MI, Lubna MA, Monem HA, Parvez MAK, Nahar S, Khan MS. 2018. Isolation, identification and antimicrobial susceptibility profile analysis of Vibrio cholerae O1 from stool samples of Bangladesh. Adv Microbiol. 8(3):188-196. https://doi.org/10.4236/aim.2018.830 [ Links ]
Recibido: 09 de Octubre de 2020; Aprobado: 28 de Enero de 2021











 texto em
texto em